重瓣大岩桐离体培养的两种途径
闫海霞,蒋月喜,何荆洲,邓杰玲,黄昌艳,王晓国,卜朝阳
(广西农业科学院 花卉研究所,广西 南宁 530007)
重瓣大岩桐离体培养的两种途径
闫海霞,蒋月喜,何荆洲,邓杰玲,黄昌艳,王晓国,卜朝阳*
(广西农业科学院 花卉研究所,广西 南宁 530007)
以大岩桐的茎段、叶片、茎尖为外植体,以MS为基本培养基,附加不同浓度的激素组合进行离体培养研究。结果表明:适宜外植体灭菌的方法为先用75%的乙醇表面消毒10 s后再用0.1% HgCl2灭菌4~5 min,或者先用75%的乙醇表面消毒5 s后再用0.1% HgCl2灭菌6 min。3种外植体均可获得组培苗,叶片通过愈伤组织诱导途径可获得组培小苗;茎段和茎尖通过不定芽途径可获得组培小苗。最适宜的愈伤分化培养基为MS+6-BA 0.50 mg/L+IBA 1.00 mg/L,适宜的不定芽增殖培养基为MS+6-BA 0.50 mg/L或者MS+6-BA 0.50 mg/L+IBA 1.00 mg/L,适宜的生根培养基为MS+IBA 1.00~2.00 mg/L,降低蔗糖含量有利于生根。MS+IBA 2.00 mg/L+AC 0.10 g/L有利于生根培养。
大岩桐;离体培养;外植体;愈伤分化
大岩桐(Sinningiaspeciosa)为苦苣苔科苦苣苔属(也有学者认为属大岩桐属)的多年生球根花卉,又名新宁治花、落雪泥,原产巴西等国。20世纪30年代,我国对大岩桐开始进行引种,90年代,仅有少量生产[1]。近年来,大岩桐作为花卉市场的新宠,以其花大、色彩丰富深受大家的喜爱。大岩桐虽然单朵花期较短,但整株花期长,一年可多次开花,是观赏价值极高的温室盆栽花卉。大岩桐多采用种子繁殖或块茎、扦插繁殖,但种子繁殖的后代变异大,易造成种性退化[2],而块茎、扦插繁殖受限条件多,均不适合大岩桐种苗的产业化生产。组培快繁是种苗工厂化生产的有效手段,既保持了原有母本的特性,又不受季节和气侯条件的限制,可周年生产,此外,还具有繁殖系数大、繁殖周期短的优点。目前,国内关于大岩桐组织培养成功的报道较多,其中包括单瓣大岩桐[3]、重瓣大岩桐[4-8]。研究所涉及的外植体种类较多,包括叶片[9-13]、嫩芽[14]、茎段[15]。彭海凤等[11]研究表明:叶片愈伤组织的诱导、继代培养基为MS+6-BA 2.00 mg/L+NAA 0.20 mg/L,生根培养基为1/2MS+IBA 0.20 mg/L+活性炭1.00 g/L。郭丽等[13]研究认为大岩桐叶片可通过两种途径建立起再生体系:愈伤诱导培养基为MS+6-BA 2.00 mg/L+NAA 0.20 mg/L,愈伤分化培养基为MS+6-BA 1.00 mg/L+NAA 0.10 mg/L,不定芽诱导培养基为MS+6-BA 0.50 mg/L+NAA 0.10 mg/L,生根培养基为1/2MS。也有以嫩芽为外植体的研究,王立凤等[14]以嫩芽为材料通过愈伤诱导途径建立了离体再生体系:最适宜的愈伤组织诱导培养基为MS+6-BA 0.30 mg/L+NAA 0.01 mg/L,最适宜的芽分化培养基为MS+6-BA 0.50 mg/L+NAA 0.01 mg/L。刘雪莲等[15]以茎段为外植体进行研究发现:腋芽丛生诱导培养基为MS+6-BA 1.00 mg/L+NAA 0.20 mg/L,腋芽增殖培养基为MS+6-BA 3.00 mg/L+NAA 0.20 mg/L效果最佳,生根培养基为1/2 MS+NAA 0.20 mg/L。大岩桐的再生体系相关报道越来越多,但多数报道只注重其中一种再生体系途径。本研究通过以叶片、茎尖以及不带节的茎段为外植体,经过两种不同的途径,建立了大岩桐的高效离体再生体系,旨在为大岩桐的产业化开发提供理论依据,为建立大岩桐快速繁殖体系和工厂化育苗提供一定技术参数,为今后大岩桐遗传转化研究提供一定的参考。
1 材料和方法
1.1 供试材料
由广西农科院花卉研究所提供的重瓣大岩桐。
1.2 试验方法
1.2.1 外植体的表面消毒 选取生长健壮、无病虫害的大岩桐叶片、茎段以及茎尖,用洗衣粉洗涤5~10 min后用流水冲洗30 min,叶片可用软毛刷轻轻刷干净。在超净工作台中,先用75%酒精表面消毒5~10 s,无菌水冲洗3~4次,再用0.1% HgCl2灭菌4~6 min,无菌水冲洗3~4次。将叶片切成0.5 cm×0.5 cm、茎段切成长0.5~1.0 cm接种于培养基中,每种处理方式接种数量为40个,每个处理重复3次。每天观察其生长情况,10 d后统计污染与存活情况。污染率和存活率计算公式为:
污染率(%)=污染数/接种数×100%;
存活率(%)=存活数/接种数×100%
1.2.2 初代诱导 将3种不同类型的外植体接种在MS培养基上,每种处理方式的接种数为10个,每个处理重复3次。20 d观察生长情况,并进行计算和分析。公式如下:
愈伤诱导率(%)=产生愈伤数/接种数×100%;
分化系数=分化数/接种数;
增殖系数=新芽数/接种数
1.2.3 愈伤组织的分化 将切割好的愈伤组织块,接入添加了不同种类和浓度激素的MS培养基中,每种处理方式的接种数为10个,每个处理重复3次。以后每天观察愈伤的变化,20 d后统计其愈伤组织分化数,筛选出最适愈伤分化培养基。
1.2.4 不定芽的增殖培养 将茎段经过初代培养获得的腋芽切取下来,接在添加有不同种类和浓度激素的MS培养基中,每种处理方式的接种数为25个,每个处理重复3次。以后每天观察不定芽的增殖变化,25 d后统计并筛选出最佳增殖培养基。
1.2.5 生根培养
1.2.5.1 不同激素组合配比对生根诱导的影响 将长约2 cm的试管苗,转接于含有不同激素组合配比的MS培养基上,15 d后观察生根情况,筛选出最适宜的激素组合配比。
1.2.5.2 蔗糖含量对生根诱导的影响 将未生根的组培苗接种在含有不同蔗糖含量的培养基上,观察生根情况并分析蔗糖对生根诱导的影响。
1.2.5.3 活性炭对生根诱导的影响 将未生根的组培苗接种在含有不同浓度的活性炭培养基上,观察生根情况并分析活性炭对生根诱导的影响。
1.2.5中的每种处理方式的接种数为25个,每个处理重复3次。生根率的计算如下:
生根率(%)=生根数/接种数×100%
1.2.6 炼苗移栽 将已经生根的组培苗放在室温中2~3 d后除去瓶盖,加入少量水将培养基软化后取出,冼净基部培养基,用800~1000倍的多菌灵溶液浸泡10 min,移栽到基质上,浇透定根水,15 d后统计移栽存活率。
1.3 统计分析
用统计软件SPSS 19.0对试验数据进行差异显著性测验(Duncan’s 多重比较)。
2 实验结果
2.1 外植体的消毒
由表1可知,不同消毒方式对外植体的影响不同。从污染率分析,处理2和处理5、6间存在显著差异,此时,处理2的污染率最低,为22.50%;处理6的污染率最高,为60.83%。从存活率分析,处理1、处理3、处理6之间存在显著差异,处理2、3、4、5之间无显著差异,其中,处理3的存活率最高,为66.67%。综上可知,适宜外植体灭菌的方法为处理2、3、4,即先用75%的乙醇表面消毒10 s后再用0.1% HgCl2灭菌4~5 min,或者先用75%的乙醇表面消毒5 s后再用0.1% HgCl2灭菌6 min。
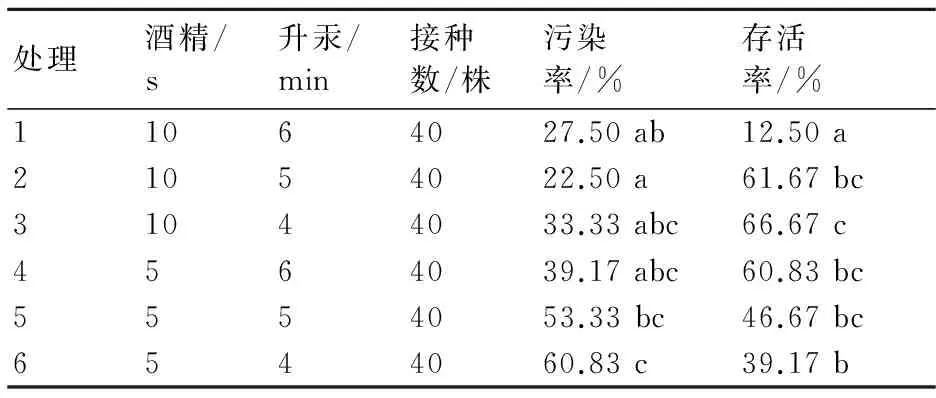
表1 不同消毒方法对大岩桐外植体的影响
2.2 初代诱导
由表2分析可知,以叶片为外植体时,愈伤诱导率为96.67%,分化数为0.57;以茎尖、茎段为外植体时,愈伤诱导率为0%,不定芽的增殖系数分别为0.33、2.57。由此可知,叶片诱导愈伤组织的能力最高,茎段诱导不定芽的能力最高,其次为茎尖。即表明叶片通过诱导愈伤组织可获得组培小苗(图1a);茎段和茎尖通过不定芽途径可获得组培小苗(图1b)。
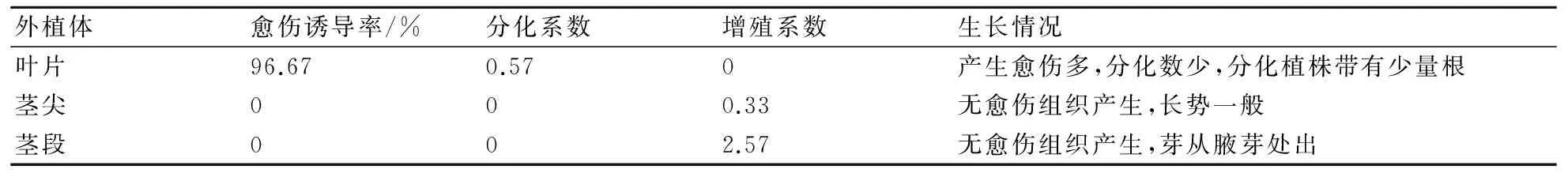
表2 大岩桐的初代培养结果
2.3 愈伤组织的分化
由表3分析可知,不同激素配比对愈伤的分化影响不同。F1和F5对愈伤的分化系数影响无显著差异,F2和F6对分化系数影响无显著差异,F3和F4、F6间分化系数无显著差异,这表明随着6-BA浓度的提高,其对愈伤分化的影响不显著。F1和F2、F3、F4、F6间分化系数存在显著差异,F2和F1、F3、F4、F5间分化系数存在显著差异,这说明随着6-BA浓度的升高,分化系数的变化略有差异。当6-BA浓度为0.10 mg/L或者1.00 mg/L时,随着IBA的浓度增加,分化系数显著升高,但当6-BA浓度为0.50 mg/L时,分化系数虽有所提高,但影响不显著,此时F4的分化系数最高,生长情况也好。由此可见,大岩桐最适宜的愈伤分化培养基为MS+6-BA 0.50 mg/L+IBA 1.00 mg/L。

表3 不同激素组合对大岩桐愈伤组织分化的影响
2.4 不定芽的增殖培养
通过表4的分析可知,当仅添加了6-BA时,Z2与Z1、Z3的增殖系数存在显著差异,Z2的增殖系数显著高于Z1、Z3,增殖系数为3.49,植株长势较好。在一定的6-BA浓度下,当添加激素为NAA时,Z6与Z4、Z5的增殖系数存在显著差异,且随着NAA浓度的升高增殖系数呈下降趋势;在一定的6-BA浓度下,当添加激素为IBA时,Z8与Z7、Z9的增殖系数存在显著差异,Z7与Z9的增殖系数无显著差异,此时Z8的增殖系数最高,为4.03。综合分析可知,Z8仅与Z2的增殖系数无显著差异,与其他处理的增殖系数均有显著差异,这表明,适宜重瓣大岩桐不定芽增殖的培养基为Z2、Z8,即MS+6-BA 0.50 mg/L或者MS+6-BA 0.50 mg/L+IBA 1.00 mg/L,增殖系数分别为3.49和4.03,植株长势健壮(图1c)。
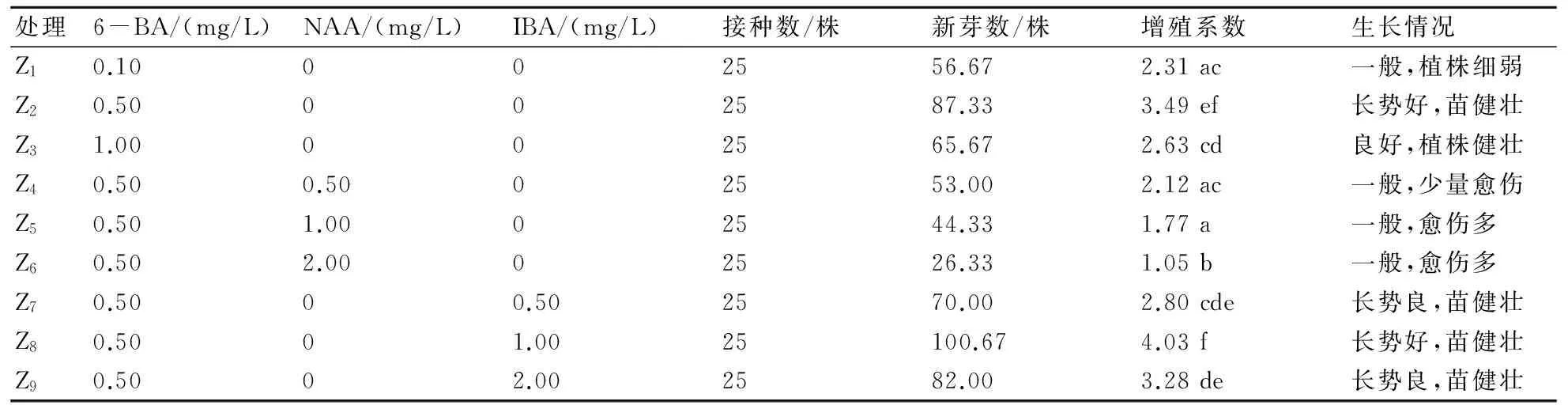
表4 不同培养基对大岩桐不定芽增殖培养的影响
2.5 生根培养
2.5.1 不同激素组合配比对生根诱导的影响 由表5分析可知,不同激素浓度对生根的影响不同。方差分析得出,6个处理的生根率无显著差异,这表明重瓣大岩桐的生根受不同种类和浓度的激素影响不明显,但是两种激素对生根植株的生长情况影响差异较大,当激素为IBA时,生根量多,植株健壮;当激素为NAA时,生根率较IBA的生根率高,生根量较多,但是植株带有愈伤,这种从愈伤产生的根系不利于植株的移栽,属于无效根。由此可得,适宜重瓣大岩桐的生根培养基为MS+1.00~2.00 mg/L IBA,植株根多,植株健壮(图4d)。
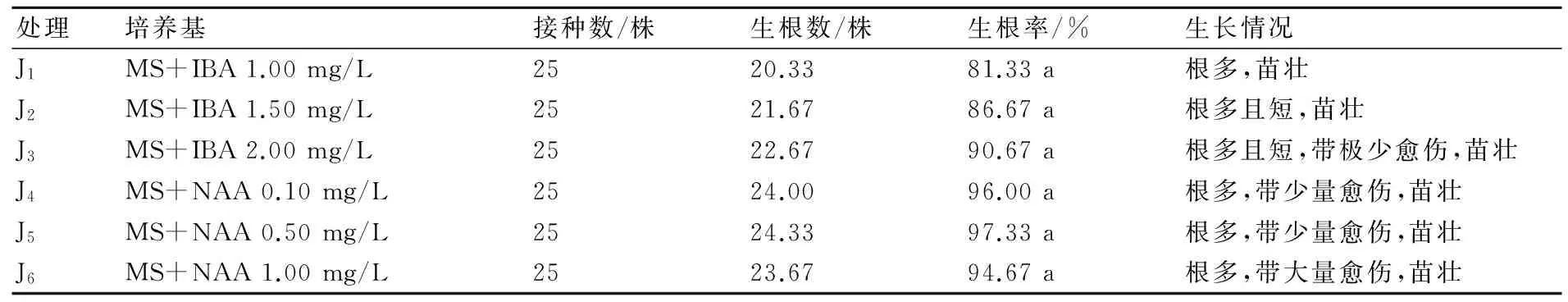
表5 激素对大岩桐生根诱导的影响
2.5.2 蔗糖含量对生根诱导的影响 由表6分析可知,蔗糖含量对生根有不同影响。方差分析得出,T1和T2对生根率的影响无显著差异,T1的生根率高于T2;T1和T3、T4对生根率的影响有显著差异,T2和T3、T4对生根率的影响也有显著差异。在生根培养基MS+IBA 2.00 mg/L+蔗糖10 g/L上的生根率最高。此外,随着蔗糖浓度的增加,生根率显著降低。综合分析后得出,降低蔗糖含量有利于生根,其中以MS+IBA 2.00 mg/L+蔗糖10 g/L的生根效果为佳。
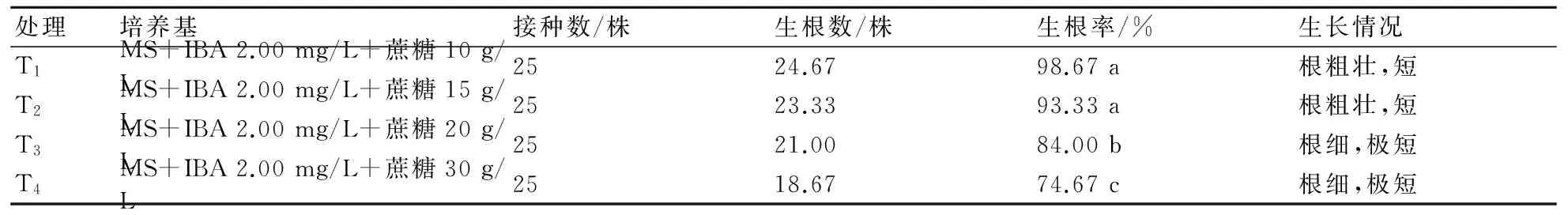
表6 蔗糖对大岩桐的生根诱导的影响
2.5.3 活性炭对生根诱导的影响
由表7可知,H1和H3、H4的生根率之间无显著差异,H2与其他3个处理间存在显著差异。H2的生根率最高,为98.67%,可见活性炭更有利于生根的诱导,尤其当活性炭含量为0.10 g/L时。由此可知,MS+IBA 2.00 mg/L+AC 0.10 g/L有利于生根培养。
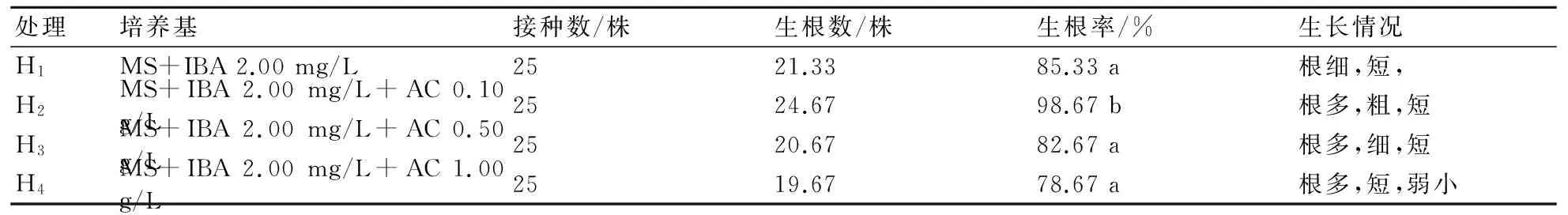
表7 活性炭对大岩桐生根诱导的影响
2.6 炼苗移栽
移栽后的重瓣大岩桐可在15 d存活,移栽存活率达到100%(图1e)。大岩桐日常管理简单,病虫害极少。小苗初期叶片颜色偏浅黄,属于正常现象,经过3个月左右,组培苗长成中苗(图1f),再经过1个月的营养生长即可进入开花期(图1g)。
3 讨论与结论
重瓣大岩桐的灭菌时间较短,尤其是HgCl2的灭菌时间仅有4~5 min,这与前人的研究结果是一致的。如张艳萍等[10]用75%酒精棉球擦拭表面,再用0.1%的HgCl2溶液消毒5 min;但也有研究采用的消毒灭菌时间较长,例如王秀英等[4]用70%的酒精浸30 s结合HgCl2灭菌10~12 min。产生这种差异的原因主要是由植物自身的特性决定的。此外,重瓣大岩桐整株被毛,在消毒上有一定操作难度,从而影响了其消毒灭菌的效果,因此存活率未达到100.00%,污染率也未达到0,要达到更好的灭菌效果需要进一步研究实践。
蔗糖、活性炭均对大岩桐的生根有影响。多数研究的生根培养基的蔗糖含量为30 g/L,但李爱华等[16]认为1/2MS+蔗糖15 g/L是最佳生根培养基。本实验得出,降低蔗糖含量有利于生根,其中以MS+IBA 2.00 mg/L+蔗糖10 g/L的生根效果为佳。可见两者之间有一定的一致性。此外,在培养基中添加一定的活性炭有利于提高生根率,在MS+IBA 2.00 mg/L+AC 0.10 g/L有利于生根培养,生根率显著提高,这可能是活性炭一方面给生根提供了一个合适的暗环境,另一方面,活性炭可能吸附了某些抑制生根的物质,具体原因有待进一步研究。
本实验通过愈伤组织途径以及不定芽诱导途径建立了重瓣大岩桐的高频再生体系。适宜的外植体灭菌的方法为先用75%的乙醇表面消毒10 s后再用0.1% HgCl2灭菌4~5 min,或者先用75%的乙醇表面消毒5 s后再用0.1% HgCl2灭菌6 min。叶片通过诱导愈伤组织可获得组培小苗;茎段和茎尖通过不定芽途径可获得组培小苗。最适宜的愈伤分化培养基为MS+6-BA 0.50 mg/L+IBA 1.00 mg/L,适宜的不定芽增殖培养基为MS+6-BA 0.50 mg/L或者MS+6-BA 0.50 mg/L+IBA 1.00 mg/L,适宜重瓣大岩桐的生根培养基为MS+IBA 1.00~2.00 mg/L,降低蔗糖含量有利于生根。MS+IBA 2.00 mg/L+AC 0.10 g/L有利于生根培养。

图1 重瓣大岩桐组培苗生长情况
[1] 李发虎,蔡永敏,樊明寿,等.不同基质对于大岩桐移栽存活率的影响研究[J].中国农学通报,2009,25(1):112-114.
[2] 曹桂萍,王建美.大岩桐的组织培养与快速繁殖研究[J].山东农业科学,2002(5):16,22.
[3] 徐全乐,谢亚红,刘文婷,等.大岩桐高频再生体系建立的两种途径[J].园艺学报,2010,37(1):135-140.
[4] 王秀英,张大惠.重瓣大岩桐组织培养[J].黑龙江农业科学,2009(3):11-12.
[5] 吴纲.利用重瓣大岩桐叶片诱导再生植株试验[J].江苏林业科技,2002,29(3):23-24,33.
[6] 王福银.重瓣大岩桐快速繁殖试验[J].江苏林业科技,2000,27(4):27-28.
[7] 韦献雅,张其坤,饶春梅,等.重瓣大岩桐叶片离体培养及植株再生[J].北京农业,2008(1):34-35.
[8] 朴日子,曹后男,宗成文,等.重瓣大岩桐叶片离体培养高频植株再生体系的建立[J].辽宁林业科技,2008(1):10-12,15.
[9] 任如意,赵金良,宗宪,等.大岩桐叶片组织培养及其组织学观察[J].北方园艺,2008(6):183-185.
[10] 张艳萍,陈玉梁,张正英,等.大岩桐叶片离体再生培养研究[J].甘肃农业科技,2006(9):5-6.
[11] 彭海凤,万开军,吕俊英.大岩桐的组织培养[J].信阳农业高等专科学校学报,2004,14(1):29-30.
[12] 秦丽,胡雪梅,廖青,等.观赏植物大岩桐(Sinningiaspeciosa)组织培养体系的建立和优化[J].新疆农业科学,2007,44(3):336-339.
[13] 郭丽,朱飞雪,贾文庆.大岩桐高频再生体系的研究[J].江苏农业科学,2015,43(5):51-53,356.
[14] 王立凤,石兰英,杨静.大岩桐的组织培养[J].河北农业科学,2012,16(6):31-33.
[15] 刘雪莲,顾地州,高艳蕊,等.大岩桐腋芽丛生的诱导及植株再生[J].北方园艺,2008(7):222-223.
[16] 李爱华,熊春玲.大岩桐的组织培养及快速繁殖[J].湖北林业科技,2003(2):5-6.
(责任编辑:许晶晶)
Two Pathways for Isolated Culture ofSinningiaspeciosa
YAN Hai-xia, JIANG Yue-xi, HE Jing-zhou, DENG Jie-ling,HUANG Chang-yan, WANG Xiao-guo, BU Zhao-yang*
(Flower Research Institute, Guangxi Academy of Agricultural Sciences, Nanning 530007, China)
The leaf, shoot tip and stem ofSinningiaspeciosawere used as explants, and their isolated culture was conducted on the MS medium supplemented with different concentrations of plant hormones. The best sterilization conditions for explants were obtained as follows: 75% alcohol for 10 s plus 0.1%HgCl2for 4~5 min, or 75% alcohol for 5 s plus 0.1%HgCl2for 6 min. Tissue-culture seedlings could be obtained from the explant leaf through callus induction pathway, and could also be obtained from the explants stem and shoot tip through adventitious bud multiplication pathway. The best culture medium for callus differentiation was MS+6-BA 0.50 mg/L+IBA 1.00 mg/L; the best culture medium for adventitious bud multiplication was MS+6-BA 0.50 mg/L or MS+6-BA 0.50 mg/L+IBA 1.00 mg/L; the optimum culture medium for rooting was MS+IBA 1.00~2.00 mg/L, and low concentration of sucrose in MS was advantageous to rooting; the medium MS+IBA 2.00 mg/L+AC 0.10 g/L was beneficial to the culture of rooting.
Sinningiaspeciosa; Isolated culture; Explant; Callus differentiation
2016-07-08
广西科学研究与技术开发计划项目(桂科攻1598006-5-8、桂科能1598022-1-5-2);南宁市科学研究与技术开发计划项目 (NC20152008-3);南宁市西乡塘区科学研究与技术开发计划项目(2015302);广西农科院项目(农成转2015009、2015JM04、 2015YT89)。
闫海霞(1981─),女,助理研究员,硕士,主要从事花卉新品种选育与示范推广工作。*通讯作者:卜朝阳。
Q813.1.3
A
1001-8581(2016)11-0030-05

