响应面法优化菊花菜中的多糖提取工艺及其抗氧化活性研究
赵秀玲,陆乐梅
(黄山学院 生命与环境科学学院,安徽 黄山 245021)
响应面法优化菊花菜中的多糖提取工艺及其抗氧化活性研究
赵秀玲,陆乐梅
(黄山学院 生命与环境科学学院,安徽 黄山 245021)
采用响应面法优化安徽省黄山菊花菜多糖的提取条件及其抗氧化活性。在单因素试验基础上,选择纤维素酶浓度、料液比、提取时间、提取温度为影响因子,应用Box-Benhnken中心组合法进行4因素3水平试验设计,以菊花菜多糖得率为响应值,进行响应面分析,并研究了菊花菜多糖的体外抗氧化活性。结果表明:菊花菜多糖的最佳提取条件为纤维素酶浓度为1.5%,液固比为40mL/g,提取时间为42min,提取温度为80℃,在此条件下,菊花菜多糖的得率可达3.94%。同时建立了酶-声波法提取菊花菜多糖的二次数学模型,对目标产物提取具有良好的预测作用。菊花菜多糖体外清除·OH、ABTS·、DPPH·能力的IC50值分别为76.23、112.25、102.86μL。且多糖样品量与各项抗氧化活性指标呈量效关系。
响应面法分析;菊花菜多糖;多糖;提取;抗氧化活性
0 引言
菊花菜,又名菊花脑(ChrysanthemumnankingenseH.M.S),味道微苦、凉性,是菊科属多年生宿根草本植物,被称为南京八野菊之一。菊花菜不仅营养丰富,富含蛋白质、脂肪、纤维素和矿物质盐类等营养物质,而且包含挥发油、菊苷、等挥发类芳香物质。它有开胃、清热解毒、疏风平肝的功能,对预防流感等疾病,缓解头晕目眩,杀菌也都有很好的作用[1]。具有较好的开发前景,尤其是保健养生方面。菊花菜生长于江苏安徽地区,冬季分根(根系发达,对土壤的适应性强,耐寒耐旱),夏季则长出嫩绿的菜苗(呈长椭圆形,边沿呈锯齿状,绿色,背面浅绿色,带有微微细毛)供人们食用。
目前,人们对菊花菜的研究有:杨念云等人首次从菊花菜中分离得到12个化合物,即正二十元烷酸、β-谷甾醇、熊果酸、金圣草黄素、木犀草素、咖啡酸、胡萝卜苷、金圣草黄素-7-O-β-D-葡萄糖苷、木犀草素-7-O-β-D-葡萄糖苷、蒙花苷、芦丁、硝酸钾等[2]。翁德宝采用石油醚除脂、热水浸提、活性炭脱色、Sevage除蛋白、乙醇醇析提取、沉淀、干燥等方法研究干燥菊花菜茎叶多糖的提取工艺并用硫酸-苯酚法对多糖含量进行了检测,结果表明菊花菜茎叶干品中粗多糖含量为0.29%[3]。
但是,除此之外人们对于菊花菜的精、深加工也仅仅处于起步阶段,因此有关菊花脑的研究仍具有较大的发展空间。而菊花菜中多糖类化合物提取工艺优化未见报导。通过以新鲜的菊花菜为试验对象,采用超声波辅助酶法提取多糖的实验方法,应用响应面法分析优化菊花菜的提取工艺,并对其抗氧化活性进行研究,得出提取菊花菜多糖的最优工艺及其抗氧化活性的强弱。以期可以为菊花菜开辟抗氧化保健食品和菊花菜多糖提取的产业化供给理论依据和技术支持。
1 材料与方法
1.1 试剂与仪器
新鲜菊花菜购于黄山市屯溪区丰华大市场,经生命与环境科学学院方建新老师鉴定为菊科属多年生宿根草本植物CrysanthemumnankingenseH.M.S(菊花菜),清洗干净。除去水分备用。
纤维素酶(30000U/g),1,1-二苯基-2-苦肼基(DPPH),上海士锋科技有限公司;2,2-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)-二氨盐(ABTS),上海华蓝化学科技有限公司;Vc(抗坏血酸)、无水乙醚、FeSO4、H2O2、水杨酸、过硫酸钾、无水硫酸钠、硫酸、苯酚、十二水合磷酸氢二钠、二水合磷酸二氢钠、柠檬酸三钠、草酸钠、葡萄糖、乙酸铅、维生素C等均为分析纯。
722N型可见分光光度计(上海奥谱勒仪器有限公司)KQ3200B型,超声波清洗器(昆山市超声仪器有限公司),恒温水浴锅(上海东星建材实验设备有限公司),PHS-3C酸度计(上海雷磁仪器厂),台式电动离心机(80-2型,金坛市杰瑞尔电器有限公司)。
1.2 方法
1.2.1 标准曲线绘制
首先精确称取葡萄糖标准品0.010g(105℃干燥至恒重),加蒸馏水溶解并定容至100mL,得浓度为0.1mg/mL葡萄糖标准液。分别吸取葡萄糖标准溶液0.00、0.10、0.20、0.40、0.60、0.80、1.00mL于试管中,不足2mL的添加蒸馏水至2.0mL,加入1.0mL苯酚溶液(50g/L),5mL的浓硫酸溶液,混匀,沸水浴处理30min,后冷却,在波长486nm处,用分光光度计测其分光度值。用试剂空白为空白组,测定吸光度值,设横坐标为葡萄糖的浓度(mg/mL),纵坐标为吸光度值(A),进行标准曲线的绘制,得线性回归方程为:y=27.51x+0.928(R2=0.982)。
1.2.2 单因素试验
首先称取5g新鲜菊花菜放置于研钵中,然后向其中加入少量乙醚,用力研磨成均匀的糊状物,再用1%质量分数的纤维素酶溶液洗涤研钵,洗涤液一同倒入烧杯,再加入1%质量分数的纤维素酶溶液40mL(40mL中包括洗研钵的1%的纤维素酶溶液),在38℃水浴中处理30min后,在设定的试验条件下(考察纤维素酶的浓度、料液比、超声时间、超声温度四个因素),等待其冷却后,逐滴滴加饱和中性醋酸铅,使其中的蛋白质除去,直到加入醋酸铅溶液时没有白色沉淀形成为止。此时将此溶液混合物和残渣一起倒入100mL容量瓶中,定量混合后振荡。再离心,4 000r/min,15min,取上清液,然后向瓶中加入0.2~0.4g草酸钠粉末,使滤液中的醋酸铅沉淀,第二次离心,4 000r/min,15min,分离出上清液,即为可溶性糖提取液。将提取液定容至100mL,取10mL,稀释10倍,再取1mL测吸光度。依据得出的标准曲线,计算出稀释后溶液中的多糖浓度,记为x。后计算出样品中多糖的提取率(%,质量分数)[4],多糖含量用下式计量:
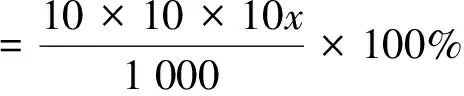
式中:x为测定的溶液的多糖的质量浓度(mg/mL)。
1.2.3 响应面试验
以上述单因素试验的结果为依据,利用液固比(B)、选取纤维素酶的浓度(A)、超声时间(C)、超声温度(D)4个比较显著的试验影响因素,在酶解时间30min,酶解温度38℃的条件下,应用Box-Benhnken实验设计的原理,进行3水平4因素的试验设计,将响应值设为水溶性多糖取率,将上述4个影响因素设为影响因子,进行响应面试验,根据试验结果,可以得出菊花菜中水溶性多糖提取的最优工艺[5-6]。
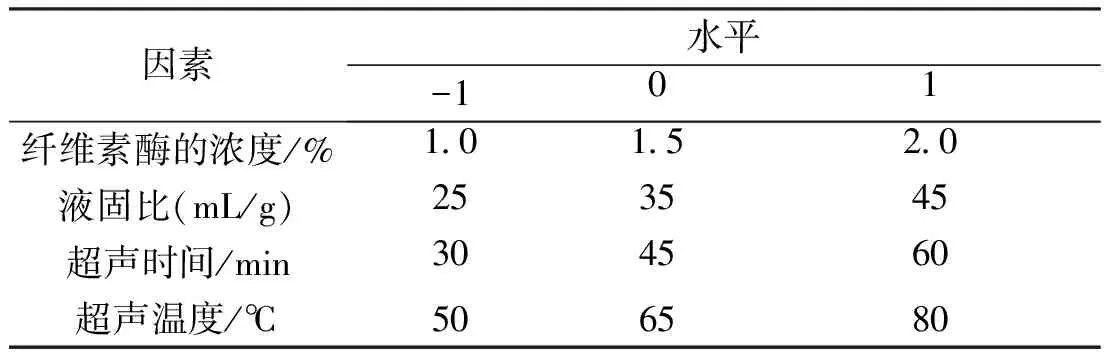
表1 响应面分析因素与水平取值
1.2.4 抗氧化活性的测定1.2.4.1 对菊花菜中的多糖清除·OH能力的测定
参考王宗成[7]的试验过程,并作适度改变及优化,分别移取0.2、0.4、0.8、1.0、1.2mL提取液置于试管中,不足2mL的添加蒸馏水补充至2mL,形成不同质量浓度样品液。再向其中加入2mL FeSO4溶液(9.0mmoL/L)、2mL的H2O2(9.0mmoL/L)溶液,混合摇匀后,静置10min,接着再加入2mL水杨酸-乙醇溶液(9.0mmoL/L),继续摇匀,在37℃下保温30min,后冷却,接着再使用离心机离心10min,要求3 000r/min,离心后取出上清液于一干净试管中,在波长510nm处测其吸光度值Ax。为了去除多糖对吸光值的影响,用相同体积的蒸馏水取代水杨酸作为样品对照组,测定吸光度值Ax0;空白对照组的吸光度值A0则用相同体积的蒸馏水取代多糖测得。阳性对照使用0.1mg/mL的维生素C代替样品测得,计算公式如下:
式中:A0、Ax、Ax0分别代表空白对照组测定的吸光度值、样品组测定的吸光度值、对照组测定的吸光度值。
1.2.4.2 对菊花菜中的多糖清除ABTS·能力的测定
参考何晋浙[8]的方法,并进行优化。分别量取0.2、0.4、0.6、0.8、1.0、1.2mL提取液置于试管中,不足2mL的用添加蒸馏水至2mL,形成质量浓度不同的样品液备用。将等量7mmoL/L ABTS液与4.9mmoL/L过硫酸钾混合后置于暗处12h。在使用前,先用pH7.1磷酸缓冲液稀释,直到在734nm波长处测得的混合液的吸光度值为0.7(±0.02)时即可。在不同质量浓度的样品液中,分别加入2mL ABTS·溶液,等待6min后,即可测定吸光度值(Ai)。同上方法,测定出与样品体积相同的磷酸缓冲液与2mL ABTS·液混合后的吸光度值(A0)以及2mL磷酸缓冲液与不同质量浓度的吸光度值(Aj)。阳性对照使用0.1mg/mL的维生素C代替样品测得。
ABTS·清除率/%=[(A0-Ai+Aj)]/A0]×100%
1.2.4.3 对菊花菜中的多糖清除DPPH·能力的测定
参考赵文红[9]的方法加以改进。分别量取0.2、0.4、0.6、1.0、1.2mL的提取液置于试管中,不足2mL的以蒸馏水补充至体积为2mL,形成不同质量浓度的样品液。然后分别加入2.0mL 2×10-4moL/L的DPPH乙醇(95%)溶液混合,阴暗处放置2h,于波长517nm处测定吸光度值(Ai),对照组为不加样品的DPPH乙醇液,测出对照组的吸光度值(A0)。阳性对照为0.1mg/mL的VC溶液。
清除率/%=(1-Ai/A0)×100%
2 结果与讨论
2.1 单因素试验
2.1.1 纤维素酶的浓度对提取率的影响
取菊花菜5.0g,纤维素酶的浓度分别为0.5%、1.0%、1.25%、1.5%、1.75%(质量浓度),液固比8mL/g,在38℃水浴中酶解30min,超声提取温度为65℃,超声提取时间为50min,观察纤维素酶的浓度对菊花菜多糖提取率的影响。纤维素酶能损坏菊花菜细胞壁的构造,使其局部坍塌、溶解、松散、有利于有效成分从胞内向提取介质扩散,有利于多糖的溶出。由图1a可知,纤维素酶的浓度为1.5%时,菊花菜中多糖提取率最大,此时酶解较彻底;纤维素酶添加量较少时,菊花菜的细胞破坏不完全,多糖部分释放出来;随着纤维素酶质量浓度的增加,酶解的同时也有一部分纤维附着在菊花菜颗粒表面,堵塞了多糖的部分溶出通道[10],因此提取率开始逐渐减小,由此可见1.5%时纤维素酶的效果最好。
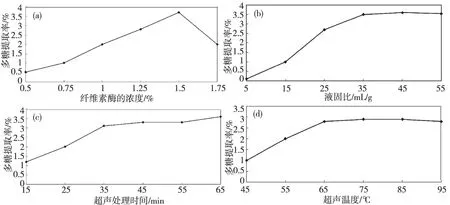
图1 纤维素酶添加量(a);液固比(b);超声处理时间(c)和超声处理温度(d)对菊花菜多糖含量的影响Fig.1 Effect of enzymatic quantity (a)、liquid-to-solid ratio (b)、ultrasonic treatment time (c)、 ultrasonic treatment temperature(d) on the extraction content of chrysanthemum nankingense polysaccharide
2.1.2 液固比对提取率的影响
取样品5.0g,纤维素酶的浓度为1.5%,液固比5、15、25、35、45、55mL/g时,在38℃水浴中酶解30min后,超声提取温度为65℃,超声提取时间为50min,考察料液比对菊花菜多糖提取率的影响。结果如图1b所示,当液固比小于35时,多糖得率增加速度较快,原因可能是当物料比较小时,物料粘度过大,多糖不能充分溶出,当达到适当的料液比时,多糖则完全溶出[11],当继续扩大料液比,使其超过35时,可以发现多糖得率的变化相对较小,几乎保持不变,这大概是因为这时物料已全部溶于溶剂中,无论在增加多少溶剂的量,对最终的结果影响都不大。所以,我们从从节约溶剂方面考虑,选择液固比为35mL/g。
2.1.3 超声提取时间对提取率的影响
取新鲜菊花菜5.0g,选择工艺条件为:纤维素酶浓度为1.5%,液固比为35 mL/g,38℃水浴中酶解30min,超声提取的温度为65℃,以上条件保持不变,仅改变超声提取的时间,分别取:15、25、35、45、55、65min。按照上面的试验方法进行试验,得出多糖含量(结果见图1c)。分析比较超声提取的时间对多糖提取率的影响。绘制图形直观反应,可以看出当超声提取的时间小于35min时,菊花菜多糖提取率随着提取时间的延长不断升高,当超声提取的时间延长超过35min时,多糖提取率就几乎保持不变了。原因可能是在提取初期,菊花菜中多糖浓度与溶剂中相差较大,存在较大的扩散驱动力,多糖能够很快从菊花菜中析出,伴随提取时间的延长,提取液和菊花菜中多糖浓度差缩小,基本达到动态平衡,多糖得率大致保持稳定[12]。
2.1.4 超声提取温度对提取率的影响
取样品菊花菜5.0g,选择纤维素酶的浓度为1.5%,液固比为35mL/g,在38℃水浴中酶解30min,超声提取时间35min保持这些条件不变,改变超声提取的温度,选择45、55、65、75、85、95℃,进行6组实验。根据试验结果,分析超声提取的温度对多糖得率的影响。结果见图1d,可以得出:当温度在45~65℃的范围内,多糖提取率随着提取温度的升高而不断增大,当温度超过65℃时,由图形可明显看出其走势变平,有下降的趋势。分析原因大概是提取溶剂的黏度随着温度的升高而降低,温度低有利于加快溶质的扩散和溶剂的渗透,从而使多糖快速溶出;一旦温度升高到一固定值,在酸性条件下一部分热稳定小的多糖分被解或者是结构被破坏,而造成多糖提取率下降。
2.2 响应面设计试验的结果及分析
2.2.1 Box-Benhnken设计方案及试验结果
由上面进行的单因素试验,分析结果可知,纤维素的浓度(A)、液固比(B)、超声处理时间(C)、超声温度(D)4个因素对菊花菜多糖提取率影响比较大,在38℃,酶解30min的条件下,将这几个因素设为试验的影响因子,将水溶性多糖提取率设为试验的响应值,以此进行响应面试验。
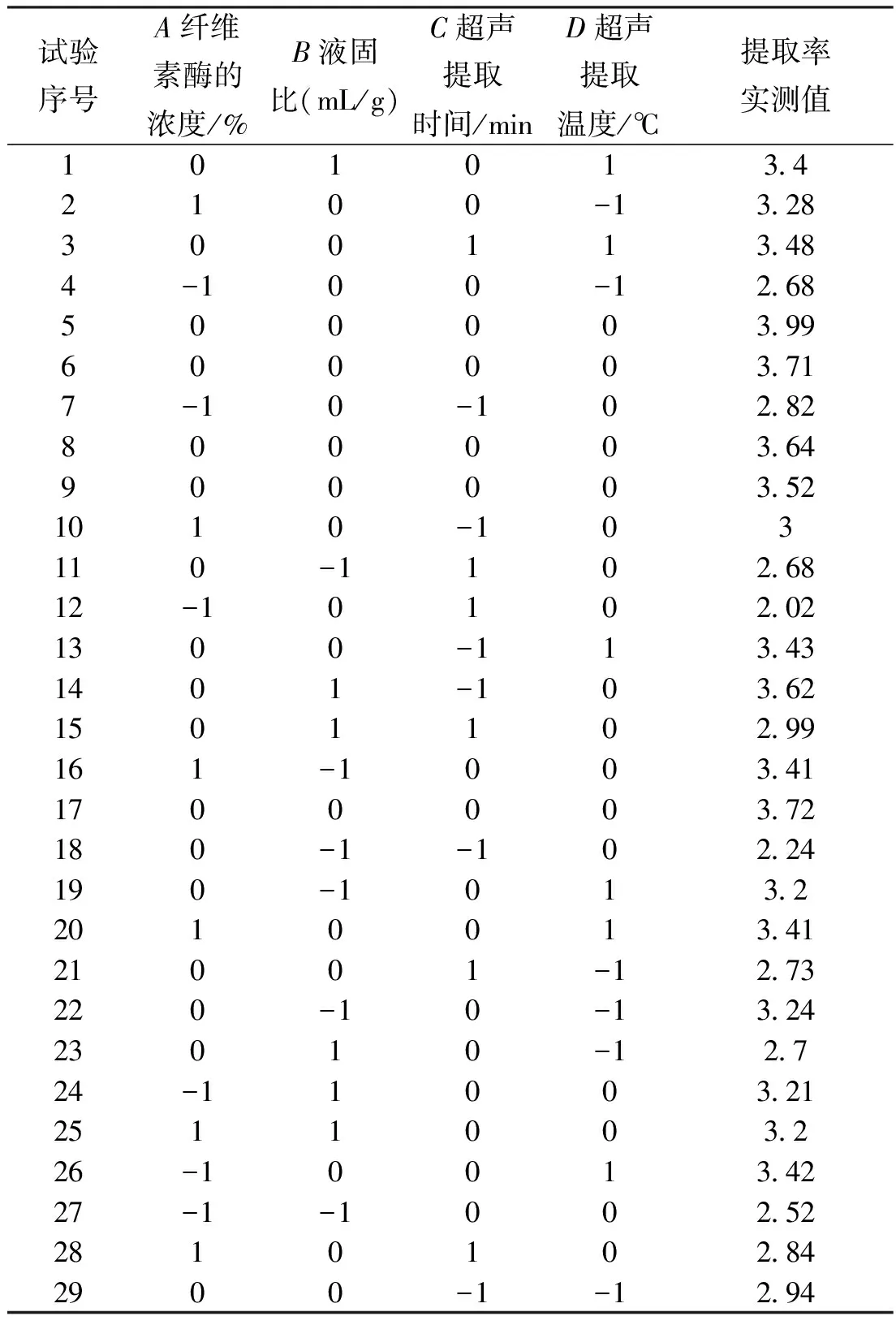
表2 菊花菜多糖提取Box-Behnken试验方案与结果
使用Design Expert 8.05软件将表2中的数据拟合处理,可以得到菊花菜多糖提取率(Y)对实验因素的二次回归方程如下:
Y=-16.772 55+7.579 33A+0.335 48B+0.229 73C+0.089 919D-0.045AB+0.021 333AC-0.020 333AD-1.783 33×10-3BC+1.233 33×10-3BD+2.888 9×10-4CD-1.743 67A2-3.609 17×10-3B2-2.504 07×10-3C2-7.707 41×10-4D2
2.2.2 响应面回归模型的方差分析

表3 菊花菜多糖提取的方差分析
注:**(P<0.01)为极显著;*(P<0.05)为显著
采用Design-Expert 8.05软件进行二次多项回归拟合、方差分析、显著性检测,结果见表3。二次回归方程中,A2、B2、C2、D2的系数均为负数,因而推断回归方程所对应的抛物面开口向下,说明有极大值点。
从表3可知,回归模型显著,表明所得二次回归方程显著,而失拟项不显著,表明方程失拟不显著,决定系数R2=0.840 5,说明该二次回归模型与实际试验值拟合度较好,且可靠性较高。变异系数(C.V.%=8.65)在较低值,说明试验值可靠。信噪比(Adeq precision)为7.696,说明精度较高。所以模型能够较好地描述各响应变量与响应值之间的关系,能够用该模型预测实验结果。D、A、A2、B2对菊花菜多糖的提取率影响显著,D2对菊花菜多糖的提取率的影响极显著,而其他交互项、料液比、超声提取时间及缺失项显著性较差。表明实因素对响应值不是简单的线性关系,而是一种非线性关系[13]。4个考察因素对菊花菜多糖提取率的影响大小为超声温度>纤维素酶浓度>液固比>超声时间。
2.2.3 响应面曲面图的分析与优化
由回归模型绘制出了影响菊花菜中的多糖提取的4个因素交互作用的响应曲面图和等值线图,见下图2中的A-F。
分析图2中A-F可知,超声温度曲线较陡,纤维素酶的浓度次之,液固比和超声时间曲线较平滑,表明超声温度对多糖含量的影响最明显,纤维素酶的浓度次之,液固比和超声时间影响较弱,这与表3结果一致。响应曲面坡度越陡峭,表明响应值对于操作条件的改变越敏感,反之曲面坡度越平缓,操作条件的改变对响应值的影响也就越小[13]。图直观地反应了各因素交互作用对响应值的影响,纤维素酶浓度和液固比交互作用曲面较陡,纤维素酶浓度和超声作用时间次之,表明其对多糖提取率的交互作用明显。与表3中AB、AC之间拟合的系数的绝对值大于DB、DC、AC、BC项的方差分析结果一致。
通过回归模型预测的菊花菜多糖的提取的最佳工艺条件为:纤维素酶的浓度为1.44%,液固比为40.73∶1,超声提取时间为42.10min,超声提取温度为79.81℃,菊花菜多糖含量的理论最高为3.94%。考虑到实际操作的可能性与方便性,将上述优化的提取工艺条件修正为:纤维素酶的农度为1.5%,液固比为40mL/g,超声提取时间为42min,超声提取温度为80℃,在此工艺条件下做验证实验3次,得到的菊花菜多糖含量平均值为3.90%,实验值与理论预测值相对误差为0.10%,证明利用响应面法分析优化得到的菊花菜多糖提取工艺条件准确可靠,具有实际指导意义。
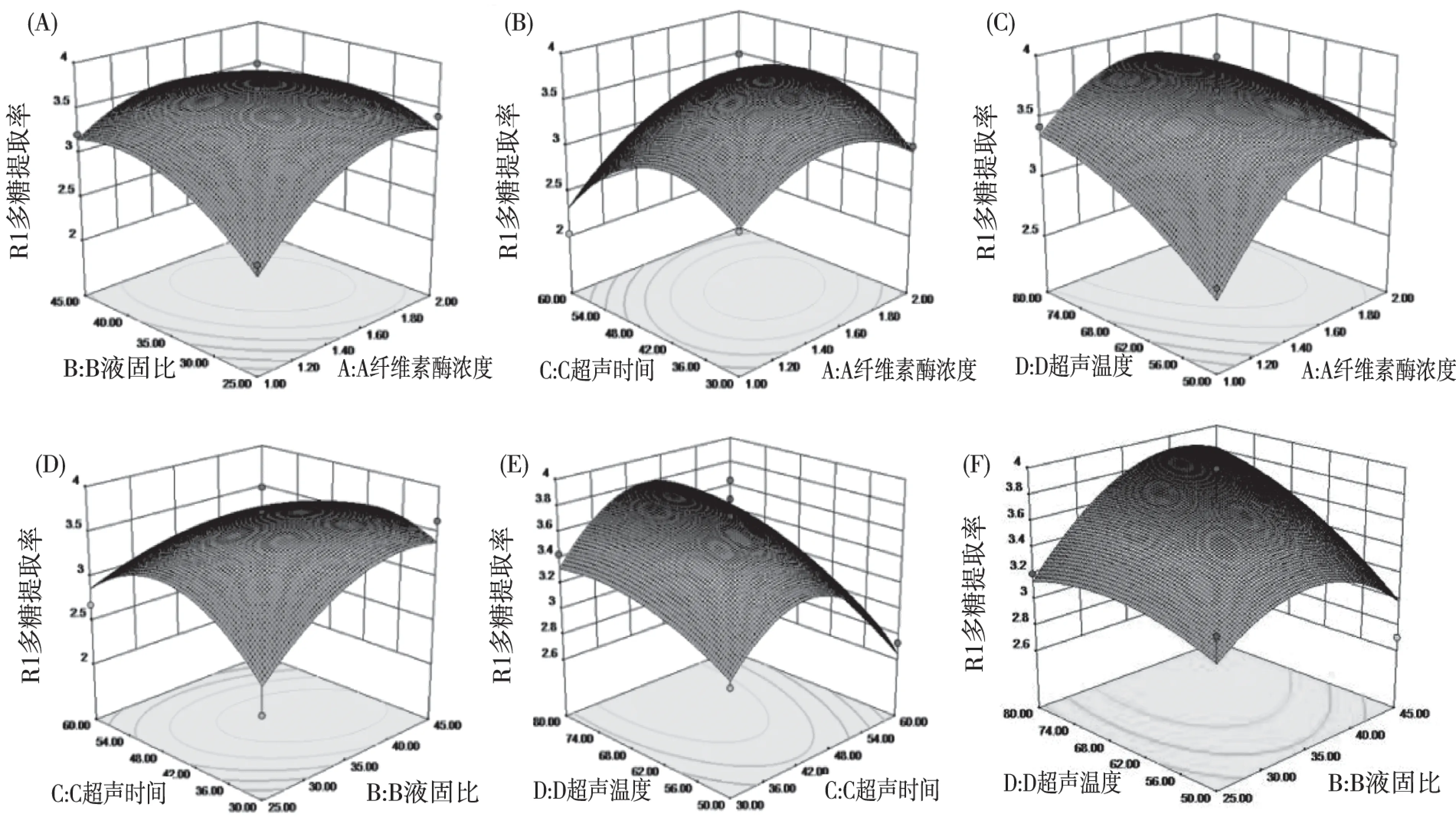
图2 两因素交互作用多糖提取率影响的相应面和等高线图纤维素酶浓度和液固比(A);纤维素酶浓度和超声时间(B);纤维素酶浓度和超声温度(C);液固比和超声时间(D);超声时间和超声温度(E);液固比和超声温度(F)Fig.2 The effect of two factors on the extraction rate of polysaccharide and the corresponding surface and contour map Cellulase concentraction and liquid-to-solid ratio(A); Cellulase concentraction and ultrasonic treatment time (B); Cellulase concentraction and ultrasonic treatment temperature(C); Liquid-to-solid ratio and ultrasonic treatment time (D); Ultrasonic treatment time and ultrasonic treatment temperature(E); Liquid-to-solid ratio and ultrasonic treatment time (F)
2.3 抗氧化活性的测定结果分析
在2.2.3中确定的最优提取工艺条件下提取了菊花菜多糖溶液的清除·OH、ABTS·、DPPH·的清除率、多糖液与自由基作用的关系式(即质量分数为0.039的菊花菜多糖提取的使用量x与对自由基的清除率y之间的回归方程)半抑制浓度见下表4。半抑制浓度(半清除率)ED50指清除率(抑制率)为50%时所需样品的浓度(或体积),所需浓度(或体积)越高,表明半抑制浓度(半清除率)越低[15]。
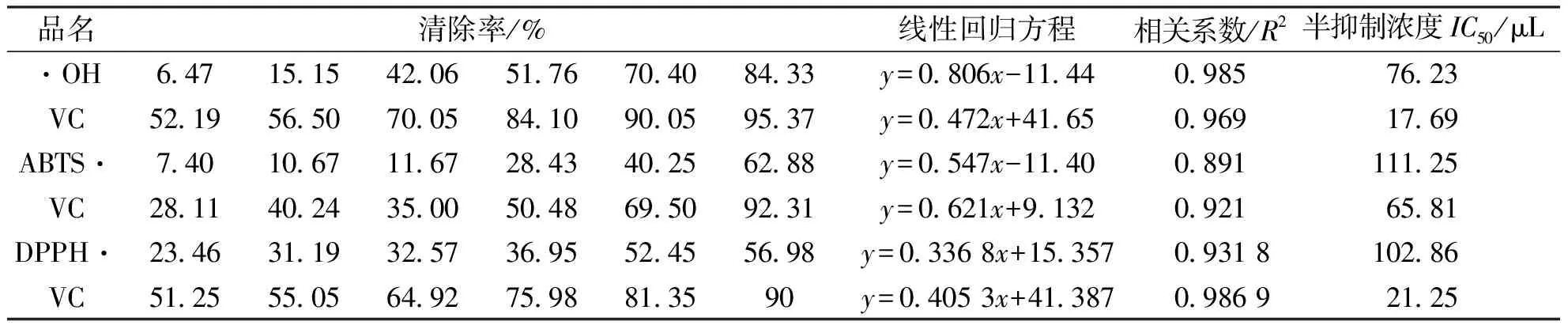
表4 菊花菜多糖溶液对自由基的清除率及其回归结果
注:上表中的清除率分别对应于多糖溶液的体积数为0.2、0.4、0.6、0.8、1.0、1.2mL时的清除率
2.3.1 菊花菜多糖溶液对·OH清除能力的测定
水杨酸能够有效捕捉·OH并产生有色物质,该有色物质在510nm处有强吸收峰,被检测物有清除·OH的作用,从在510nm处吸光值的变化判断其抗氧化能力[14],可评价菊花菜多糖提取液对·OH的清除能力。
由表4可知,菊花菜多糖溶液对·OH有一定的清除能力,且清除率随浓度的升高而增大,与浓度存在一定的量效关系。菊花菜多糖溶液的IC50为76.23μL,VC的IC50为17.69μL,菊花菜多糖溶液的清除能力比VC弱,同样也可以说明菊花菜多糖溶液具有较强的清除·OH的能力。
2.3.2 菊花菜多糖溶液对ABTS·清除能力的测定
由表4分析可得,菊花菜多糖溶液对ABTS·有较好的清除能力,且随着多糖溶液体积的增加,对ABTS·的清除效果逐渐增强。说明样品体积与清除作用间存在剂量依赖关系。由表还可得出,其清除效果低于VC。菊花菜多糖溶液与VC的IC50分别为112.25、65.81μL。
2.3.3 菊花菜多糖溶液对DPPH·清除能力的测定
从表4可以看出,在试验浓度范围内,随着菊花菜多糖的体积数的增加,其清除DPPH·的能力也逐步增强。和VC溶液的清除能力相比还有一定的差距。由表可以得到菊花菜多糖在体积数达到120μL时,清除率可以达到56.98%。在同等浓度下VC溶液的清除率则为90%。由此可以得出其清除DPPH·的能力不足VC。但不能否定菊花菜多糖也表现出了较强的抗氧化性。利用线性关系得出菊花菜多糖清除DPPH·的IC50为102.86μL。
从以上分析看出,菊花菜多糖溶液清除·OH、ABTS·、DPPH·的能力均弱于VC。这是因为各种试验因素的影响造成菊花菜多糖纯度不高,而抗氧化剂VC使用的是纯品,单位体积内浓度相对较高,所以清除力较强。
3 结论
该实验首先进行单因素试验,得出结果,在此基础上,应用响应面法对菊花菜中多糖的提取工艺进行了优化,由二次多项模型分析,得出了最优工艺条件。在38℃酶解30min的条件下,菊花菜多糖提取的最佳工艺是纤维素酶的浓度为1.5%,液固比为40mL/g,超声提取时间42min,超声提取温度80℃。在此条件下提取得菊花菜多糖为3.90%,此结果与理论预测值偏差较小,因此得出在应用响应面分析法得到的工艺条件具有可行性,而且此条件下多糖提取率高。此外,在该条件下对提取的菊花菜多糖进行了抗氧化性试验,由结果可得随着多糖浓度的升高,菊花菜多糖对·OH、ABTS·及DPPH·的清除能力逐渐增强,表明菊花菜多糖也具有较高的抗氧化活性。
[1] 胡熙明,张文康,朱庆生.中华本草[M].国家中医药管理局(中华本草)编委会.上海:上海科技出版社,1999:6847.
[2] 杨念云,任受农,胡万春,等.菊花脑嫩茎叶的化学成分[J].中国医科大学学报,2005,36(5):402-404.
[3] 翁德宝,周丽娜.菊花脑多糖及黄酮类化合物分离提取的研究[J].湖南中医药大学学报,2007(8):349-351
[4] 赵秀玲,陶文东.竹叶多糖提取工艺及体外抗氧化性研究[J].贵州师范大学学报(自然科学版),2015,33(5):92-95,116.
[5] 黎英,陈雪梅,严月萍,等.超声波辅助酶法提取红腰豆多糖工艺优化[J].农业工程学报,2015,31(15):293-301.
[6] 黎英,尤双圳,赖丹妮,等.响应面法优化超声波辅助提取状元豆多糖工艺[J].食品与发酵工业.2015,41(4):223-229.
[7] 王宗成,蒋玉仁,刘小文,等.响应面优化生姜茎叶总黄酮提取工艺及其抗氧化活性研究[J].天然产物研究与开发,2015(27):1582-1588.
[8] 何晋浙,徐瑶阳,孙培龙.不同来源猴头菌营养成分及其多糖化学组成和抗氧化活性比较[J].食品与发酵工业,2015(12):134-140.
[9] 赵文红,莫依灿,洪泽淳,等.红曲对广东客家黄酒抗氧化活性的影响[J].现代食品科技,2015,32(1):143-150.
[10]ACEDO J A,THANH C D,VAN L T S,et al.Tomato precooling using simple hydrocooler and fruit quality changes during ambient and cold storage[C/OL]//Asia Pacific Symposium on Assuring Quality and Safety of Agri-Foods 837.2008:135-140.[2016-05-25]http://www.actahort.org/books/837/837_15.htm.
[11]陈红,张艳荣,王大为,等.微波协同酶法提取玉米须多糖工艺的优化研究[J].食品科学,2010,31(10):42-46.
[12]黄慨,祝亚,冼学权,等.响应面法优化桐粕残油的超声波辅助提取工艺[J].广西科学,2015,22(6):651-657..
[13]林建原,季丽红.响应面法优化银杏叶中黄酮的提取工艺.中国食品学报,2013,13(2):83-90.
[14]赵艳红,李建科,赵维,等.常见药食植物提取物体外抗氧化活性的评价[J].食品科学,2009,30(3):104-108.
[15]陈奕,谢明勇,弓晓峰.黑灵芝提取物清除DPPH自由基作用[J].天然产物研究与开发,2006,18(6):917-921.
Optimization of extraction of polysaccharide from Chrysanthemum nankingense by using response surface methodology and evaluation of its antioxidant activity
ZHAO Xiuling,LU Lemei
(School of Life and Environment Sciences, Huangshan University, Huangshan,An’hui 245021,China)
Response surface methodology (rsm) was employed to optimize the extraction conditions of polysaccharide fromChrysanthemumnankingensecollected from huangshan (anhui province). Based on single-factor tests, box-benhnken center-composite experiment was carried out with four factors, including cellulase concentration, material liquid ratio, ultrasonic time and ultrasonic temperature. Rsm was used to determine the effect of prime factors on the yield of polysaccharide. Besides, the antioxidant activity of polysaccharide from that the optimal extraction conditions were cellulase concentration 1.5%, material liquid ratio 1:40 mg/mL, ultrasonic time 42 min, ultrasonic temperature 80℃. Under these conditions, the extraction yield of polysaccharide was 3.94%, which was close to the predicted value. Thus, the fitted quadratic regression model was valid. TheChrysanthemumnankingensepolysaccharide exhibited significant antioxidant activities in vitro in a concentration-dependent fashion. TheIC50of the obtained polysaccharide against OH, ABTS, DPPH were 76.23, 112.25, 102.86 μL, respectively.
response surface methodology;Chrysanthemumnankingense; polysaccharide; extraction; antioxidant activity
1004—5570(2016)06-0081-07
2016-06-03
安徽省大学生创新创业计划项目(AH2014103753122);2013年黄山学院校级科研项目(编号:2013xkj002);2015年度安徽省教育厅高校自然科学一般研究项目(KJHS2015B03)
赵秀玲(1973-),女,硕士,讲师,研究方向:食品功能性的研究,E-mail: zhaoxiuling2008ren@aliyun.com.
O657.7+1;O657.63
A

