Leica DMI6000 B活细胞工作站的配置及应用
李 婧, 尤元义, 石庆喜, 李 旭
(西安交通大学 第一附属医院,陕西 西安 710061)
·仪器设备供应与管理·
Leica DMI6000 B活细胞工作站的配置及应用
李 婧, 尤元义, 石庆喜, 李 旭
(西安交通大学 第一附属医院,陕西 西安 710061)

通过介绍Leica DMI6000 B活细胞工作站(Live Cell Application, LCA)的配置和技术参数,样品制备要求,图像采集的参数设置原则等,并以实例讲解LCA目前在生物医学领域的应用。DMI6000 B配有细胞孵育系统和图像采集系统,孵育系统对活细胞进行常氧或缺氧培养,图像采集系统实时采集细胞图像。图像采集系统中的焦平面跟踪系统,可防止在延时拍摄中图像变虚;明场与荧光多通道采集,可帮助实现活细胞荧光示踪;多位点采图,可帮助实现多视野动态观察;拼接扫描可采集样本全景图像;z轴扫描可对样本进行立体观察。LCA具有倒置荧光显微镜和细胞培养箱的双重功能,可跟踪观察活细胞的动态变化;DMI6000 B还可在缺氧条件下完成上述功能。
活细胞工作站; Leica DMI6000 B; 延时拍摄; 配置及应用
0 引 言
LCA是对活细胞进行不同水平动态研究的一款新仪器,对活细胞在培养的同时进行图像采集,弥补了传统显微镜只能定时观察的不足。LCA在细胞水平可以实现定性与定量分析、活细胞图像处理、活细胞动态示踪,如研究活细胞增殖、迁移[1]、侵袭[2]、凋亡[3]、内吞[4]等生物学现象,细胞迁移过程的动态评估[5]、细胞迁移速率及轨迹的研究[6]、精卵结合过程研究[7]、受精卵起始72 h发育观察[8]。在分子水平可做到基因定位定量表达的动态分析,如蛋白质翻译[9]、降解、运输、蛋白质相互作用的动态研究、蛋白质合成与胞内信号转导、细胞骨架(细胞3D结构重建及空间定位)、细胞骨架的代谢动力学测定、细胞周期各时相的动态观察[10]、荧光共振能量转移FRET、荧光示踪[11]等。因此,熟悉该仪器的配置和使用对从培养的细胞获取更多有价值的研究资料具有非常重要意义。
1 Leica DMI6000 B配置和技术参数
(1) DMI6000 B倒置研究型荧光显微镜。该显微镜包含五个物镜镜头:5×,10×,20×,40×,63×(油镜)。其中5×,10×,20×物镜具有相差功能。
显微镜使用EL6000紧凑型光源,荧光光源为汞灯,包含A、I3、N2.1三个荧光滤块。A为UV激发蓝光,激发光波长范围:340~380 nm,发射光波长425 nm;I3为蓝光激发绿光,激发光:450~490 nm,发射光515 nm;N2.1为绿光激发红光,激发光:515~560 nm,发射光590 nm。
显微镜配有shuttle开关,用于减少延时拍摄中光源对样本的损伤。每次采图,shuttle自动打开,光源照射样本采图;采集完毕,shuttle自动关闭。
(2) PECON O2-CO2-℃孵育系统。该系统可提供的细胞常规培养条件:5%CO2,37 ℃恒温,饱和湿度;可达到的缺氧浓度范围1%~10%。
系统核心构成包括五部分:孵育器S.,加热插件P或M96,3700 CTI控制器,37-2型电子温控器,氧气控制器。另外还配有CO2气瓶、氮气气瓶和加湿器等。
系统工作原理:孵育器和加热插件构成培养细胞的密闭小室;氮气或压缩空气通过氧气控制器和加湿器后,与CO2气体共同进入CTI控制器加热并混合,再输出进入小室,为细胞提供常氧或缺氧培养环境。电子温控器调控加热插件及混合气体温度,温控范围10~40 ℃;CTI控制器调控CO2浓度,调控范围2%~7.5%;氧气控制器通过调控氮气进入的流速来调控缺氧浓度。
(3) 焦平面跟踪系统AFC(Adaptive Focus Control)。AFC可根据实验时间及细胞空间位置(尤为垂直方向)的改变自动调节焦平面,确保在整个延时拍摄中,持续获得样本最清晰图像。
AFC还可帮助实现多点延时拍摄,其AFC+HighSpeed模式可自动、快速调节不同视野的焦平面,消除因数次位置移动带来的图像变虚。
(4) CCD相机。配置了Leica DFC365FX,一款拥有144万像素的高端荧光全帧CCD相机。它在信号较弱时,仍能采集到清晰的荧光照片,并可扣除样本杂背景。
相机拥有标准和NIR两种采集模式。NIR为近红外模式,可采集并增强波长大于700 nm的近红外波段,弥补了常规显微镜不能敏锐检测近红外波段荧光的缺陷。
(5) AF6000宽场系统。该系统成像原理为“面成像”,即一个时间点获得整个二维图像,区别于激光共聚焦的点成像,点成像是对样本焦平面实现点照明,点扫描[12]。
(6) 操作和分析软件。LAS AF 2.5操作软件。
2 活细胞工作站样品制备要求
(1) 待观察样品。贴壁或悬浮细胞、部分活体组织(DFC365FX相机说明书提及的三日龄黑腹果蝇幼虫)。
(2) 荧光染料的选择。参考前述1.1,荧光滤块的观察范围。
(3) 培养器材的选择。延时拍摄可选择器材:直径为35 mm或60 mm细胞培养皿、激光共聚焦专用皿、POC-R2显微镜细胞组织培养系统(见图1)、96孔板、三维培养Lab-Tek Chamber Slide(见图2)等。

图1 POC-R2系统

图2 Lab-Tek chamber slide
普通拍摄可选择器材:不同直径细胞培养皿、培养瓶、孔板、载玻片(选用0.13~0.17 μm厚度的盖玻片[13])等。
3 Leica DMI6000 B图像采集基本参数设置
3.1 长时间定时拍摄(延时拍摄)
(1) 时间序列采图。单击激活t选项,设置采集两张图片的时间间隔、采集图像总时间或总循环数等(如,每15 min拍摄一张,拍摄8 h)。将图像调节清晰后,选择Adaptive Focus Control模式,勾选AFC on、on demand mode、Hold current position,开启图像采集。
(2) 多位点采图。激活“Mark & Find”选项。在该选项中点击相应图标,可存储或删除某位置,设置完毕,点击Start,仪器会按照设定的位置逐一采图;还可实现多位点延时采图,此时需开启AFC+HighSpeed 模式,如前1.3述。
(3) 多通道采图。点击“+”“-”设置通道(FCr)数量,通过色表(LUT selection)为通道设定伪彩;在光路设置(Light Path Settings)中,通过Contrast Method选择观察方式如,明场BF、微分干涉DIC、荧光FLUO。
3.2 荧光采图
在激发光滤片(Excitation Filter)中选择合适的滤光片,如,A、I3、N2.1,见前述1.1。
将激发光强度(Intensity)调至4或5,若荧光染料抗淬灭性差可调至3;曝光时间(Exposure)200 ms左右最佳,最长不超过1 s;摄像头信号的电子增益(Gain)不宜过高,建议调至2。
3.3 拼接扫描
激活“Tile Scan”选项,点击鼠标定义某区域的两个对角位置,可拼接多个相邻视野,获得大视野图像。样本较厚且要进行荧光拼接扫描时,需同时启动z轴扫描,设定采图上、下限,以获得最清晰图像(见图5)。
3.4 z轴序列采图
激活z选项,z-position代表焦平面当前位置。调节好样本焦平面后,点击并挪动立方体两侧箭头设置z轴扫描上限(Begin)和下限(End),点击Start,仪器会采集该样本不同层面的图像。
4 活细胞工作站主要功能及在生物医学领域的应用
4.1 明场条件下的延时拍摄
明场条件下的延时拍摄通过时间序列扫描,对活细胞进行长时间培养及观察,实现对活细胞的动态研究。实验结果既可导出随时间改变的序列组图,也可导出Movie。具体应用如,单细胞示踪、实时观察细胞迁移[1]、侵袭[2]、凋亡[3]、增殖(见图3)、内吞[4]、融合[14]等生物学过程。
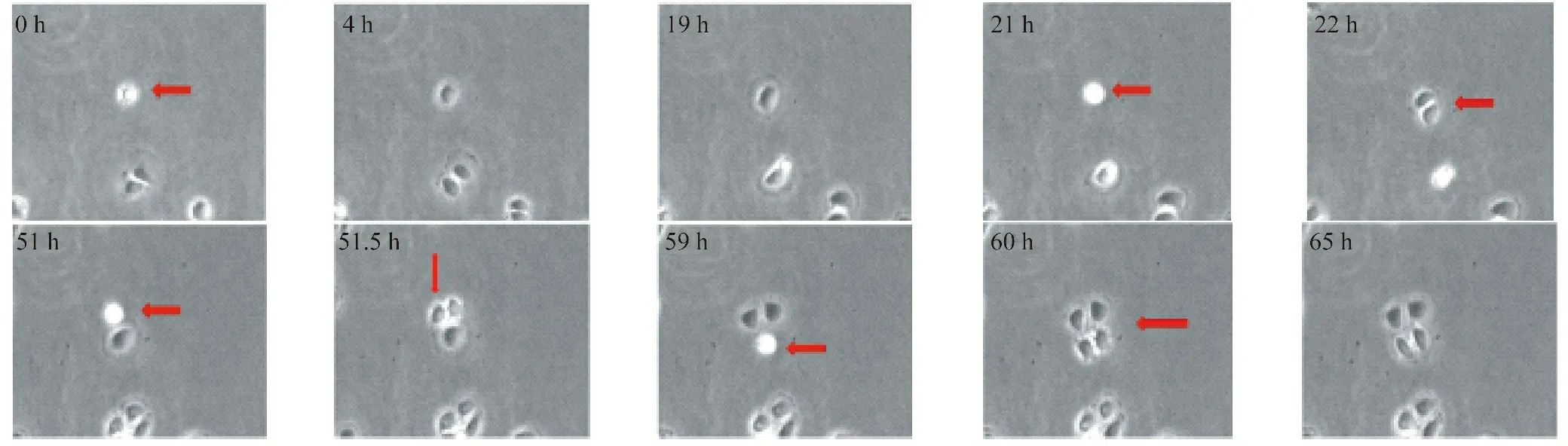
图3 明场延时拍摄卵巢癌细胞SKOV3的增殖过程(100×)
细胞在传代后4 h贴壁,19 h左右展现出完整形态,21 h变球形准备分裂,22 h第一次分裂完成;51 h其中一个子代细胞变球形准备分裂,51.5 h分裂完成;59 h另一个子代细胞变球形准备分裂,60 h分裂完成。最终由一个细胞生成4个细胞。
4.2 多通道图像采集与荧光示踪
多通道图像采集可同时进行明场与荧光延时拍摄,并进行后期不同通道图像叠加,可实现荧光示踪等功能。用于观察记录细胞内外某特定成分的动态变化过程。如,荧光示踪细胞周期中核的动态变化过程(荧光标记细胞核)[10]、老鼠胚胎干细胞体外发育过程(胞质表达荧光融合蛋白)[15]、小鼠卵母细胞后期成熟与极体排放过程(荧光标记DNA)[11]、肿瘤细胞凋亡过程(GFP标记细胞核)[16]、成釉细胞内吞荧光标记蛋白的过程[17]、荧光标记的siRNA片段转染细胞过程(见图4)等。
每张图像右上角表示拍摄时间(时:分:秒:毫秒)。组图依次为转染后0,1,2 h直至8 h的明场与荧光叠加图像。随时间延长,细胞内绿色荧光增多,说明通过转染进入细胞的siRNA片段增多。
4.3 拼接扫描
拼接扫描可用于拍摄明场或荧光条件下的组织全景图、细胞或组织大视野图(见图5)。
4.4 z轴扫描
用于观测样品空间结构和空间定位。
4.5 缺氧培养
4.1及4.2所述功能也可在缺氧条件下进行,大大拓宽了该仪器的应用范围。

图4 双通道延时拍摄FAM标记的siRNA片段转染SKOV3细胞过程(200×)

图5 银杏树枝横截面 荧光拼接扫描局部图(200×)
5 活细胞工作站维护与管理
5.1 日常维护
(1) 严格遵守仪器操作流程,避免因操作不当造成仪器损坏。
(2) 整个操作过程不要有液体流入系统,保持系统干燥和清洁,以防真菌生长。
(3) 使用完毕,切断电源,清洁物镜目镜。镜头表面用擦镜纸蘸取少量无水酒精,从中心往外周螺旋式擦拭。擦拭时勿对镜头表面施加压力。镜头表面浸油可先用擦镜纸抹去,再蘸取酒精擦拭。
(4) 显微镜表面和任何塑料部件只可用清水擦拭,不可使用有机溶剂。光学部件表面灰尘可用吸耳球吹去。
(5) 房间最适温度15~25 ℃,湿度60%;系统工作温度15~40 ℃(显微镜切勿超过40 ℃)。
5.2 使用过程注意事项
(1) 载物台初始化:打开显微镜前,务必先将密闭小室从通气与出气管上取下,放在合适位置。否则开启显微镜,载物台自动初始化会使小室发生剧烈震动,损害仪器;
(2) 启动多位点拍摄前载物台初始化:开启软件时再做一次初始化。
(3) CTI控制器预热30 min后再输入CO2。若做缺氧培养,先输入CO2,再输入氮气。
(4) 加湿器内最多加入350 mL水。
(5) 使用63×油镜时,需使用显微镜DRY/IMM按钮完成切换。
(6) 图像和数据资料必须用光盘刻录,严禁使用U盘。
[1] Gujral T S, Chan M, Peshkin L. A Noncanonical Frizzled2 Pathway Regulates Epithelial-Mesenchymal Transition and Metastasis[J]. Cell.2014, Cell159: 844-856.
[2] Wong A D, Searson P C. Microvessel Platform Live-Cell Imaging of Invasion and Intravasation in an Artificial [J]. Cancer Res 2014, 4937-4945.
[3] Poon I K H, Chiu Y H, Armstrong A J. Unexpected link between an antibiotic, pannexin channels and apoptosis [J]. Nature, 2014, Vol507:329-334.
[4] Overholtzer M, Mailleux A A, Mouneimne G. A Nonapoptotic Cell Death Process, Entosis, that Occurs by Cell-in-Cell Invasion[J]. Cell, 2007, Cell131: 966-979.
[5] 胡剑江,雷洪涛,侯燕鸣. 肿瘤细胞迁移过程中的动态评估方法[J]. 中国药理学通报,2010, 26(1): 128-131.
[6] 易诚青,姚爱华,马春辉.装载趋化因子CXCL13的中空羟基磷灰石微球对间充质干细胞的趋化效应研究[J].上海交通大学学报,2012,32(12):1532-1535.
[7] YAMASHITA M, YAMAGATA K, TSUMURA K. Acrosome Reaction of Mouse Epididymal Sperm on Oocyte Zona Pellucida[J]. Journal of Reproduction and Development, 2007, 53(2):255-262.
[8] Chawla M, Fakih M, Shunnar A. Morphokinetic analysis of cleavage stage embryos and its relationship to aneuploidy in a retrospective time-lapse imaging study[J]. EMBRYO BIOLOGY, 2014.
[9] Calmettes G, Weiss JN, Degtyar VE. A Quantitative Method to Track Protein Translocation between Intracellular Compartments in Real-Time in Live Cells Using Weighted Local Variance Image Analysis[J]. PLoS one, 2013, 8(12).
[10] Sakaue-Sawano A, Kurokawa H, Morimura T. Visualizing Spatiotemporal Dynamics of Multicellular Cell-Cycle Progression[J]. Cell, 2008, Cell132: 487-498.
[11] 毕 晔,张克梅. 活细胞工作站技术在小鼠卵母细胞实时观察中的应用[J]. 临床检验杂志,2011,29(9):678-679.
[12] 段 妍,关苑君,蓝秀健. Zeiss LSM710激光扫描共聚焦显微镜的使用和管理[J]. 实验室研究与探索,2012,31(8):228-230,239.
[13] 边 玮. 激光共聚焦显微镜样品制备方法(二)组织切片样品[J]. 电子显微学报,2010,29(4):399-402.
[14] 俞索静,肖鲁伟,吴承亮. 破骨细胞血系起源的活细胞成像观察[J]. 中国骨伤,2012, 25(4):317-323.
[15] Nowotschin S, Eakin G S, Hadjantonakis A K. Live-imaging fluorescent proteins in mouse embryos: multi-dimensional, multi-spectral perspectives [J]. Trends in Biotechnology, 2009, 266-276.
[16] 赵凯迪,高 静,李 香. 吡啶锰配合物诱导肿瘤细胞死亡的作用及对线粒体功能的影响[J]. 中国细胞生物学学报,2012,34(6):544-554.
[17] 杨 婷,周 涛,段小红. 成釉细胞受体介导的内吞功能的研究[J]. 实用口腔医学杂志,2011,27(3):307-310.
·知识园地·
摘要的分类
按摘要的不同功能来划分,大致有如下3种类型:报道性摘要、指示性摘要、报道—指示性摘要。
本刊要求科技论文写成报道性摘要,而对综述性、资料性或评论性文章可写成另两种摘要形式,下面着重介绍报道性摘要。
报道性摘要是指明一次文献的主要范围及内容梗概的简明摘要,相当于简介。报道性摘要一般用来反映科技论文的目的,方法及主要结果与结论,在有限的字数内向读者提供尽可能多的定性或定量的信息,充分反映该研究的创新之处。科技论文如果没有创新内容,如果没有经得起检验的与众不同的方法或结论,是不会引起读者的阅读兴趣的,所以本刊选用报道性摘要,以比其他类摘要字数稍多的篇幅,向读者介绍论文的主要内容,以“摘录要点”的形式报道出作者的主要研究成果和比较完善的定量及定性的信息。篇幅以300字左右为宜。
(本编辑部摘编)
Configuration and Application of Live Cell Application Leica DMI6000 B
LIJing,YOUYuan-yi,SHIQing-xi,LIXu
(The First Affiliated Hospital, Xi’an Jiaotong University, Xi’an 710061, China)
This paper introduces the configuration and function of Leica DMI6000 B Live Cell Application. It aims to expand applications of LCA in the field of biomedical research. The configuration and technical parameters, sample preparation requirements, parameter setting principles of image acquisition etc are comprehensively introduced, examples of applications of LCA in biomedical research are given. DMI 6000 B is equipped with incubating system as well as image acquiring system, the latter acquires real-time cell images when the former incubates cells in normoxia or hypoxia. In order to capture successive clear images in time-lapse imaging, adaptive focus control of image acquiring system is needed. The bright and fluorescence field help to realize living cell fluorescence trace, and multi-position image acquisition helps to get real-time cell images of several fields meanwhile. Tile scan supplies overview image of a sample; z-menu scans samples in three-dimensional. Therefore, LCA can be used for observing the dynamic changes of the cultured living cells since it integrates the function of inverted fluorescence microscope with cell culture incubator, furthermore, DMI6000 B can accomplish functions mentioned above in hypoxia.
live cell application; Leica DMI6000 B; time-lapse imaging; configuration and application
2015-04-15
国家自然科学基金面上项目(81372151)
李 婧(1984-),女,陕西西安人,硕士,助理研究员,主要从事科研仪器设备与实验室管理。
Tel.: 029-85323528, 18291420181; E-mail: li-jing-smile@163.com
李 旭(1956-),男,陕西西安人,博士,教授,博士生导师,主要从事肿瘤学方面的研究。
Tel.: 029-85323528; E-mail: lixu56@mail.xjtu.edu.cn
Q 334
A
1006-7167(2016)02-0273-04

