磁性蒙脱石对废水中磷的吸附
王 元 有
(扬州工业职业技术学院 化学工程学院, 江苏 扬州 225127)
磁性蒙脱石对废水中磷的吸附
王 元 有
(扬州工业职业技术学院 化学工程学院, 江苏 扬州 225127)

通过蒙脱石与磁性Fe3O4纳米粒子复合,对其层间距进行磁性柱撑,采用扫描电子显微镜、傅里叶变换红外光谱(FITR)对磁性蒙脱石结构进行表征,将制得的磁性蒙脱石作为吸附剂,研究了对水溶液中磷的去除效果及其影响因素。结果表明,磁性蒙脱石投入量1 g/L,初始浓度2 mol/L,pH 3左右时,废水中磷的去除率最高。
磁性蒙脱石; 吸附; 磷
0 引 言
磷是作物生长所必需的三大营养元素之一,但磷在土壤中过多地积累,会影响土壤中微量元素Zn、Mn、Fe、Cu的有效性和在植株中的含量[1]。过量的磷还会随地表径流、淋溶作用流入水体,造成地下水体磷污染,随着磷酸盐在水体中增加,蓝藻等微生物会大量富集,从而生物耗氧量提高,导致水体中的溶解氧大量流失[2-4],水体富营养化,甚至引发赤潮。为防止水体富营养化, 开发、研制废水的除磷技术是非常必要的。
目前,去除磷的方法主要有凝聚沉淀法、生物脱磷法、晶析法等,但都存在不少问题。吸附与其他常规方法(如膜滤法沉淀法)相比有许多重要的优势,特别在经济和环保方面,简单、有效、低廉、易操作[5-8]。本文采用磁性蒙脱石处理含磷废水,研究磁性蒙脱石的吸附性能,所用模拟废水中的离子为正磷酸盐。泥土是磷循环和归宿的一种介质,磷酸盐其不同的形态与泥土的亲和力和形成络合物的稳定性不同,所以泥土对其吸附行为也有很大差异,正磷酸盐通过形成共价键化合物被稳定地吸附在泥土官能团上[9]。P吸附比较有效的矿物有含Al矿物(如勃姆石)和含Fe矿物(如针铁矿、赤铁矿和高岭石)[10-12]。而这些吸收主要是因为矿物表面存在Al-OH和Fe-OH官能团,因而磷酸盐与泥土中的铁铝氧化物/氢氧化物具有较强的亲和力[13],所以泥土中铁铝氧化物的含量、存在形态、电位和所带电荷对磷的迁移、生物有效性和归宿有很大影响。水铝矿、蒙脱石等黏土矿物、铁铝氧化物对磷的吸附已有报道[14-16],但磁性蒙脱石对磷的吸附研究还未见报道。
1 实验部分
1.1 实验试剂与仪器
(1) 试剂。钠基蒙脱石(山东华潍膨润土有限公司),氢氧化钠(NaOH,国药集团化学试剂有限公司),硝酸钠(NaNO3,国药集团化学试剂有限公司),硫酸亚铁(FeSO4·7H2O,国药集团化学试剂有限公司),柠檬酸三钠(C6H5O7Na·2H2O,国药集团化学试剂有限公司),磷酸(H3PO4, A.R国药集团化学试剂有限公司),氢氧化钠(NaOH, A.R国药集团化学试剂有限公司),磷酸二氢钾(KH2PO4,A.R国药集团化学试剂有限公司),钼酸铵((NH4)6Mo7O24·4H2O, A.R国药集团化学试剂有限公司),酒石酸锑氧钾(K(SbO)C4H4O6·1/2H2O,A.R国药集团化学试剂有限公司),抗坏血酸(Vc, A.R国药集团化学试剂有限公司)。
(2) 仪器。电光分析电平(TG328型,上海电平仪器厂),傅里叶红外光谱仪(NEXUS-670F-IR),透射电子显微镜(TECNAI 12 Philip Apparatus Co., USA),振动磁强计,X-射线粉末衍射仪(Dmax/IIIB型,日本理学工业株式会社),差热-热重分析仪(DTG-50/50,日本岛津公司)。
1.2 实验方法
磁性蒙脱石的制备。
(1) 方法一。采用Fe/Mt=10 mmol/g。将8 mmol柠檬酸钠、4 mmol硝酸钠在去离水中机械搅拌混合溶解后,取8 mL 1 mol/L硫酸亚铁溶液和蒙脱石的悬浊液,加到柠檬酸钠和硝酸钠的反应体系中,用2 mol/L氢氧化钠调节pH到11,于80 ℃水浴控温搅拌1 h。将制得的磁性物质用去离子水和乙醇洗涤、离心数次后于真空干燥箱内50 ℃真空干燥0.5 h,即得磁性蒙脱石纳米粒子(FMt1),见图1。
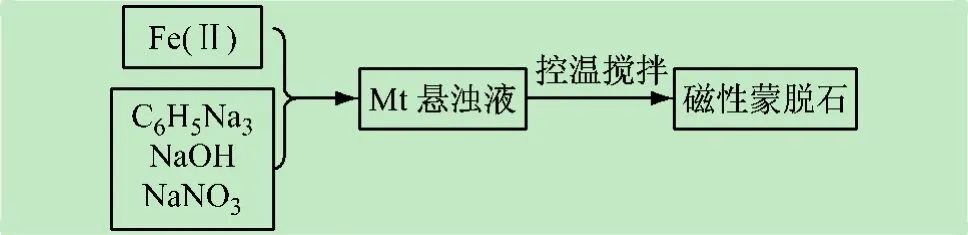
图1 方法一制备磁性蒙脱石流程图
(2) 方法二。在方法一的基础上先对蒙脱石的层间距用Fe(Ⅱ)进行柱撑。取8 ml 1 mol/L硫酸亚铁溶液,室温下磁力搅拌,边搅拌边用2 mol/L氢氧化钠调节pH为7.5,然后加入蒙脱石悬浊液搅拌10 min。将8 mmol柠檬酸钠、4 mmol硝酸钠机械搅拌混合溶解后,把搅拌好的蒙脱石悬浊液加入其中,再用氢氧化钠调节pH到11,于80 ℃水浴控温搅拌1 h。将制得的磁性物质用去离子水和乙醇洗涤、离心数次后于真空干燥箱内50 ℃干燥0.5 h,即得磁性蒙脱石纳米粒子(FMt2),见图2。

图2 方法二制备磁性蒙脱石流程图
1.3 磷模拟废液的配置
将KH2PO4于110 ℃干燥2 h,干燥器中冷却后,准确称取一定量的KH2PO4溶解,加入一定量的硫酸(1+1)溶液,于容量瓶中定容到刻度线。
1.4 磁性蒙脱石对模拟废水的吸附反应
将磁性蒙脱石纳米粒子置于不同的模拟废液中,采用控制变量的方法,测定在不同的吸附剂用量、废液初始浓度、pH值、反应时间下对废液的吸附效果。
1.5 废液中磷含量的测定
采用钼锑抗分光光度计测定。根据标准曲线的拟合方程换算出滤液中磷的含量,然后分别计算磷吸附量和去除率:
(1)
(2)

2 结果与讨论
2.1 磁性蒙脱石红外光谱分析
2.1.1 蒙脱石的红外光谱分析
图3是对磁性蒙脱石与原蒙脱石对比分析的红外光谱图,图中3 000~3 600 cm-1均有宽广的吸收谷, 这是由H2O的伸缩振动所引起的吸收峰,在红外谱图中,通常我们首先可获得有关H2O和—OH的信息。在1 600~1 650 cm-1处原蒙脱石和制备的磁性蒙脱石都有吸收谷,可归属于蒙脱石层间水分子的弯曲振动,表明在蒙脱石分子中含有一定的结晶水,图3的3条谱线中在900~1 100 cm-1处和467 cm-1处的吸收谷分别归属于Si—O伸缩振动和Si—O可能发生的变角振动所引起[17]。图3中磁性蒙脱石和原蒙脱石红外谱图的峰型基本一致,表明磁性对蒙脱石的基本骨架没有产生明显的影响。对比图3中的3条谱线,在580 cm-1的吸收谷,FMt1和FMt2制备的磁性蒙脱石在原蒙脱石的峰型的基础上都有成包的趋势,对比Fe3O4的标准图谱,其在560 cm-1出现一包状的吸收谷,因此认为此处的吸收谷是由蒙脱石上载有了Fe3O4所引起的[17]。

图3 磁性蒙脱石和原蒙脱石对比的Ft-IR图
2.1.2 磁性蒙脱石形貌的影响
在蒙脱石负载磁性四氧化三铁纳米粒子的制备过程中,不仅受到反应体系中柠檬酸钠和硝酸钠用量的影响,反应时间对四氧化三铁的形成、粒径的调控和在蒙脱石表面的附着都有重要的影响。从图4可见,四氧化三铁纳米粒子基本均匀地负载在蒙脱石的表面,四氧化三铁纳米粒子的粒径控制得很均匀,其在蒙脱石表面附着得也很均匀,达到了理想负载的效果。

图4 磁性蒙脱石的电镜图
2.2 磁性蒙脱石处理废水中磷效果
2.2.1 磁性蒙脱石的投入量对磷吸附效果的影响
从图5(b)可以看出,随着吸附剂用量的增加,磷的去除率有所增大,其中吸附剂Mt对磷的去除率增大得最明显,且在吸附剂用量达到1.2 g/L时去除率达最大,并趋于稳定。对照图5(b)中3条曲线可知,吸附剂FMt1和FMt2对磷的去除率随其用量的增加略有增大,最大去除率已接近100%,其去除效果明显优于Mt。对磷的吸附很大程度可能依赖于吸附剂内外表面提供的活性吸附位的数量,比表面积越大结晶度越高,表面活性和吸附位越多,同时用量越多,活性吸附位越多,磷的去除率增大,如图5(a)所示,在磷浓度一定时,单位吸附剂吸附磷的量减少。
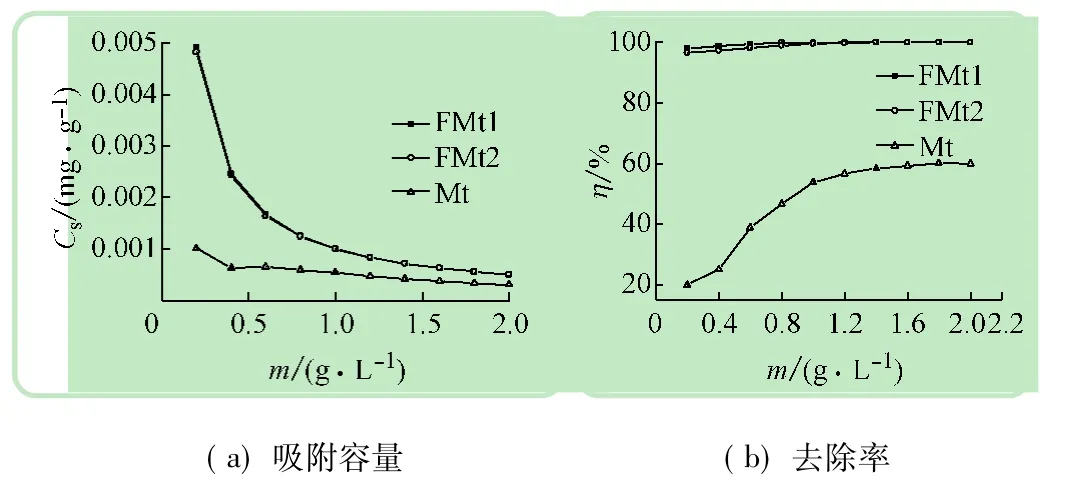
图5 吸附剂的用量对P吸附效果的影响
2.2.2 废水初始浓度对磷吸附效果的影响
在保持吸附剂用量不变的情况下,不断改变废水中磷浓度来研究其除磷效果,如图6所示。随着废液中磷含量的增加,3种吸附剂对磷的去除率都下降。在废液浓度2 mol/L时,磷的去除率达到了100%。随着浓度的增大,吸附剂对于磷的去除率也下降了50%左右。随着废水中磷浓度的增加,去除率不断减小,而吸附剂对磷的吸附容量呈不断增加的趋势,这与吸附剂处理重金属废水的现象一致,也是因为随着磷在废水中数量的不断增加,不断地被吸附到吸附剂表面和孔道内,从而导致吸附剂吸附量的不断增加。图6(b)所示,磷的去除率不断减小,说明了吸附剂对废液中磷的吸附增加量明显小于废液中磷的增加量。

图6 P初始浓度对吸附效果的影响
2.2.3 pH对磷吸附效果的影响
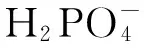
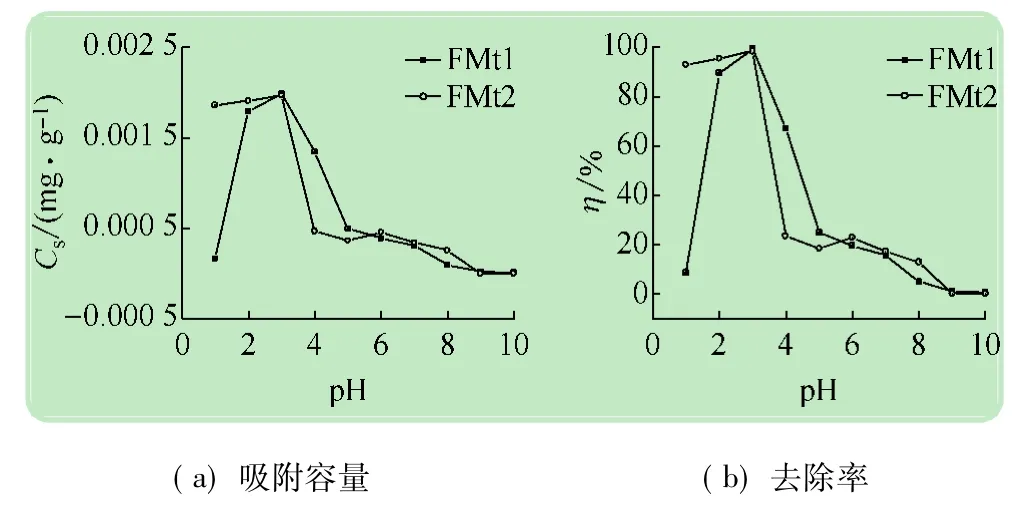
图7 pH对P吸附效果的影响
2.2.4 反应时间对磷吸附效果的影响
磁性蒙脱石对磷的吸附行为是一个复合动力学过程,分为快吸附和慢吸附。如图8所示的曲线波动不大,反应开始时,磷主要靠静电引力直接吸附于蒙脱石的外表面的活性吸附位,吸附速率很快,这一平衡很迅速就达到,这一过程是慢吸附。随后,主要表现为磷在微孔结构中的扩散和在内表面的吸附,其扩散速率与孔径大小、孔径连通度和活化能等因素密切相关,因此吸附速率较慢,为慢吸附过程。

图8 吸附时间对P吸附效果的影响
3 结 语
通过红外分析得出,Fe3O4纳米粒子的复合,使蒙脱石的层间距和层间结构发生了改变,有铁的氧化物进入到层间距。透射电镜和扫描电镜下看到,蒙脱石的表面也被修饰上了磁性四氧化三铁粒子,磁性粒子基本均匀地分布在蒙脱石的表面。磁性蒙脱石作为吸附剂能够很好地去除废水中的磷,其去除率都达到了100%。通过从磁性蒙脱石的投入量、废水初始浓度和pH对吸附效果进行研究,得出对于含磷废水磁性蒙脱石的投入量在1g/L,初始浓度在2 mol/L,pH在3左右时,去除率最高。
[1] 黄德明, 徐秋明, 李亚星, 等. 土壤氮、磷营养过剩对微量元素锌、锰、铁、铜有效性及植株中含量的影响 [J]. 植物营养与肥料学报, 2007, 13(5): 966-970.
[2] Fox I, Malati M A. The adsorption and release of phosphate from sediments of a river receiving sewage effluent [J]. Chem Tech Biotechnol, 1993, 57: 97-107.
[3] Sharpley A N, Chapra S C, Wedepohl R,etal. Managing agriculrural phosphorus for protection of surface water: Issues and options. Journal of Environmental Quality [J]. Environ Qual, 1994, 23: 437-451.
[4] Ruan H D, Gilkes R. Phosphorus accumulationin farm ponds and dams in southwest Australia [J]. Environ Qual, 2000, 29: 1875-1881.
[5] Hashem A, Akasha R A, Ghith A,etal. Adsorbent based on agricultural wastes for heavy metal and dye removal [J]. Energy Edu Sci Technol, 2007, 19: 69-86.
[6] Ravikumar K, Deebika B, Balu K. Decolourization of aqueous dye solutions by a novel adsorbent [J]. Journal of Hazardous Materials, 2005, 122(1-2): 75-83.
[7] 雷绍民,郝 骞,熊毕华,等.蒙脱石矿物特性及开发利用前景[J].资源环境与工程,2006,20(5):565-569.
[8] Marcel G Martins, Daniel O, Martins T A,etal. Synthesis and characterization of montmorillonite clay intercalated with molecular magnetic compounds[J].Solid State Chemistry, 2015, 228(8):99-104.
[9] Daimei Chen, Wa Li, Yanru Wu,etal. Preparation and characterization of chitosan/montmorillonite magnetic microspheres and its application for the removal of Cr (VI) [J]. Chemical Engineering, 2013, 221(4): 8-15.
[10] Ileana Perassi, Laura Borgnino.Adsorption and surface precipitation of phosphate onto CaCO3-montmorillonite: effect of pH, ionic strength and competition with humic acid [J].Geoderma, 2014,232(12): 600-608.
[11] Dawen Gao, Hang Yin, Lin Liu,etal. Effects of idle time on biological phosphorus removal by sequencing batch reactors [J].Environmental Sciences, 2013, 25(12): 2396-2402.
[12] You-Hwan Son, Jung-Kun Lee, Yee Soong,etal. Heterostructured zero valent iron-montmorillonite nanohybrid and their catalytic efficacy[J].Applied Clay Science, 2012, 62(6): 21-26.
[14] Sunjin Kim, Yunhee Lee, Sun-Jin Hwang.Removal of nitrogen and phosphorus by Chlorella sorokiniana cultured heterotrophically in ammonia and nitrate [J].International Biodeterioration & Biodegradation,2013, 85(12): 511-516.
[15] Meng Zhang, Kai Zheng, Jiajia Jin,etal. Effects of Fe(II)/P ratio and pH on phosphorus removal by ferrous salt and approach to mechanisms[J].Separation and Purification Technology,2013, 118(10):801-805.
[16] Krishnan K A, Haridas A. Removal of phosphate from aqueous solutions and sewage using natural and surface modified coir pith [J]. Hazard Mater, 2008,152(16) 527-535.
[17] Borggaard O K, Raben-Lange B, Gimsing A L,etal. Influence of humic Substances on phosphate adsorption by aluminium and iron oxides [J].Geoderma,2005,127 (3) 270-279.
[18] Kasama T, Watanabe Y, Yamada H. Sorption of phosphates smectites and micaatacidictoneutralonAI pillaredpH[J].Appl Clay SoL,2004,25(3):167-172.
Adsorption of Phosphorus by Magnetic Montmorillonite in Wastewater
WANGYuan-you
(Department of Chemical Engineering, Yangzhou Polytechnic Institute, Yangzhou 225127, China)
Magnetic montmorillonite was prepared by combing montmorillonite with magnetic Fe3O4nanoparticles. Magnetic montmorillonite was regard as adsorbent; its removal efficiency of phosphorus and the relevant influence factors were studied. By studying the influence of input amount of magnetic montmorillonite, initial concentration of waste water and pH on the adsorption efficiency, it found that the removal efficiency of phosphorus reached the maximum value when the input amount of magnetic montmorillonite was 1 g/L, the initial concentration was 2 mol/L, and the pH was 3.
magnetic montmorillonite; adsorption; phosphorus
2015-04-23
江苏省高级访问学者基金(2015FX089)资助;2014年校级‘青蓝工程’资助;“江苏省环境材料与环境工程重点实验室”开放课题(K13065)资助
王元有(1977-), 男,江苏仪征人,副教授,主要研究方向为复合材料研究。Tel.:13665272372;E-mail:wangyy@ypi.edu.cn
X 703
A
1006-7167(2016)02-0041-04

