七里海中华绒螯蟹遗传多样性的RAPD和ISSR分析
石洪玥,刘 阳,王晓梅,高金伟,邱琳珊,李晶晶
( 1.天津农学院 水产学院,天津市水产生态及养殖重点实验室,天津300384;2.天津市水生动物疫病预防控制中心,天津300402 )
七里海中华绒螯蟹遗传多样性的RAPD和ISSR分析
石洪玥1,刘 阳1,王晓梅1,高金伟1,邱琳珊1,李晶晶2
( 1.天津农学院 水产学院,天津市水产生态及养殖重点实验室,天津300384;2.天津市水生动物疫病预防控制中心,天津300402 )
利用RAPD-PCR及ISSR-PCR两种分子标记技术,分析了七里海中华绒螯蟹第6代繁育群体的遗传多样性。用10个多态性高的RAPD引物对24个七里海中华绒螯蟹样本个体进行扩增,共检测出107个不同的扩增位点,扩增片段大小为300~2300 bp。其中多态位点总数为66个,平均多态位点比例为61.32%,群体内香农-维纳多样性值为0.1714。用 8 个多态性高的ISSR 引物对24个个体共检测到106个位点,扩增片段为200~1500 bp。其中多态性位点79 个,平均多态位点百分率为74.53%,群体内香农-维纳多样性值为0.1778。结果显示,该群体的多态位点比例和香农-维纳多样性值均较大,说明其有较丰富的遗传多样性,同时也说明RAPD和ISSR技术用于七里海中华绒螯蟹核基因组的遗传多样性分析,具有较高的检出率和灵敏度。
七里海中华绒螯蟹;遗传多样性;RAPD-PCR;ISSR-PCR
中华绒螯蟹(Eriocheirsinensis)在我国境内分布较广,自然分布主要在长江水域、辽河水域、瓯江水域及海河水域的四大水系中[1]。由于其极具市场价值,已成为我国水产养殖领域的重点培育品种。自20世纪70年代末中华绒螯蟹人工养殖和人工育苗的难关被突破后,中华绒螯蟹养殖改变了蟹苗完全依赖天然产量的局面,但随着中华绒螯蟹养殖产业的迅猛发展[2-5],天然中华绒螯蟹的苗种明显不能满足其需求,在养殖生产过程中需从各地引进苗种,导致中华绒螯蟹基因间的混杂以及优势基因的丧失[6-7]。由于过度捕捞、环境污染、兴修水利、水质资源变化等多种原因,蟹苗的自然资源产量已濒临枯竭。因此,通过有效的试验技术对七里海中华绒螯蟹种质资源进行探究,分析其遗传背景、遗传差异和遗传多样性,不仅有助于七里海中华绒螯蟹种群的鉴别,而且对七里海中华绒螯蟹的养殖和育种也大有帮助[8]。
物种遗传物质变异多样性研究可直接反映在DNA分子标记技术的结果上,DNA标记是对遗传变异的直接反映,且信息丰富,可作为生物种质鉴定的新方法。因此,DNA分子标记技术对遗传学研究和有关方面的育种起到了有效的推动作用[9]。目前,对中华绒螯蟹群体遗传多样性的研究已见相关报道,如胡鹏飞等[10]采取RFLP 技术对长江水系中华绒螯蟹线粒体DNA的遗传多样性进行分析。高志千等[11]用RAPD方法分析了辽河、长江和瓯江中华绒螯蟹种群的遗传变异。郑芳等[12]应用ISSR分子标记技术对天然水域中华绒螯蟹进行遗传检测。此外,还有关于中华绒螯蟹在同工酶水平上的遗传变异[13-14]以及微卫星SSR分析[15]的研究报道。
本研究利用RAPD 和ISSR两项技术对七里海中华绒螯蟹第6代繁育群体的遗传多样性进行分析,旨在了解七里海中华绒螯蟹的基因库,为七里海中华绒螯蟹的良种繁育以及中华绒螯蟹现有资源的保护以及开发和利用提供理论依据,同时对RAPD和ISSR两种分子标记技术进行了比较和探讨。
1 材料与方法
1.1 材料
试验中分析用样本为天津市水生动物疫病预防控制中心培育的七里海中华绒螯蟹第6代繁育群体,随机选取30只个体,样本取回后,附肢于95%乙醇保存备用。
1.2 主要试剂和仪器设备
1.2.1 药品和试剂
无水乙醇:天津市恒昊公司化学试剂厂;Taq酶:生工生物工程(上海)股份有限公司;三羟甲基氨基甲烷(Tris):美国Genview公司;100 bp+1.5 kb DNA Marker-K:生工生物工程(上海)股份有限公司;EDTA-2Na:生工生物工程(上海)股份有限公司;蛋白酶K:美国AMRESCO公司;三羟甲基氨基甲烷饱和酚:鼎国生物工程有限公司;三氯甲烷:青岛化学试剂厂;异戊醇:青岛化学试剂厂;冰乙酸:天津市风船化学试剂科技有限公司;TE缓冲液:10 mmol/L Tris-HCl(pH=8.0),1 mmol/L EDTA,pH=8.0;琼脂糖:进口分装,鼎国生物工程有限公司;上样缓冲液(6X):0.25%溴酚蓝,40%(m/V)蔗糖水溶液;PCR水(RNase Dnase-free):生工生物工程(上海)股份有限公司;1×TAE:50×TAE 20 mL,蒸馏水 980 mL;溴酚蓝:鼎国生物工程有限公司;引物:生工生物工程(上海)股份有限公司。
1.2.2 主要仪器和设备
高速离心机(德国 Eppendorf公司,5417R型),生物安全柜(上海力申科技有限公司,HFsafe 900/C型),PCR仪(美国MJ Research公司,PTC-200 型),电泳检测设备[君意东方电泳设备(北京)有限公司,JY600 型],凝胶成像分析仪(英国SYNGENE公司,GENEGENIUS型),电热恒温水浴锅(上海博迅实业有限公司,HHS型),超微量紫外可见分光光度计(德国 IMPLEN公司,P-300 型)。
1.3 试验方法
1.3.1 总DNA的提取
采用常规酚/氯仿提取方法从七里海中华绒螯蟹的螯肢肌肉中提取总体DNA。
1.3.2 RAPD和ISSR扩增反应体系及反应程序
RAPD和ISSR的扩增反应总体积为25 μL,包括:2.5 μL 10× buffer,0.5 μL dNTP(10 mmol/L),2 μL引物(5 μmol/L),0.3 μL Taq plus DNA聚合酶(5 U/μL),18.7 μL PCR水,1 μL样本DNA。RAPD引物购自生工上海生物工程股份有限公司。ISSR扩增反应所用50个引物是依据加拿大哥伦比亚大学(UBC)公布的第9套ISSR引物序列(http://www.Michaelsmith.Ubc.a/services/NAPS/ Primer-Sets/Primers),由生工上海生物工程股份有限公司合成。RAPD扩增PCR循环程序:首先经94 ℃变性5 min后,进行40个扩增循环,每个循环包括94 ℃,1 min;37 ℃,1 min;72 ℃,2 min;最后72 ℃延伸10 min。ISSR扩增PCR循环程序:经95 ℃预变性4 min后,前15个扩增循环,每个循环包括94 ℃ 变性40 s,温度A退火40 s,72 ℃延伸1.5 min, 后22个循环包括94 ℃变性45 s,温度B退火40 s,72 ℃延伸1.5 min,最后72 ℃延伸10 min。扩增产物用1.8%的琼脂糖进行电泳检测(5 V/cm)。将重复性好、扩增条带清晰的电泳图谱用于七里海中华绒螯蟹的遗传多态性分析。
1.3.3 数据分析
电泳检测后的图谱利用RAPD分析软件Quantity One 4.6.2进行分析,选取清晰的扩增片段进行数据统计,将有条带的记为1,无条带的记为0,得到0、1矩阵,从而统计位点总数,多态位点数以及多态位点比例等[16]。
香农—维纳多样性指数H0=-∑πilnπi
香农—维纳多样性值H=-∑πilnπi/N
式中,πi为某一条带在某一群体中出现的频率,N为所测的总位数。
群体的多态位点百分率/%=该群体的多态位点数/总位点数×100%
群体的多态位点频率/%=具有该位点的样本数/总样本数×100%
2 结果与分析
2.1 RAPD和ISSR引物筛选结果
共用33个RAPD引物和30个ISSR引物对七里海中华绒螯蟹核基因组进行分析,其中21个RAPD引物具有扩增产物,10个引物具有清晰的扩增条带。8个ISSR引物,扩增条带清晰,稳定性好,用于进行七里海中华绒螯蟹样本的遗传多样性分析。
2.2 RAPD扩增及数据统计结果
利用10个多态性高的RAPD引物对24个七里海中华绒螯蟹样本个体进行扩增,引物S97、S397、S376和S83的扩增结果见图1。统计分析显示,共检测出107个不同的扩增位点,扩增片段大小为300~2300 bp。每个引物扩增出多态位点数4~9个,位点总数8~13个。10个引物多态位点百分率为50.00%~72.73%,多态位点总数为66个,平均多态位点百分率为61.32%(表1)。说明RAPD技术用于七里海中华绒螯蟹核基因组的遗传多样性分析,具有较高的检出率和灵敏度。根据多态性位点的基因频率计算出群体内香农—维纳多样性指数为 18.3419,群体内香农—维纳多样性值为0.1714。可以看出七里海中华绒螯蟹群体的遗传多态性较高。

图1 RAPD引物S97、S397、S376、S83在七里海中华绒螯蟹群体中的扩增图谱注:泳道M为Marker,100 bpDNA标准分子量.下同.
2.3 ISSR扩增结果
利用8个多态性高的ISSR引物对24个七里海中华绒螯蟹样本个体进行扩增,引物817、835、846和848的扩增电泳图见图2。统计分析显示,共检测出106个不同的扩增位点,扩增片段大小为200~1500 bp。每个引物扩增出多态位点数7~19个,位点总数为11~21个。8个引物多态位点百分率为53.85%~90.47%,多态位点总数为79个,平均多态位点百分率为74.53%(表2)。由扩增图谱可见,每个引物在群体的不同个体间均表现出很高的多态性。根据多态性位点的基因频率计算出群体内香农—维纳多样性指数为18.8425和群体内香农—维纳多样性值为0.1778,可见,七里海中华绒螯蟹表现出丰富的遗传多样性。

图2 ISSR引物817、835、846、848在七里海中华绒螯蟹群体中的扩增图谱
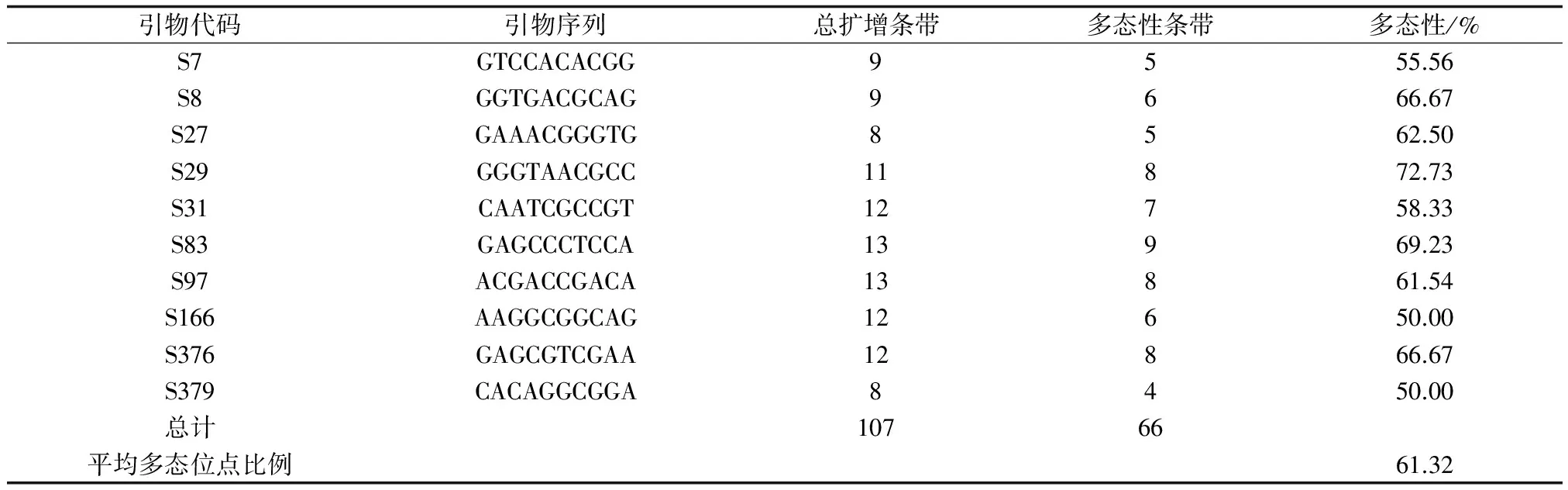
表1 筛选出的RAPD引物序列及其扩增结果

表2 筛选出的ISSR 引物序列及其扩增结果
3 讨 论
七里海中华绒螯蟹是天津宁河县的特产,因在天津七里海水域生长而以此得名,早在清朝年间就被视为宫廷贡品,百姓对其低脂肪、高蛋白以及独特的风味更是赞不绝口,2006年12月,国家质检总局对七里海中华绒螯蟹的地理标志产品保护的申请给予批准[17]。
遗传多样性是生物多样性研究的重要内容,只有通过对遗传多样性的研究才能从本质上揭示物种多样性的起源、变异和进化[18]。平均多态位点比率和香农-维纳多样性指数是衡量生物群体遗传多样性高低的参数。RAPD和ISSR分子标记技术是评估遗传多样性的一种有效手段,二者以其高度多样性在物种的遗传多样性研究已得到了广泛的应用[19]。RAPD技术在20世纪90年代末期得到广泛地应用与发展,其是以PCR技术为基础的可对整个未知序列核基因组的遗传多态性进行分析的一种分子标记技术[20]。RAPD 分析技术无需事先了解所要研究生物的核苷酸序列组成,所用引物可随机地选定与合成,每个RAPD 反应中,仅加单个引物,扩增无特异性,退火温度较低,因此可保证核苷酸引物与模板DNA的稳定结合,同时允许适当的错配,使得RAPD 有较高的检出率,RAPD 分析所需的DNA样品量极少,RAPD 技术简便易行、省时省力,易于程序化,利用一套随机引物便可得到大量的分子标记,并可借助计算机软件进行相应地统计分析。
我国在20世纪90年代后期[21-28]开始对中华绒螯蟹的分子遗传学进行研究,应用RAPD技术,对绒螯蟹属种间[中华绒螯蟹和日本绒螯蟹(E.japonica)]及中华绒螯蟹种群间的亲缘关系与分子遗传标记进行研究。如谢浩等[21]利用RAPD技术对中华绒螯蟹、日本绒螫蟹及日本绒螯蟹合浦亚种3种绒螫蟹亲缘关系的研究,发现了区分中华绒螯蟹与日本绒螯蟹的分子遗传标记。周开亚等[22]首次应用RAPD标记对中华绒螯蟹种群进行了分子鉴定,在200个随机引物中,筛选出2个特异性RAPD引物能够用于长江种群的鉴别。李思发等[23]应用RAPD分析技术,得出辽河与瓯江中华绒螯蟹种群的遗传距离最大(0.171)。邱涛等[24-25]用RAPD 方法分析了辽河、长江和瓯江种群的遗传变异,并用RAPD技术识别中华绒螯蟹性别差异,发现17个引物扩增出了群体水平的性别差异,筛选出一个引物扩增出了个体水平的性别差异。赵姝华等[26]采用RAPD技术对中华绒螯蟹同一来源的不同个体进行遗传差异分析,初步得出个体间遗传变异在20%以下,同源程度达80%以上。
ISSR方法是基于 SSR 基础上的一种分子标记手段,该技术利用锚定引物扩增微卫星位点之间的区域,与RAPD相比,其每条引物可产生更多的多态性条带[29]。相较于RAPD标记在中华绒螯蟹方面的研究,ISSR标记在中华绒螯蟹种质研究中的报道并不多见。郑芳等[12]采用ISSR 技术鉴定4个水系(鸭绿江、长江、闽江和南流江)中华绒螯蟹,共获得80条清晰稳定的条带,其中有53条多态性条带,多态率为66.25%。
本研究利用10条RAPD引物和8条ISSR引物分别对七里海中华绒螯蟹第6代繁育群体进行了总 DNA 的基因扩增,且两种分子标记技术均能扩增出清晰、稳定的条带。由研究结果可以看出,RAPD和ISSR两种标记方法获得的每条引物多态性位点的平均值分别为6.60个和 9.88 个,多态性条带百分率的平均值分别为61.32%和 74.53%。但两种分子标记技术所表现出的物种的遗传信息不尽相同,可见,七里海中华绒螯蟹存在丰富的遗传多样性。
遗传多样性是指存在于生物个体间、单个物种间以及物种之间的基因多样性[30]。一种生物的遗传变异越突出、越多样性,它对环境的适应能力越强,同时一个物种对环境的适应能力越强它的进化潜力也就越大。群体的香农—维纳多样性值是衡量群体遗传多样性的重要指标,此数值越大则表明该物种的遗传多样性越高,对环境的适应能力也就越强。根据多态性条带的基因频率分别计算出RAPD和ISSR标记技术群体内香农—维纳多样性指数为 18.3419和18.8425,群体内香农—维纳多样性值为0.1714和0.1778。可见,七里海中华绒螯蟹第6代繁育群体具有较高的遗传多态性。电泳图谱可知,每个引物在该群体中,均表现出很高的多态性,同时也说明了RAPD和ISSR标记技术可以成功地对七里海中华绒螯蟹核基因组DNA进行扩增并进行遗传多样性分析。两种标记技术均能得到各自的的多态性条带,但是所呈现的多态性和检测水平各不相同,因此,结合RAPD和ISSR两种标记技术获得的七里海中华绒螯蟹遗传多样性信息更全面客观。
[1] 马成学, 李晓东, 王晓梅, 等. 绒螯蟹线粒体细胞色素b基因的RFLP分析[J]. 天津师范大学学报, 2006, 26(3):23-27.
[2] 李思发, 工成辉, 赵乃刚. 湖泊放养长江水系中华绒螯蟹的性成熟规律研究[J]. 水生生物学报, 2001, 25(4):251-257.
[3] 许步邵. 河蟹养殖技术[M]. 北京:金盾出版社, 1987:36-51.
[4] 张德隆, 杜小燕, 赵金利, 等. 河蟹性早熟成因及控制方法的研究[J]. 淡水渔业, 2001, 31(4):36-39.
[5] 刘伟. 长江水系河蟹不同家系一龄蟹种生长的比较研究[D]. 上海:上海海洋大学, 2010.
[6] 谷孝鸿, 赵福顺. 长江中华绒螯蟹的资源与养殖现状及其种质保护[J]. 湖泊科学, 2001, 13(3):267-271.
[7] 彭武汉.中华绒螯蟹种群在珠江流域变异问题的初步探讨[J]. 水产科技情报, 1986, 13(2):32-42.
[8] 张秀梅, 柳广东, 高天翔. 绒螯蟹种质资源研究进展[J].青岛海洋大学学报, 2002, 32(4):533-542.
[9] 朱颜, 周国利, 吴玉厚, 等. 遗传标记的研究进展和应用[J]. 延边大学农学学报, 2004, 26(1):64-69.
[10] 胡鹏飞, 王茜, 戴伟, 等. 长江水系中华绒螯蟹线粒体DNA的遗传多样性研究[J]. 水产学杂志, 2006, 19(1):1-5.
[11] 高志千, 周开亚. 中华绒螯蟹遗传变异的RAPD分析[J].生物多样性, 1998, 6(3):186-190.
[12] 郑芳, 吕秀玲, 孙红英, 等. ISSR标记在河蟹种质检测中的应用[J].中国水产科学, 2007, 14(1):46-51.
[13] 乔新美, 曹维孝, 邹世平. 长江、瓯江中华绒螯蟹几种同工酶的分析比较[J]. 淡水渔业, 1994, 24(5):10-13.
[14] Li G,Shen Q, Xu Z. Morphometric and biochemical genetic variation of the mitten crab,Eriocheir, in southern China [J]. Aquaculture, 1993,111(1/4):103-115.
[15] Sui L Y, Zhang F M, Wang X M. Genetic diversity and population structure of the Chinese mitten crabEriocheirsinensisin its native range[J]. Mar Biol, 2009, 156(8):1573-1583.
[16] Wachira F N, Waugh R, Hackett C A, et al. Detection of genetic diversity in tea(Camelliasinensis) using RAPD markers[J]. Genome, 1995, 38(7):201-210.
[17] 国家质量监督检验检疫总局网.关于批准对七里海河蟹实施地理标志产品保护的公告[EB/OL].2006-12-22. [2015-09-16]http://www.aqsiq.gov.cn/xxgk_13386/jlgg_12538/zjgg/2006/200701/t20070118_315367.htm.
[18] Ayliffe M A,Lawrence G J,Ellis J G,et al. Hetero-duplex molecules formed between allelic sequences cause nonparental RAPD bands[J]. Nucleic Acids Research,1994, 22(9):1632-1636.
[19] Karp A, Edwards K J. Molecular technologies in the analysis of the extent and distribution of genetic diversity, IPGRI Workshop on molecular genetic tools in plant genetic resources[M]. Rome:IPGRI, 1995.
[20] 周孟娇, 刘臻. RAPD 技术及其在虾、蟹类研究中的应用[J]. 水产科技情报, 2003, 30(1):25-28.
[21] 谢浩, 陆仁后, 项超美, 等. 利用RAPD技术对三种绒螯蟹亲缘关系的研究[J]. 水生生物学报, 1999, 23(2):120-125.
[22] 周开亚, 高志千. RAPD 标记鉴别中华绒螯蟹种群的初步研究[J]. 应用与环境生物学报, 1999, 5(2):176-180.
[23] 李思发, 邹曙明. 中国大陆沿海6水系绒螯蟹(中华绒螯蟹和日本绒螯蟹)群体亲缘关系:RAPD指纹标记[J]. 水产学报, 1999, 23(4):325-330.
[24] 邱涛, 陆仁后, 项超美, 等. RAPD 方法对中华绒螯蟹长江、辽河、瓯江三群体的遗产多样性分析[J]. 淡水渔业, 1997, 27(5):3-6.
[25] 邱涛, 陆仁后, 项超美, 等. 用RAPD技术识别中华绒螯蟹性别差异[J].水产学报,1998, 22(2):175-177.
[26] 赵姝华, 张胜利, 温恩涛, 等. 中华绒螯蟹RAPD扩增条件及个体间遗传差异[J].水产科学, 1998, 17(5):3-6.
[27] 项超美, 陆仁后, 谢浩, 等. 四种十足目甲壳动物遗传差异的RAPD分析[J].水生生物学报, 1998, 22(3):251-256.
[28] Wolfe A D, Xiang Q Y, Kephart S R. Assessing hybridization in natural populations ofPenstemon(Scrophulariaceae) using hypervariable intersimple sequence repeat (ISSR) bands[J]. Molecular Ecology, 1998, 7(9):1107-1125.
[29] 丁淑燕, 黄亚红, 柏如发, 等. 江苏及安徽地区十个中华绒螯蟹成蟹群体的RAPD分析[J].水产科学, 2008, 27(8):418-420.
[30] 庞广昌, 姜冬梅. 群体遗传多样性和数据分析[J]. 林业科学, 1995, 31(6):543-550.
AnalysisofGeneticDiversityofChineseMittenHandedCrabEriocheirsinensisfromQilihaibyRAPDandISSRMarkers
SHI Hongyue1,LIU Yang1,WANG Xiaomei1,GAO Jinwei1,QIU Linshan1,LI Jingjing2
( 1.Tianjin Key Laboratory of Aquatic Ecology and Aquaculture, College of Fisheries,Tianjin Agricultural University, Tianjin 300384, China; 2.Tianjin Aquatic Animal Infectious Disease Control and Prevention Center, Tianjin 300402, China )
Two types of molecular markers, namely, Randomly Amplified Polymorphic DNA (RAPD) and Inter-Simple Sequence Repeat (ISSR) were used to detect the genetic diversities at the intra sixth generation breeding population of Chinese mitten handed crabEriocheirsinensisfrom Qilihai. Using 10 RAPD primers selected from 33 primers, a total of 107 amplified loci ranging from 300 to 2300 bp were observed from 24 individuals, and 66 of 107 loci detected were polymorphic with the percent of 61.32%, and the Shannon′s index of 18.3419. Eight ISSR primers of 50 primers used generated 106 reproducible and stable bands, ranging from 200 to 1500 bp, 79 of 107 loci detected were polymorphic with the percent of 74.53%, and the Shannon′s index of 18.8425. These findings indicated that the sixth generation breeding population had high genetic diversity, and that the proportion of polymorphic loci and Shannon′s index of Qilihai Chinese mitten handed crab were high, indicating that they have abundant genetic diversity.
Eriocheirsinensisin Qilihai; genetic diversity; RAPD; ISSR
10.16378/j.cnki.1003-1111.2016.03.011
S917
A
1003-1111(2016)03-0255-06
2015-09-16;
2015-11-10.
天津市水产局科技发展计划项目(J2013-21).
石洪玥(1986-),女,助理实验师;研究方向:水产养殖学.E-mail:youyan_shy@126.com.通讯作者:王晓梅(1962-),女,教授;研究方向:水产动物遗传育种及分子生物学.E-mail: xiaomeiw@tjau.edu.cn.

