恶喹酸与诺氟沙星对异育银鲫体内嗜水气单胞菌的抑菌效果比较
孙朋辉,鲁建飞,邱玮晨,吕利群,2
( 1.上海海洋大学 水产与生命学院,农业部淡水种质资源重点实验室,上海 201306; 2.淡水水产健康养殖湖北省协同创新中心,湖北 武汉 430070 )
恶喹酸与诺氟沙星对异育银鲫体内嗜水气单胞菌的抑菌效果比较
孙朋辉1,鲁建飞1,邱玮晨1,吕利群1,2
( 1.上海海洋大学 水产与生命学院,农业部淡水种质资源重点实验室,上海 201306; 2.淡水水产健康养殖湖北省协同创新中心,湖北 武汉 430070 )
在水温(25±2) ℃下,给体质量150~200 g的异育银鲫分别口灌3种剂量(20、30、40 mg/kg)的诺氟沙星和恶喹酸,结合这两种药物对嗜水气单胞菌AH10的体外药效学研究和对异育银鲫单次口灌不同剂量的诺氟沙星、恶喹酸的体内药代动力学,研究诺氟沙星、恶喹酸对异育银鲫体内嗜水气单胞菌AH10的抑菌效果。试验结果表明,恶喹酸和诺氟沙星对嗜水气单胞菌AH10的最小抑菌质量浓度分别为1 μg/mL 和 0.5 μg/mL。口灌上述3种剂量恶喹酸、诺氟沙星后,异育银鲫血浆中恶喹酸的最大药物质量浓度分别为4.1 μg/mL、6.0 μg/mL和8.89 μg/mL;诺氟沙星的最大药物质量浓度分别为11.5 μg/mL、15.1 μg/mL和18.9 μg/mL;恶喹酸的最大药物质量浓度/最小抑菌质量浓度分别为4.1、6.0和8.89;诺氟沙星的最大药物质量浓度/最小抑菌质量浓度分别为23、30.2和37.8; 恶喹酸0~24 h内药—时曲线下面积/最小抑菌质量浓度分别为21.6214、33.1449、39.1846;诺氟沙星0~24 h内药—时曲线下面积/最小抑菌质量浓度分别为274.75、451.55、578.35。综合0~24 h内药—时曲线下面积/最小抑菌质量浓度、最大药物质量浓度/最小抑菌质量浓度这两个指标可知,诺氟沙星对异育银鲫体内的嗜水气单胞菌AH10抑制效果强于恶喹酸。
异育银鲫;嗜水气单胞菌;恶喹酸;诺氟沙星;药效动力学;药代动力学
恶喹酸、诺氟沙星都有喹诺酮环结构,属于喹诺酮类药物,主要通过阻断细菌DNA复制导致病原菌死亡,在水产养殖中使用量较大[1-4]。喹诺酮类药物的杀菌作用在一定范围内随药物含量的增高而增强,目前市场上存在四代兽用喹诺酮类药物,恶喹酸属于第二代药物;诺氟沙星属于第三代药物,第三代药物含氟原子,又称氟喹诺酮类药物,抗菌活性有所增强[5-7]。理论上含氟化合物的杀菌活性大于不含氟药物,但是,在水生动物细菌病控制的实际临床应用中,第三代药物并未比第一代或第二代药物显示出显著优势,致使三代药物长期共见于渔药市场。这种三代药物并存的情况给药物的选择带来了困扰,迫切需要探明不同代喹诺酮类药物对水产致病菌治疗效果不同的机理。
喹诺酮类药物在水产动物中的药代动力学研究比较多,设定了休药期,以利于食品安全[8-11];但基于药代/药效动力学结合参数研究喹诺酮类药物治疗效果的研究还很少。药动学研究机体各组织对药物吸收、分布和消除的规律,即研究在一定给药情况下机体药物质量浓度随时间的变化;药效学则研究药物对致病菌的抑制效果。将药代动力学和药效学相结合才能更好地评价药物的临床效果,给出准确的给药方案。技术成熟药物研究大多都结合药代/药效动力学,如氟罗沙星的给药方案[12]、头孢他美钠对犬的给药方案[13]等。本试验研究了第二代药物恶喹酸和第三代药物诺氟沙星,对可以导致出血病的革兰氏阴性菌—嗜水气单胞菌(Aeromonashydrophila)AH10的体外药效学和异育银鲫(Carassiusauratusgibelio)体内的药代动力学,判断这两种药的抑菌效果,为喹诺酮类药物的选择使用提供理论参考。
1 材料与方法
1.1 试验生物
300尾健康异育银鲫购于上海浦东新区果园某养殖场,体质量150~200 g。暂养于水族箱内,试验水温(25±2) ℃,暂养两周内不投食。
嗜水气单胞菌AH10,由上海海洋大学国家水生动物病原库从患病异育银鲫体内分离纯化。
1.2 药品和试剂
诺氟沙星标准品纯度≥99.0%(浙江国邦药业有限公司),诺氟沙星原料药纯度≥98.5%[生工生物工程(上海)股份有限公司],恶喹酸标准品纯度≥99.0%[国药集团化学试剂有限公司(上海)],恶喹酸原料药纯度≥98.5%[生工生物工程(上海)股份有限公司];乙二胺四乙酸二钠,乙腈(色谱纯)、浓盐酸(分析纯)、四丁基溴化铵(分析纯)、甲醇(色谱纯)、冰醋酸(分析纯)(国药集团化学试剂有限公司)。
1.3 试验仪器
Agilent 1100 高效液相色谱仪配有荧光检测器(宁波拓谱生物科技有限公司);高压灭菌锅(上海茸研仪器有限公司);水浴锅(常州澳华仪器有限公司);冰箱(青岛海尔电冰箱有限公司);涡旋仪(南京东迈科技仪器有限公司);恒温箱(广东宏展科技有限公司)。
1.4 恶喹酸、诺氟沙星对嗜水气单胞菌AH10体外药效学研究
1.4.1 药品的配制
称取一定量的恶喹酸原料药,用少量0.03 mol/L 氢氧化钠溶解后,加入一定量的蒸馏水于50 mL离心管中,使药物质量浓度为1280 μg/mL,4 ℃保存备用;称取一定量的诺氟沙星原料药用少量流动相溶解后,加入一定量的生理盐水于50 mL离心管中,使药物质量浓度为1280 μg/mL,4 ℃保存备用。
1.4.2 最小抑菌质量浓度的测定
采用试管两倍稀释法,嗜水气单胞菌AH10 菌悬液密度为106cfu/mL,混合后放置30 ℃恒温摇床培养24 h,目测将发生浑浊的试管的最低药物质量浓度作为最小抑菌质量浓度。重复5次,取平均值为最小抑菌质量浓度[14-15]。
1.5 在异育银鲫体内恶喹酸、诺氟沙星药物动力学研究
1.5.1 给药及样品采集
将33尾体质量相同的异育银鲫分成3组;配制20、30、40 mg/kg剂量的试验药物分别口灌入3组异育银鲫前肠。灌后将鱼体朝上直立片刻,无回吐药物的鱼用于试验。口灌鱼在给药0.5、1、2、4、6、8、10、12、16、24、48 h时自尾静脉取血液1.5 mL,加入100 μL 10%的草酸钾溶液(抗凝剂)混匀后放置4 ℃冰箱放置8~12 h,同时取空白血液作对照[16]。
1.5.2 样品处理
处理方法参考马寅[17]。将-20 ℃冰箱中血浆在室温下自动融化,吸取1.00 mL 血浆加入到15 mL 离心管中,加 20%三氯乙酸甲醇溶液 200 μL涡旋混匀,再加入乙酸乙酯 5 mL,漩涡混合 5 min,10 000 r/min 离心15 min。将上清液吸入另一 15 mL离心管中,于 40 ℃水浴锅中用氮气将其吹干;然后加 1 mL流动相、2 mL正己烷,涡旋5 min使析出物溶解,10 000 r/min离心3 min。吸取上清液,用 0.22 μm 有机滤膜过滤,取100 μL 滤液上机检测。
1.5.3 色谱条件
恶喹酸HPLC分析参考林丽聪等[18]的方法。流动相:2%甲醇∶冰醋酸=40∶60(V/V);色谱柱:RP-ODS C18分析柱(150 mm×4.6 mm,5 μm);多波长紫外检测器,紫外检测波长:260 nm;流速:1.0 mL/min;柱温:室温;进样量:20 μL。
诺氟沙星HPLC分析参考房文红等[19]试验方法。流动相:0.01 mol/L的四丁基溴化铵溶液(用磷酸调pH 至3.1)∶乙腈=95∶5(V/V);色谱柱:RP-ODS C18分析柱(150 mm×4.6 mm,5 μm);进样量:20 μL;荧光检测器,激发波长:280 nm,发射波长:450 nm;柱温:40 ℃;流速:1.5 mL/min。
1.5.4 标准曲线的建立
按照1.4药品配制方法,配制标准液。将标准液分别稀释成0.05、0.1、0.5、1、10、20、200 μg/mL的样品。将样品用0.22 μm微孔滤膜进行过滤,然后进行HPLC检测。以峰面积(y)对质量浓度(x)做回归方程[20]。
1.5.5 回收率和精密度
取恶喹酸和诺氟沙星200、100、50 μg/mL溶液各100 μL,分别加入到900 μL的空白异育银鲫血清中,使混合液的理论质量浓度分别为20、10、5 μg /mL,按照1.5处理,进行HPLC测定,以3次平均值为实际质量浓度。
回收率/%=样品实际质量浓度/样品理论质量浓度×100%
将同一样品在一天内不同时间重复测3次,连续测定3 d,计算血清中恶喹酸和诺氟沙星的日内平均变异系数和日间平均变异系数,以衡量检测方法的精密度[21]。
1.5.6 数据处理
将Agilent 1100 高效液相色谱仪测出的数据用Excel 绘出标准曲线及实时药物质量浓度,应用 Kinetic 4.4 药代动力学软件,计算药代动力参数。
2 结 果
2.1 诺氟沙星、恶喹酸对嗜水气单胞菌AH10体外药效学研究
经测定,诺氟沙星和恶喹酸对嗜水气单胞菌AH10的最小抑菌质量浓度分别为0.5 μg/mL和1 μg/mL。
2.2 诺氟沙星在异育银鲫体内的药动学
2.2.1 诺氟沙星标准工作曲线
诺氟沙星的标准工作曲线方程为:y=173.96x+ 12.787(r2=0.9994),在0.1~20 μg/mL的范围内,诺氟沙星的色谱面积与质量浓度呈线性相关(图1)。以引起两倍基线噪音的药量为最低检测限,可知诺氟沙星的检测限为0.05 μg/mL。

图1 诺氟沙星标准品溶液工作曲线
2.2.2 回收率和精密度
诺氟沙星在血清中的平均回收率为90.91%,日内变异系数为1.21%,日间变异系数为2.26%。
2.2.3 诺氟沙星在异育银鲫血清中的代谢规律
口灌诺氟沙星40 mg/kg和30 mg/kg时,血清达峰时间为0.5 h;口灌诺氟沙星20 mg/kg时,血清达峰时间为1 h(图2)。
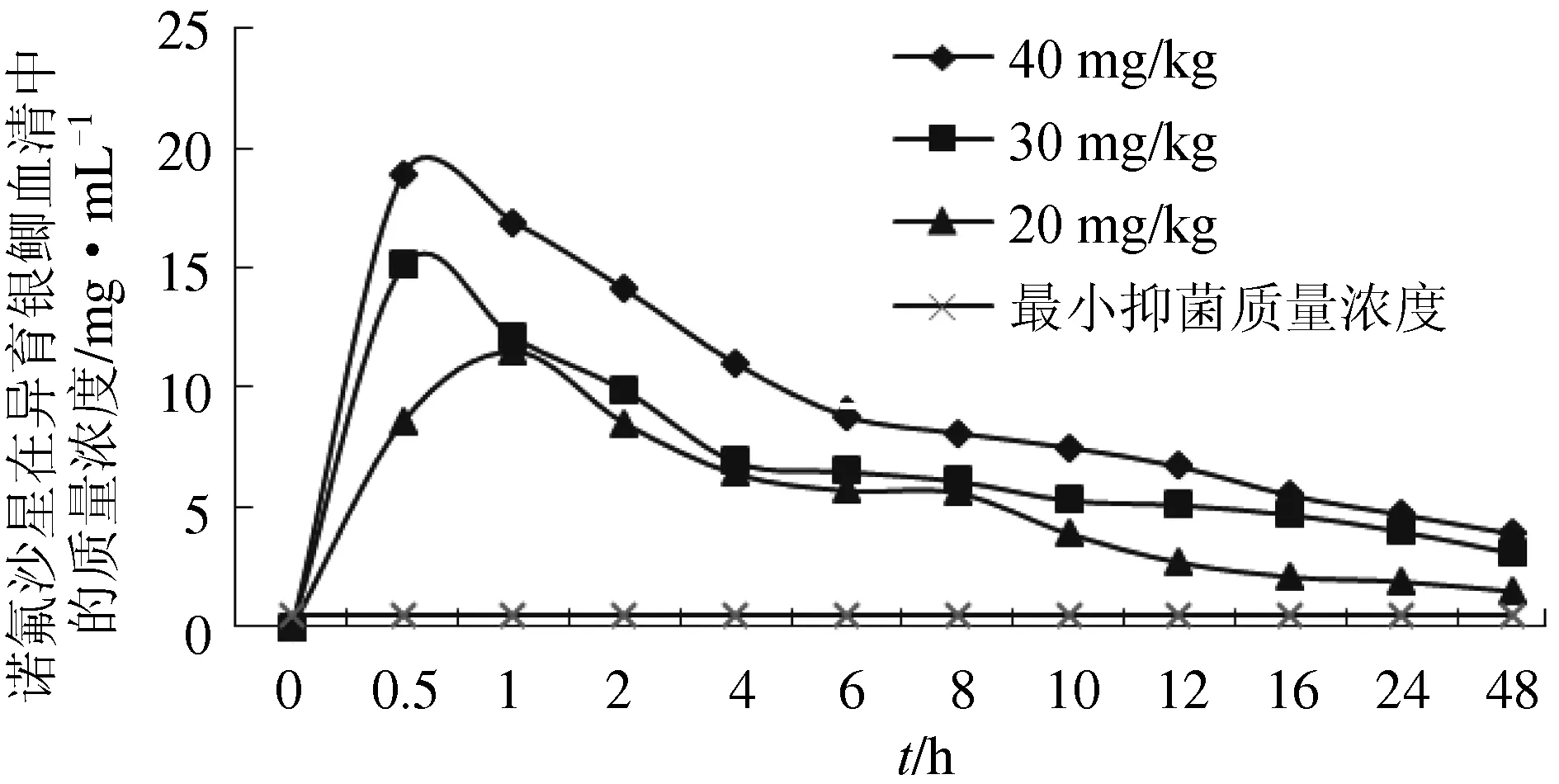
图2 异育银鲫在口灌不同剂量诺氟沙星时血清中的药—时曲线
2.3 恶喹酸在异育银鲫体内的药动学
2.3.1 恶喹酸标准工作曲线
恶喹酸的标准工作曲线方程为:y= 177.78x+23.272(r2=1),在0.1~200 μg/mL质量浓度范围内,恶喹酸的色谱面积与质量浓度呈线性相关。以引起两倍基线噪音的药量为最低检测限,可知恶喹酸的检测限为0.1 μg/mL(图3)。
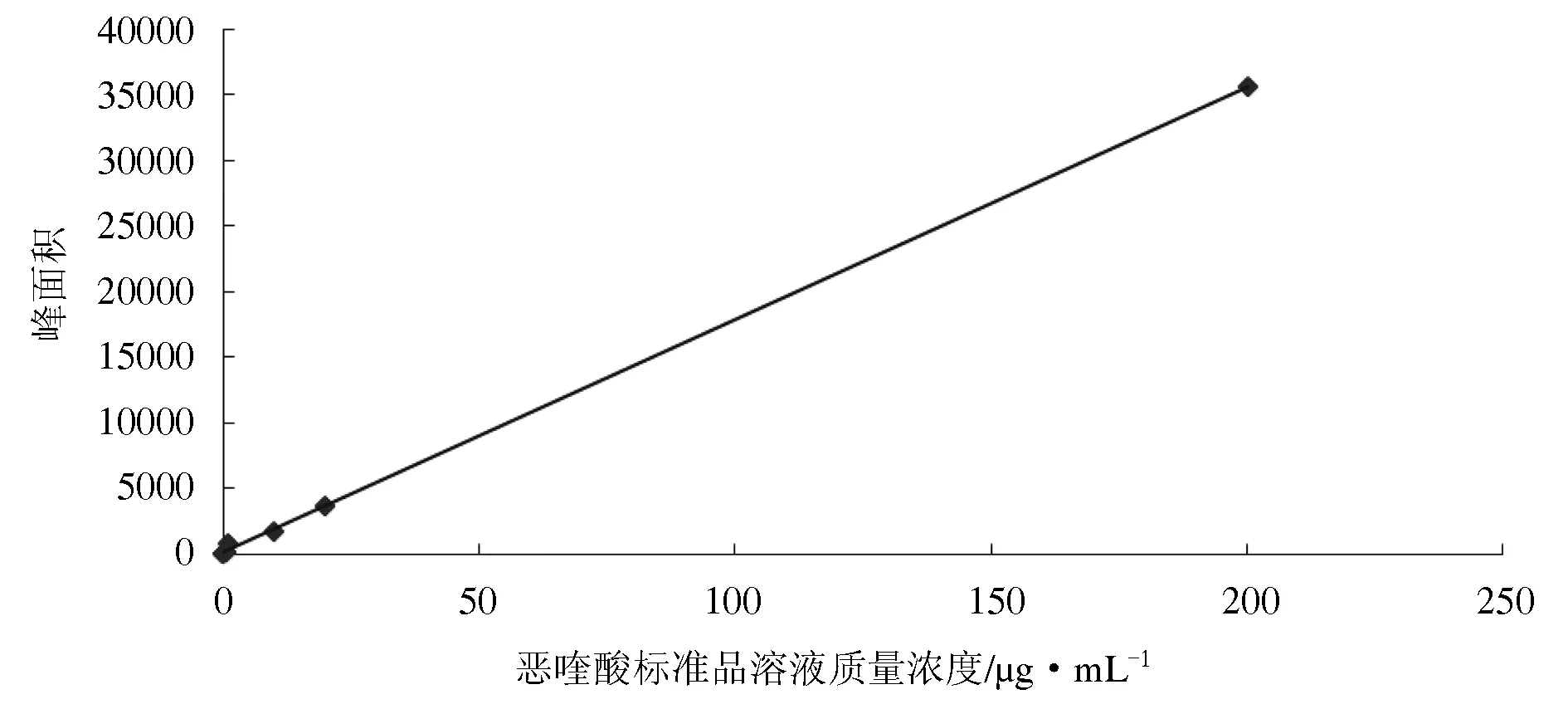
图3 恶喹酸标准溶液的工作曲线
2.3.2 回收率和精密度
恶喹酸在血清的平均回收率为88.83%,日内变异系数为2.35%,日间变异系数为3.62%。
2.3.3 恶喹酸在异育银鲫血清中的代谢规律
恶喹酸在异育银鲫血浆中的药—时曲线为双峰现象。在口灌恶喹酸40、30、20 mg/kg时,恶喹酸在血清中达峰时间均为1 h(图4)。

图4 异育银鲫在口灌不同剂量恶喹酸时血清中的药—时曲线
2.4 诺氟沙星与恶喹酸在异育银鲫血浆中的药代动力学参数
经Kinetica 4.4软件分析,单次口灌不同剂量的诺氟沙星和恶喹酸时,根据异育银鲫血浆中的药时数据得出的药代动力学参数见表1。
口灌20、30、40 mg/kg的恶喹酸、诺氟沙星,异育银鲫体内恶喹酸最大药物质量浓度/最小抑菌质量浓度分别为4.1、6.0和8.89;诺氟沙星最大药物质量浓度/最小抑菌质量浓度分别为23、30.2和37.8;恶喹酸0~24 h药—时曲线下面积/最小抑菌质量浓度分别为21.6214、33.1449和39.1846; 诺氟沙星0~24 h药—时曲线下面积/最小抑菌质量浓度分别为274.75、451.55和578.35。

表1 口灌不同剂量诺氟沙星和恶喹酸后在异育银鲫体内的药代动力学参数
3 讨 论
3.1 诺氟沙星与恶喹酸对异育银鲫体内嗜水气单胞菌的抑菌效果
本试验结合了诺氟沙星、恶喹酸在异育银鲫体内的药代动力学和对嗜水气单胞菌AH10的体外药效学研究。药效学结果显示,在同等剂量下,诺氟沙星对嗜水气单胞菌AH10抑菌效果强于恶喹酸;药代动力学结果显示,异育银鲫对诺氟沙星的吸收速率、吸收量和消除速率均大于恶喹酸。喹诺酮类药物在最大药物质量浓度/最小抑菌质量浓度达8~10时,可获得良好的临床和细菌学疗效,可减少细菌对该类药物产生耐药性;喹诺酮类药的抗菌活性存在菌种的特异性,如对革兰阴性菌的0~24 h内药—时曲线下面积/最小抑菌质量浓度为100~125时可取得良好的疗效,对革兰阳性菌则为30~40[22-23]。结果发现,对异育银鲫口灌不同剂量诺氟沙星均能达到最大药物质量浓度/最小抑菌质量浓度>8和0~24 h内药—时曲线下面积/最小抑菌质量浓度>100的要求,而恶喹酸只有在口灌40 mg/kg的剂量才能满足最大药物质量浓度/最小抑菌质量浓度>8,但不能同时满足0~24 h内药—时曲线下面积/最小抑菌质量浓度>100。由此可以确定,诺氟沙星对异育银鲫体内的嗜水气单胞菌AH10抑制效果强于恶喹酸。
关于诺氟沙星和恶喹酸的传统给药方案研究,一般是在水产动物的药代动力学基础上结合体外药效学(最小抑菌质量浓度)给出用药方案[24-25],以达到治疗的目的。虽然体外药效的最小抑菌质量浓度对选择抗菌药物有重要指导作用,但只以最小抑菌质量浓度为用药指导有片面性和局限性。首先最小抑菌质量浓度是体外细菌暴露在特定抗菌药物质量浓度下的测定结果,忽略了抗菌药物质量浓度在体内不断变化这一基本事实[26];未考虑到只用最小抑菌质量浓度给药可能产生耐药性等问题。本试验结合了最大药物质量浓度/最小抑菌质量浓度和0~24 h内药—时曲线下面积/最小抑菌质量浓度,不仅可使药物达到良好的治疗效果,而且减少了细菌对该类药物产生耐药性的几率,但未能结合Dong等[27-28]提出的防耐药突变浓度和耐药突变窗,限制细菌的耐药性扩增,对于耐药性面应更加深入进行研究。
3.2 恶喹酸和诺氟沙星在异育银鲫体内的药代动力学特征
本试验研究的恶喹酸和诺氟沙星的药代动力学与已有的研究结果基本吻合。恶喹酸出现双峰并且符合一级消除二室模型,但又有不同之处,梁增辉等[29]在水温(22.5±1) ℃时给鳗鲡(Anguillajaponica)尾静脉按10 mg/kg的剂量注射恶喹酸,血药质量浓度再次升高的时间间隔为4 h,而本试验的血药质量浓度再次升高的时间间隔为7 h。由此推出不同的给药剂量、给药方法和受试动物对药物的再次吸收有一定的差异。曲晓荣等[30]在水温(17±2) ℃的条件下按30 mg/kg的剂量给大菱鲆(Scophthalmusmaximus)口灌诺氟沙星,药物在血浆中吸收迅速,约2 h,血药质量浓度即达到最高药物质量浓度9.24 μg/mL,而本试验在同剂量的给药情况下,达到峰值的时间短于大菱鲆,峰值高于大菱鲆。王群等[31]研究发现,在给鲈鱼(Lateolabraxjaponicus)口灌诺氟沙星后0.33 h即可达到峰质量浓度。可见,受试对象不同,诺氟沙星的吸收速率和吸收量均有明显差异。
从以上药物动力学比较看出,由于受试动物、给药方式和给药量的不同,获得的结果差异较大,对于病原菌,不同株菌的致病性和耐药性也有很大差异。因此本文的药效学和药物动力学研究结果尚不具有普遍借鉴意义,但是基于血药质量浓度的变化和最小抑菌质量浓度评价抗生素的相对临床效果可以为药物选择提供理论参考。
[1] Bearden D T,Danziger L H.Mechanism of action of and resistance to quinolones [J].Pharmacotherapy,2001,21(10P2):224-232.
[2] 李军, 黎志强, 樊品科. 氟喹诺酮类药物对草鱼常见病原菌的体外抑菌试验[J] . 中国兽药杂志, 1999, 33(4):25-27.
[3] 郑国兴, 周凯. 嗜水气单胞菌欧洲鳗皮肤溃疡分离株的耐药性[J] . 中国水产科学, 1999, 6(3):69-72.
[4] 蒋志伟, 王宝安, 王永坤, 等. 环丙沙星对水产动物气单胞菌的药效研究[J] . 兽药与饲料添加剂, 1999, 4(3):3-5.
[5] 梁万衡.喹诺酮类抗生素研究与应用进展[J] .广西医学,2002,24(6):829-830.
[6] 张泽锋,李有俊.喹诺酮类药物的研究进展及合理应用[J].临床医药实践杂志,2007,11(16):1045-1053.
[7] 方之平,彭玉芬,操继跃.洛美沙星在鲤鱼体内的药物动力学及残留[J].淡水渔业,2005,35(1):17-21.
[8] 张雅斌,张祚新,郑伟,等.诺氟沙星在鱼类细菌性疾病中的应用研究[J].大连水产学院学报,2000,15(2):79-85.
[9] 朱秋华,钱国英.3种药物在甲鱼体内的残留研究[J].中国水产科学,2001,8(3):50-53.
[10] Guo L Q,Xie Z H,Lin X C,et al.Pharmacokinetics of ciprofloxacin in eels by high-performance liquid chromatography with fluorescence detection [J].Analytical Biochemistry,2005,341(2):275-279.
[11] Rigos G,Tyrpenou A E,Nengas I,et al.The kinetic profile of oxolinic acid in sharp snout sea bream,Diploduspuntazzo[J].Aquaculture Research,2004,35(14):1299-1304.
[12] 吴干斌,张军,周建华,等.蒙特卡洛模拟方法优化氟罗沙星临床最佳给药方案[J].中国抗生素杂志,2014,39(6):470-474.
[13] 毛旭东,孙文霞,张云,等.用蒙特卡罗模型探索头孢他美钠的给药方案[J].中国抗生素杂志,2013,38(1):73-77.
[14] 戴自英.临床抗菌药物学[M].北京:人民卫生出版社,1985:6-8.
[15] 刘远飞.氟喹诺酮类抗菌药后效应及其机制的研究[D].哈尔滨:东北农业大学,2002.
[16] 徐丽娟,权可艳,王浩,等.恩诺沙星控制嗜水气单胞菌性鲫鱼败血症的防耐药用药方案[J].中国水产科学,2013,20(3):635-643.
[17] 马寅.氟苯尼考和恩诺沙星在大黄鱼体内的代谢动力学研究[D].宁波:宁波大学,2012.
[18] 林丽聪,樊海平,廖碧钗,等.噁喹酸在欧洲鳗鲡体内的药代动力学及残留研究[J].淡水渔业,2014,42(1):24-29.
[19] Fang W,Zhou S,Yu H,et al.Pharmacokinetics and tissue distribution of enrofloxacin and its metabolite ciprofloxacin inScyllaserratafollowing oral gavage at two salinities[J].Aquaculture,2007,272(1/4):180-187.
[20] 丁俊仁,艾晓辉,王开毓.强力霉素在斑点叉尾鮰体内药物动力学及残留消除规律研究[J].水生生物学报,2012,36(1):126-132.
[21] 艾晓辉,陈正望,张春光.喹乙醇在鲤体内的药物代谢动力学及组织浓度[J].水生生物学报,2012,27(3):273-277.
[22] 李燕明,孙铁英.喹诺酮类抗菌药物的药动学和药效学研究进展[J].中国新药杂志,2005,14(9):1123-1126.
[23] 杨亚军,李剑勇,李冰.药动学-药效学结合模型及其在兽用抗菌药物中的应用[J].湖北农业科学,2011,50(1):114-117.
[24] 简纪常,吴灶和,陈刚.恩诺沙星在眼斑拟石首鱼体内的药物代谢动力学[J].中国兽医学报,2005,25(2):195-198.
[25] 刘玉林,王翔凌,杨先东,等.诺氟沙星在大黄鱼体内的药代动力学及残留研究[J].水产学报,2007,31(5):655-660.
[26] 刘倩,张晶,林立敏,等.氟喹诺酮类抗菌药物的药动学/药效学研究进展[J].中国医院用药评价与分析,2014,14(8):765-768.
[27] Dong Y,Zhao X,Domagala J,et al. Effect of fluoroquinolone concentration on selection of resistant mutants ofMycobacteriumbovisBCG andStaphylococcusaureus[J].Antimicrobial Agents and Chemotherapy,1999,43(7):1756-1758.
[28] Drlica K.The mutant selection window and antimicrobial resistance[J].Journal of Antimicrobial Chemotherapy, 2003, 52(1):11-17.
[29] 梁增辉,林黎明,刘靖靖,等.嘿喹酸和氟甲喹在鳗鱼体内的药代动力学研究[J].海洋水产研究,2006,27(3):86-92.
[30] 曲晓荣,王印庚,李胜忠,等.诺氟沙星在大菱鲆体内药代动力学及残留消除规律[J].海洋水产研究,2007,28(5):24-29.
[31] 王群,刘淇,唐雪莲,等.诺氟沙星在养殖鲈体内的代谢动力学和残留研究[J].水产学报,2004,28(3):14-18.
ComparativeBacteriostasisofOxolinicAcidandNorfloxcinagainstPathogenicBacteriumAeromonashydrophilainAllogyogeneticsSilverCrucianCarpCarassiusauratusgobelio
SUN Penghui1,LU Jianfei1,QIU Weichen1,LÜ Liqun1,2
( 1.National Pathogen Collection Center for Aquatic Animals,College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China; 2.Cooperative Innovation Center of Freshwater Aquaculture in Hubei Province, Wuhan 430070,China )
In vitro and in vivo pharmacokinetics of oxolinic acid and norfloxcin against pathogenic bacteriumAeromonashydrophila(AH10) were studied in allogyogenetics silver crucian carpCarassiusauratusgobeliowith body weight of 150—200 g singly and orally administrated at a dose of 20,30,and 40 mg per kg body weight at water temperature of (25±2) ℃.The minimal inhibitory concentration (MIC) on AH10 was shown to be 1 μg/mL in oxolinic acid and 0.5 μg/mL in norfloxcin.The maximum serum concentration of oxolinic acid in allogyogenetics silver crucian carp was 4.1 μg/mL at a dose of 20 mg per kg body weight,6.0 μg/mL at a dose of 30 mg per kg body weight,and 8.89 μg/mL at a dose of 40 mg per kg body weight,and the maximum serum concentration of norfloxcin were 11.5 μg/mL at a dose of 20 mg per kg body weight,15.1 μg/mL at a dose of 30 mg per kg body weight, and 18.9 μg/mL at a dose of 40 mg per kg body weight.Cmax of oxolinic acid /MIC of oxolinic acid was 4.1,6.0 and 8.89 at various doses,respectively; Cmax of norfloxcin /MIC of norfloxcin was 23,30.2 and 37.8 at various doses,respectively.The area under the curve (AUC24,0—24 h) of oxolinic acid/MIC of oxolinic acid was 21.6214,33.1449 and 39.1846 at various doses,respectively;AUC24of norfloxcin /MIC of norfloxcin was 274.75,451.55 and 578.35 at various doses,respectively.Based on the AUC24/MIC and Cmax/MIC,there was greater bacteriostasis in norfloxcin than in oxolinic acid againstA.hydrophilain allogyogenetics silver crucian carp.
Carassiusauratusgobelio;Aeromonashydrophila; oxolinic acid; norfloxacin; pharmacodynamics; pharmacokinetics
10.16378/j.cnki.1003-1111.2016.03.005
S943
A
1003-1111(2016)03-0221-06
2015-05-18;
2015-08-04.
现代农业产业技术体系建设专项(CARS-46-12).
孙朋辉(1990-),男,硕士研究生;研究方向:水产药物防控.E-mail:13052398178@163.com.通讯作者:吕利群(1971-),男,教授,博士;研究方向:动物病毒学.E-mail:lqlv@shou.edu.cn.

