杏鲍菇多糖PEP-2的结构表征及其对肝癌细胞HepG-2抑制作用的研究
姜艳红,张玲帆,吕 瑛,汤 曦,任道远
(陕西师范大学食品工程与营养科学学院,食品科学与工程专业,陕西西安 710119)
杏鲍菇多糖PEP-2的结构表征及其对肝癌细胞HepG-2抑制作用的研究
姜艳红,张玲帆,吕 瑛,汤 曦,任道远*
(陕西师范大学食品工程与营养科学学院,食品科学与工程专业,陕西西安 710119)
目的:研究杏鲍菇多糖(Pleurotuseryngiipolysaccharides)的结构表征及抗肿瘤活性。方法:杏鲍菇多糖经过DEAE-52纤维素和Sephadex G-100葡聚糖凝胶柱层析分离纯化,得到一种杏鲍菇多糖组分PEP-2。采用高效液相色谱(HPLC)法测定了PEP-2的单糖组成及分子量。采用MTT法检测了PEP-2对肝癌细胞HepG-2存活率的影响。通过DAPI染色对HepG-2细胞形态进行观察。结果:HPLC分析表明PEP-2是主要由葡萄糖组成的杂多糖,PEP-2的分子量为4.63×105u。对HepG-2抗肿瘤研究活性研究表明高分子量的PEP-2有很强的抗肿瘤活性。DAPI染色结果显示没有处理的细胞大而且圆,并没有出现核质浓缩及核仁破碎现象,而PEP-2处理的细胞大部分出现核质浓缩核仁破碎的现象。结论:本研究为开发杏鲍菇多糖作为预防肿瘤的保健食品提供了新的理论依据。
杏鲍菇,多糖,纯化,抗肿瘤,凋亡
多糖又称多聚糖(polysaccharides),由10个以上单糖残基通过糖苷键连接而成,广泛存在于植物、动物和微生物中[1]。多糖是近年来科学研究的热点之一,目前已经从灵芝[2]、黑木耳[3]、茯苓[4]、山药[5]、芦荟[6]、银杏[7]、人参[8]、当归[9]和枸杞[10]等食用菌以及中药中分离出了活性多糖。而食用菌多糖的研究近年来也逐渐走入人们的视野,我国的食用菌生产遍布全国各地,在食品工业[11]、发酵工业[12]及医药领域[13]上有着广泛的应用。目前国内外已对多种食用菌,比如香菇[14]、银耳[15]、冬虫夏草[16]、灵芝[2]、黑木耳[3]、蜜环菌[17]等进行了多糖的提取纯化、分离鉴定及功能性方面的研究。
杏鲍菇(Pleurotuseryngii),生长于典型的亚热带草原干旱的沙漠地区,是腐生或者兼性寄生于大型伞型花科植物的根上和四周土中的野生食用菌,这些植物有刺芹、阿魏、拉瑟草等,杏鲍菇子实体通常中等偏大,菌肉为白色,质地肥嫩,有杏仁味。杏鲍菇学名刺芹侧耳,具有降血脂、降血压、降低胆固醇和增强肌体免疫力等功效[18]。杏鲍菇作为药食两用的食用菌,有着非常广阔的应用前景。研究表明杏鲍菇富含维生素、矿物质以及可以降血压血脂、降低胆固醇和抗衰老的多糖,是营养保健价值极高的食用菌[19]。另外,有研究表明,杏鲍菇的水溶性多糖能有效地提高肝损伤小鼠的抗氧化酶活性、清除自由基,进而降低高脂肪小鼠的总胆固醇、总甘油三酯和低密度脂蛋白胆固醇水平,同时增加高密度脂蛋白胆固醇水平[20-22]。但是,目前国内外对于杏鲍菇多糖的分离纯化以及抗肿瘤活性方面都鲜有报道。
本研究采用本实验室较为成熟的热水提取的方法,来对杏鲍菇粗多糖(PEP)进行初提取。再经过多糖的除蛋白以及脱色处理之后,利用HPLC-UV初步分析其单糖组成,并检测其抗氧化能力的强弱。然后采用MTT法检测了PEP-2对肝癌细胞HepG-2存活率的影响,并通过DAPI染色对HepG-2细胞形态进行了研究,为开发杏鲍菇多糖作为预防肿瘤的保健食品提供了新的理论依据。
1 材料与方法
1.1 材料与仪器
杏鲍菇 西安华润万家超市;DEAE-52纤维素 Solarbio公司;Sephadex G-100 Pharmacia公司;标准葡聚糖、D-甘露糖(Man)、D-核糖(Rib)、L-鼠李糖(Rha)、D-葡萄糖醛酸(GlcUA)、D-半乳糖醛酸(GalUA)、D-葡萄糖(Glc)、D-木糖(Xyl)、D-半乳糖(Gal)、L-阿拉伯糖(Ara)、D-岩藻糖(Fuc)、1-苯基-3-甲基-5-吡唑啉酮(PMP) 美国Sigma公司;甲醇、乙腈均为色谱纯 美国Honeywell公司;RPMI 1640 Grand Island,USA;胎牛血清FBS Woodland,USA;乳酸脱氢酶(LDH)检测试剂盒 上海贝博公司;氟尿嘧啶(5-Fu) 上海润成生物科技有限公司。
Shimadzu LC-2010A高效液相色谱仪、Shimadzu Class-VP6.1色谱工作站 日本岛津公司;Milli-Q超纯水仪 美国Millipore公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;FACSCalibur流式细胞仪 美国BD公司;IX71倒置荧光显微镜 Nikon公司;ESCO生物安全柜、ESCO CO2培养箱 新加坡ESCO公司。
1.2 实验方法
1.2.1 杏鲍菇多糖的提取与精制 提取方法根据参考文献[23]的方法并稍加改动,杏鲍菇经粉碎机粉碎、称取200 g匀浆置于圆底烧瓶中,加入1000 mL乙醇脱脂。取脱脂后的杏鲍菇组织100 g于烧瓶中,加入10倍体积蒸馏水,80 ℃水浴,回流提取4 h,过滤。重复提取一次,合并滤液并浓缩至300 mL,加四倍体积无水乙醇,放置冰箱过夜,重复两次。离心,弃去乙醇,沉淀加水溶解,采用反复冻融10次除蛋白[23],而后透析2 d,每天换3次水,冷冻干燥,即得杏鲍菇多糖样品。
1.2.2 PEP的分离纯化 杏鲍菇多糖参照文献[24]的方法纯化。取粗多糖0.3 g溶于蒸馏水10 mL中,离心,上清液经DEAE-52型纤维素柱层析分离,依次用蒸馏水,0.1、0.3、0.5 mol/L NaCl溶液洗脱,体积流量为1 mL/min,DBS-100型收集器进行收集,每管8 mL,苯酚-硫酸法检测,收集各组分洗脱液,减压浓缩后冷冻干燥。主峰多糖组分0.1 mol/L NaCl溶液洗脱所得组分,命名为P-2,取P-2 30 mg溶于蒸馏水5 mL中,离心,上清液再经Sephadex G-100 型凝胶柱层析纯化,蒸馏水为洗脱液,体积流量为0.3 mL/min,每管收集3 mL,苯酚-硫酸法检测,收集洗脱液。冷冻干燥得到多糖PEP-2。
1.2.3 HPLC-UV分析PEP-2的单糖组成 参考文献[23]。
1.2.3.1 对照品溶液的制备 精确称取一定量的10种单糖分别用10 mL的10%甲醇溶液配成0.1 mol/L的母液,然后取适量的各种母液梯度稀释为5个不同浓度的系列单糖溶液,备用。用PMP对样品衍生化,取系列单糖溶液各10 μL,充分混合后共100 μL,依次加入200 μL 的PMP甲醇溶液(0.5 mol/L)和300 μL 的NaOH溶液(0.3 mol/L)。混匀后,在70 ℃下水浴反应1 h,冷却至室温后,加入300 μL 的HCl溶液(0.3 mol/L),充分震荡。然后再用氯仿萃取:加入氯仿2.0 mL,充分震荡后,3000 r/min下离心2 min,用细针头取掉有机相,重复操作3次。取水相稀释到适当的浓度,并过0.45 μm微孔滤膜,取续滤液备用。
1.2.3.2 供试品溶液的制备 配制3.0 mol·L-1的TFA,量取2.0 mL放置在安培瓶中,再将准确称取的10 mg PEP-2充分溶解于TFA,安瓿瓶充氮气封口。样品在90 ℃水解8 h,冷却,1000 r/min,离心5 min,上清液转至5.0 mL圆底烧瓶,减压浓缩,蒸干后用1.0 mL超纯水溶解,得多糖水解液。取水解液样品100 μL,按“1.3.3.1”项下PMP衍生化方法制备PMP标记物。
1.2.3.3 HPLC色谱条件 采用梯度洗脱方式,色谱条件:流动相A:纯乙腈;流动相B:0.45 g KH2PO4、0.45 mL TEA、100 mL乙腈和900 mL超纯水组成,调pH至7.5。色谱柱:Venusil C18柱(250 mm×4.6 mm id,5 μm);梯度洗脱:0~5 min 91%B洗脱,5~15 min 91%~90% B洗脱,15~25 min 90% B洗脱,25~30 min 90%~88% B洗脱。进样量20 μL,流速1.0 mL/min,检测波长为250 nm,柱温为35 ℃。
1.2.4 PEP-2的纯度和相对分子质量测定 采用HPLC对PEP-2进行纯度鉴定。称取PEP-2适量,配置2 mg/mL质量浓度多糖溶液,进行HPLC分析。色谱条件:Waters1525型高效液相色谱系统,色谱柱为Shodex Ohpak SB-804 HQ,流动相为超纯水,体积流量为0.8 mL/min,Waters2414型示差折光监测器,柱温30 ℃,进样量为20 μL,以洗脱峰的保留时间为横坐标,已知葡聚糖标品相对分子质量的对数值为纵坐标,绘制标准曲线。
1.2.5 紫外吸收光谱(UV)分析 利用紫外吸收光谱的原理[25],准确称取PEP-2,10 mg,定容10 mL,得到浓度为1 mg/mL的多糖溶液,以蒸馏水作为空白,以200~900 nm为扫描范围,进行全波长的扫描。
1.2.6 红外波谱(IR)分析 根据文献[25],称取一定量的PEP-2,加入适量的KBr研磨混均压片,进行IR扫描,利用BRUKER EQUINOX55型红外光谱仪,4000~500 cm-1范围扫描,以KBr 为扫描背景。
1.2.7 MTT法检测细胞增殖 参照文献[24]操作取对数生长期细胞,用新鲜培养基制成细胞悬液,接种在96孔培养板中,调浓度至约1×105个/mL。每孔加90 μL,置于恒温CO2细胞培养箱中培养,24 h后分别加入10 μL浓度梯度的多糖样品溶液,使终浓度为50、100、200 μg/mL(阳性对照为5-Fu 100 μg/mL,阴性对照为10 μL的生理盐,分别加10 μL)。继续培养24 h后,每孔分别加入20 μL MTT(5 mg/mL),培养4 h,最后加入SDS终止反应,在CO2细胞培养箱中放置过夜后,用酶标分析仪在570 nm处测定吸光值,每个处理设置三个重复实验。
细胞存活率的计算公式:细胞存活率(%)=1-(对照孔A570-实验孔A570)/对照孔A570×100。
1.2.8 LDH法检测细胞毒性 细胞前期处理同“1.2.7”,区别在于,细胞悬液的浓度调至约2×105个/mL,接种于6孔培养板,每孔900 μL,置于CO2细胞培养箱中培养。24 h后,弃去培养液,分别加入900 μL新鲜培养液和100 μL浓度梯度的PEP-2样品溶液,使终浓度为50、100、200 μg/mL(阳性对照为5-Fu 100 μg/mL,阴性对照为10 μL的生理盐,分别加10 μL)。缓慢晃动培养板,使样品溶液与培养液充分混匀后继续培养。24 h后吸取细胞培养液,使用乳酸脱氢酶(LDH)检测[26]试剂盒进行实验。并按照以下公式计算PEP-2的细胞毒性:
细胞毒性计算公式:LDH活性(U/L)=(测定孔A450-对照孔A450)/(标准孔A450-空白孔A450)×标准浓度×样品测试前稀释倍数×1000。
1.2.9 DAPI染色观察细胞形态 取对数生长期的HepG2细胞,使用胰酶消化细胞之后,用培养液将细胞重悬。于每孔1×105/mL个细胞,将细胞悬浮液加入有盖玻片的6孔培养板。培养细胞24 h。带细胞贴壁之后,加入100 μg/mL的PEP-2(细胞存活实验以及细胞毒性实验中筛选出的抗肿瘤作用较强的多糖组分)进行药物处理,作用的时间分别为0、6、12、24 h。倒掉上清液,用PBS缓冲液清洗3次。用4%的多聚甲醛固定30 min,PBS缓冲液洗涤细胞之后,再加入DAPI染色避光孵育30 min,最后再用PBS缓冲液洗涤。将细胞培养板放置于倒置荧光显微镜下检测,紫外激发。
2 结果与分析
2.1 PEP的DEAE-52纯化结果
如图1所示,图1所示为杏鲍菇多糖经DEAE-52柱层析纯化的结果。洗脱液分别采用0、0.05、0.1、0.3、0.5 mol/L NaCl 溶液梯度洗脱,图中所示,得到三个单一的洗脱峰。0.1、0.3、0.5 mol/L NaCl 溶液洗脱得到的组分极少,几乎没有洗脱峰。其中蒸馏水和0.05 mol/L NaCl 浓度溶液洗脱峰面积最大,为主要洗脱峰。本研究仅对0.05 mol/L NaCl洗脱液洗脱所得组分进一步纯化,做深入研究。收集0.05 mol/L NaCl洗脱液洗脱部位,减压蒸馏,透析(分子截留量10000 u)3 d,每天换水4次,冷冻干燥,得组分P-2。
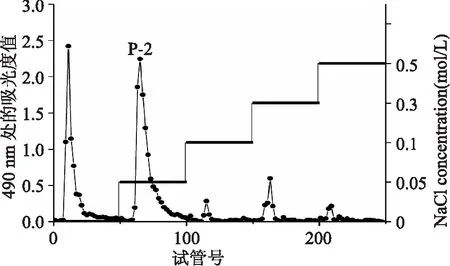
图1 PEP的DEAE-52柱层析图Fig.1 Eluting curve of PEP on DEAE-52 column
2.2 G-100葡聚糖凝胶纯化结果
杏鲍菇多糖经过DEAE-52柱层析纯化后得到较多的一个组分P-2,进一步进行G-100葡聚糖凝胶层析柱层析,结果如图2。由图2可知,P-2的G-100葡聚糖凝胶柱层析得到的两个洗脱峰,收集较大的洗脱峰,命名为PEP-2,以便于后续实验中区分。
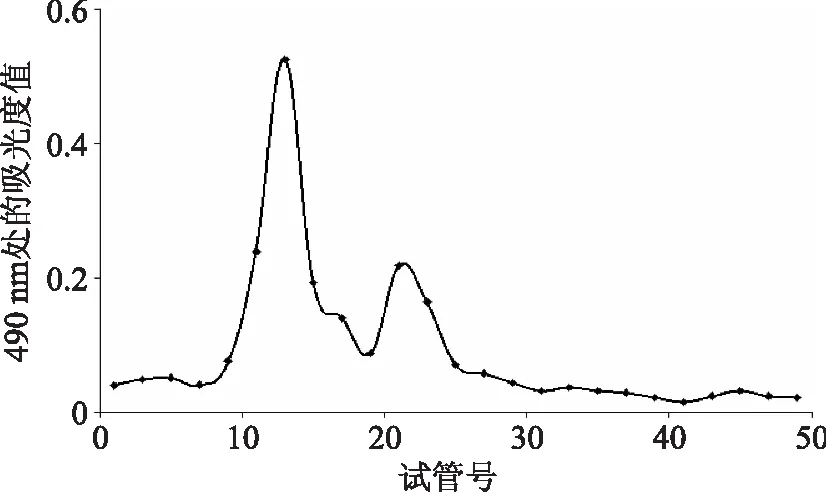
图2 PEP-2的葡聚糖凝胶柱层析图Fig.2 Elution curve of PEP-2 on Sephadex G-100 column
2.3 PEP-2的单糖组成分析
如图3,A图为标品的洗脱曲线,B图为多糖组分PEP-2的洗脱曲线。由图中分析可得出结果:
结果显示,组成PEP-2的单糖为甘露糖(mannose)、葡萄糖(glucose)以及半乳糖(galactose)三种,他们的摩尔百分比为10.92%:78.60%:10.48%。
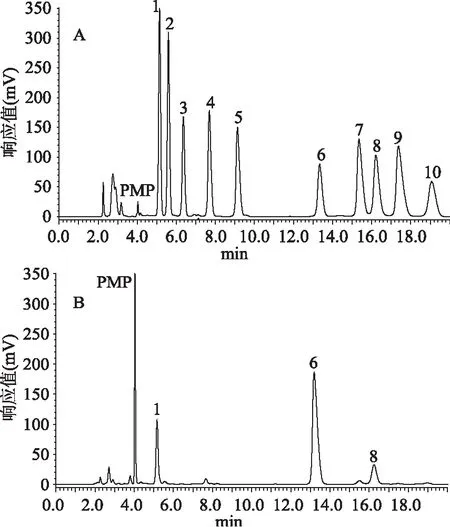
图3 PMP衍生化的HPLC-UV色谱图Fig.3 HPLC chromatograms based on percolumn derivatization with PMP注:A:PMP标记的10种单糖标品的HPLC色谱图;B:PMP标记的PEP-2的HPLC色谱图;1.D-甘露糖(Man);2.D-核糖 (Rib);3.L-鼠李糖(Rha);4.D-葡萄糖醛酸(GlcUA);5.D-半乳糖醛酸(GalUA);6.D-葡萄糖(Glc);7.D-木糖(Xyl);8.D-半乳糖(Gal);9.L-阿拉伯糖(Ara);10.D-岩藻糖(Fuc)。
2.4 PEP-2分子量测定结果
如图4所示,PEP-2在HPLC中呈现单一对称尖峰,表明其为均一多糖。根据标准葡聚糖系列Dextran T-2000、T-500、T-70、T-40、T-10制作标准曲线:lgMw=-0.3812tR+8.4449,R2=0.9914。其中Mw为重均相对分子质量,tR为保留时间(min)。根据HPLC的保留时间tR7.200 min。代入回归方程中,计算得多糖PEP-2的相对分子质量为463396 u。
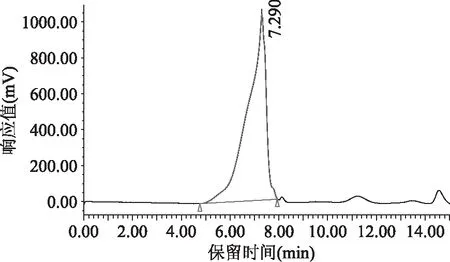
图4 PEP-2的高效液相色谱图Fig.4 The HPLC spectrogram of PEP-2
2.5 紫外扫描(UV analysis)结果
PEP-2的紫外光谱全波长扫描如图5所示,在200 nm和204 nm处有多糖的特征吸收峰;在260 nm和280 nm处并无吸收,则说明PEP-2均不含核酸和蛋白质。
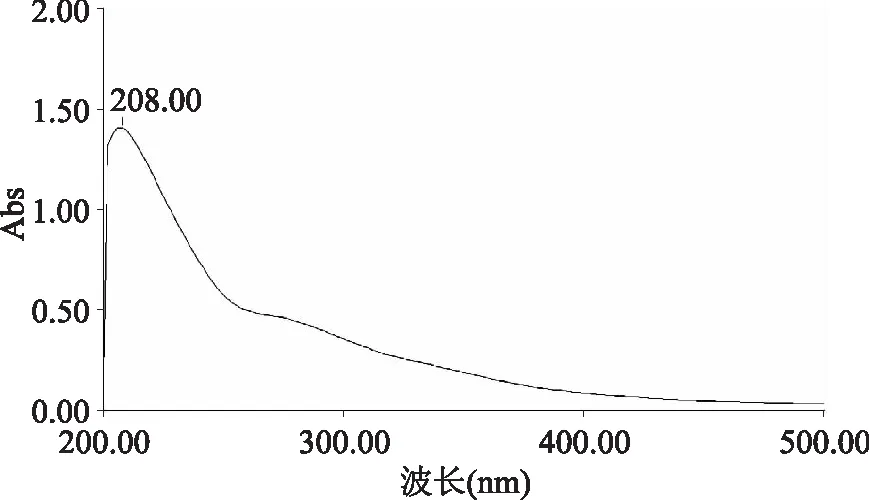
图5 PEP-2紫外扫描图谱Fig.5 The UV scanning spectrum of PEP-2
2.6 红外波谱扫描(IR analysis)
PEP-2的红外光谱从400~4000 cm-1,如图6所示,PEP-2含有典型的多糖的特征吸收峰,在3424、2937、2788、2704、1627、1384、1352、1074、760、618 cm-1等处呈现吸收带,在3424 cm-1处有较强的羟基O-H振动[27],在2788等处有较弱的CH3,CH2,CH的伸缩振动[25],在波数1627 cm-1处有C=O非对称的伸缩振动峰,在波数1074、760、618 cm-1处有吸收带的情况,可推测是吡喃环型的多糖[28],其中1074处的吸收峰是吡喃环内酯与羟基的吸收产生的[25]。
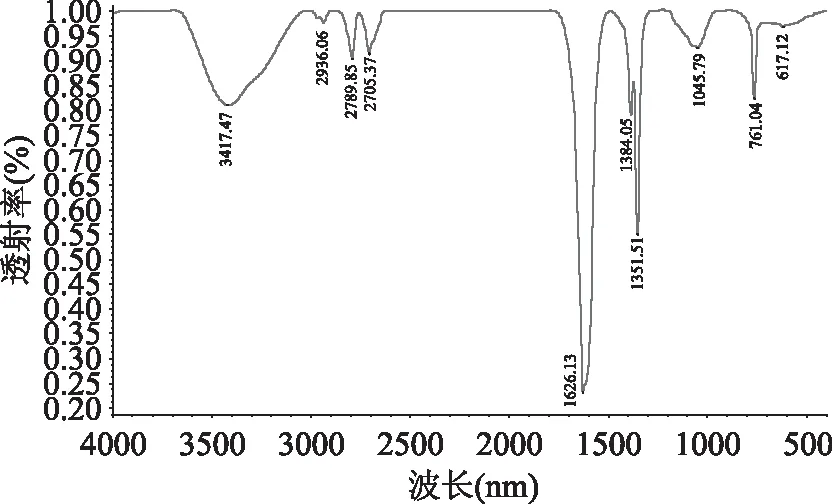
图6 PEP-2红外扫描图谱Fig.6 IR of PEP-2
2.7 细胞存活率测定结果
如图7所示为杏鲍菇一种多糖组分PEP-2作用于人体肝癌细胞HepG2细胞24 h后细胞存活率的变化情况。由图中可以看出,在作用于HepG2细胞24 h之后,在PEP-2浓度为50 μg/mL时,HepG2细胞存活率为78%(p<0.05),相较于较阴性对照下降了22%,当浓度上升到100 μg/mL时,细胞存活率下降至58%(p<0.05),当浓度超过100 μg/mL时,细胞存活率为46%(p<0.05),对比阴性细胞下降了44%,由此可得,样品PEP-2对HepG2细胞的抑制作用随着浓度的增加有显著的变化,结果表明,PEP-2对人体肝癌细胞HepG2存活率有明显的抑制,作用显著(p<0.05),存在明显的量效关系。
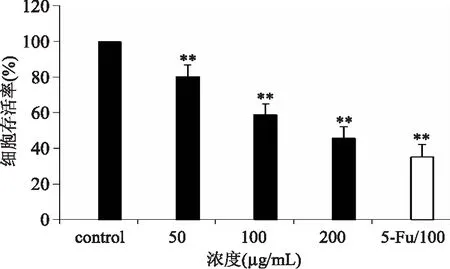
图7 PEP-2对HepG2细胞的抑制作用Fig.7 Inhibitory effect of PEP-2 on HepG2 cell proliferation注:“**”表示与对照组比有显著差异(p<0.05),图8同。
2.8 细胞毒性分析结果
图8所示为杏鲍菇一种多糖组分PEP-2作用于人体肝癌细胞HepG2细胞24 h后,细胞外乳酸脱氢酶LDH释放量的检测结果。如图所示,多糖PEP-2的浓度为50 μg/mL浓度范围内时,胞外LDH的活性随着多糖组分浓度的增大而增大,PEP-2增加的趋势明显,但当浓度逐渐增大时,PEP-2的细胞毒性作用依然随着浓度的上升而增大,PEP-2浓度为100 μg/mL时,HepG2细胞产生了256 U/L的释放量(p<0.05),当继续增大PEP-2浓度为200 μg/mL时,HepG2细胞产生了425 U/L的释放量(p<0.05)。结果显示,PEP-2对人体肝癌细胞HepG2有较强的细胞毒性作用,并呈现量效依赖的关系。这与2.7中MTT的结果是吻合的。

图8 PEP-2对HepG2细胞乳酸脱氢酶释放的影响Fig.8 Effect of PEP-2 on LDH release in HepG2 cells
2.9 细胞形态学变化
图9为倒置荧光显微镜下观察到的细胞形态变化。经DAPI染色后,细胞核染成蓝色。对照组细胞数量较多且形态规则,而PEP-2处理6 h细胞即出现了细胞皱缩或者不规则的形态。随着时间的增长,可以明显的从图中看出,在经过处理12 h之后,细胞出现了染色质凝集,核碎裂和凋亡小体等细胞凋亡的典型特征,PEP-2处理24 h之后,药物处理时间更长,细胞死亡现象普遍,贴壁细胞数量越少。由此,细胞形态学结果显示,PEP-2引起的HepG2细胞死亡属于细胞凋亡。

图9 DAPI染色观察PEP-2对HepG2细胞形态影响Fig.9 Inverted microscope morphological characteristics of HepG2 cells treated with PEP-2
3 结论与讨论
蘑菇是一种药食两用的真菌,大量的研究表明不同种类的蘑菇均具有良好的抗肿瘤活性[29]。多糖是蘑菇中最有效的活性成分,具有抗肿瘤及免疫调节活性[24]。长期以来,多糖的相对分子质量大小被公认为会影响多糖的抗肿瘤活性。人们普遍认识到,分子量和单糖组成是两个影响天然多糖抗癌活性的重要因素[22]。事实上,一些蘑菇多糖已开始进入人类临床评估阶段[30-31]。1985年,分子量为5×105u的香菇多糖在日本被批准并产生作为辅助剂治疗癌症[31]。
在本研究中,用DEAE-52阴离子交换柱和Sephadex G-100葡聚糖凝胶柱层析分离,将杏鲍菇粗多糖进一步分离得到分子量为4.63×105u的高分子量组分PEP-2。单糖分析表明,PEP-2均主要由78.60%摩尔百分比的葡萄糖组成。在体外抗肿瘤活性实验中我们发现高分子量的PEP-2对HepG-2细胞表现出显著的高抗肿瘤活性,这表明分离纯化可以筛选出杏鲍菇多糖的抗肿瘤活性高的组分。PEP-2良好的抗肿瘤活性使之有潜力成为新颖且有效的癌症的预防剂。
[1]窦姣,郭玉蓉,李洁,等. 苹果疏除幼果与成熟果多糖成分分析及抗氧化活性研究[J]. 食品工业科技,2015,01(015):110-114.
[2]Zhang H N,Lin Z B. Hypoglycemic effect of Ganoderma lucidum polysaccharides[J]. Acta Pharmacologica sinica,2004,25(2):191-195.
[3]韩春然,徐丽萍. 黑木耳多糖的提取、纯化及降血脂作用的研究[J]. 中国食品学报,2007,7(1):54-58.
[4]张璐,刘强. 茯苓多糖制备工艺及药理作用研究进展[J]. 中国实验方剂学杂志,2006,12(4):61-64.
[5]Yang W F,Wang Y,Li X P,et al. Purification and structural characterization of Chinese yam polysaccharide and its activities[J]. Carbohydrate Polymers,2015,117:1021-1027.
[6]Tan Z J,Li F F,Xu X X,et al. Simultaneous extraction and purification of aloe polysaccharides and proteins using ionic liquid based aqueous two phase system coupled with dialysis membrane[J]. Desalination,2012,286:389-393.
[7]胡绪乔,原菲,严春艳,等. 银杏多糖的分离鉴定和体外抗氧化活性测试[J]. 中药材杂志,2011,34(12):1950-1953.
[8]Wang J,Li S S,Fan Y Y,et al. Anti-fatigue activity of the water-soluble polysaccharides isolated from Panax ginseng C. A. Meyer[J]. Journal of Ethnopharmacology,2010,130:421-423.
[9]Yang X B,Zhao Y,Lv Y.Invivomacrophage activation and physicochemical property of the different polysaccharide fractions purified from Angelica sinensis[J]. Carbohydrate Polymers,2008,71:372-379.
[10]He N W,Yang X B,Jiao Y D,et al. Characterisation of antioxidant and antiproliferative acidic polysaccharidesfrom Chinese wolfberry fruits[J]. Food Chemistry,2012,133:978-989.
[11]余雄涛,潘鸿辉,谢意珍. 食用菌风味物质的研究及应用进展[J]. 中国食用菌,2013,32(3):4-7.
[12]邓超,邬敏辰. 食用菌深层发酵及其多糖活性研究进展[J]. 安徽农业科学,2007,35(15):4622-4625.
[13]李磊,王卫国. 真菌多糖药理作用及其提取、纯化研究进展[J]. 河南工业大学学报,2008,29(2):87-92.
[14]Yue K,Ye M,Zhou Z J,et al. The genus Cordyceps:a chemical and pharmacological review[J]. Journal of Pharmacy and Pharmacology,2013,65(4):474-493.
[15]Kiho T,Morimoto H,Kobayashi T,et al. Effect of a polysaccharide(TAP)from the Fruiting bodies of tremella aurantia on Glucose Metabolism in Mouse liver[J]. Bioscience Biotechnology and Biochemistry,2000,64(2):417-419.
[16]袁建国,程显好,侯永勤. 冬虫夏草多糖组分研究及药理实验[J]. 食品与药品,2005,7(1):45-48.
[17]Chen Y C,Wu S Y,Chen C C,et al. Armillaria mellea component armillarikin induces apoptosis in human leukemia cells[J]. Journal of Functional Foods,2014,6:196-204.
[18]郭美英. 珍稀食用菌杏鲍菇生物学特性的研究[J]. 福建农业学报,1998,13(3):44-49.
[19]Han E H,Hwang Y P,Kim H G,et al. Inhibitory effect of Pleurotus eryngii extracts on the activities of allergic mediators in antigen-stimulated mast cells[J]. Food and Chemical Toxicology,2011,49:1416-1425.
[20]Li S Q,Shah N P. Antioxidant and antibacterial activities of sulphated polysaccharidesfrom Pleurotus eryngii and Streptococcus thermophilus ASCC 1275[J]. Food Chemistry,2014,165:262-270.
[21]Ren D Y,Zhao Y,Nie Y,et al. Chemical composition of Pleurotus eryngii polysaccharides and their inhibitory effects on high-fructose diet-induced insulin resistance and oxidative stress in mice[J]. Food and Function,2014,5:2609-2620.
[22]Chen J J,Mao D,Yong Y Y. et al. Hepatoprotective and hypolipidemic effects of water-soluble polysaccharidic extract of Pleurotus eryngii[J]. Food Chemistry,2012,130:687-694.
[23]Lv Y,Yang X B,Zhao Y,et al. Separation and quantification of component monosaccharides of the tea polysaccharides from Gynostemma pentaphyllum by HPLC with indirect UV detection[J]. Food Chemistry,2009,112:742-746.
[24]Shi X L,Zhao Y,Jiao Y D,et al. ROS-Dependent mitochondria molecular mechanisms underlying antitumor activity of Pleurotus abalonus acidic polysaccharides in human breast cancer MCF-7 cells[J]. Plos One,2013,8(5):1-12.
[25]Dou J,Meng Y H,Liu L,et al. Purification,characterization and antioxidant activities of polysaccharides from thinned-young apple[J]. International Journal of Biological Macromolecules,2015,72:31-40.
[26]Wang N,Ren D Y,Deng S,et al. Differential effects of baicalein and its sulfated derivatives in inhibiting proliferation of human breast cancer MCF-7 cells[J]. Chemico-Biological Interactions,2014,227:99-708.
[27]Yi Y,Liao S T,Zhang M W,et al. Physicochemical characteristics and immunomodulatory activities of three polysaccharide-protein complexes of Longan Pulp[J]. Molecules,2011,16:6148-6169.
[28]Yi Y,Liao S T,Zhang M W,et al. Structural features and immunomodulatory activities of polysaccharides of longan pulp[J]. Carbohydrate Polymers,2012,87:636-643.
[29]Zhang M,Cui S W,Cheung P C K,et al. Antitumor polysaccharides from mushrooms:a review on their isolation process,structural characteristics and antitumor activity[J]. Trends in Food Science and Technology,2007,18:4-19.
[30]Chen X Y,Xu X J,Zhang L N,et al. Chain conformation and anti-tumor activities of phosphorylated(1→3)-β-D-glucan from Poria cocos[J]. Carbohydrate Polymers,2015,78:581-587.
[31]Zong A Z,Cao H Z,Wang F S. Anticancer polysaccharides from natural resources:A review of recent research[J]. Carbohydrate Polymers,2012,90:1395-1410.
Chemical characterization ofPleurotuseryngiipolysaccharide PEP-2and its tumor-inhibitory effects against human hepatoblastoma HepG-2 cell
JIANG Yan-hong,ZHANG Ling-fan,LV Ying,TANG Xi,REN Dao-yuan*
(College of Food Engineering and Nutritional Science,Shaanxi Normal University,Xi'an 710119,China)
Objective:ThisstudywasdesignedtoinvestigatethechemicalcharacterizationandantitumoreffectsofPleurotus eryngiipolysaccharides(PEP).Method:Anovelwater-solublePEPwaspurifiedfromP. eryngiibyCelluloseDEAE-52andSephadexG-100chromatographytogetonefractions,namelyPEP-2.ThemonosaccharidescompositionandmolecularweightofPEP-2wasanalyzedbyHPLC.ColorimetricMTTassaywasperformedtoassesscellviabilityofHepG-2cellstreatedwithPEP-2.ThechangeinHepG-2cellnormalmorphologywasobservedbyDAPIstaining.Result:HPLCanalysisshowedthatPEP-2washeteropolysaccharidesmainlycomposedofglucosewiththeaveragemolecularweightsof4.63×105u.TheantitumoractivitiesofthepolysaccharidesagainsthumanhepatoblastomaHepG-2cellswerestudiedin vitro,andPEP-2showedstronggrowthinhibitionagainstHepG-2cells.DAPIstainingshowedthatthenucleusofuntreatedcontrolcellswaslargeandroundwithoutcondensationorfragmentation,whereasthenucleusfromthePEP-2treatedcellswascondensedandfragmented.Conclusion:ItwasamajorbreakthroughbringingnewinsightofthepotentialuseoftheP. eryngiipolysaccharidesashealth-carefoodtoprovidesignificantnaturaldefenseagainsthumancancer.
Pleurotus eryngii;polysaccharide;purification;anti-proliferation;apoptosis
2016-03-21
姜艳红 (1993-),女,本科生,研究方向:食品功能与营养研究,E-mail:1273544966@qq.com。
*通讯作者:任道远 (1988-),男,博士研究生,研究方向:食品营养化学研究,E-mail:dyren@snnu.edu.cn。
国家自然科学基金项目(C31171678);大学生创新创业训练计划项目(201510718020)。
TS201.1
A
1002-0306(2016)19-0111-06
10.13386/j.issn1002-0306.2016.19.013

