不同家系中华绒螯蟹幼蟹在室外和室内的生长
胡清彪,李晓东,姜玉声,司永国,郑 岩,孙 娜
( 1. 大连海洋大学,辽宁 大连116023;2. 盘锦光合蟹业有限公司研发中心,辽宁省中华绒螯蟹育种重点实验室,辽宁 盘锦124200 )
不同家系中华绒螯蟹幼蟹在室外和室内的生长
胡清彪1,2,李晓东2,姜玉声1,司永国2,郑 岩2,孙 娜2
( 1. 大连海洋大学,辽宁 大连116023;2. 盘锦光合蟹业有限公司研发中心,辽宁省中华绒螯蟹育种重点实验室,辽宁 盘锦124200 )
2015年6月上旬,将3个家系中华绒螯蟹大眼幼体分别饲养在面积为40 m2(6.50 m×6.15 m)的稻田围隔中,每个围隔约2500尾。2015年7月中下旬,随机从中选取各3个家系的幼蟹,放入室内300 L的养殖缸(30只/缸)中对比养殖。2015年8—10月连续测量了幼蟹的头胸甲宽、头胸甲长、体质量,用多重方差分析了环境、家系及生长阶段的性状参数。试验结果表明,养殖环境对A家系幼蟹生长性状的影响不显著(P>0.05),对B家系则极显著(P<0.01),对C家系,除了初始的生长性状影响不显著外(P>0.05),其余均存在显著影响(P<0.05),表明A家系具有一定的环境适应性。家系因素对幼蟹生长性状参数均存在显著影响(P<0.05),表明遗传对于幼蟹的生长具有重要作用。相关分析表明,蟹种的头胸甲宽、头胸甲长在两种养殖环境中均呈极显著正相关(P<0.01),相关系数分别为0.314、0.305;体质量呈不显著正相关(r=0.146,P>0.05),表明以头胸甲宽、头胸甲长为选育指标得到的后代对两种养殖环境有一定的适应性。
中华绒螯蟹;生长性状;环境;家系;方差分析
中华绒螯蟹(Eriocheirsinensis)是我国重要的经济蟹种,整个生活周期中的生长发育都经过蜕壳而实现[1],每一次蜕壳生长及形态性状发生变化。甲壳动物蜕壳受神经系统、内分泌系统和多种激素以及外界环境的协同调控[2-4],其中外界环境是影响蜕壳的重要因素。慈元吉等[5]研究了中华绒螯蟹仔蟹在不同饲养环境下的生长,表明不同饲养环境下中华绒螯蟹仔蟹生长差异巨大。对长江水系10个家系中华绒螯蟹生长比较和分析表明,不同家系生长速度不同[6]。生长性状(头胸甲宽、头胸甲长、体质量)是遗传育种的重要考量对象,徐海龙等[7]分析研究了影响渤海湾4种蟹类表型形态性状对体质量的作用效果,给出了影响4种蟹类体质量的主要表型形态性状。而环境因素以及家系因素都影响生长性状,但目前有关影响中华绒螯蟹幼蟹到蟹种这一阶段生长的研究尚未见报道。本文就环境、家系对中华绒螯蟹幼蟹到蟹种的生长性状进行了统计学研究,探讨了环境、家系和养殖环境对幼蟹生长性状及发育影响和相关性,为中华绒螯蟹的合理养殖和育种提供参考。
1 材料与方法
1.1 亲本来源
不同家系中华绒螯蟹亲本为盘锦光合蟹业有限公司培育的光合选育系中华绒螯蟹,从中选取健全、活力强、无疾病、性腺发育好的中华绒螯蟹作为亲本。
1.2 苗种及一龄蟹种的培育
苗种培育在盘锦光合蟹业有限公司土池育苗场中进行,按规范化流程进行。2015年6月上旬,不同家系大眼幼体饲养在室外稻田围隔中(N 40°54′13″,E 121°52′14″),围隔面积40 m2(6.50 m×6.15 m),密度为每个围隔约2500尾。2015年7月中下旬,由稻田围隔中随机自A、B、C 3个家系中各选取90只幼蟹(采集时C家系幼蟹数量少,只选取60只),分别置于养殖车间内300 L的养殖缸(30只/缸)中进行室内养殖。养殖期间,室内养殖缸平均水温22.5 ℃,溶解氧7.2 mg/L;室外稻田围隔平均水温24.9 ℃,溶解氧7.0 mg/L,养殖期间均投喂同一饲料。
1.3 生长性状参数的测量
在7月31日、8月15日、8月31日、9月15日、10月1日测量室内、外养殖的3个家系中华绒螯蟹的头胸甲宽、头胸甲长和体质量。测量时每个家系分别随机选取30只,共测量了540个参数。长度精确至0.01 mm,质量精确至0.01 g。
1.4 数据处理
采用SPSS 20.0、Excel 2010等软件整理、处理各项数据,对数据进行多重方差分析及具有一个重复测量因素的方差分析;对不同家系蟹种的生长性状值进行相关分析,所有显著性检验均以P<0.05为差异有统计学意义。
生长速度用特定生长率表示:
特定生长率/%·d-1=[(lnm2-lnm1)/(t2-t1)]×100%
式中,m1、m2分别为初始体质量和终末体质量(g),t1、t2分别为初始时间和终末时间(d)。
2 结果与分析
2.1 幼蟹生长性状分析
不同时间3个家系幼蟹在两种养殖环境中的头胸甲宽(图1)、头胸甲长(图2)和体质量的平均值见表1。由表1可知,室外养殖的B家系幼蟹头胸甲宽(1.58倍)和头胸甲长(1.50倍)增长最大,室内C家系最小(1.16倍和1.17倍)。两种养殖环境中3个家系幼蟹10月初相对于7月底的特定生长率见表2。由表2可知,室外养殖的B家系特定生长率最高,室内养殖的C家系最小。
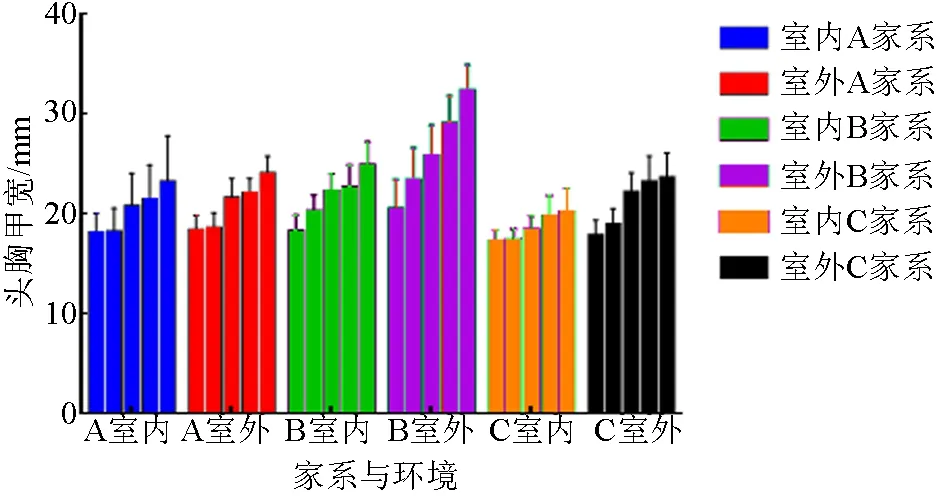
图1 不同环境下养殖的各家系幼蟹的头胸甲宽

图2 不同环境下养殖的各家系幼蟹的头胸甲长

家系参数养殖环境07-3108-1508-3109-1510-01A家系头胸甲宽/mm头胸甲长/mm体质量/g室内17.94±2.0618.08±2.4820.63±3.4321.31±3.5723.04±4.73室外18.22±1.5918.44±1.6921.49±2.0321.91±1.6523.92±1.84室内16.55±2.1016.65±1.8718.83±3.0719.31±3.8020.78±4.21室外16.61±1.6916.72±1.4319.57±1.8019.93±1.4121.60±1.86室内2.49±0.952.74±0.824.20±1.974.79±2.346.04±3.69室外2.42±0.592.69±0.934.40±1.114.56±1.196.34±1.65B家系头胸甲宽/mm头胸甲长/mm体质量/g室内18.11±1.7820.08±1.8122.14±1.8422.50±2.3724.74±2.46室外20.37±3.0923.20±3.4225.67±3.2328.93±2.8832.18±2.75室内16.46±1.6118.30±1.6620.16±1.7020.57±2.2022.36±2.22室外19.54±4.3621.53±3.0223.73±3.2526.49±2.6529.36±3.01室内2.57±0.773.61±0.934.77±1.085.16±1.496.78±1.92室外3.64±1.455.70±2.187.40±2.4011.45±3.7214.27±3.69C家系头胸甲宽/mm头胸甲长/mm体质量/g室内17.10±1.3017.22±1.2518.26±1.5319.63±2.1920.06±2.45室外17.72±1.6418.80±1.7022.06±2.0223.08±2.7023.52±2.56室内15.72±1.1915.81±1.4017.19±2.6017.82±1.4718.20±2.21室外16.05±1.5217.16±1.5919.96±1.8720.89±2.4521.17±2.22室内2.19±0.662.30±0.792.71±0.673.56±0.764.11±1.30室外2.25±0.653.02±0.844.95±1.405.72±1.986.06±2.13
2.2 方差分析
中华绒螯蟹幼蟹头胸甲宽、头胸甲长和体质量的变化与环境因素、家系因素以及环境与家系之间的交互作用均表现出极显著的差异(P<0.01)(表3)。为进一步区分环境因素、家系因素分别对中华绒螯蟹幼蟹生长过程中5个时间点头胸甲宽、头胸甲长、体质量的具体影响,进行了具有一个重复测量因素的方差分析(表4)。

表2 不同养殖环境下各家系幼蟹7月至10月的特定生长率 %/d

表3 养殖环境与家系对中华绒螯蟹幼蟹生长参数的多重方差分析

表4 养殖环境、家系分别对中华绒螯蟹头胸甲宽、头胸甲长、体质量的影响效应检验
7月底至10月初,养殖环境对A家系幼蟹的头胸甲宽、头胸甲长、体质量变化均无显著影响(P>0.05),而对B家系幼蟹的这些值的变化均有极显著影响(P<0.01);养殖环境对C家系幼蟹头胸甲宽、头胸甲长、体质量值的变化除了7月31日均无差异外(P>0.05),其他时间均存在显著性差异(P<0.05)(表4)。
7月底至10月初,室内养殖环境中,家系因素对幼蟹的头胸甲宽、头胸甲长、体质量值的变化除7月31日无差异外(P>0.05),其余均存在差异显著(P<0.05);室外养殖环境中,家系因素对幼蟹5个时间点的头胸甲宽、头胸甲长、体质量的值的变化均存在极显著差异(P<0.01)(表4)。
2.3 不同环境中各家系蟹种各性状值的相关分析
相关分析(表5)表明,室内、室外养殖的中华绒螯蟹蟹种头胸甲宽、头胸甲长与环境中均呈正相关,相关系数分别为0.314和0.305,相关性检验极显著(P<0.01),体质量在室内、室外两种养殖环境中呈正相关,相关系数为r=0.146,相关性检验不显著(P>0.05)。

表5 不同养殖环境下中华绒螯蟹蟹种各性状的相关情况
注:**表示在0.01水平上显著相关.
3 讨 论
3.1 环境对幼蟹生长性状的影响
环境对中华绒螯蟹的生长发育影响很大。中华绒螯蟹幼蟹的蜕壳与环境密切相关[8],不同养殖环境下,中华绒螯蟹生长速度也存在着显著的差异[9-13]。其他甲壳动物,如罗氏沼虾(Macrobrachiumrosenbergii)在不同池塘中生长与存活率有显著差异[14];不同盐度、温度和溶解氧含量等对龙虾(Panuliruslongipes)、蓝蟹(Callinectessapidus)仔蟹生长有显著影响[15-17]。本试验发现,室外养殖的中华绒螯蟹头胸甲宽、头胸甲长增长最大,室内的最小;室外养殖的中华绒螯蟹体质量的特定生长率高于室内养殖的,这与慈元吉等[5]报道的仔蟹到幼蟹阶段的结果一致。多重方差分析发现,幼蟹生长的头胸甲宽、头胸甲长、体质量的变化存在着极显著的环境差异性。考虑环境因素分别对3个家系生长性状的影响时发现:A家系在5个时间点生长性状参数变化不存在环境差异性;B家系在5个时间点生长性状参数变化均存在极显著环境差异;C家系在初始7月31日外的其他时间的生长性状参数的变化存在显著环境差异,表明环境因素对不同家系的影响不同,即环境因素对于B、C家系生长性状变化均存在着显著影响,可能是因为室内养殖缸的养殖环境、水体营养等条件较室外围隔的大水体条件差,且两种养殖环境中存在着不同的溶解氧、温度和光照,因此有理由推测,两种养殖环境对B、C家系造成了影响,但是环境因素对A家系却未造成影响。这从侧面说明A家系幼蟹生长过程中受环境的影响较小,可能比B、C家系具有更强的环境适应能力,A家系具有作为未来选育过程中具有较强适应性品种的潜力。
3.2 家系对幼蟹生长性状的影响
家系对不同甲壳动物生长存在着影响。张吕平等[18]测量发现,不同家系凡纳滨对虾(Litopenaeusvannamei)生长状况存在明显差异。不同家系中华绒鳌蟹的生长状况也存在着差异[6]。生长性状分析发现,中华绒螯蟹幼蟹到蟹种阶段,B家系头胸甲宽、头胸甲长的增长最大,特定生长率也最大,而C家系均最小。多重方差分析发现,在生长过程中,幼蟹的头胸甲宽、头胸甲长、体质量变化存在着极显著的家系差异性。考虑家系因素对室内外养殖环境中生长性状的影响时发现,室内养殖环境中,除去初始生长性状参数(7月31日),其他时间的生长性状参数与家系因素均存在显著性差异;室外养殖环境中,5个时间的生长性状参数与家系因素均存在显著性差异。这表明家系因素对幼蟹性状的生长存在影响,其原因是不同家系的亲本不同,家系之间的遗传性有差异,造成了不同家系生长性状的差异。
3.3 不同家系蟹种在不同环境中生长性状的相关性
已有诸多学者研究了养殖密度对虾类生长的影响[19-22],不同密度间虾竞争使能量消耗程度不同,进而影响生长。由此可推测,本试验中两种养殖环境下中华绒螯蟹的养殖密度不同,加上养殖环境以及不同家系的差异,使其生长受到影响,进而影响了同一性状在室内、外两种养殖环境中的相关性。当中华绒螯蟹由幼蟹发育为蟹种时,对不同环境蟹种性状的相关性分析可知,室内养殖的蟹种头胸甲宽、头胸甲长与室外养殖环境中头胸甲宽、头胸甲长间均存在极显著正相关性(P<0.01);而体质量存在不显著正相关性(P>0.05),表明一定条件下,以头胸甲宽和头胸甲长作为选育指标培育的优良品种会具有一定范围的适用性,可以基本适应室内、室外两种养殖环境。实际上头胸甲宽与头胸甲长对体质量均有直接和间接的决定效应,不同的蟹类决定效果不同[7]。这给实际育种工作带来了一些启示:在中华绒螯蟹选育过程中将头胸甲宽、头胸甲长作为选择指标,培育出的后代比将体质量作为选育指标培育的后代具有更强的环境适用性,可适应不同的环境。该指标只是对以环境适应性为目的的育种有一定的指导意义,不同育种目的还需用不同的选育指标。
综合来看,在幼蟹生长过程中,根据环境与生长性状的方差分析可以初步区分对环境有广适应性的家系;当其发育为蟹种时,通过环境与生长性状的相关性分析得知,头胸甲宽、头胸甲长这两个指标选育出的品种具有一定范围的适用性。因此育种过程中需要根据不同的育种目的来选择不同的方案,以获得期望的育种效果。本文只是利用统计学方法对不同环境、不同家系幼蟹的生长性状进行了初步分析,要更好地应用于中华绒螯蟹优良品种的选育工作中去,还需持续跟踪研究。
[1] 李晓东.北方河蟹养殖新技术[M].北京:中国农业出版社,2006:26-27.
[2] 申玉春,陈作洲,刘丽,等.盐度和营养对凡纳滨对虾蜕壳和生长的影响[J].水产学报,2012,36(2):290-299.
[3] 朱小明,李少菁.甲壳动物幼体蜕皮的调控[J].水产学报,2001,25(4):379-384.
[4] Buchholz F,Buchholz C.Growth and moulting in Northern krill (MeganyctiphanesnorvegicaSars)[G]//Geraint A. Tarling: Advances in Marine Biology—Biology of Northern Krill-57. Netherlands: Elsevier, 2010:173-197.
[5] 慈元吉,黄姝,岳武成,等.饲养环境对中华绒螯蟹仔蟹生长与蜕壳相关基因表达的影响[J].上海海洋大学学报,2015,24(4):481-488.
[6] 刘伟,李应森,王武,等.长江水系中华绒螯蟹不同家系扣蟹阶段生长性能的研究[J].湖北农业科学,2010,49(4):933-935.
[7] 徐海龙,刘杨,谷德贤,等.渤海湾4种蟹类形态性状关系及对体质量的影响[J].水产科学,2014,33(3):142-146.
[8] 张堂林,李钟杰.中华绒螯蟹幼蟹蜕壳的生态学观察[J].湖泊科学,1999,11(4):333-337.
[9] 汪留全,周婉华.池养中华绒螯蟹幼蟹生长特性的初步研究[J].水产学报,1989,13(1):17-23.
[10] 洪美玲.水中亚硝酸盐和氨氮对中华绒螯蟹幼体的毒性效应及维生素E的营养调节[D].上海:华东师范大学,2007.
[11] 程建新,宋学宏,吴林坤,等.养殖水环境对中华绒螯蟹不同营养供给模式的响应[J].水生生物学报,2008,32(5):657-668.
[12] 徐建荣,沈颂东,张加梅,等.环境条件对中华绒螯蟹大眼幼体蜕壳生长的影响[J].水产科学, 2006,25(10):505-508.
[13] 王悦如,李二超,龙丽娜,等.中华绒螯蟹对盐度变化的适应及其渗透压调节的研究进展[J].海洋渔业,2011,33(3):352-360.
[14] 杨国梁,罗坤,孔杰,等.罗氏沼虾不同养殖条件下的生长和存活率相关分析[J].海洋水产研究,2008,29(3):74-79.
[15] Chittleborough R G.Environmental factors affecting growth and survival of juvenile western rock lobstersPanuliruslongipes(Milen-Edwards)[J].Marine and Freshwater Research, 1975,26(2):177-196.
[16] Guerin J L,Stickle W B.Effects of salinity gradients on the tolerance and bioenergetics of juvenile blue crabs (Callinectessapidus) from waters of different environmental salinities[J].Marine Biology,1992,114(3):391-396.
[17] Leffler C W. Some effects of temperature on the growth and metabolic rate of juvenile blue crabs,Callinectessapidus, in the laboratory[J].Marine Biology,1972,14(2):104-110.
[18] 张吕平,吴立峰,沈琪,等.凡纳滨对虾全同胞家系的建立及生长比较[J].水产学报,2009, 33(6):932-939.
[19] 兰国宝,阎冰,廖思明.南美白对虾集约化养殖产量与密度关系研究[J].水产养殖,2003,24(4):38-39.
[20] 肖鸣鹤,肖英平,吴志强,等.养殖密度对克氏原螯虾幼虾生长、消化酶活力和生理生化指标的影响[J].水产学报,2012,36(7):1088-1093.
[21] Allan G L, Maguire G B.Effects of stocking density on production ofPenaeusmonodonFabricius in model farming ponds[J].Aquaculture,1992,107(1):49-66.
[22] Coman G J,Crocos P J, Preston N P. The effects of density on the growth and survival of different families of juvenilePenaeusjaponicasBate[J].Aquaculture,2004,229 (1/4):215-223.
ComparativeGrowthTraitsinDifferentFamiliesofJuvenileChineseMittenHandedCrab,Eriocheirsinensis,CulturedinNetCagesDisposedinRicefieldsandinanIndoorTank
HU Qingbiao1,2, LI Xiaodong2, JIANG Yusheng1, SI Yongguo2, ZHENG Yan2, SUN Na2
( 1.Dalian Ocean University, Dalian 116023, China; 2. Research & Development Center, Key Laboratory of Breeding of Chinese Mitten Crab in Liaoning Province′ China, Panjin Guanghe Crab Industry Co. Ltd., Panjin 124200, China )
Megalopa larvae of A, B and C families of Chinese mitten handed crab (Eriochiersinensis) were reared in a 40 m2net cage (6.50 m×6.15 m) at a stocking density of 2500 individuals per cage in early June of 2015. Some of the juveniles were randomly sampled from the net cages and comparatively reared in an indoor 300 L tanks at a stocking density of 30 individuals per tank later July of 2015. Carapace width, carapace length and body weight reared in the juveniles in the ricefields and in an indoor tank were measured in a some 15 day interval from August to October in 2015, and the data above were analyzed by multiple analysis of variance and repeated measures analysis of variances from environmental factor, family factor and the growth traits. The results showed that there was no significant influence of rearing environmental factor on the growth traits in the crab juveniles in family A(P>0.05), with very significant influence on those in family B(P<0.01),and significant influence on those in family C(P<0.05) except for at the beginning period of growth(P>0.05), indicating that the juveniles in family A had a certain environmental adaptability. Meanwhlie, family factor was found to have significant effects on growth traits of the crab juveniles in different periods(P<0.05), which shows that heredity plays an important role in the growth of crab juveniles. The correlation analysis of rearing environments revealed that there was very significant positive correlation between growth traits (carapace width and carapace length) and rearing environment, with correlation coefficients of 0.314 and 0.305(P<0.01), and no significant correlation with the body weight (r=0.146,P>0.05). The findings indicate that the offspring will have a certain adaptation when carapace width and carapace length are chosen as selection indices in two different rearing environments.
Eriochiersinensis; growth trait; environment; family; analysis of variance
10.16378/j.cnki.1003-1111.2016.05.015
S968.25
A
1003-1111(2016)05-0547-05
2016-01-21;
2016-04-18.
国家“十二五”科技支撑计划项目(2012BAD26B00);辽宁省科学技术厅科学技术计划项目(2015203003).
胡清彪(1991—),男,硕士研究生;研究方向:中华绒螯蟹遗传与育种.E-mail:hqbone@163.com.通讯作者:李晓东(1965—),男,教授,博士;研究方向:水生动物育种.E-mail:lxd001@ceraap.com.

