植物提取物在断奶仔猪饲粮中的应用效果研究
朱宇旌,王博,李方方,郑丽莉,高原,孟玲,郭福来,丁兰,张勇
(1.沈阳农业大学畜牧兽医学院,辽宁沈阳110866;2.辽宁德宝农牧集团有限公司,辽宁沈阳110171;3.沈阳福康农牧科技有限公司,辽宁沈阳110164)
植物提取物在断奶仔猪饲粮中的应用效果研究
朱宇旌1,王博1,李方方1,郑丽莉1,高原2,孟玲2,郭福来2,丁兰3,张勇1
(1.沈阳农业大学畜牧兽医学院,辽宁沈阳110866;2.辽宁德宝农牧集团有限公司,辽宁沈阳110171;3.沈阳福康农牧科技有限公司,辽宁沈阳110164)
试验旨在研究植物提取物在仔猪生产中的应用效果。选用(10.30±1.13)kg大白断奶仔猪240头,随机分为4组,每组4个重复,每个重复15头猪,对照组饲喂基础饲粮,试验组在基础饲粮中分别添加植物提取物A(PE-A)500 mg/kg、植物提取物B(PE-B)500 mg/kg和植物提取物C(PE-C)250 mg/kg,试验期28 d。结果表明:1)PE-A组第1~14天料重比比对照组显著降低5.65%。2)与对照组相比,PE-A组仔猪血清IgM、IgG、T淋巴细胞转化率和血清总蛋白分别提高1.15%(P>0.05)、1.38%(P>0.05)、17.07%(P<0.01)、6.46%(P<0.01),尿素氮水平降低16.36%(P<0.01)。3)PEA组肠道中大肠杆菌数量较对照组降低8.29%(P<0.01),PE-B和PE-C组比对照组分别降低4.65%(P<0.05)、3.39%(P<0.05);PE-A、PE-B、PE-C组肠道中乳酸杆菌数量分别比对照组提高5.65%(P<0.01)、3.53%(P<0.05)和3.11%(P<0.05);PE-A、PE-B、PE-C组双歧杆菌菌落数分别比对照组提高5.76%(P<0.01)、4.75%(P<0.05)和3.89%(P<0.05)。4)PE-A显著提高干物质、粗蛋白质、粗脂肪、磷和钙的表观消化率(P<0.05),分别提高2.91%、5.41%、5.62%、5.92%、6.08%。综上所述,在仔猪饲粮中添加PE可以有效提高仔猪的生长性能、血液生理生化指标水平、饲料消化利用率,改善肠道微生物平衡。综合试验各项指标,仔猪饲粮中添加PE-A效果较好。
植物提取物;断奶仔猪;生长性能;粪便微生物菌群
目前寻找可替代抗生素类的新型饲料添加剂已成为动物营养领域的研究热点。植物提取物(plant extract,PE)是以物理、化学或生物学手段分离、提纯天然植物性原料(根茎、花、叶、种子等)中的有效成分,以生物小分子形式存在的基团或高分子为主要成分的植物性产品[1]。大量的研究表明它能提高动物机体免疫力,促进生长,改善肠道微生物环境、抗氧化、抗菌效果显著,且具有毒副作用和耐药性较少等优点[2-3]。但目前有关PE在仔猪生产中的应用效果及作用机制少有报道。因此本试验以大白仔猪为试验对象,通过在饲粮中添加不同的PE以研究其对仔猪生长性能、血液生理生化指标、免疫机能、养分消化率和粪便中微生物菌群的影响,为PE在实际生产中的应用提供参考。
1 材料与方法
1.1 试验材料
植物提取物A(PE-A)为黄芪、杜仲、金银花、黄连等天然植物提取物复方,主要活性成分为植物类黄酮、有机酸、多糖、多酚类及生物碱。其中总多糖≥9.0%,总黄酮≥2.0%,总生物碱≥3.0%。
植物提取物B(PE-B)为苦木、甘草等植物提取物复方,主要活性成分为生物碱、皂甙、多糖。其中苦木总碱≥0.2%,甘草酸≥0.1%。
植物提取物C(PE-C)为止痢草、肉桂等天然植物提取物复方。主要活性成分为香芹酚和肉桂醛。其中总多糖≥4.0%,总黄酮≥1.0%,总生物碱≥2.0%。
1.2 试验动物及饲粮
试验于2014年4—6月在辽宁德宝农牧集团艾德蒙种猪场进行。选用平均体重在(10.30±1.13)kg的大白仔猪。基础饲粮参考NRC(1998)配制,其组成及营养水平见表1。
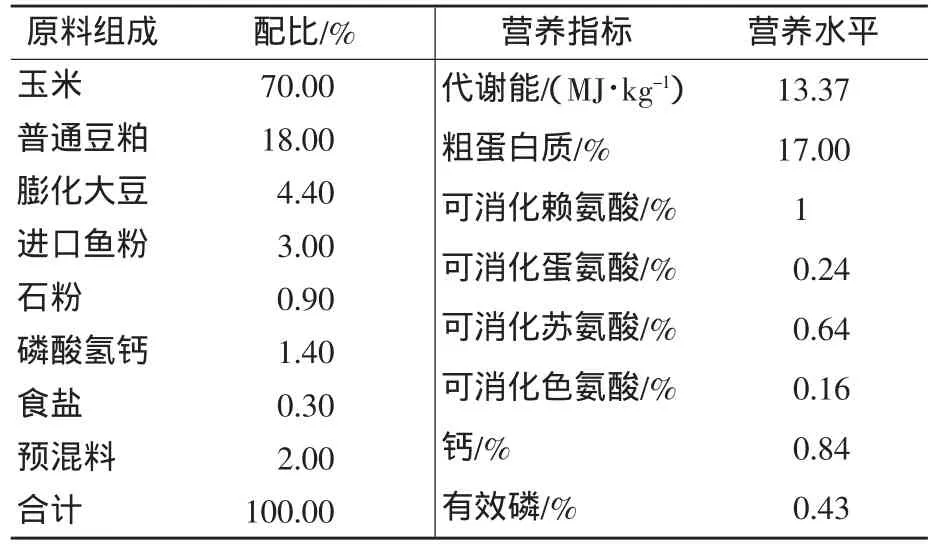
表1 基础饲粮组成及营养水平(风干基础)
1.3 试验设计及饲养管理
选用体重相近、健康状况良好的大白断奶仔猪240头,随机分为4组,每组4个重复,每个重复15头仔猪。饲喂期28 d。对照组饲喂基础饲粮,试验组在基础饲粮中分别添加PE-A 500 mg/kg、PE-B 500 mg/kg和PE-C 250 mg/kg。
试验开始前对保育猪舍进行冲洗及消毒,试验仔猪采用高床饲养,自由采食及饮水。免疫和驱虫程序按猪场常规程序进行,随时观察、记录仔猪的采食和腹泻情况以及每天的饲料消耗量。
1.4 样品的采集和检测
1.4.1 生长性能指标的测定分别在试验第1、第14和第28天以个体为单位对所有试验猪进行空腹称重,试验过程中以重复为单位记录采食量,并测定仔猪的平均日采食量、平均日增重。根据平均日增重和平均日采食量计算料重比。
1.4.2 血清生理生化指标的测定采用日本日立7160全自动生化仪测定血清总蛋白(total protein,TP)、尿素氮(ureanitrogen,BUN)。采用比色法测定IgA、IgG、IgM含量,试剂盒由南京建成生物工程研究所提供。
1.4.3 T淋巴转化率的测定取抗凝血3 mL,500 r/min离心10 min,小心取中层(血浆与血细胞之间的白色膜),用加Hank'S液2 mL,3 500 r/min离心10 min,取上清液,洗涤2次,用PRMI 1 640稀释细胞用血球仪计数白细胞,使其密度为107/mL的白细胞悬液。分装成2管。在一管中加10%小牛血清和10%植物血凝素各100 μL,另一管(对照管)加10%小牛血清和PRMI 100 mL,混匀。取上述100 μL加入96孔板细胞培养板内,设2个重复管,在5%二氧化碳、37℃、饱和湿度下培养48 h,每孔加5 mg/mL MTT 10 μL培养4 h,再加10 mL 10%的SDS-0.04M HCl,培养2 h后取出,室温放置5 min,采用酶联免疫检测仪检测[2]。
1.4.4 养分消化率的测定饲料和粪样中干物质(DM)、粗蛋白质(CP)、粗脂肪(EE)、钙(Ca)和磷(P)的表观消化率用酸不溶灰分(AIA)内源指示剂法测定[3]。
1.4.5 粪中微生物菌群的测定测定大肠杆菌、乳酸杆菌、双歧杆菌菌落数量,采用平板涂布法计数[4]。
1.5 数据统计分析
试验数据经Excel初步处理后用SPSS 19.0软件进行单因素方差分析(one-way ANOVA),差异显著时用邓肯法(duncan)进行多重比较,P<0.05为差异显著,P<0.01为差异极显著,结果以平均数±标准差表示。
2 结果与分析
2.1 植物提取物对仔猪生长性能的影响
由表2可知,与对照组相比,PE-A组仔猪中期重、末重分别提高2.65%(P>0.05)、4.21%(P>0.05)。PE-C组中期重、末重比对照组分别显著降低5.64%、8.79%。试验第1~14天仔猪日增重,PE-A组与对照组差异不显著(P>0.05),PE-B组比对照组降低3.77%(P<0.05),PE-C组比对照组降低13.21%(P<0.01);试验第15~28天,PE-A组与对照组相比提高9.80%(P<0.05),PE-C组比对照组降低15.69%(P<0.01)。日采食量各试验阶段各试验组与对照组相比均差异不显著(P>0.05)。料重比在试验第1~14天,PE-A组比对照组降低5.65%,但差异不显著(P> 0.05);PE-B组和PE-C组比对照组分别显著提高8.87%、9.68%;试验第15~28天和第1~28天各组差异不显著(P>0.05)。

表2 植物提取物对仔猪生长性能的影响
2.2 植物提取物对仔猪血液生化指标的影响
2.2.1 植物提取物对仔猪蛋白质代谢指标的影响
由表3可知,PE-A组、PE-B组、PE-C组尿素氮与对照组相比分别降低16.36%(P<0.01)、13.64%(P< 0.01)、4.55%(P>0.05)。

表3 植物提取物对仔猪蛋白质代谢的影响
2.2.2 植物提取物对仔猪免疫机能的影响由表4可知,各试验组血液中IgA含量与对照组相比,差异不显著(P>0.05)。PE-A组、PE-B组血液中IgM含量比对照组都提高1.15%(P>0.05),PE-C组血液中IgM含量比对照组显著降低2.30%。与对照组相比,PE-C组血液中IgG含量降低2.88%(P<0.05),其余组间差异不显著(P>0.05)。血液T淋巴细胞转化率,PE-A组比对照组极显著提高17.07%,PE-B组、PE-C组比对照组极显著降低14.63%、24.39%。PE-A组总蛋白比对照组极显著提高6.46%。

表4 植物提取物对仔猪血液免疫指标的影响
2.3 植物提取物对仔猪养分消化率的影响
由表5可见,PE-A组干物质消化率与对照组相比提高2.91%,差异显著(P<0.05),其余各试验组与对照组相比无显著差异(P>0.05)。PE-A组粗蛋白质与粗脂肪消化率显著高于对照组,分别提高5.41%、5.62%,PE-C组粗脂肪消化率低于对照组5.76%(P< 0.05)。与对照组相比,PE-A组磷消化率提高5.92%(P<0.05),PE-C组降低6.90%(P<0.05)。与对照组相比,PE-A组钙消化率比对照组提高6.08%(P<0.05),其余各组差异不显著(P<0.05)。

表5 植物提取物对仔猪养分表观消化率的影响
2.4 植物提取物对仔猪肠道微生物数量的影响
由表6可知,PE-A组肠道中大肠杆菌数量比对照组极显著降低8.29%,PE-B和PE-C组比对照组分别显著降低4.65%、3.39%。PE-A、PE-B、PE-C组肠道中乳酸杆菌数量分别比对照组提高5.65%(P< 0.01)、3.53%(P<0.05)、3.11%(P<0.05)。PE-A、PE-B、PE-C组双歧杆菌菌落数分别比对照组提高5.76%(P<0.01)、4.75%(P<0.05)、3.89%(P<0.05)。
3 讨论
3.1 植物提取物与仔猪生长性能的关系
植物提取物促进仔猪生长的作用机理可能是通过保证饲粮的卫生安全促进肠道健康或者通过控制潜在的病原菌保持胃肠道中微生物菌落数的生态平衡实现的[5]。大多数植物提取物能起到防止胃肠胀气、减缓食物在胃肠道中的排空速度、促进消化液的分泌和提高消化酶活性的作用[6]。如黄芪属植物提取物能有效缓解应激、提高食欲、降低动物的腹泻率[5]。本试验研究表明,添加PE能提高仔猪日增重,降低料重比,但对日采食量无显著影响,这与Ranucci等[5]试验结果基本一致。
3.2 植物提取物与血清生理生化的关系
血清总蛋白含量和尿素氮浓度能够比较准确地反映出动物体内蛋白质代谢和饲粮氨基酸平衡的状况[7]。本研究发现,在饲粮中添加PE-A能极显著地提高仔猪血清中总蛋白水平,极显著地降低仔猪血液中尿素氮水平,这与Coma等[8]研究结果相似。这是由于PE能促进蛋白质在仔猪体内的合成,降低体内氨基酸的分解作用,从而改善了机体内氨基酸的平衡状态,促进机体蛋白质的合成或减少体内含氮物质的分解,进而增加机体蛋白质沉积。
陈艳珍[9]指出,断奶会使仔猪肠绒毛萎缩、隐窝加深,保护仔猪的胃肠道黏膜可减弱应激对仔猪的损伤作用,而免疫球蛋白在保护肠道、呼吸道、泌尿生殖道、乳腺和眼睛抵抗微生物入侵方面起关键作用。研究表明,PE能够增强动物的免疫系统,有效降低疾病的发生率,同时有效地缓解过敏症、因应激产生的病理反应、炎症及增强免疫应答[10-12]。据报道,将PE添加到仔猪饲粮中发现其具有提高抗逆性和免疫反应的作用,表现为仔猪血清中的IgG、IgA、C-反应蛋白(CRP)和干扰素-γ浓度都有了不同程度的提高[13]。本试验研究表明,在仔猪饲粮中添加PE可以极显著提高仔猪T淋巴细胞转化率,提高仔猪血清中IgG、IgM的水平,但对IgA无显著影响,这与以上的报道一致。
3.3 植物提取物与仔猪营养消化利用率的关系
仔猪消化酶活性越高,消化吸收能力越好。添加PE能提高十二指肠蛋白酶、淀粉酶活性,从而提高营养物质的消化吸收[14-15]。本试验结果表明,PE具有促进仔猪对饲料中氮的沉积和提高蛋白质表观消化率的作用。Kiarie等[16]试验发现,中药制剂能显著提高仔猪对饲粮粗蛋白质和粗脂肪消化率。Ranucci等[5]研究表明,PE能够改善肠道环境,减少腹泻率,显著地提高仔猪营养消化利用率[14]。本试验结果表明,PE-A能显著地提高干物质、钙、磷、粗蛋白质和粗脂肪消化率,这与以上报道基本一致。
3.4 植物提取物与粪便微生物菌群数的关系
本试验表明,PE-A能极显著降低大肠杆菌的数量,极显著地提高肠道乳酸杆菌和双歧杆菌数量,这与Manzanilla等[2]、Ranucci等[5]研究结果基本一致。仔猪早期断奶后受到各种应激影响,肠道微生物菌群严重失调,断奶后2 d内回肠中乳酸杆菌的数量几近消失,而大肠杆菌的数量显著增加,且pH越高,大肠杆菌的数量越多,而大肠杆菌是引起仔猪断奶后腹泻的主要病原菌[16]。由此可见,植物提取物可改善消化道菌群平衡状态,降低仔猪腹泻发生率。
4 结论
(1)在仔猪饲粮中PE-A能提高仔猪的平均日增重,降低料重比,有利于提高仔猪的生长性能;添加PE-A可以显著提高仔猪干物质、钙、磷、粗蛋白质和粗脂肪消化率,有利于提高仔猪的饲料转化率。
(2)添加PE-A能够极显著提高仔猪血液中T淋巴细胞转化率,提高IgG和IgM水平,使仔猪免疫机能得到改善。
(3)添加PE-A可以极显著降低仔猪粪便中大肠杆菌数量,极显著增加乳酸杆菌和双歧杆菌数量,间接反映了其能够抑制肠道大肠杆菌的生长和繁殖,增加有益菌数量,维持肠道微生态平衡。
[1]Tang M,Laarveld B,Van Kessel A G,et al.Effect of segregated early weaning on postweaning small intestinal development in pigs[J].Journal of Animal Science,1999,77(12):3191-3200.
[2]Manzanilla E G,Perez J F,Martin M,et al.Effect of plant extracts and formic acid on the intestinal equilibrium of early-weaned pigs[J].Journal of Animal Science,2004,82(11):3210-3218.
[3]William H,Latimer G W.Official methods of analysis[M].Association of Official Agriculture Chemists(US),2005:248.
[4]Zhang L,Xu Y Q,Liu H Y,et al.Evaluation of Lactobacillus rhamnosus GG using an Escherichia coli K88 model of piglet diarrhoea:effects on diarrhoea incidence,faecal micrflora and immune responses[J].Veterinary Microbiology,2010,141(1-2):142-148.
[5]Ranucci D,Beghelli D,Trabalza-Marinucci M,et al.Dietary effects of a mix derived from oregano(Origanum vulgare L.)essential oil and sweet chestnut(Castanea sativa Mill.)wood extract on pig performance,oxidative status and pork quality traits[J].Meat Science,2015,100:319-326.
[6]Chen X,Zhu F,Cao Y,et al.Novel expression vector for secretion of cecropin AD in bacillus subtillis with enhanced antimicrobial activity[J].Antimicrobial Agents and Chemotherapy,2009,53(9):3683-3689.
[7]Fujiwara Y,Kaji T.Possible mechanism for lead inhibition of vascular endothelial cell proliferation:a lower response to basic fibroblast growth factor through inhibition of heparan sulfate synthesis[J].Toxicology,1999,133(2):144-157.
[8]Coma J,Carrion D,Zimmerman D R.Use of plasma urea nitrogen as a rapid response criterion to determine the lysine requirement of pigs[J].Journal of Animal Science,1995,73(2):472-481.
[9]陈艳珍.环境条件对早期断奶仔猪生产性能的影响[J].养猪,1995(4):23.
[10]Fujikawa T,Yamaguchi A,Morita I,et al.Protective effects of acanthopanax senticosus harms from hokkaido and its components on gastric ulcer in restrained cold water stressed rats[J].Biological and Pharmaceutical Bulletin,1996,19(9):1227-1230.
[11]Bontempo V,Jiang X R,Cheli F,et al.Administration of a novel plant extract product via drinking water to post-weaning piglets:effects on performance and gut health[J].Animal,2014, 8(5):721-730.
[12]Turner J L,Dritz S S,Higgins J J,et al.Effects of a extract on growth performance and immune function of weanling pigs challenged with Salmonella typhimurium[J].Journal of Animal Science,2002,80(7):1939-1946.
[13]Ilsley S E,Miller H M,Kamel C.Effects Of dietary Quillaja saponinand curcuminon the performance and immune status of weaned piglets[J].Journalof Animal Science,2005,83(1):82-88.
[14]Pirgozliev V,Murphy T C,Owens B,et al.Fumaric and sorbic acid as additives in broiler feed[J].Research in Veterinary Science,2008,84(3):387-394.
[15]Gerritsen R,Van Dijk A J,Rethy K,et al.The effect of blends of organic acids on apparent faecal digestibility in piglets[J].Livestock Science,2010,134(1):246-248.
[16]Kiarie E,Nyachoti C M,Slominski B A,et al.Growth performance,gastrointestinal microbial activity,and nutrient digestibility in early-weaned pigs fed diets containing flaxseed and car bohydrase enzyme[J].Journal of Animal Science,2007,85(11):2982-2993.
(编辑:富春妮)
The Research and Application of Plant Extract in Piglets
ZHU Yujing1,WANG Bo1,LI Fangfang1,ZHENG Lili1,GAO Yuan2,MENG Ling2,GUO Fulai2,DING Lan3,ZHANG Yong1
(1.College of Animal Sciences and Veterinary Sciences,Shenyang Agricultural University,Shenyang 110866, China;2.Liaoning Debao Argi-animal Husbandry Co.,Ltd.,Shenyang 110171,China; 3.Shenyang Fukang Agriculture and Animal Husbandry Technology Co.,Ltd.,Shenyang 110164,China)
This test was designed to study the effects of plant extracts(PE)in pig production.240 pigs(10.30± 1.13)kg and randomly divided into 4 groups,and each group 4 repeats,each repeat 15 pigs.The control group was fed based diet;the experimental groups were fed basic diet with 500 mg/kg PE-A,500 mg/kg PE-B and 250 mg/ kg PE-C,respectively.Experiment lasted for 28 days.Results showed that:1)Compared with control group,PE-A group decrease the F/G 5.65%(P<0.05)during the first fourteen day;2)compared with control group,the PE-A group improve piglests'serum IgM,IgG,T lymphatic conversion rates and TP 1.15%(P>0.05),1.38%(P>0.05), 17.07%(P<0.01),6.46%(P<0.01)respectively,and reduce BUN 16.36%(P<0.01);3)PE-A,PE-B and PE-C were able to dramatically reduce E.coli colony count in pig manure 8.29%(P<0.01),4.65%(P<0.05)and 3.39%(P<0.05)respectively;increase Lactobacillus 5.65%(P<0.01),3.53%(P<0.05)and 3.11%(P<0.05);increase bifidobacterium colony count 5.76%(P<0.01),4.75%(P<0.05)and 3.89%(P<0.05)respectively;4)PE-A group was able to respectively significantly improve DM digestion rate,CP apparent digestion rate,EE absorption rate,P digestion rate and Ca absorption rate 2.91%(P<0.05),5.41%(P<0.05),5.62%(P<0.05),5.92%(P<0.05),6.08%(P<0.05)compared with control group.Adding PE in diet can effectively improve pig growth performance,blood physiological, biochemical indicators,feed digestion utilization and improve intestinal microbial balance.The results indicate that adding PE-A is best in all three groups.
plant extracts;weaning pig;production performance;fecal microflora
S858.28
A
1002-1957(2016)01-0009-05
2015-11-24
国家自然科学基金(31440082和31101253)
朱宇旌(1972-),女,辽宁彰武人,副教授,博士,主要从事动物营养与饲料科学研究工作.E-mail:syndzhyj@163.com
张勇,教授,硕士生导师.E-mail:syndzhy@126.com

