酿酒酵母发酵液对断奶仔猪生长性能、小肠发育及小肠黏膜免疫功能的影响
王斌星 王蜀金 郭春华* 何 欢 高彦华
柏 雪1 杨加豹2 周 琳3
(1.西南民族大学生命科学与技术学院,成都610041;2.四川省畜牧科学研究院动物遗传育种四川省重点实验室,成都610066;3.深圳比利美英伟营养饲料有限公司,深圳518103)
酿酒酵母发酵液对断奶仔猪生长性能、小肠发育及小肠黏膜免疫功能的影响
王斌星1王蜀金1郭春华1*何 欢1高彦华1
柏 雪1杨加豹2周 琳3
(1.西南民族大学生命科学与技术学院,成都610041;2.四川省畜牧科学研究院动物遗传育种四川省重点实验室,成都610066;3.深圳比利美英伟营养饲料有限公司,深圳518103)
本试验旨在探究酿酒酵母(S.cerevisiae)发酵液对断奶仔猪生长性能、小肠发育及小肠黏膜免疫功能的影响。选取平均体重为(6.57±0.13) kg的26日龄“长白×杜洛克”断奶仔猪60头(公母各占1/2),按体重和性别随机分为3个组,每组4个重复,每个重复5头仔猪。3个组分别为:对照组(基础饲粮+300 mL/kg空白培养液)、酿酒酵母发酵液组(基础饲粮+300 mL/kg酿酒酵母发酵液)和抗生素组(基础饲粮+20 mg/kg硫酸黏杆菌素+40 mg/kg杆菌肽锌)。试验期21 d。结果表明:1)与对照组相比,酿酒酵母发酵液组和抗生素组的平均日增重(ADG)和平均日采食量(ADFI)显著或极显著升高(P<0.05或P<0.01),料重比极显著降低(P<0.01);但酿酒酵母发酵液组与抗生素组的以上生长性能指标均无显著差异(P>0.05)。2)与对照组相比,酿酒酵母发酵液组和抗生素组的十二指肠、空肠和回肠黏膜总蛋白、DNA和RNA含量显著或极显著升高(P<0.05或P<0.01);但酿酒酵母发酵液组与抗生素组的以上指标均无显著差异(P>0.05)。3)与对照组相比,酿酒酵母发酵液组和抗生素组的十二指肠和回肠绒毛高度显著升高(P<0.05),十二指肠、空肠和回肠绒毛高度/隐窝深度(V/C)显著或极显著升高(P<0.05或P<0.01);但酿酒酵母发酵液组与抗生素组的以上指标均无显著差异(P>0.05)。4)与对照组相比,酿酒酵母发酵液组和抗生素组的十二指肠、空肠和回肠黏膜免疫球蛋白A、免疫球蛋白G和免疫球蛋白M含量均显著或极显著升高(除空肠黏膜免疫球蛋白G外)(P<0.05或P<0.01);但酿酒酵母发酵液组和抗生素组的以上指标均无显著差异(P>0.05)。结果显示,饲粮中添加酿酒酵母发酵液能够提高断奶仔猪的生长性能,促进小肠发育,提高小肠黏膜免疫功能,达到与抗生素相当的效果。提示酿酒酵母发酵液可有效缓解断奶应激,减少或者替代抗生素在断奶仔猪饲粮中的使用,这为研发无抗饲粮提供了有力的理论依据和数据支持。
酿酒酵母;断奶仔猪;小肠发育;免疫球蛋白;断奶应激
早期断奶作为提高母猪生产力和养猪生产效益的重要技术之一,蕴藏一定的经济价值。但早期断奶易引起仔猪胃肠道发生严重的应激反应,使仔猪消化道微生物菌群失调、病原菌大量繁殖,从而导致仔猪生长受阻、死亡率提高,通常称之为断奶应激综合征[1-2]。Mecraeken等[3]研究认为,断奶仔猪生长受阻主要是因为饲粮中的抗原蛋白引起仔猪的自身免疫反应,破坏肠道黏膜,导致腹泻及免疫力和采食量的下降。在断奶仔猪饲粮中添加抗生素能在一定程度上提高动物的生长性能和抗病能力,缓解断奶应激综合征。但是饲粮中抗生素的大量应用会引起病原菌产生耐药性、肠道正常菌群结构被破坏以及排泄物对环境造成污染等一系列的问题,从而给人类健康造成潜在的危害。在倡导健康养殖和注重肉品质安全的今天,研发抗生素替代品势在必行[4-6]。酵母及其代谢产物是抗生素的理想替代品之一,对断奶动物的生长性能、肠道发育和免疫功能具有积极作用[7-9]。王蜀金等[4]和胡新旭等[7]在断奶仔猪饲粮中添加发酵物均可提高仔猪的平均日采食量(ADFI)和平均日增重(ADG),降低料重比(F/G),能够达到与抗生素提高动物生长性能类似的效果。研究也发现,酿酒酵母(Saccharomycescerevisiae,S.cerevisiae)作为有益菌,在增殖过程中能有效竞争抑制病原菌的繁殖,对肠道菌群有保护作用,促进肠道黏膜发育,提高动物对营养物质的消化和吸收[5]。酿酒酵母作为国内外农业主管部门批准可直接添加到饲粮中使用的饲料添加剂,在发酵生产过程中可产生细胞壁多糖、活性有益菌、次级代谢产物、矿物质、维生素和未知促生长因子等有益于动物肠道微生态平衡及增强免疫功能的成分,具有重要的研究价值[9-11]。
因此,本试验在断奶仔猪饲粮中添加酿酒酵母发酵培养液,探讨其对断奶仔猪生长性能、小肠发育及小肠黏膜免疫功能的影响,旨在为开发安全、高效、环保的无抗仔猪饲粮提供理论参考和依据。
1 材料与方法
1.1 试验材料
试验用酿酒酵母营养缺陷型菌株INVScl购自美国Invitrogen公司。酿酒酵母菌种在酵母浸出粉胨葡萄糖琼脂培养基(YPD琼脂)平板上涂布接种,30 ℃恒温培养箱中发酵培养24 h。通过平板计数法测定酿酒酵母菌数为4×107CFU/mL。
主要材料和设备包括:酶联免疫吸附测定(ELISA)试剂盒(美国Sigma公司)、BCA蛋白定量试剂盒(北京庄盟国际生物有限公司)、Trizol试剂盒(美国Invitrogen公司)、Multlskan MK3型酶标仪(塞默飞世尔仪器有限公司)、数码三目摄像显微镜(BA400Digital,麦克奥迪实业集团有限公司)等。
1.2 试验动物与试验设计
选取平均体重为(6.57±0.13) kg的26日龄“长白×杜洛克”(Landrace×Duroc)断奶仔猪60头(公母各占1/2),按体重和性别随机分为3个组,每组4个重复,每个重复5头仔猪。3个组分别为:对照组(基础饲粮+300 mL/kg空白培养液)、酿酒酵母发酵液组(基础饲粮+300 mL/kg酿酒酵母发酵液)和抗生素组(基础饲粮+20 mg/kg硫酸黏杆菌素+40 mg/kg杆菌肽锌)。试验期21 d。
1.3 试验饲粮与饲养管理
基础饲粮组成及营养水平见表1。试验于广东省恩平动物试验中心进行。按照试验猪场常规饲养制度饲养管理,每栏5头仔猪,各栏自由采食,不浪费的前提下适量多餐,自由饮水。按照猪场常规免疫程序进行免疫,并记录疾病及治疗情况。
1.4 样品采集
试验结束时,禁食12 h,每组随机选取接近平均体重的4头断奶仔猪,按每千克体重静脉注射150.00 mg戊巴比妥钠,待其麻醉后,按常规程序进行屠宰,并采集小肠各段[包括十二指肠(距幽门约10 cm处),空肠(小肠中断)及回肠(距回盲肠结远端约5 cm处)]各2.5 cm,固定于10%中性甲醛溶液中,制作石蜡切片,苏木精-伊红(HE)染色以检测肠道形态;各段剩余部分纵向剖开以无菌磷酸盐缓冲液(PBS)冲洗,再以载玻片刮下各段黏膜于-80 ℃保存备用。
1.5 测定指标
1.5.1 生长性能
每天记录各栏断奶仔猪的饲粮投喂量和剩余量,计算平均日采食量;试验开始和结束时分别于晨饲前测定每只断奶仔猪的体重,根据初始体重和终末体重计算平均日增重。
料重比=平均日采食量/平均日增重。
1.5.2 小肠发育
光学显微镜下观察HE染色的石蜡切片(横切面),并测量十二指肠、空肠、回肠的绒毛高度和隐窝深度;同时,将十二指肠、空肠、回肠黏膜称重并采用BCA蛋白定量试剂盒测定肠道黏膜总蛋白含量,紫外分光光度计测定260 nm处RNA及DNA的吸光值,并计算RNA及DNA的含量。

表1 基础饲粮组成及营养水平(饲喂基础)
1)维生素预混料为每千克饲粮提供 Vitamin premix provided the following per kg of the diet:VA 10 000 IU,VD31 500 IU,VE 50 IU,VB14.50 mg,核黄素 riboflavin 60.00 mg,烟酸 nicotinic acid 36.00 mg,泛酸 pantothenic acid 1.00 mg,VB610.00 mg,叶酸 folic acid 2.00 mg,钴胺素 cobalamin 0.01 mg,生物素 biotin 0.50 mg,VK32.00 mg,VC 200 mg。
2)矿物质预混料为每千克饲粮提供 Mineral premix provided the following per kg of the diet:FeSO4(Fe) 100 mg,CuSO4(Cu) 6.00 mg,MnSO4(Mn) 4.00 mg,ZnSO4(Zn) 100 mg,Na2SeO3(Se)0.30 mg,KI(I)0.30 mg;CoSO4(Co) 0.14 mg。
3)营养水平均为计算值。Nutrient levels were all calculated values.
1.5.3 小肠黏膜免疫球蛋白含量
十二指肠、空肠和回肠黏膜溶于2 mL PBS(pH=7.4)中,于3 500×g离心5 min,收集上清,按照ELISA试剂盒说明书操作,检测小肠黏膜免疫球蛋白A(IgA)、免疫球蛋白G(IgG)和免疫球蛋白M(IgM)的含量。免疫球蛋白指标由成都里来生物实验室合作完成。
1.6 数据统计分析
试验数据采用Excel 2013初步处理后,采用SPSS 18.0统计软件中单因素方差分析(one-way ANOVA)程序进行差异显著性检验,结果以平均值±标准差表示。以P<0.01作为差异极显著的判断标准,P<0.05作为差异显著的判断标准,0.05≤P<0.10作为呈升高或降低趋势的判断标准。
2 结果与分析
2.1 酿酒酵母发酵液对断奶仔猪生长性能的影响
由表2可知,与对照组相比,酿酒酵母发酵液组和抗生素组的平均日采食量极显著升高(P<0.01),平均日增重显著升高(P<0.05),料重比极显著降低(P<0.01);但酿酒酵母发酵液组与抗生素组的以上生长性能指标均无显著差异(P>0.05)。由此推断,饲粮中添加酿酒酵母发酵液可以提高断奶仔猪的生长性能,且效果与抗生素相当。
2.2 酿酒酵母发酵液对断奶仔猪小肠黏膜总蛋白、DNA及RNA含量的影响
由表3可知,与对照组相比,酿酒酵母发酵液组和抗生素组的十二指肠黏膜总蛋白和DNA含量显著升高(P<0.05),RNA含量极显著升高(P<0.01),空肠和回肠黏膜总蛋白、DNA和RNA含量极显著升高(P<0.01);但酿酒酵母发酵液组与抗生素组的小肠黏膜总蛋白、DNA和RNA含量均无显著差异(P>0.05)。由此推断,饲粮中添加酿酒酵母发酵液能刺激断奶仔猪肠道黏膜生长,从而促进仔猪肠道生长发育,且效果与抗生素相当。
2.3 酿酒酵母发酵液对断奶仔猪小肠形态的影响
由图1和表4可知,与对照组相比,酿酒酵母发酵液组和抗生素组的十二指肠和回肠绒毛高度、十二指肠绒毛高度/隐窝深度(V/C)显著升高(P<0.05),空肠和回肠绒毛高度/隐窝深度极显著升高(P<0.01);但酿酒酵母发酵液组与抗生素组的以上指标均无显著差异(P>0.05)。由此推断,饲粮中添加酿酒酵母发酵液能够增加断奶仔猪肠道黏膜对营养物质吸收的表面积。
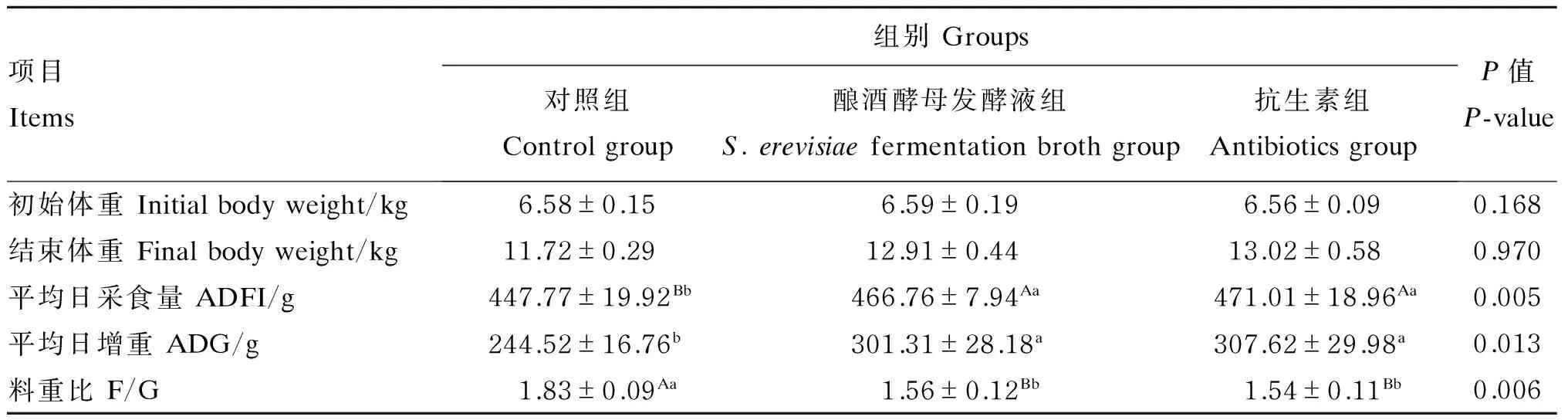
表2 酿酒酵母发酵液对断奶仔猪生长性能的影响
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。下表同。
In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), and with different small letter superscripts mean significant difference (P<0.05), while with different capital letter superscripts mean very significant difference (P<0.01). The same as below.
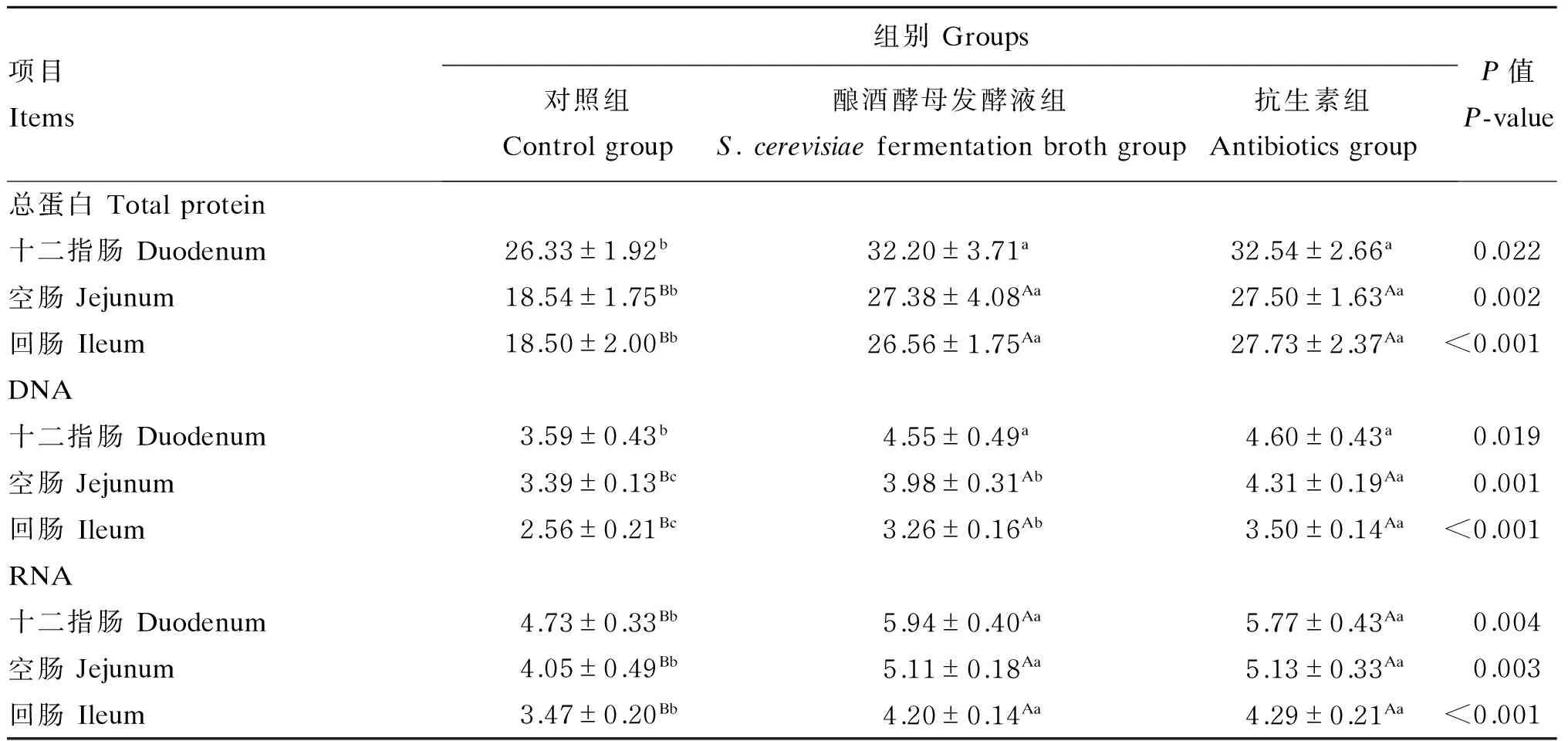
表3 酿酒酵母发酵液对断奶仔猪小肠黏膜总蛋白、DNA和RNA含量的影响
2.4 酿酒酵母发酵液对断奶仔猪小肠黏膜免疫球蛋白含量的影响
由表5可知,与对照组相比,酿酒酵母发酵液组和抗生素组的十二指肠黏膜免疫球蛋白A和免疫球蛋白G含量显著升高(P<0.05),免疫球蛋白M含量极显著升高(P<0.01);空肠黏膜免疫球蛋白A和免疫球蛋白M含量显著升高(P<0.05);回肠黏膜免疫球蛋白A和免疫球蛋白M含量极显著升高(P<0.01),免疫球蛋白G含量显著升高(P<0.05)。但酿酒酵母发酵液组和抗生素组的以上指标均无显著差异(P>0.05)。由此推断,饲粮中添加酿酒酵母发酵液可以提高断奶仔猪的免疫功能。
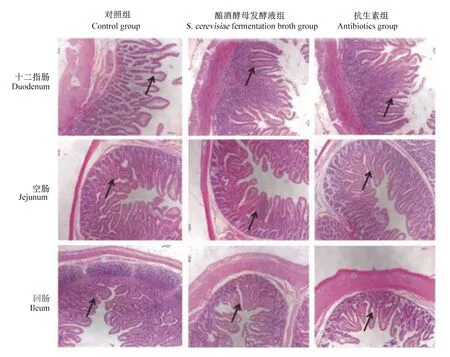
图1 断奶仔猪小肠形态学检测
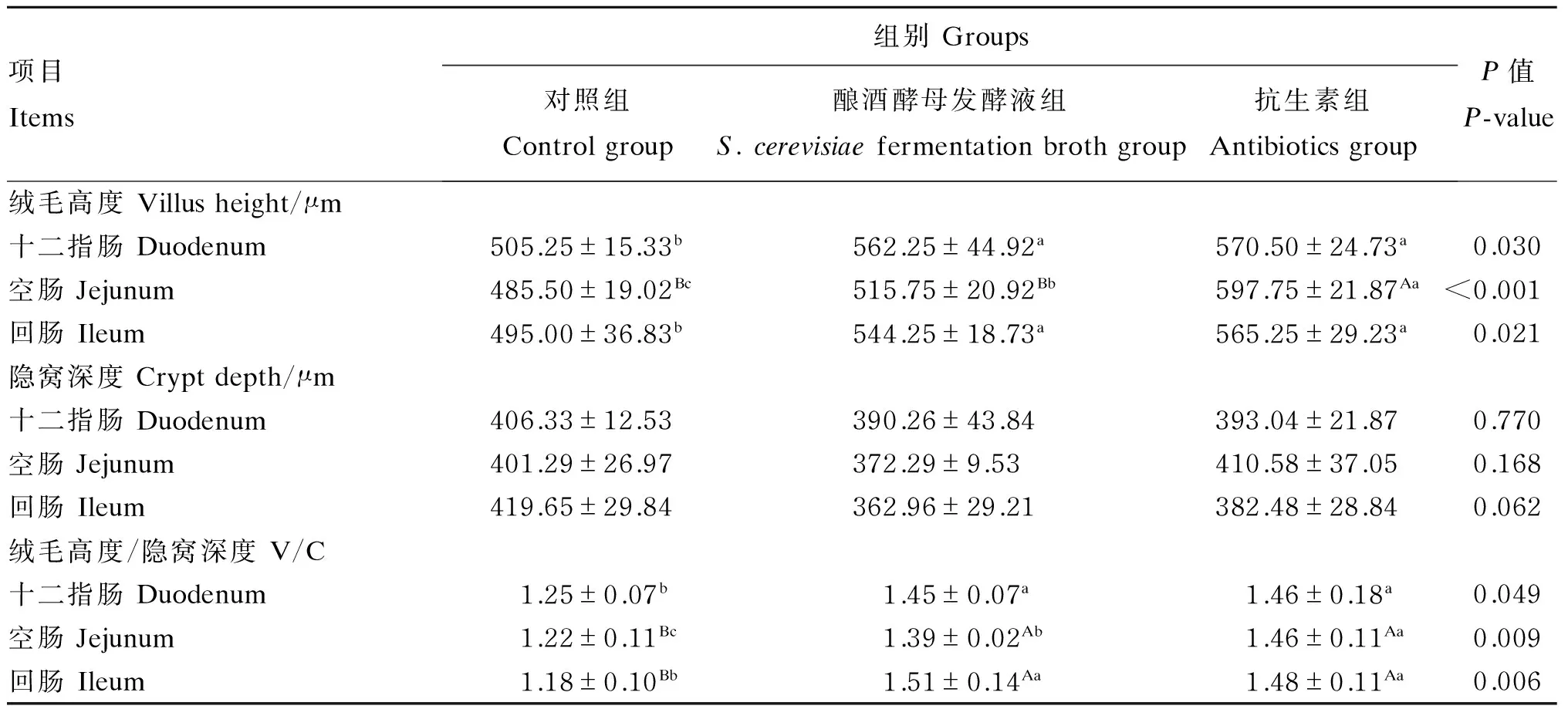
表4 酿酒酵母发酵液对断奶仔猪小肠形态的影响
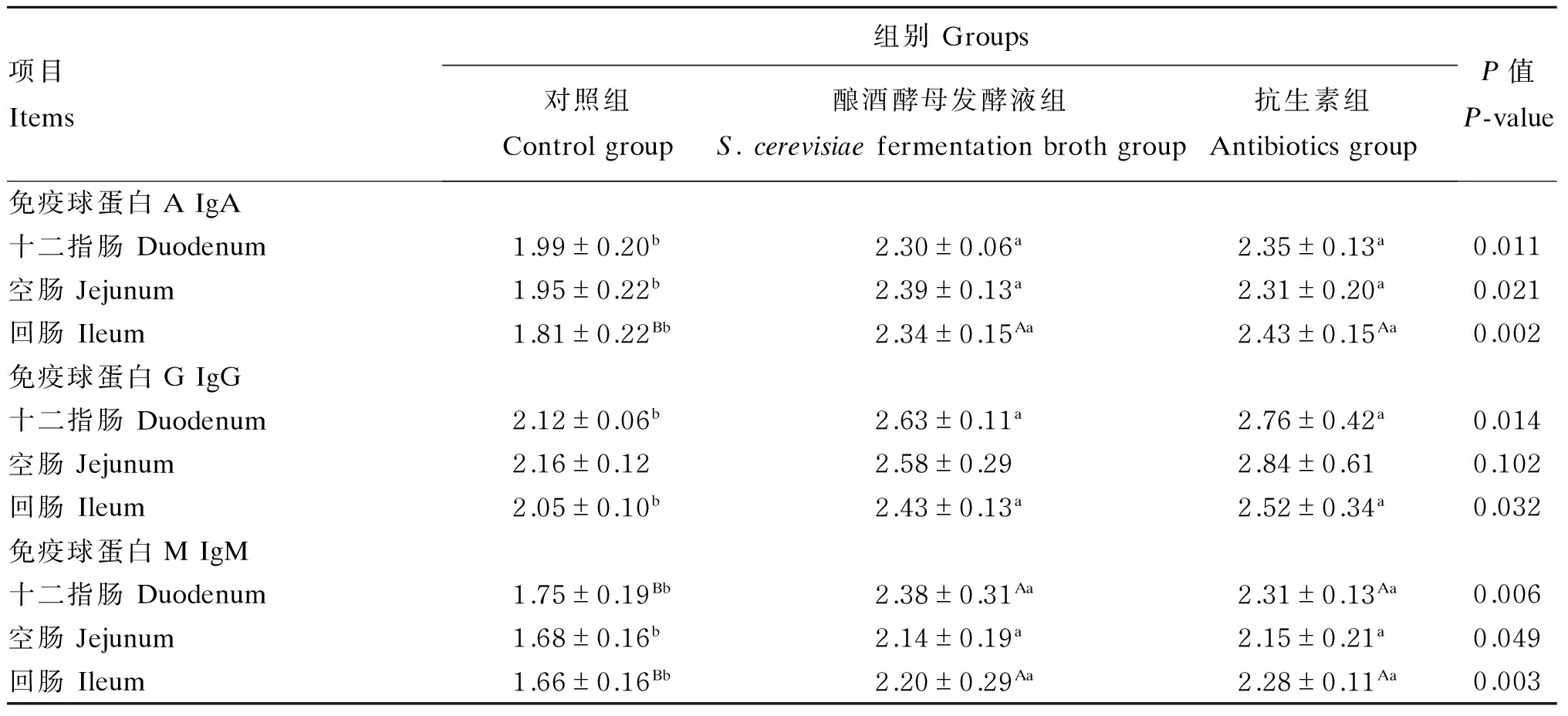
表5 酿酒酵母发酵液对断奶仔猪小肠黏膜免疫球蛋白含量的影响
3 讨 论
3.1 酿酒酵母发酵液对断奶仔猪生长性能的影响
酿酒酵母可以通过向动物体内的微生物菌群提供营养底物来改善胃肠道环境和菌群结构,稳定胃肠道pH,促进有益菌的繁殖,提高有益菌的浓度和活力,从而促进动物对营养物质的消化、吸收和利用,增加采食量,改善饲料利用率,提高生长性能[7,12]。降低早期断奶对仔猪的应激一直是人们探讨的课题之一,目前普遍采用在仔猪饲粮中添加抗生素来降低断奶应激造成的负面影响,随着人们对断奶动物胃肠道微生物构成及定植规律研究的不断深入和抗生素作为饲料添加剂存在的药物残留和抗药性问题的担忧,应用酿酒酵母替代抗生素的使用具有重要的意义。本研究发现,饲粮中添加酿酒酵母发酵液能显著提高断奶仔猪的平均日采食量和平均日增重,显著降低料重比。王蜀金等[5]在断奶SD大鼠饲粮中添加与本试验相同的酿酒酵母培养液后,显著提高了断奶SD大鼠的平均日增重和降低料重比,达到与抗生素相当的效果。Mathew等[8]、Wang等[13]和Jurgens等[14]在饲粮中添加酿酒酵母培养液均提高了断奶仔猪的生长性能,得到了与本试验一致的结果。本试验结果也表明,酿酒酵母发酵液组与抗生素组断奶仔猪的生长性能无显著差异。胡新旭等[7]在断奶仔猪饲粮中添加富含乳酸菌、酵母菌的发酵饲料替代部分基础饲粮,结果表明酵母培养液能够提高断奶仔猪的生长性能,且与抗生素的效果无显著差异。断奶动物饲粮中添加抗生素可以促进动物的生长发育,但抗生素会使动物产生耐药性和引发食品安全问题,因此在动物饲粮中添加酿酒酵母具有重要的应用前景。
3.2 酿酒酵母发酵液对断奶仔猪小肠发育的影响
酿酒酵母作为蛋白性原料,不仅在发酵过程中能产生有益于动物肠道发育的细胞壁多糖、次级代谢产物、氨基酸等多种营养成分,而且在动物肠道内也能继续分泌多种代谢产物,促进肠道发育。小肠作为动物消化、吸收的主要场所,常作为衡量动物消化吸收功能的重要指标,保持正常的肠道黏膜结构是动物机体对营养物质进行充分消化、吸收的基本保证[11]。小肠绒毛高度、隐窝深度反映了小肠接触和吸收营养物质的面积以及吸收功能的强弱,绒毛高度/隐窝深度综合反映了小肠功能状态,绒毛高度/隐窝深度越大,表明黏膜结构越完善,小肠绒毛对营养物质的消化吸收功能越强[15]。早期断奶会导致乳源性生长因子及免疫球蛋白等物质供给突然消失,使断奶动物的免疫力下降、病原菌增殖,导致胃肠道微生物菌群失调及小肠绒毛组织和形态发生变化,从而引起腹泻、食欲下降等症状[5,16]。本试验结果发现,饲粮中添加酿酒酵母发酵液可显著提高断奶仔猪小肠黏膜总蛋白、DNA和RNA含量,十二指肠和回肠绒毛高度以及小肠绒毛高度/隐窝深度。研究发现,当小肠绒毛高度增加时,能够增加肠上皮成熟细胞数量,增加与肠道内营养物质的接触和吸收面积,从而增强对营养物质的吸收能力[17]。有关酵母及其培养物能够改善小肠黏膜组织结构的确切机理还没有一致结论,推测可能与酿酒酵母细胞壁中含有β-葡聚糖和甘露聚糖有关。β-葡聚糖和甘露聚糖可通过吸附、吞噬、破坏和吸收入侵细菌等来减少胃肠道黏膜与抗原的结合,从而保护胃肠道黏膜免受破坏,Iji等[18]和Zhang等[19]研究证实了这一结论。也有研究认为,酵母能够促进幼畜肠道发育可能与细胞生长和分化必需的多胺物质有关,分布在肠道黏膜组织里的多胺物质能够提高肠道上皮细胞增殖速率,进而改善肠道黏膜的组织结构[20-21]。酿酒酵母能够改善小肠黏膜组织结构还可能与酿酒酵母作为有益菌,在增殖过程中能够在体内产生有机酸等物质,降低肠道pH,从而抑制大肠杆菌等病原菌在肠道上定植,对肠道黏膜起到保护作用有关。本试验中,酿酒酵母发酵液与抗生素对断奶仔猪小肠生长发育的影响无显著差异。抗生素可有效抑制病原菌的增殖,但会破坏胃肠道微生物菌群结构,酿酒酵母能够通过竞争性抑制有害病原菌的繁殖,从而对肠道菌群结构起到保护作用[21-22]。对于酿酒酵母对断奶仔猪肠道菌群结构和肠道发育的影响,还需进一步深入研究。
3.3 酿酒酵母发酵液对断奶仔猪小肠黏膜免疫功能的影响
甘露聚糖是酵母细胞壁中含有的能提高免疫力的多糖类物质,作为免疫激活剂能有效提高机体的免疫系统,激发机体的体液免疫和细胞免疫,导致机体免疫力和抗病力增强[23]。周淑芹等[24]试验结果表明,饲粮中添加酵母培养物能够提高肉仔鸡血清免疫球蛋白A、免疫球蛋白G和免疫球蛋白M含量,且与抗生素组无显著差异。原因可能是肉仔鸡饲粮中添加酵母培养物,减少了肠道有害菌的数量,从而增强了肉鸡免疫系统的应答能力。本试验结果发现,饲粮中添加酿酒酵母发酵液可显著提高断奶仔猪小肠黏膜免疫球蛋白A和免疫球蛋白M含量,这与周淑芹等[24]和岳支华等[25]的研究报道结果相一致。酿酒酵母作为益生菌,除了能够促进动物免疫器官的生长、成熟,从而增加T淋巴细胞和B淋巴细胞的数量,帮助启动机体免疫应答反应,还可以代谢合成乳多肽类抗生物质等细菌素,刺激免疫应答,激活免疫系统[26-27]。王蜀金等[5]在断奶SD大鼠饲粮中添加酿酒酵母,饲喂16 d后发现酿酒酵母未能提高断奶SD大鼠的血清免疫球蛋白A、免疫球蛋白G和免疫球蛋白M含量,与本试验结果不一致,原因可能与试验动物品种、酿酒酵母的添加剂量以及作用机制不同有关,有待进一步深入探索和研究。
4 结 论
饲粮中添加酿酒酵母发酵液能够提高断奶仔猪的生长性能、促进小肠发育和提高小肠黏膜免疫功能,达到与抗生素组相当的效果。本试验结果提示,酿酒酵母发酵液可有效缓解断奶应激,减少或者替代抗生素在断奶仔猪饲粮中的使用,为研发无抗饲粮提供了有力的理论依据和数据支持。
[1] 李维,冯培刚,王恬.仔猪断奶应激及其营养调控[J].家畜生态学报,2007,28(6):1-4.
[2] 王向荣,贺建华,戴求仲,等.早期断奶应激对仔猪肠黏膜屏障功能的影响及其检测与修复[J].动物营养学报,2014,26(11):3197-3202.
[3] MCCRACKEN B A,GASKINS H R,RUWEKAISER P J,et al.Diet-dependent and diet-independent metabolic responses underlie growth stasis of pigs at weaning[J].The Journal of Nutrition,1995,125(11):2838-2845.
[4] 王蜀金,王斌星,郭春华,等.分泌表达pEGF的重组酿酒酵母在断奶仔猪上的应用研究[J].畜牧兽医学报,2016,47(5):944-954.
[5] 王蜀金,陈慧娜,张正帆,等.酿酒酵母对断奶大鼠生产性能、肠道发育、血液理化指标及免疫功能的影响[J].家畜生态学报,2014,35(10):41-45.
[6] 王蜀金,周琳,陈惠娜,等.重组猪表皮生长因子在酿酒酵母中的克隆表达及其生物学活性鉴定[J].畜牧兽医学报,2014,45(12):1971-1980.
[7] 胡新旭,周映华,刘惠知,等.无抗发酵饲料对断奶仔猪生长性能、肠道菌群、血液生化指标和免疫性能的影响[J].动物营养学报,2013,25(12):2989-2997.
[8] MATHEW A G,CHATTIN S E,ROBBINS C M,et al.Effects of a direct-fed yeast culture on enteric microbial populations,fermentation acids,and performance of weanling pigs[J].Journal of Animal Science,1998,76(8):2138-2145.
[9] WANG S J, GUO C H, ZHOU L,et al.Effects of dietary supplementation with epidermal growth factor-expressingSaccharomycescerevisiaeon duodenal development in weaned piglets[J].British Journal of Nutrition,2016,115(9):1509-1520.
[10] 高俊.酵母培养物对肉仔鸡的作用及其机理[D].博士学位论文.北京:中国农业科学院,2008.
[11] 肖曼,高振华,李兴华,等.酵母培养物对肉仔鸡生长性能、肠黏膜结构及肠道菌群的影响[J].动物营养学报,2013,25(7):1624-1631.
[12] 俞晓荣.酵母及其培养物应用前景[J].中国饲料添加剂,2008(9):9-12.
[13] WANG S J,GUO C H,ZHOU L,et al.Comparison of the biological activities ofSaccharomycescerevisiae-expressed intracellular EGF,extracellular EGF,and tagged EGF in early-weaned pigs[J]. Applied Microbiology and Biotechnology,2015,99(17):7125-7135.
[14] JURGENS M H,RIKABI A,ZIMMERMAN D R,et al.The effect of dietary active dry yeast supplement on performance of sows during gestation-lactation and their pigs[J].Journal of Animal Science,1997,75(3):593-597.
[15] 王子旭,佘锐萍,陈越,等.日粮锌硒水平对肉鸡小肠黏膜结构的影响[J].中国兽医科技,2003,33(7):18-21.
[16] 董克苏,肖振铎.产酸型活菌制剂对新生仔猪小肠绒毛形态影响的观察[J].吉林农业大学学报,1994,16(1):93-96.
[17] HAMPSON D J.Alterations in piglet small intestinal structure at weaning[J].Research in Veterinary Science,1986,40(1):32-40.
[18] IJI P A,SAKI A A,TIVEY D R.Intestinal structure and function of broiler chickens on diets supplemented with a mannan oligosaccharide[J].Journal of The Science of Food and Agriculture,2001,81(2):1186-1192.
[19] ZHANG A W,LEE B D,LEE S K,et al.Effects of yeast(Saccharomycescerevisiae) cell components on growth performance,meat quality,and ileal mucosa development of broiler chicks[J].Poultry Science,2005,84(7):1015-1021.
[20] BONTEMPO V,DI GIANCAMILLO A,SAVOINI G,et al.Live yeast dietary supplementation acts upon intestinal morpho-functional aspects and growth in weanling piglets[J].Animal Feed Science and Technology,2006,129(3/4):224-236.
[21] COSTALOS C,SKOUTERI V,GOUNARIS A,et al.Enteral feeding of premature infants withSaccharomycesboulardii[J].Early Human Development,2003,74(2):89-96.
[22] VAN HEUGTEN E,FUNDERBURKE D W,DORTON K L.Growth performance,nutrient digestibility,and fecal microflora in weanling pigs fed live yeast[J].Journal of Animal Science,2003,81(4):1004-1012.
[23] 林伯全,杨慧,王恬.酵母细胞壁和益生素对蛋鸡生产性能及免疫功能的影响[J].动物营养学报,2014,26(5):1327-1332.
[24] 周淑芹,孙文志.酵母培养物与抗生素对肉仔鸡生长性能及免疫机能影响的研究[J].畜牧与兽医,2004,36(11):9-11.
[25] 岳支华,曾箭民.酵母细胞壁(PR-500)及其在养殖生产中的应用[J].中国水产,2000,294(5):68-69.
[26] WANG S J,ZHOU L,CHEN H N,et al.Analysis of the biological activities ofSaccharomycescerevisiaeexpressing intracellular EGF,extracellular EGF,and tagged EGF in early-weaned rats[J].Applied Microbiology Biotechnology,2015,99(5):2179-2189.
[27] 张腾飞.无抗生素发酵饲料对猪免疫功能的影响[J].中国畜牧兽医文摘,2011,27(5):180.
*Corresponding author, professor, E-mail: 531893818@qq.com
(责任编辑 李慧英)
Effects ofSaccharomycescerevisiaeFermentation Broth on Growth Performance, Small Intestine Development and Immune Function of Small Intestinal Mucosa of Weaned Piglets
WANG Binxing1WANG Shujin1GUO Chunhua1*HE Huan1GAO Yanhua1BAI Xue1YANG Jiabao2ZHOU Lin3
(1.CollegeofLifeScienceandTechnology,SouthwestUniversityforNationalities,Chengdu610041,China; 2.AnimalBreedingandGeneticsKeyLaboratoryofSichuanAnimalScienceAcademy,Chengdu610066,China; 3.ShenzhenPremixNutritionCo.,Ltd,Shenzhen518103,China)
The objective of this study was to determine the effects ofSaccharomycescerevisiae(S.cerevisiae) fermentation broth on growth performance, small intestine development and immune function of small intestinal mucosa of weaned piglets. A total of 60 (male and female in half) 26-day-old “Landrace×Duroc” weaned piglets with average body weight of (6.57±0.13) kg were randomly divided into 3 groups with 4 replicates per group and 5 weaned piglets per replicate by weight and gender. The weaned piglets in the control group were fed the basal diet supplemented with 300 mL/kg blank culture medium, those inS.cerevisiaefermentation broth group were fed the basal diet supplemented with 300 mL/kgS.cerevisiaefermentation broth, ant the others in antibiotics group were fed the basal diet supplemented with 20 mg/kg colistin sulfate and 40 mg/kg bacitracin zinc. The experiment lasted for 21 d. The results showed as follows: 1) compared with the control group, the average daily gain (ADG) and average daily feed intake (ADFI) inS.cerevisiaefermentation broth group and antibiotics group were significantly increased (P<0.05 orP<0.01), and the ratio of feed to gain (F/G) was significantly decreased (P<0.01). There were no significant differences in above growth performance indexes betweenS.cerevisiaefermentation broth group and antibiotics group (P>0.05). 2) Compared with the control group, the contents of total protein, DNA and RNA of duodenum, jejunum and ileum mucosa inS.cerevisiaefermentation broth group and antibiotics group were significantly increased (P<0.05 orP<0.01). No significant differences were found in above indexes betweenS.cerevisiaefermentation broth group and antibiotics group (P>0.05). 3) Compared with the control group, the villus height of duodenum and ileum inS.cerevisiaefermentation broth group and antibiotics group was significantly increased (P<0.05), and the ratio of villous height to crypt depth (V/C) of duodenum, jejunum and ileum was significantly increased (P<0.05 orP<0.01). No significant differences were found in above indexes betweenS.cerevisiaefermentation broth group and antibiotics group (P>0.05). 4) Compared with the control group, the contents of immunoglobulin A (IgA), immunoglobulin G (IgG) and immunoglobulin M (IgM) of duodenum, jejunum and ileum mucosa inS.cerevisiaefermentation broth group and antibiotics group were significantly increased except for the content of IgG of jejunum mucosa (P<0.05 orP<0.01). No significant differences were found in above indexes betweenS.cerevisiaefermentation broth group and antibiotics group (P>0.05). The results show that dietaryS.cerevisiaefermentation broth with the same effects of antibiotic can improve the growth performance, promote the development of small intestine, and improve the immune function of intestinal mucosal. It suggests thatS.cerevisiaefermentation broth can effectively alleviate weanling stress, reduce or replace the using of antibiotics in diets of weaned piglets, and provides a powerful theoretical basis and data support for researching non-antibiotics diets.[ChineseJournalofAnimalNutrition, 2016, 28(12):4014-4022]
Saccharomycescerevisiae; weaned piglets; small intestine development; immunoglobulin; weanling stress
10.3969/j.issn.1006-267x.2016.12.036
2016-06-02
四川省财政运行专项项目(SASA2015CZYX014);四川省科技支撑计划(优质风味猪育种材料与方法创新,16ZC2850)
王斌星(1990—),男,安徽岳西人,硕士研究生,研究方向为动物营养与饲料科学。E-mail: 1045302767@qq.com
*通信作者:郭春华,教授,硕士生导师,E-mail: 531893818@qq.com
S828
A
1006-267X(2016)12-4014-09

