舒肩胶囊加速稳定性试验
郭敏,许梅
·炮制制剂·
舒肩胶囊加速稳定性试验
郭敏,许梅
目的:对舒肩胶囊的稳定性进行初步试验。方法:按照加速稳定性试验的要求,于温度40±2 ℃,相对湿度75%±5%的条件下分别于0、1、2、3、6月取样进行考察。结果:各指标均符合标准规定,质量基本稳定。
舒肩胶囊: 加速稳定性: 试验
舒肩胶囊是我院新申报的医院制剂。现将加速稳定性试验方法与结果报告如下:
1 试验用样品
舒肩胶囊样品三批,由重庆市江北区中医院试制,批号分别为20110601/20110602/20110603。
2 试验方法
加速试验:将本品置试验用包装(铝塑板内包装、药用复合膜袋外包装)中(与拟上市包装一致),于温度40±2 ℃,相对湿度75%±5%的条件下分别于0、1、2、3、6月取样进行考察,共取样4次,考察6个月。
3 试验条件
3.1 仪器设备:
高效液相色谱仪LC-2010A(日本岛津);超声波清洗器CQ-100型(上海跃进医用光学器械厂);光学读数分析天平TG328A型(湖南湘仪天平仪器厂);低速离心机TL04C 型(北京大恒建海科贸公司)等。
3.2 试剂与试药:
均为分析纯。
3.3 试验环境条件:
温度40±2 ℃,相对湿度75%±5%。
4 项目及内容
4.1 性状
本品为硬胶囊,内容物为棕褐色粉末;味苦微辛。
4.2 鉴别
4.2.1 桂枝的鉴别 取本品内容物6 g,加乙酸乙酯50 mL,加热回流1小时,滤过,滤液置水浴上蒸干,残渣加乙酸乙酯2 mL使溶解,作为供试品溶液。另取桂皮醛对照品,加乙酸乙酯制成每1 mL含2 μL的溶液,作为对照品溶液。照薄层色谱法(中国药典2010年版一部附录Ⅵ B)试验,吸取上述供试品溶液10 μL,对照品溶液5 μL,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶G薄层板上,以石油醚(60~90℃)-乙酸乙酯(8.5∶1.5)为展开剂,展开,取出,晾干,喷以2,4-二硝基苯肼乙醇溶液。供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。
4.2.2 防风的鉴别 取本品内容物4 g,加水30 mL使溶解,离心,分取上清液,加乙醚振摇提取2次,每次20 mL,弃去乙醚液。水液加水饱合的正丁醇振摇提取2次(30 mL,20 mL),合并正丁醇液,加入氨试液50 mL,摇匀,放置使分层,分取正丁醇液,蒸干,残渣加甲醇1 mL使溶解,作为供试品溶液。另取防风对照药材1 g,加丙酮20 mL,超声处理20分钟,滤过,滤液蒸干,残渣加甲醇1mL使溶解,作为对照药材溶液。再取升麻素苷和5-Ο-甲基维斯阿米醇苷对照品,分别加甲醇制成每1 mL含1 mg的溶液,作为对照品溶液。照薄层色谱法(中国药典2010年版一部附录VI B)试验,吸取上述供试品溶液和对照药材溶液各5~10 μL,对照品溶液各2 μL,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶GF254薄层板上,以三氯甲烷-甲醇(4∶1)为展开剂,展开二次,取出,晾干,置紫外光灯(254 nm)下检视。供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。
4.3 检查:
应符合胶囊剂项下有关的各项规定(《中华人民共和国药典》2010年版一部附录)。
4.4 含量测定:
照高效液相色谱法(《中华人民共和国药典》2010年版一部附录Ⅵ D)测定。
4.4.1 色谱条件与系统适应性试验 用十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相A,以0.1%磷酸水溶液为流动相B,按下表进行梯度洗脱;检测波长为250 nm。理论板数按5-Ο-甲基维斯阿米醇苷峰计算应不低于2000。

时间(分钟) 流动相A(%) 流动相B(%)0~10 16 84 10~25 16→22 84→78 25~30 22 78 30~35 22→34 78→66 35~43 34 34
4.4.2 对照品溶液的制备 精密称取 5-Ο-甲基维斯阿米醇苷对照品适量,加甲醇制成每1 mL含25 µg的溶液,即得。
4.4.3 供试品溶液的制备 取本品装量差异项下的内容物,研细,取1.5 g,精密称定,加甲醇35 mL,超声处理40 分钟,过滤,甲醇少量分次洗涤残渣,合并滤液及洗涤液,滤液浓缩至约2 mL,加中性氧化铝1.5 g,搅拌均匀,干燥,置中性氧化铝柱(100~200目,1.5 g,内径1 cm)上,用水60 mL洗脱,水洗液用水饱和正丁醇提取5次,每次30 mL,合并水饱和正丁醇提取液,蒸干,残渣加甲醇适量使溶解,移至25 mL量瓶中,加甲醇定容至刻度,摇匀,0.45 μm滤膜过滤,取续滤液,即得。
测定法 精密吸取对照品溶液与供试品溶液各10 μL,注入液相色谱仪,测定,即得。
本品每粒含防风以5-Ο-甲基维斯阿米醇苷(C22H28Ο10)计,应不低于0.1 mg。
5 试验结果
试验结果见表1、表2、表3。

表1 制剂加速稳定性试验报告
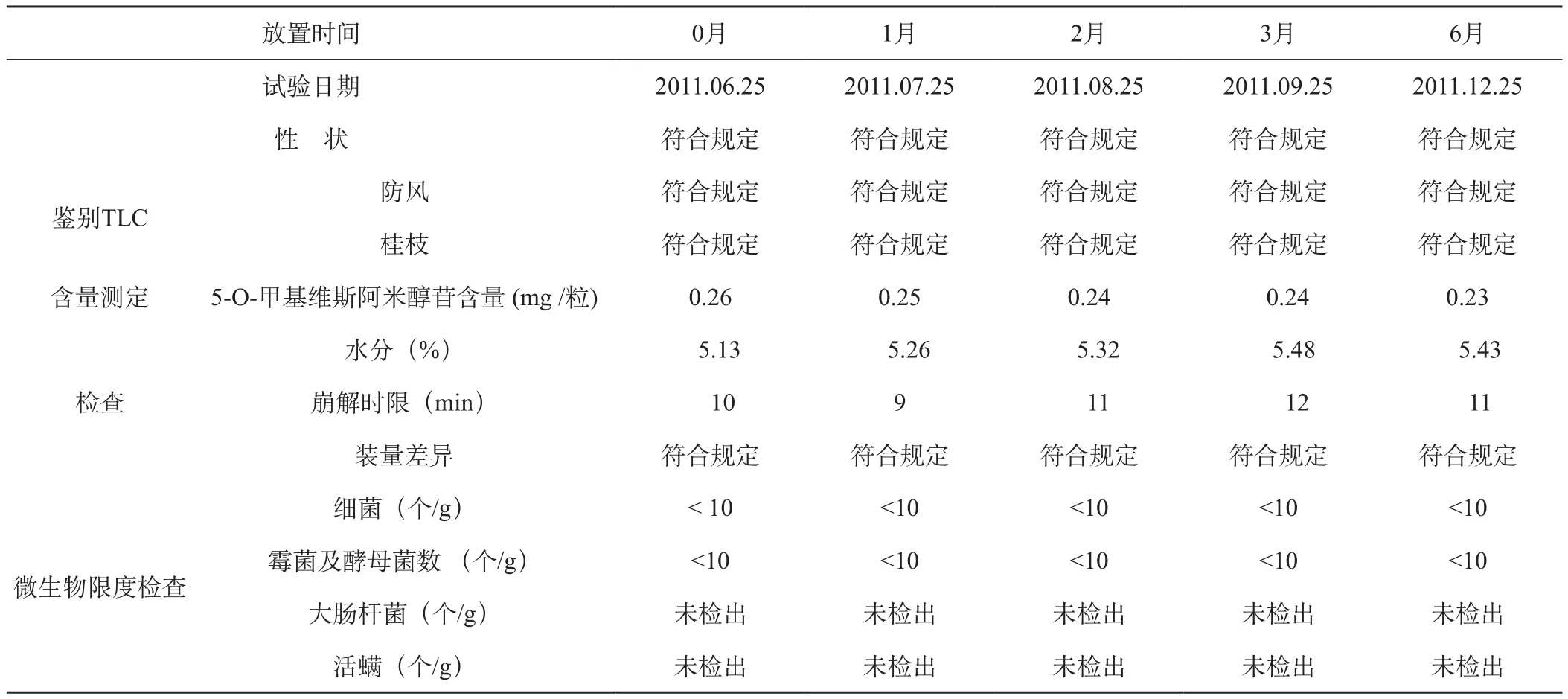
表2 制剂加速稳定性试验报告
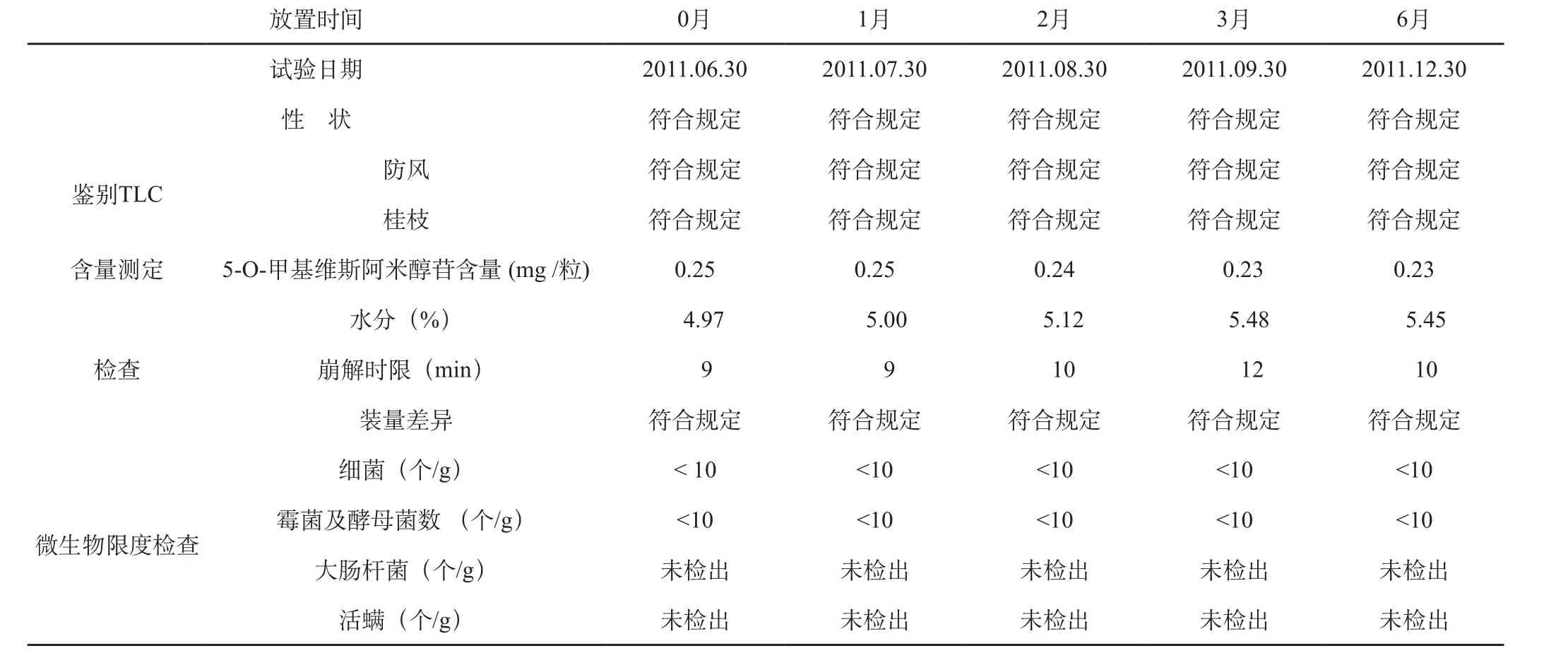
表3 制剂加速稳定性试验报告
6 结论
加速试验结果表明:本品在临床试验用包装条件下,于温度40±2 ℃,相对湿度75%±5%条件下考察6个月,各指标均符合标准规定,质量基本稳定。
[1] 国家药典委员会.中华人民共和国药典[S].一部.北京:化学工业出版社,2010
[2] 国家药品监督管理局.《中药、天然药物稳定性研究技术指导原则》[S].2006.
(责任编辑:傅舒)
Experiment on accelerated stability of Shujian Capsule/
GUO Min, XU Mei//(Chongqing Jiangbei District Chinese Medicine Hospital, Chongqing 400020)
Objective: To study the stability of Shujian Capsule. Method: According to the requirements of accelerated stability test, sample stability at 40±2℃ with relative humidity of 75%±5% were investigated at 0, 1, 2, 3, 6 month, respectively. Result: The sample is stable with indicators satisfying test requirement.
Shujian Capsule; accelerated stability; experiment
R 283.1
A
1674-926X(2016)03-007-03
重庆市江北区中医院,重庆 400020
郭敏,女,大学本科,主要从事医院制剂研究
Tel:13883733273 Email:hhys111@yeah.net
2015-11-16

