326例药品不良反应/不良事件报告
王 龙,彭 华
(重庆南桐矿业有限责任公司总医院药剂科临床药学室,重庆 400802)
326例药品不良反应/不良事件报告
王 龙,彭 华
(重庆南桐矿业有限责任公司总医院药剂科临床药学室,重庆 400802)
目的:了解重庆市万盛区南桐总医院(以下简称“我院”)药品不良反应/事件(adverse drug reaction/events,ADR/ADE)的发生特征,规范临床合理用药。方法:收集我院2004年4月—2015年9月上报的326例ADR/ADE报告,对患者年龄、性别、怀疑的药品种类、给药途径、累及器官和(或)系统、程度分级及转归、既往过敏史发生情况等进行分析。结果:326例ADR/ADE报告中,≥61岁者共计110例(占33.74%);抗感染药引起ADR/ADE的最多(206例,占63.19%);引发ADR/ADE的主要途径以静脉滴注为主(303例,占92.94%),其次为口服给药(19例,占5.83%);药品以抗感染药为主,共206例(占63.19%)。ADR/ADE累及器官和(或)系统以皮肤及其附件为主(269例,占48.64%),其次为全身性损伤(85例,占15.37%),累及器官和(或)系统整体上以累及单个系统为主,共发生185例(占56.75%)。一般的ADR/ADE报告最多(277例,占84.97%),其次为新的一般的ADR/ADE(33例,占10.12%);ADR/ADE报告中7例有明确过敏史(占2.15%),208例无过敏史(占63.80%),111例过敏史不详(占37.05%)。结论:临床应加强ADR/ADE的监管和宣传,制订和实施相关合理用药质量控制标准,减少用药伤害,促进临床合理用药。
药品不良反应; 药品不良事件; 合理用药
药品不良反应/事件(adverse drug reaction/events,ADR/ADE)是指合格的药品在正常的用法与用量下出现的与用药目的无关的或意外的有害反应。其不包括无意或故意超剂量用药引起的反应以及用药不当引起的反应[1]。据世界卫生组织统计,各国住院患者ADR发生率为10%~20%,5%的患者因为严重的ADR死亡;在全世界死亡患者中约有1/3死于用药不当,ADR致死率占第4位[2]。现将重庆南桐矿业有限责任公司总医院(以下简称“我院”)326例ADR/ADE报告进行分析,了解其发生的特点及规律,为临床合理用药和我院药品供应目录的调整提供依据,以降低和避免ADR/ADE的发生,减少医患纠纷,促进安全用药。
1 资料与方法
1.1 资料来源
收集我院2004年1月—2015年9月上报的326例ADR/ADE报告。针对患者的性别、年龄、怀疑的药品种类、给药途径、累及器官和(或)系统、给药时间、ADR/ADE严重程度、既往过敏史情况在ADR/ADE构成比情况进行分类。
1.2 方法
采用国家食品药品监督管理局制定的《世界卫生组织不良反应术语集》(2013年版)软件对ADR累及器官和(或)系统术语进行分类。按照国家《药品不良反应报告和监测管理办法》[1]对本次调查ADR/ADE报告进行严重程度分级,分为一般的、严重的、新的ADR和死亡病例。采用Excel对数据进行分类统计分析。
2 结果
2.1 发生ADR患者的性别及年龄分布
326例ADR/ADE报告中,男性168例,女性158例,男性稍多于女性;<11岁者24例,≥61岁者110例,见表1。
表1 引发ADR患者的性别及年龄分布[例(%)]
Tab 1 Distribution of gender and age in ADR cases[cases(%)]

年龄/岁性别男性女性合计<13(0 92)0(0)3(0 92)1~<1113(3 99)8(2 45)21(6 44)11~<214(1 23)9(2 76)13(3 99)21~<317(2 15)20(6 13)27(8 28)31~<4121(6 44)30(9 20)51(15 64)41~<5127(8 28)25(7 67)52(15 95)51~<6122(6 75)28(8 59)49(15 03)61~<7137(11 35)16(4 91)54(16 56)71~<8124(7 36)19(5 83)43(13 19)≥8110(3 07)3(0 92)13(3 99)合计168(51 53)158(48 47)326(100 00)
2.2 引发ADR/ADE的药品类型分布及构成比
根据《新编药物学》(17版)[3]对药品类型进行分类。抗感染药引起的ADR/ADE最多(主要为含β-内酰胺环、大环内酯类和氟喹诺酮类抗菌药物),共206例(占63.19%);其中怀疑单个药品引发ADR/ADE共282例(占86.50%);怀疑由多个药品引发ADR/ADE共44例(占13.50%),见表2。
表2 引发ADR/ADE的药物类型分布及构成比
Tab 2 Distribution and constituent ratio of categories of ADR/ADE-inducing drugs

药物类型怀疑单个药品报告/例怀疑多个药品报告/例合计/例构成比/%抗感染药1792720663 19中成药注射剂3284012 27中枢神经系统用药171185 52维生素营养水电解质92113 37消化系统用药82103 07心血管系统用药9092 76血液及造血系统用药7182 45其他类药物诊断用药6061 84影响变态反应和免疫功能药物4151 53泌尿和生殖系统用药3141 23激素及其有关药物3030 92抗肿瘤药2130 92老年病用药2020 61呼吸系统用药1010 31合计/例28244326构成比/%86 5013 50100 00
2.3 引发ADR/ADE的给药途径分布
引发ADR/ADE的主要途径以静脉滴注为主,其次为口服给药,见表3。
表3 引发ADR/ADE的给药途径分布
Tab 3Distribution of ADR/ADE-inducing route of administration
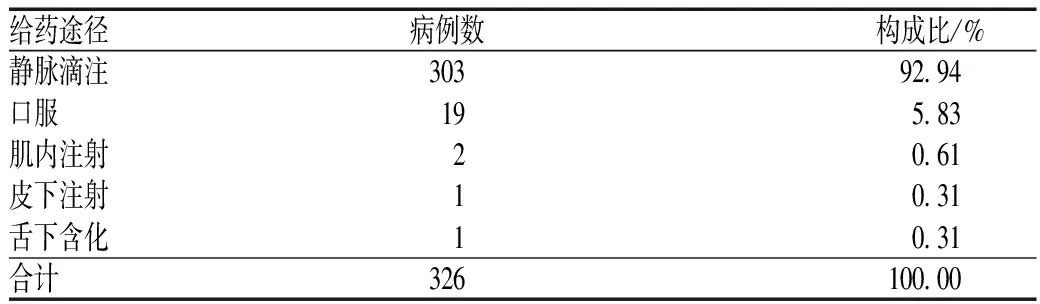
给药途径病例数构成比/%静脉滴注30392 94口服195 83肌内注射20 61皮下注射10 31舌下含化10 31合计326100 00
2.4 ADR/ADE累及器官和(或)系统
2.4.1 ADR/ADE累及器官和(或)系统及主要临床表现:ADR/ADE累及器官和(或)系统以皮肤及其附件为主,表现为皮肤局部反应(红、肿、热、痛)、皮疹、瘙痒;其次为全身性损伤,表现为全身麻木、变态反应、发热、出汗、过敏性休克、寒战、无力、体温过低、全身疼痛,见表4。
2.4.2 ADR/ADE累及单个及多个器官和(或)系统及构成比:本调查中可见,ADR/ADE整体上以累及单个系统为主,共发生185例(占56.75%),但怀疑多个药品引发ADR/ADE中却以累及多个器官和(或)系统为主,共31例(占70.45%),见表5。
表4 ADR/ADE累及器官和(或)系统的主要临床表现
Tab 4 ADR/ADE involved organs and (or) systems and clinical manifestations

累及器官和(或)系统临床表现怀疑单个药品引起报告病例数怀疑多个药品引起报告病例数只有1种临床表现的(占单项的构成比/%)有多个临床表现的(构成比/%)单项合计(占总病例数构成比/%)只有1种临床表现的(构成比/%)有多个临床表现的(构成比/%)单项合计(占总病例数构成比/%)合计(构成比/%)皮肤及其附件损害皮肤局部反应(14)、皮疹(161)、瘙痒(94)115(55 83)91(44 17)206(76 58)12(19 05)51(80 95)63(23 42)269(48 64)全身性损害全身麻木(1)、变态反应(1)、发热(25)、出汗(7)、过敏性休克(9)、寒战(30)、无力(3)、体温过低(4)、全身疼痛(5)15(22 73)51(77 27)66(77 65)1(5 26)18(94 74)19(22 35)85(15 37)交感副交感神经系统损害心悸(42)、发麻(1)、面色苍白(1)、皮肤潮红(6)、心律失常(1)、血压降低(1)、血压升高(2)7(14 58)41(85 42)48(88 89)0(0)6(100 00)6(11 11)54(9 76)胃肠系统损害腹痛(1)、腹泻(3)、呕吐(16)、呃逆(1)、恶心(15)、胃肠道反应(2)、消化不良(1)、胃肠胀气、厌食(1)5(13 89)31(86 11)36(90 00)0(0)4(100 00)4(10 00)40(7 23)心血管损害过敏性紫癜(1)、静脉炎(13)、脉管炎(1)、水肿(13)14(58 33)10(41 67)24(85 71)0(0)4(100 00)4(14 29)28(5 06)中枢及外周神经系统损害头晕(12)、头痛(6)、头昏(1)感觉迟钝(1)、感觉异常(1)、麻痹(1)、视力异常(1)、意识模糊(1)、认知障碍(2)、谵妄(2)2(9 09)20(90 91)22(78 57)0(0)6(100 00)6(21 43)28(5 06)呼吸系统损害呼吸困难(9)、咳嗽(1)、哮喘(1)、窒息感(3)、换气过度(2)、发绀(1)、气促(3)3(21 43)11(78 57)14(70 00)0(0)6(100 00)6(30 00)20(3 62)用药部位损害用药部位红肿(1)、用药部位疼痛(4)、用药部位瘙痒(6)、用药部位皮疹(2)9(81 82)2(18 18)11(84 62)0(0)2(100 00)2(15 38)13(2 35)神经紊乱憋气(5)、幻觉(2)、焦虑(1)、哈欠(1)、失眠(2)0(0)9(100 00)9(81 82)0(0)2(100 00)2(18 18)11(1 99)肝胆系统损害肝细胞损害(1)、肝炎(2)1(100 00)0(0)1(33 33)0(0)2(100 00)2(66 67)3(0 54)泌尿系统损害血尿(2)2(100 00)0(0)2(100 00)0(0)0(0)0(0)2(0 36)合计173(39 41)266(60 59)439(79 39)13(11 40)101(88 60)114(20 61)553(100 00)
注:同一ADR可累及多个器官和(或)系统,故总例次数>326
Note: one ADR may involve multiple organs and (or) systems, so the total number of cases were >326
2.5 ADR/ADE严重程度分级及转归
本调查中可见,一般的ADR/ADE报告最多,为277例(占84.97%),其次为新的一般的ADR/ADE,共33例(占10.12%),见表6。
2.6 发生ADR/ADE发生患者的既往过敏史情况
326例ADR/ADE报告中,患者有明确过敏史的共7例(占2.15%);无过敏史患者208例(占63.80%);有不详过敏史者111例(占37.05%),见表7。
表5 ADR/ADE累及单个及多个器官和(或)系统及构成比
Tab 5 ADR involved single and multiple organ and (or) system and clinical manifestations

ADR/ADE类型怀疑单个药品引起病例数只累及单器官或系统及占单项构成比同时累及多器官多系统及占单项构成比单项合计怀疑多个药品引起病例数只累及单器官或系统及占单项构成比同时及多器官多系统及占单项构成比单项合计只累及单器官或系统总计同时累及多器官多系统总计合计报告病例数172(60 99)110(39 01)28213(29 55)31(70 45)44185141326占总病例数构成比/%52 7633 7486 53 999 5113 556 7543 25100
表6 ADR/ADE严重程度分级及转归
Tab 6 ADR/ADE classification and prognosis

ADR/ADE严重程度怀疑单个药引起怀疑多个药引起新的、一般的新的、严重的一般的严重的死亡合计新的、一般的新的、严重的一般的严重的死亡合计报告例数3312408028200376144占各单项构成比/%11 700 3585 112 840100 000084 0913 642 27100 00占总病例数构成比/%10 120 3173 622 45086 500011 351 840 3113 50
表7 发生ADR/ADE患者的既往过敏史情况
Tab 7 Allergic history of ADR/ADE patients

过敏史描述怀疑单个药品引起报告例数 有(明确) 有(不详) 无单项合计怀疑多个药品引起报告例数 有(明确) 有(不详) 无单项合计报告病例数6921842821192444占各单项构成比/%2 1332 6265 25100 002 2743 1854 55100 00占总病例数构成比/%1 8428 2256 4486 500 315 837 3613 50
3 讨论
3.1 ADR/ADE与患者年龄的关系
本次调查的326例ADR/ADE报告中,≥61病例数居首位,这可能与我国人口老龄化进程加快,老年患者数量明显上,老年人组织器官生理性退化,药物半衰期延长等因素有关[4]。因此,老年患者用药时,应根据肌酐清除率、肝功能等情况合理设计给药方案,以减少ADR/ADE的发生。
3.2 ADR/ADE与药物类型关系
由表2可见,引发ADR/ADE药物以抗感染药为主(占63.19%),其次是中成药注射剂(占12.27%)。造成抗菌药物构成比较高的原因为:(1)抗感染药适用范围广,使用人群分布广,基数大;(2)我院对抗感染药监管严格,ADR/ADE报告上报率高,临床医务人员对抗感染药引起ADR/ADE的警惕性高;(3)抗感染药存在一定不合理用药现象。中药注射剂引发ADR/ADE的与相关报道[4]相一致,其发生率的原因可能为:(1)不同患者对中药注射剂的耐受不同,个体差异较大;(2)原材料产地不同,质量控制标准低,成分复杂,制药过程中需要添加一些辅助剂,可能引起局部组织缺血、缺氧甚至水肿等过敏反应;(3)临床上常采用中西药联合的方式来增强药效,但是中药注射液的成分复杂,在联合用药中可能引发不良反应;(4)临床使用不按中医辩证理论用药,超适应证用药,具有相同成分或相似药理作用的中成药联合应用等[10-11]。因此,应加强中药注射剂质量控制标准研究,严格按照中医辨证理论合理用药,谨慎联合用药,加强护理观察,降低中药注射剂ADR的发生概率。抗肿瘤药引发的ADR/ADE占比较低,与文献报道[9]不相符,可能与我院对抗肿瘤药ADR/ADE报告管理的相关措施及我院临床医师对抗肿瘤药物ADR/ADE上报的意识不强有关,应加强医院ADR/ADE报告制度的实施和填报的相关培训。
3.3 ADR/ADE与给药途径的关系
由表3可见,静脉滴注是引发ADR/ADE的主要途径(占92.94%,远远高于其他给药途径),与文献报道一致[4-6]。造成这一结果原因可能为:(1)ADR/ADE报告来源属于医疗机构的住院患者,多为静脉滴注;(2)静脉滴注本身具有一定的药代动力学特征[7-8],给药后药物直接进入血液系统,无肝脏首关效应,药物浓度较高,作用迅速,对机体的刺激较强;药物的pH、渗透压、内毒素、微粒及给药速度均可能为引发ADR/ADE的直接诱因。本调查中可见,口服给药所致ADR的发生率较高,占5.83%,这也可能与口服给药方式的应用范围广等因素有关。医务人员应严格掌握注射剂用药指征,遵循“能口服给药绝不肌内注射给药,能肌内注射给药绝不静脉给药”的原则,尽量减少静脉给药,降低ADR/ADE发生率[9]。
3.4 ADR/ADE累及器官和(或)系统
由表4—5可见,ADR/ADE临床表现以皮肤及其附件为主(269例,占48.64%),造血系统、神经系统和肝胆系统损害等ADR/ADE报告较少,可能因皮肤及其附件的临床表现较易观察,故上报率较高,但临床应加强造血系统、神经系统和肝胆系统损害等ADR/ADE报告较少器官和(或)系统的临床观察和上报。从表5中可见,怀疑单个药品引起的ADR/ADE以单个器官和系统损害为主(占单项的构成比为60.99%),而在怀疑多个药品引起的ADR/ADE中以多个器官或系统损害为主(占单项的构成比为70.45%),考虑多个药品合用时,可能更容易引起多器官多系统损害。临床联合用药时应仔细评估风险效益比,尤其是当2个或2个以上相近或相似的药品联合应用后,有可能增加ADR/ADE对器官和(或)系统的损害范围。
3.5 ADR/ADE严重程度分级及与患者过敏史的关系
由表6可见,ADR/ADE严重程度整体上以一般的为主,其次为新的一般的ADR/ADE。但在怀疑多个药品引起的ADR/ADE严重程度中,居第2位的是严重的ADR/ADE,考虑在多个药品的联用中,可能更容易导致严重甚至死亡ADR/ADE的发生,因此应加强用药监测。由表7可见,有过敏史患者ADR/ADE报告数明显少于无过敏史者,可能与临床针对既往有过敏史患者用药时更加谨慎有关。因此,临床应加强对无过敏史患者的ADR/ADE监控,不排除ADR/ADE的发生与患者的过敏史有一定相关性。
综上所述,为了减少ADR/ADE造成的伤害,临床应做到以下几点:(1)特殊人群应据具体情况,加强对既往史的关注,根据不同的机体功能设计给药方案;(2)严格按照世界卫生组织推荐的给药途径选择方案,设计给药途径,加强静脉用药质量控制标准的建立和实施;(3)加强一些肉眼不易观察的ADR/ADE观察与填报,如骨髓抑制、肝肾功能损害等;(4)非必要或没有循证医学证据情况下[12-14],尽量不选择多药联合应用,确实需要联合用药时,应充分了解药物的作用机制及理化性质后再应用,以减少ADR/ADE的发生[15];(5)加强抗感染药和中药注射剂的监管。
[1]卫生部.药品不良反应报告和监测管理办法[S].卫生部令第81号.2011-05-04.
[2]孙东东,田侃,李刃,等.我国药品不良反应的监管趋势刍议[J].南京中医药大学学报:社会科学版,2008,9(4):228-232.
[3]陈新谦,金有豫,汤光.新编药物学[M].17版.北京:人民卫生出版社,2011:938.
[4]郭玉姝,王媛媛,韦劲,等.303例药品不良反应报告分析[J].中国执业药师,2015,12(6):45-48.
[5]丁长玲,田文梅,赵永德,等.449份药品不良反应报告分析[J].中国医院药学杂志,2014,34(9):774-777.
[6]周华,谭喜莹,邱召娟.我院1056例药品不良反应报告分析[J].中国药房,2014,25(6):543-545.
[7]王秀英.545例药品不良反应报告分析[J].中国医院用药评价与分析,2011,11(4):370-372.
[8]姜玲,沈爱宗,杜德才,等.我院2002—2005年990例药品不良反应报告回顾性分析[J].中国药房,2007,18(8):614-616.
[9]娄元生,李惠民,许文学,等.481例药品不良反应分析与讨论[J].中国卫生质量管理,2015,22(2):16-17,120.
[10] 解娜.37例柴胡注射液不良反应分析[J].中医临床研究,2015,7(11):115-116.
[11] 陈黎,邵学军.358例中药不良反应分析[J].青岛医药卫生,2002,34(2):57-58.
[12] 战伟.中西药联用不良反应例析[J].中医药临床杂志,2005,17(2):145.
[13] 张耀玲,侯会周.临床中药与西药不合理联用的不良反应[J].中国现代药物应用,2009,3(3):178-179.
[14] 吴再起.头孢菌素类与多种西药联用致不良反应分析[J].临床合理用药杂志,2015,8(2):108-109.
[15] 戴劲.多种西药联用的不良反应分析[J].中国医药指南,2011,9(17):110-111.
326 Cases of Adverse Drug Reaction/Adverse Drug Events Reports
WANG Long, PENG Hua
(Dept.of Pharmacy, Clinical Pharmaceutics Room, Chongqing Nantong Mining co., LTD General Hospital, Chongqing 400802, China)
OBJECTIVE:To investigate the occurrence characteristics of adverse drug reaction(ADR) /adverse drug events(ADE) in Chongqing Wansheng District Nantong General Hospital(hereinafter referred to as “our hospital”), so as to standardize the rational drug use in clinic. METHODS: 326 cases of ADR/ADE reported from Apr. 2014 to Sept. 2015 were collected, analysis was conducted on patients’ age, gender, suspected drug categories, route of administration, involved organs and (or) systems, classification and prognosis, allergy history, etc. RESULTS: Of the 326 cases, patients ≥61 years old were 110 cases(33.74%); ADR/ADE induced by anti-infectious drugs took the lead(206 cases, 63.91%). The main route of administration induced ADR/ADE were intravenous infusion(303 cases, 92.94%), followed by oral administration(19 cases, 5.83%); drugs that induced ADR/ADE were mainly anti-infectious drugs, totally 206 cases(63.91%). ADR/ADE involved organs and (or ) systems mainly performed as skin and its accessories damage(269 cases, 48.64%), followed by systemic damage(85 cases, 15.37%). Totally 185 ADR/ADE cases(56.75%) involved a single organ or system. The general ADR/ADE reports took the lead(277 cases, 84.97%), followed by new and general ADR/ADE(33 cases, 10.12%). 7 patients had allergic history(2.15%) and 208 patients without any allergic history(63.80%), with 111 patients’(37.05%) allergy were unknown. CONCLUSIONS: The supervision and propaganda of ADR/ADE should be strengthened, the relevant quality control standard for the rational use of drugs should be developed and implemented to reduce harm drugs by the clinic, so as to promote the rational drug use in clinic.
Adverse drug reaction; Adverse drug events; Rational drug use
R969.3
A
1672-2124(2016)11-1556-04
2016-03-28)
*药师,中药师。研究方向:临床药学。E-mail:893405530@qq.com
#通信作者:药师。研究方向:临床药学。E-mail:609800101@qq.com
DOI 10.14009/j.issn.1672-2124.2016.11.041

