鹅不食草药材的质量研究
张自强,田 磊,邱 斌,杨叶婷,周志宏,程永现,张雯洁
(1.云南中医学院中药学院,云南 昆明 650500; 2.中国科学院昆明植物研究所,植物化学与西部植物资源持续利用国家重点实验室,云南 昆明650201; 3.云南省食品药品检验所中药室,云南 昆明 650011; 4.云南省药物研究所天然药物资源研究室,云南 昆明 650111)
·论 著·
鹅不食草药材的质量研究
张自强,田 磊,邱 斌,杨叶婷,周志宏,程永现,张雯洁
(1.云南中医学院中药学院,云南 昆明 650500; 2.中国科学院昆明植物研究所,植物化学与西部植物资源持续利用国家重点实验室,云南 昆明650201; 3.云南省食品药品检验所中药室,云南 昆明 650011; 4.云南省药物研究所天然药物资源研究室,云南 昆明 650111)
目的:参照《中华人民共和国药典》(2015年版)附录相关方法,对来自全国多批鹅不食草药材进行质量标准的提高,以完善《中华人民共和国药典》中鹅不食草药材的质量标准。方法:对鹅不食草药材的性状、显微特征进行研究;对其水分、浸出物进行测定;以对照药材和与药材功效相关的主要成分6-氧-当归酰多梗白菜菊素(6-O-angeloylplenolin,6-OAP)为对照,采用薄层色谱方法进行定性鉴别;以与药材功效相关的主要成分6-OAP为指标,采用高效液相色谱法进行含量测定。结果:鹅不食草的显微特征明显;薄层色谱斑点清晰;6-OAP在鹅不食草中在0.200 75~8.030 00 μg区间呈良好的线性关系(r=0.999 9),平均加样回收率为103%,6-OAP的质量分数为0.13%~0.32%(平均值为0.21%)。结论:本研究所建立的方法简单易行、准确可靠,可用于鹅不食草的质量控制和《中华人民共和国药典》标准提高。
质量标准; 鹅不食草; 含量测定; 6-氧-当归酰多梗白菜菊素
鹅不食草为菊科植物鹅不食Centipedaminima(L.) A. Br. et Aschers的干燥全草,又名石胡荽、鸡肠草,始载于南唐《食性本草》,《本草纲目》中亦有记载,其有通鼻窍、止咳之功效,多用于治疗风寒头痛、咳嗽痰多、鼻塞不通等。鹅不食草在我国分布较广,东北、华北、华中、华南、西南等地均可见。该药材含有多种结构新颖、生物活性强的次生代谢产物,近30年来已从中分离出的结构类型包括甾体、愈创木内酯型倍半萜、三萜、黄酮及百里香酚衍生物等[1-9],其中,倍半萜类化合物被报道具有抗菌、抗过敏等多种生理活性[10]。传统上认为鹅不食草是治疗鼻炎、头风的要药,代表方剂如碧云散,中成药如胆香鼻炎片等。近代研究结果显示,鹅不食草可抗肿瘤[3,11-12],有文献报道鹅不食草中具有细胞毒素和抗菌活性的倍半萜内酯多达约150种[13]。鹅不食草药材虽已被《中华人民共和国药典》收载,但缺乏有效成分含量测定项目,难以控制药材及其制剂的质量。以主要有效成分或多个有效成分进行药材质量控制是中药质量科学控制的核心。曾对鹅不食草进行系统研究,从中发现了一系列倍半萜和百里香酚类化合物[14]。关于鹅不食草中化合物的功能研究,曾提出一个大胆的科学假设,即鹅不食草之所以得名是因为其味“辛”以至于鹅不食,故其功效的产生应该与“辛”相关。中医认为“辛开温散”,而肿瘤属于阴邪,需要开散,因此,辛味物质可能具有抗肿瘤作用。基于这一思维,曾经研究发现了鹅不食草中一个低极性的倍半萜6-氧-当归酰多梗白菜菊素(6-O-angeloylplenolin,6-OAP),其对血癌及实体瘤体内、外均具有较好的抑制作用[15-16],表明6-OAP是鹅不食草药材的重要药效物质,因此,以其进行质量控制将可能保证临床用药的有效性。
1 材料
1.1 仪器
Agilent 1100型、Agilent 1200型高效液相色谱仪(美国安捷伦公司);Sartorius BSA124S-CW型电子分析天平(德国赛多利斯集团);KQ-2500型数控超声波清洗器(昆山市超声仪器有限公司);W201型恒温水浴锅(上海申生科技有限公司)。
1.2 试剂
甲醇(色谱醇,德国默克公司);水(娃哈哈纯净水);硅胶G薄层板(德国默克公司)。
1.3 药材与对照品
鹅不食草对照药材(中国食品药品检定研究院),6-OAP对照品为中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室自制,经比旋光、质谱法和核磁共振波谱法鉴定其结构,与文献报道数据一致。高效液相色谱检测其为单一峰,峰面积归一化法计算其纯度达99%以上。15批鹅不食草药材来源于:(1)江苏省淮安市盱眙县仇集镇明;(2)云南省昭通市巧家县巧家营;(3)广西省南宁市西乡塘区坛洛镇;(4)云南省景洪市勐养镇;(5)云南省玉溪市元江县县城江边;(6)广西省南宁市武鸣县大明山;(7)广西省桂林市荔浦县;(8)云南省昭通市盐津县;(9)云南省玉溪市新平县磨盘山;(10)四川省峨眉山市峨山镇;(11)浙江省;(12)浙江省;(13)江西省;(14)安徽省;(15)江苏省。药材经云南省药物研究所邱斌高级工程师鉴定为菊科植物鹅不食草Centipedaminima的干燥全草。凭证标本存放于中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室。
2 方法与结果
2.1 性状
干燥全草相互缠成团,呈灰绿色或棕褐色,茎细而多分枝,颜色较深;质脆易断,断面黄白色,中央有白色的髓或已形成空洞;叶小,多皱折,破碎不全,完整的叶片呈匙形,边缘有3~5个锯齿,叶脉不明显;质极脆,易碎落;头状花序小,球形,黄色或黄褐色;闻之略有香气,久闻有刺激性,口尝味苦微辛。该性状特征与《中华人民共和国药典》(2015年版)描述相一致。
2.2 显微鉴别
本品粉末灰绿色至棕褐色。茎表皮细胞呈长方形或类多角形,壁稍厚,表皮可见角质纹理,具气孔,叶表皮细胞呈类多角形,垂周壁薄,波状弯曲,气孔不定式,副卫细胞4~6个腺毛顶面观呈鞋底形,细胞成对排列,内含黄色物;花冠表皮细胞黄色,表面观呈长方形或类多角形,细胞向外延伸呈绒毛状突起,表面有角质纹理;非腺毛2列性,1列为单细胞,稍短,另一列为2细胞,基部细胞较短,先端常呈钩状或卷曲,上部2/3表面有微细角质纹理;花粉粒淡黄色,呈类圆形,直径15~22 μm,具3孔沟,表面有刺,见图1。其显微特征与《中华人民共和国药典》(2015年版)描述相一致。
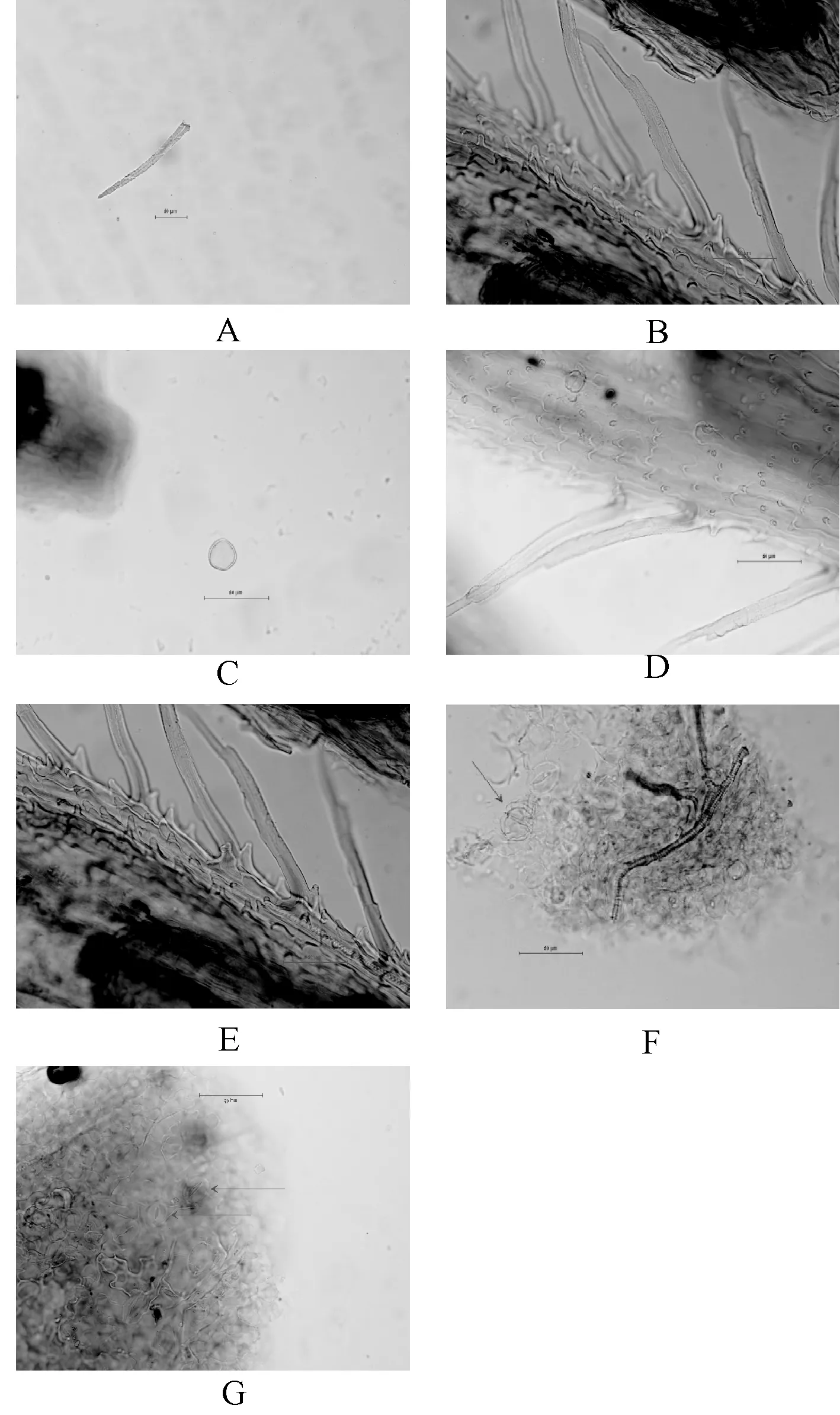
A.非腺毛;B.非腺毛的二列性;C.花粉粒;D.花冠表皮细胞;E.花冠表皮细胞有突起;F.腺毛;G.叶表皮细胞及气孔A.Non-glandular hairs;B.Second column of glandular hairs;C.Pollen grain;D.Epidermal cells of Corolla;E.Corolla epidermal cells with the processes;F.Glandular hairs;G.Leaf epidermal cells and stomata图1 鹅不食草药材粉末显微特征图Fig 1 Microscopic features of Centipeda minima powder
2.3 薄层色谱(thin layer chromatography,TLC)鉴别
2.3.1 以鹅不食草对照药材为参照的TLC鉴别:参照《中华人民共和国药典:一部》(2015年版)“鹅不食草”项下薄层鉴别方法。取本品粉末1 g,加二氯甲烷20 ml,超声处理30 min,滤过,滤液蒸干,残渣加甲醇2 ml使溶解,作为供试品溶液。另取鹅不食草对照药材1 g,同法制成对照药材溶液。参照《中华人民共和国药典》(2015年版)TLC法(“通则0502”)试验,吸取上述2种溶液各2 μl,分别点于同一以硅胶G薄层板上,以石油醚(60~90 ℃)-二氯甲烷(V∶V=3 ∶1)为展开剂,展开,取出,晾干,喷以10%的硫酸乙醇溶液,在110 ℃加热至斑点显色清晰,置紫外光灯(波长365 nm)下检视。结果显示,供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色荧光斑点,见图2。
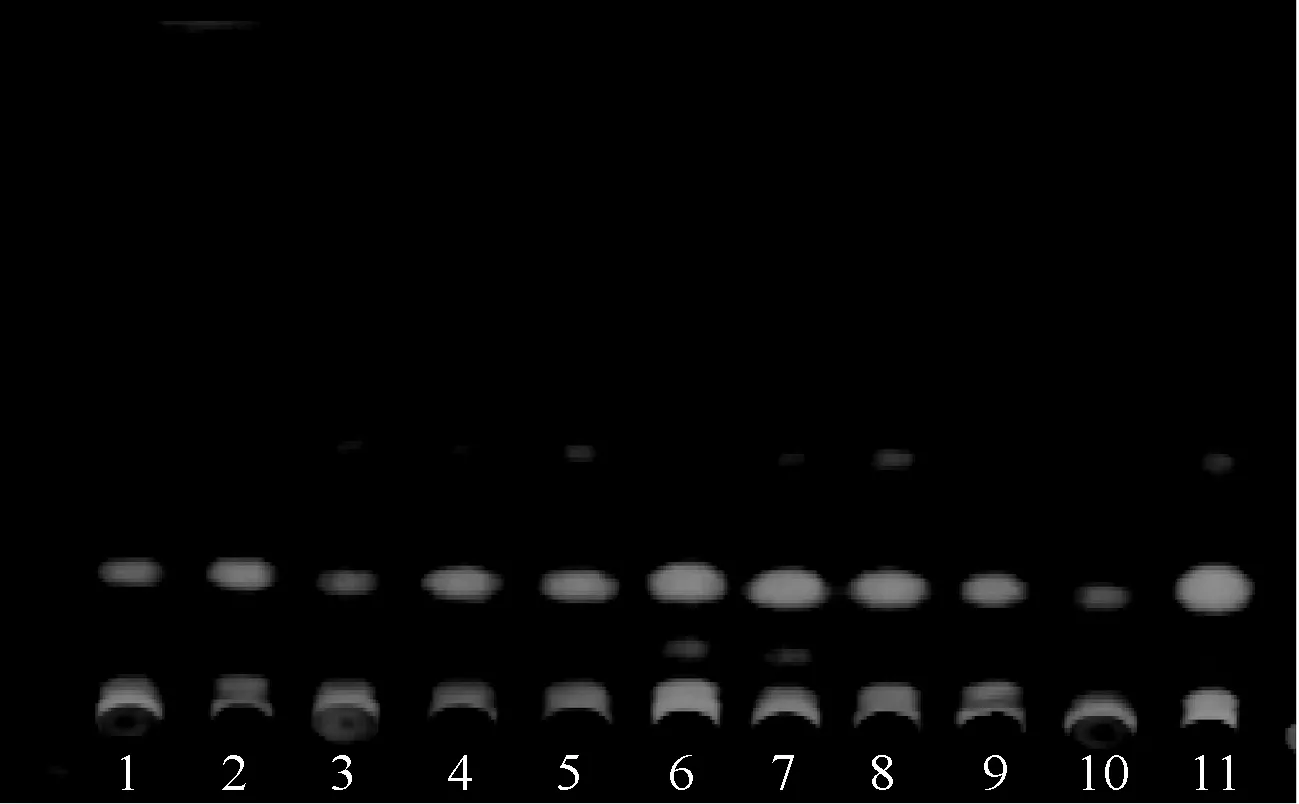
1—10为样品;11为对照药材No.1-10 standard for samples;11 standards for reference material medica图2 鹅不食草TLC图(365 nm) Fig 2 TLC chromatogram of Centipeda minima(365 nm)
2.3.2 以6-OAP为对照的TLC鉴别:(1)对照品溶液的制备。取6-OAP对照品适量,加甲醇制成每1 ml含2.5 mg的溶液,作为对照品溶液。(2)供试品溶液的制备。取本品粉末1.5 g,加甲醇50 ml,超声处理30 min,滤过,取滤液作为供试品溶液。(3)TLC条件及结果:参照《中华人民共和国药典》(2015年版)TLC法(“通则0502”)试验,吸取供试品20 μl、对照品溶液5 μl,分别点于同一硅胶GF254薄层板上,以正己烷-丙酮(V∶V=3 ∶1)为展开剂,展开,取出,晾干,置紫外光灯(波长254 nm)下检视。结果显示,供试品色谱中,在与对照品色谱相应位置处显相同荧光斑点,见图3。
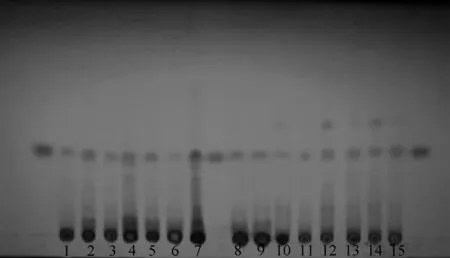
1—15为样品;其余为对照品No. 1-15 stand for samples;the rest stand for reference compound图3 鹅不食草TLC图(254 nm) Fig 3 TLC chromatogram of Centipeda minima(254 nm)
2.4 水分检查
取供试品粗粉3 g,共2份,按照《中华人民共和国药典》(2015年版)“通则0832 第一法”测定。共测定了10批不同产地鹅不食草的水分含量。结果显示,各产地鹅不食草的水分含量为8.86%~11.58%,平均值为10.45%,标准差为0.83%,RSD为7.9%,见表1。
2.5 浸出物测定
按《中华人民共和国药典》(2015年版)“通则2201”测定。取鹅不食草药材,粉碎,使其通过2号筛并混合均匀。
表1 15批鹅不食草样品水分和浸出物含量测定结果
Tab 1 Water content and extract yields of 15 batches of samples
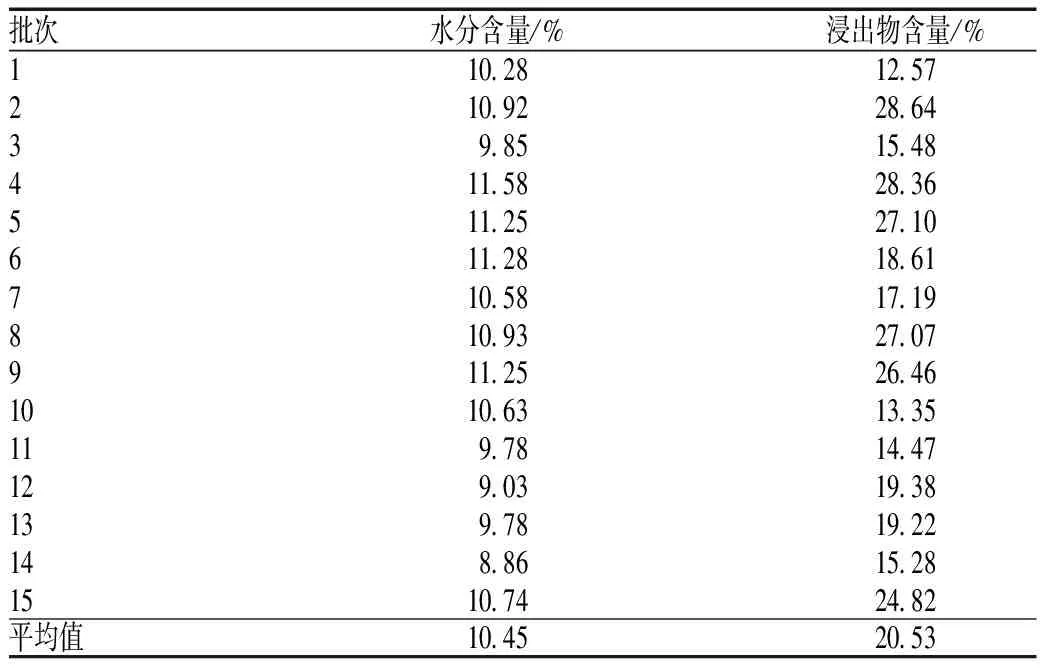
批次水分含量/%浸出物含量/%110 2812 57210 9228 6439 8515 48411 5828 36511 2527 10611 2818 61710 5817 19810 9327 07911 2526 461010 6313 35119 7814 47129 0319 38139 7819 22148 8615 281510 7424 82平均值10 4520 53
取药材中粉4 g,共2份,精密称定,置于250 ml锥形瓶中,精密加水100 ml,密塞,冷浸,前6 h内时时振摇,再静置18 h;用干燥滤器迅速滤过,精密量取续滤液20 ml,置于已干燥至恒质量的蒸发皿中,在水浴上蒸干后,于105 ℃干燥3 h,置于干燥器中冷却30 min,迅速精密称定质量。以干燥品计算供试药材中水溶性浸出物的含量。结果显示,各产地鹅不食草浸出物含量为12.57%~28.64%,平均值为20.53%,标准差为5.91%,RSD为28.8%,见表1。
2.6 鹅不食草中6-OAP含量的测定
2.6.1 色谱条件:色谱柱为Agilent C18(4.6 mm×20 mm,5 μm);流动相为水-乙腈(V∶V=60∶40);流速为1.0 ml/min;柱温为30 ℃;检测波长为230 nm;进样量为10 μl;理论塔板数按6-OAP计应≥8 000。此条件下6-OAP与其他成分可达到基线分离,见图4。
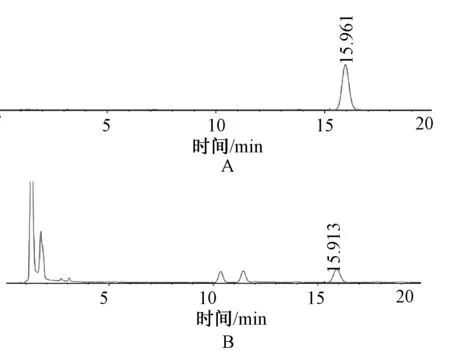
A. 对照品;B.鹅不食草A.Reference compound;B.Centipeda minima图4 高效液相色谱图Fig 4 HPLC chromatograms
2.6.2 对照品溶液制备:取于五氧化二磷容器中减压干燥至恒质量的6-OAP对照品适量,精密称定,加甲醇制成每1 ml含0.2 mg的溶液,即得。
2.6.3 供试品溶液制备:取鹅不食草药材粉碎过4号筛,混匀,取约1.5 g,精密称定,置于250 ml锥形瓶中,加入甲醇50 ml,称质量,水浴加热回流30 min,放冷,用甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.6.4 线性关系考察:精密称量对照品适量,加甲醇配制成质量浓度分别为0.803 000、0.401 500、0.200 750、0.040 150、0.020 075 mg/ml的溶液。吸取上述对照品溶液各10 μl注入高效液相色谱仪,按照上述色谱条件进行测定。以对照品峰面积(Y)为纵坐标,以进样量(μg)为横坐标(X)绘制标准曲线,得线性回归方程为:Y=1 978.6X+86.262,r2=0.999 9。结果显示,6-OAP在0.200 75~8.030 00 μg范围内呈良好的线性关系。
2.6.5 精密度试验:取同一供试品溶液,按照上述色谱条件连续进样6次,记录色谱峰面积。结果显示,6-OAP的色谱峰面积的RSD为0.56%,表明精密度良好。
2.6.6 稳定性试验:取同一供试品溶液(2号样品),分别于制备后0、3、6、9、12、15、18、21、24 h进样测定,记录峰面积,计算峰面积的RSD。结果显示,12 h内峰面积的RSD为0.66%,24 h内为6.06%,而15 h测定的峰面积与之前测定的峰面积差异较大,RSD>2%,表明在12 h内供试品溶液的稳定性良好。
2.6.7 重复性试验和范围测定:取同一批样品粉末(2号样品)1.0、1.5、2.0 g各3份,精密称定,分别按照“2.6.3”项下方法制备供试品溶液。按照上述色谱条件进行6-OAP含量测定,结果显示,其平均含量为0.24%,RSD为0.4%,表明方法重复性良好,且样品量在1.0~2.0 g间能按上述方法提取充分,故可采用1.5 g样品作为药材的称定质量。
2.6.8 加样回收率试验:取已知含量的样品粉末(2号样品)6份,各0.75 g,精密称定。分别加入1.6 mg/ml的对照品溶液1 ml,按照“2.6.3”项下操作,并按上述色谱条件进行测定,计算加样回收率。结果显示,6-OAP的平均回收率为103.0%,RSD为1.17%,见表2。
表2 6-OAP加样回收率测定(n=6)
Tab 2 Recovery test of 6-OAP(n=6)
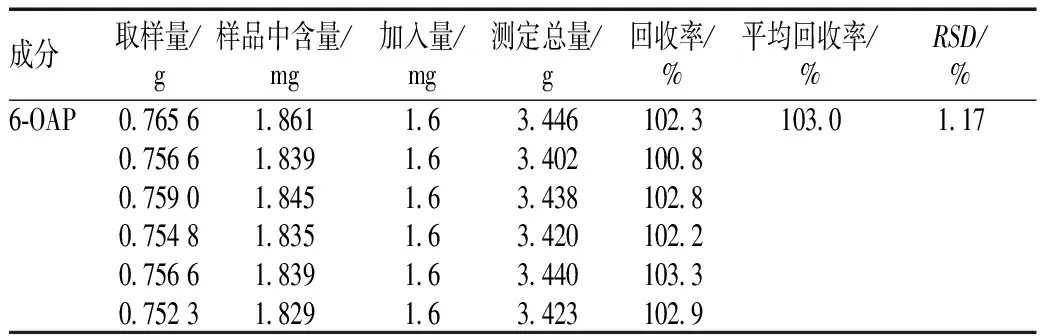
成分取样量/g样品中含量/mg加入量/mg测定总量/g回收率/%平均回收率/%RSD/%6⁃OAP0 76561 8611 63 446102 3103 01 170 75661 8391 63 402100 80 75901 8451 63 438102 80 75481 8351 63 420102 20 75661 8391 63 440103 30 75231 8291 63 423102 9
2.6.9 检测限和定量限:精密量取已知浓度的对照品溶液,用甲醇依次稀释制成浓度由高至低的溶液,测得6-OAP的检测限(信噪比为3)为0.003 9 μg,定量限(信噪比为10)为 0.013 μg。
2.6.10 耐用性试验:本研究考察了2根不同长度的色谱柱Agilent C18(4.6 mm×25 mm,5 μm)、Agilent C18(4.6 mm×20 mm,5 μm)对供试品溶液中6-OAP的分离效果;也考察了采用同一根色谱柱Agilent C18(4.6 mm×20 mm,5 μm),在分别改变柱温(25、30、35 ℃)和流速(0.8、1.0、1.2 ml/min)的情况下,对供试品溶液中6-OAP的分离效果。结果显示,在上述各种条件下6-OAP均能得到很好的分离,表明本方法对上述因素的耐用性良好。
2.6.11 样品测定:分别取鹅不食草样品粉末1.5 g,精密称定,按“2.6.3”项下操作,制成供试品溶液。分别精密吸取对照品溶液和供试品溶液各10 μl,注入液相色谱仪,测定,按干燥品计算6-OAP的含量,结果见表3。
3 讨论
鹅不食草属于冷僻药材,迄今《中华人民共和国药典》对其的质量控制尚不完善。由于鹅不食草是古今治疗鼻炎、头风方剂的主要组成药味之一,加上近年来关于鹅不食草抗肿瘤的研究方兴未艾,因此,有必要完善或提高该药材的质量标准,以利于以该药材为组成的中成药的开发和质量控制。本研究关于鹅不食草的显微鉴别比较特征与《中华人民共和国药典》相一致。但关于浸出物的含量,《中华人民共和国药典》(2010、2015年版)规定均不得<15%,本研究按照《中华人民共和国药典》相同的方法,却发现各产地间鹅不食草浸出物含量的差异较大,为12.57%~28.64%,平均含量为20.53%,按照《中华人民共和国药典》规定,部分产地的鹅不食草药材仅凭此项可能就不符合法定标准要求。本研究以对照药材为参考对各产地鹅不食草药材进行了鉴别,可见其TLC指纹特征趋于一致,具有明显的鉴别意义。鉴于以有效成分为指标的TLC鉴别对于药材质量控制的重要性,本研究在长期关于鹅不食草药效物质研究的基础上,增加了以6-OAP为指标的TLC鉴别,由于该对照品在10%硫酸乙醇试剂喷洒后加热,显色不明显,因此采用了波长254 nm检识,方法简单可行,建议可作为《中华人民共和国药典》(2015年版)关于鹅不食草药材的质量标准提升。基于对6-OAP抗肿瘤作用及其作用机制研究的深入性,以其为主要有效成分进行含量测定具有重要意义。从不同产地的15批鹅不食草药材的测定结果可见,6-OAP在药材中的含量普遍>0.1%,以云南、四川、浙江、江西、安徽、江苏等省所产鹅不食草中6-OAP的含量为高,>0.2%,平均含量为0.21%。为兼顾鹅不食草药材的市场供应及药材的优质性,以平均含量下浮50%,规定按干燥品计算,鹅不食草中6-OAP的含量不得<0.105%,建议此限量可用于提升《中华人民共和国药典》(2015年版)中鹅不食草的质量标准。以此含量限度来看,本研究所测定的各产地鹅不食草药材均符合要求,但这一结论与以浸出物含量为指标得出的判断有所矛盾。鉴于主要有效成分(“偏性物质”)控制的重要性,加上浸出物的测定方法是以水为溶剂,可能对鹅不食草中低极性成分的溶出相对有限。因此,关于鹅不食草的质量标准,当分别以有效成分和浸出物含量为指标得出的结论有出入时,建议以有效成分含量所推荐的药材优质性为主,或重新考虑浸出物含量的标准修订。
表3 15批鹅不食草6-OAP含量测定结果(%)
Tab 3 Content determination of 6-OAP inCentipedaminima(%)

批次产地6⁃OAP含量1江苏省淮安市盱眙县仇集镇明0 132云南省昭通市巧家县巧家营0 273广西省南宁市西乡塘区坛洛镇0 204云南省景洪市勐养镇0 195云南省玉溪市元江县县城江边0 186广西省南宁市武鸣县大明山0 217广西省桂林市荔浦县0 128云南省昭通市盐津县0 229云南省玉溪市新平县磨盘山0 2310四川省峨眉山市峨山镇0 2211浙江省0 1812浙江省0 3213江西省0 2314安徽省0 2215江苏省0 30
[1]姚光弼.临床肝脏病学[M].上海:上海科学技术出版社,2004:550.
[2]Liang H,Bao F,Dong X,et al.Antibacterial thymol derivatives Isolated fromCentipedaminima[J].Molecules,2007,12(8):1606-1613.
[3]朱艳平.鹅不食草化学成分及抗肿瘤活性研究[D].武汉:湖北中医药大学,2012.
[4]林远灿,高明.鹅不食草的化学成分及药理研究进展[J].浙江中医药大学学报,2011,35(2):303-304.
[5]曹俊岭,李国辉.鹅不食草化学成分研究[J].中国中药杂志,2012,37(15):2301-2303.
[6]吴凌莉,刘扬,陈美红,等.鹅不食草的化学成分研究[J].中南药学,2016,14(4):351-354.
[7]周娇娇,毕志明,黄炎,等.鹅不食草的化学成分[J].药学与临床研究,2013,21(2):133-134.
[8]杨艳芳,张炳武,闫斌,等.鹅不食草正丁醇部位化学成分研究[J].时珍国医国药,2013,24(10):2358-2359.
[9]吴和珍,刘玉艳,杨艳芳,等.鹅不食草醋酸乙酯部位化学成分的研究[J].时珍国医国药,2010,21(5):1096-1098.
[10] 刘宇,杨艳芳,刘红兵,等.鹅不食草的化学成分及生物活性研究进展[J].湖北中医杂志,2005,27(5):52-53.
[11] 郭育卿.中药鹅不食草提取物对人鼻咽癌细胞CNE-1增殖抑制和凋亡诱导作用的研究[D].北京:北京协和医学院,2013.
[12] 张舒娜,张亚玉.鹅不食草的临床应用及药理研究进展[J].吉林农业,2015(19):76-77.
[13] Taylor RS,Towers GH.Antibacterial constituents of the Nepalese medicinal herb,Centipedaminima[J].Phytochemistry,1998,47(4):631-634.
[14] Liang HX,Bao FK,Dong XP,et al.Two new antibacterial sesquiterpenoids fromCentipedaminima[J].Chem Biodiver,2007,4(12):2810-2816.
[15] Liu YQ,Wang XL,Cheng X,et al.Skp1 in lung cancer:clinical significance and therapeutic efficacy of its small molecule inhibitors[J].Oncotarget,2015,6(33):34953-34967.
[16] Liu Y,Chen XQ,Liang HX,et al.Small compound 6-O-angeloylplenolin induces mitotic arrest and exhibits therapeutic potential in multiple myeloma[J].PLoS One,2011,6(7):e21930.
Quality Study onCentipedaMinimaΔ
ZHANG Ziqiang1,2,3, TIAN Lei2, QIU Bin4, YANG Yeting1, ZHOU Zhihong1, CHENG Yongxian2, ZHANG Wenjie3
(1.Traditional Chinese Medicine College, Yunnan Traditional Chinese Medicine College,Yunnan Kunming 650500, China; 2.Kunming Institute of Botany, Chinese Academy of Sciences, Plant Chemistry and National Key Laboratory of Plant Resources Sustainable Utilization in Western,Yunnan Kunming 650201, China; 3.Chinese Traditional Medicines Division, Yunnan Institute for Food and Drug Control,Yunnan Kunming 650011, China; 4.Natural Medicine Resources Research Division, Yunnan Institute of Medicine,Yunnan Kunming 650111, China)
OBJECTIVE:By reference to the relevant methods of appendix of Chinese Pharmacopoeia, the quality standard ofCentipedaminimafrom all over the country would be improved, so as to perfect the quality standard ofCentipedaminimain Chinese Pharmacopoeia. METHODS: The character and microscopic features ofCentipedaminimawere studied, and the water content and extract yield were determined. By reference to the standard crude drugs and the major components of 6-O-angeloylplenolin (6-OAP) that associated with medicinal efficacy, TLC method was adopted to conduct the qualitative discrimination; to set 6-OAP as indicators, HPLC method was adopted to conduct the content determination. RESULTS: The microscopic features ofCentipedaminimawere significant; and TLC spots were clear, the linear ranges of 6-O-angeloylplenolin was 0.200 75-8.030 00 μg(r=0.999 9). The average recovery was 103%. The quantity of 6-O-angeloylplenolin was 0.13%-0.32%(average 0.21%). CONCLUSIONS: The method developed in this study are simple and easy to conduct, which could be used to better the quality control ofCentipedaminima.
Quality standard;Centipedaminima; Content determination; 6-O-angeloylplenolin
中国科学院重点部署项目(No.KSZD-EW-Z-004-03-3)
R927
A
1672-2124(2016)11-1462-05
2016-06-29)
*硕士研究生。研究方向:中药质量标准与控制。E-mail:811010297@qq.com
#通信作者1:博士,研究员。研究方向:中药药效物质研究。E-mail:yxcheng@mail.kib.ac.cn
#通信作者2:主任药师。研究方向:药品检验。E-mail:782190409@qq.com
DOI 10.14009/j.issn.1672-2124.2016.11.006

