不同蛋白质源饲料中添加α-酮戊二酸对杂交鲟幼鱼肝脏谷氨酰胺含量、抗氧化能力及生长激素、胰岛素样生长因子-Ⅰ基因表达的影响
王连生 徐奇友 陈 迪,2 郑荣宁
(1.中国水产科学研究院黑龙江水产研究所,哈尔滨150070;2.上海海洋大学水产与生命学院,上海201306;3.连云港金陵饲料有限公司,连云港222313)
不同蛋白质源饲料中添加α-酮戊二酸对杂交鲟幼鱼肝脏谷氨酰胺含量、抗氧化能力及生长激素、胰岛素样生长因子-Ⅰ基因表达的影响
王连生1徐奇友1陈 迪1,2郑荣宁3
(1.中国水产科学研究院黑龙江水产研究所,哈尔滨150070;2.上海海洋大学水产与生命学院,上海201306;3.连云港金陵饲料有限公司,连云港222313)

杂交鲟幼鱼;α-酮戊二酸;谷氨酰胺;抗氧化;生长激素基因;胰岛素样生长因子-Ⅰ基因

α-酮戊二酸(α-ketoglutarate,AKG)作为Gln的前体物质,是三羧酸循环的中间代谢产物,可以与氨结合生成谷氨酸和Gln。AKG能有效促进机体氮代谢,可以降低铵离子对机体的毒性[8]。AKG可以激活雷帕霉素靶蛋白信号通路,进而促进肠道上皮细胞蛋白质沉积[9]。鲤鱼饲料中添加AKG能显著提高谷氨酰胺酶(GS)基因的表达量,进而提高机体Gln的含量[10]。本实验室前期研究了AKG对杂交鲟和松浦镜鲤生长、氨氮应激、肠道健康及抗氧化功能的影响,在不同饲料原料、不同饲料蛋白质水平条件下均具有促进生长的作用,在氨氮应激条件下可以通过提高热应激蛋白减缓应激作用,同时具有改善肠道形态、提高抗氧化能力的作用[11-15]。肝脏是机体氨基酸代谢的主要场所,本试验拟在不同蛋白质源饲料中添加AKG,研究AKG对杂交鲟幼鱼肝脏功能的影响,并进一步研究AKG对肝脏中生长相关基因生长激素(GH)和胰岛素样生长因子-Ⅰ(IGF-Ⅰ)基因表达的影响,为Gln在杂交鲟饲料中的应用进一步提供理论依据。
1 材料与方法
1.1 试验材料
杂交鲟幼鱼购自北京房山鲟鱼养殖基地。AKG购自Sigma-Aldrich公司,纯度≥98.5%。
1.2 试验饲料
分别以大豆浓缩蛋白(SPC)和SPC+鱼粉(FM,进口)为蛋白质源,并在此基础上分别添加0和1%的AKG,配制蛋白质水平均为44%的4种试验饲料,试验饲料组成及营养水平见表1。各组原料经粉碎,过40目筛,逐级混匀,制成粒径为2.0 mm的颗粒饲料,室温条件下通风干燥后,在-20 ℃冰柜存放。
1.3 试验分组及饲养管理
试验用杂交鲟幼鱼用食盐水(5%)消毒后暂养2周。挑选健康、大小均一、平均体重为(7.65±0.04) g的试验鱼500尾,随机分为4组,每组5个重复,每个重复25鱼。养殖水环境条件为温度(21.2±1.0) ℃,溶氧浓度大于5 mg/L,pH 7.8,自然光照。试验期间每天投喂3次,投喂时间分别为08:00、13:00和17:00,每次饱食投喂,投喂量约为鱼体重的5%,每天投喂后吸取残饵和粪便,定期检测水质,每天换去水族箱内1/3水并注入已曝气的水,确保水质良好,养殖周期为8周。

表1 试验饲料组成及营养水平(风干基础)

续表1项目Items试验饲料Experimentaldiets1234食盐NaCl0.500.50合计Total100.00100.00100.00100.00营养水平Nutrientlevels粗蛋白质CP44.0544.2944.2844.04粗脂肪EE15.9715.4316.4416.33
预混料为每千克饲料提供The premix provided the following per kg of diets:VA 8 000 IU,VE 70 mg,硫胺素 thiamine 18 mg,VB235 mg,VB618 mg,泛酸 pantothenic acid 50 mg,烟酸 niacin 200 mg,生物素 biotin 2.5 mg,VB120.6 mg,叶酸 folic acid 6 mg,肌醇 inositol 1 000 mg,胆碱 choline 5 000 mg,VC 500 mg,VD32 000 IU,VK 7 mg,Zn 65 mg,Fe 75 mg,Cu 3.5 mg,Mn 16 mg,I 0.65 mg,Co 0.1 mg,Se 0.1 mg。
1.4 样品采集与分析
养殖试验结束后,饥饿24 h,从每个重复随机取4尾鱼,用麻醉剂间氨基苯甲酸乙酯甲磺酸盐(MS-222)麻醉后取其肝脏,按质量(g)与体积(mL)比为1∶9加入预冷的生理盐水,然后用FJ-200CL高速组织匀浆机匀浆(15 000 r/min,3 min)稀释,在4 ℃下以4 000 r/min离心10 min,取上清液放入1.5 mL离心管中,保存于冰箱(-40 ℃)中,用于Gln含量、CS活性、碱性磷酸酶(ALP)活性及抗氧化指标分析。采用南京建成生物工程研究所生产的试剂盒测定Gln含量、CS活性、ALP活性、还原型谷胱甘肽(GSH)含量、超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性及丙二醛(MDA)含量,具体方法参见试剂盒说明书。
每个重复另随机取3尾鱼的肝脏,包裹在锡箔纸中,迅速投入到液氮中,使其迅速冷冻,然后置于-80 ℃冰箱中储存,用于肝脏中GH、IGF-Ⅰ基因相对表达量的测定。肝脏总RNA的提取根据总RNA提取试剂盒SV total RNA Isolation System (Promega)说明书进行。cDNA用反转录试剂盒进行反转录,步骤见PrimeScriptTMRT Reagent Kit with gDNA Eraser (Perfect Real Time)说明书,结束后于-20 ℃条件下保存备用。利用Primer premier 5.0引物设计软件,根据鲟鱼类GH、IGF-Ⅰ mRNA的基因序列,设计GH、IGF-Ⅰ的引物,IGF-Ⅰ:5′-TCATCGCCCTGACAGTCTACAT-3′(F),5′-GGTCGCCTGCTGAAATAAAAG-3′(R);GH:5′-AGATGAGCAGCGTCACTCCAGC-3′(F),5′-AGAGCCACAATACCTTCCTCCA-3′(R);18S rRNA:5′-CCGCTTTGGTGACTCTGGAT-3′(F),5′-CTTGGATGTGGTAGCCGTTTC-3′(R)。所有引物由生工生物工程(上海)公司合成。采用Aapplied Biosystems 7500 Real-Time PCR System检测各组GH、IGF-ⅠmRNA的实时表达量,PCR反应体系为20 μL。采用2-ΔΔCT法计算各基因的相对表达量,数据取3次重复的平均值。
1.5 数据分析
数据采用SPSS 19.0软件进行数据分析,以蛋白质源和AKG添加量为影响因素,采用双因素方差分析,显著性水平为P<0.05,试验结果以平均值±标准差表示。
2 结 果
2.1 不同蛋白质源饲料中添加AKG对杂交鲟幼鱼肝脏Gln含量、GS活性和ALP活性的影响
不同蛋白质源饲料中添加AKG对杂交鲟幼鱼肝脏Gln含量、GS活性和ALP活性的影响见表2。双因素方差分析表明:AKG添加量显著影响肝脏Gln含量和GS活性(P<0.05),饲料中添加1% AKG显著提高肝脏Gln含量和GS活性(P<0.05),对ALP活性无显著影响(P>0.05)。蛋白质源对肝脏Gln含量、GS活性和ALP活性无显著影响(P>0.05),蛋白质源和AKG添加量对肝脏Gln含量、GS活性和ALP活性无显著交互作用(P>0.05)。
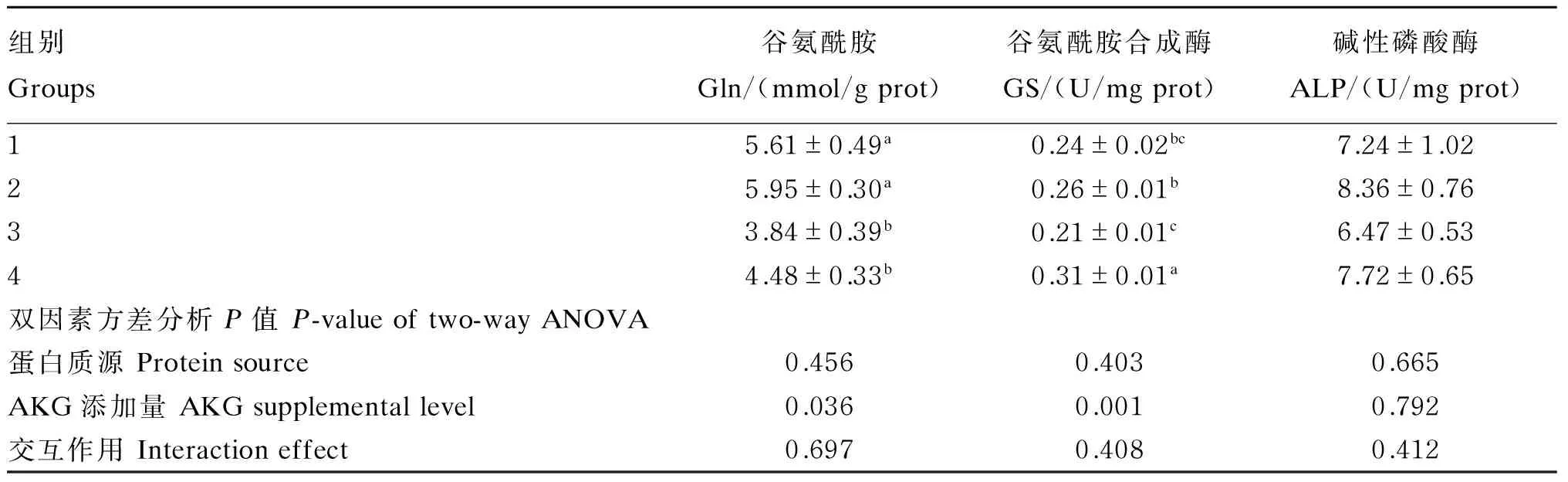
表2 不同蛋白质源饲料中添加AKG对杂交鲟幼鱼肝脏Gln含量、GS活性和ALP活性的影响
同列数据肩标无字母或相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05)。下表同。
In the same column, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different letter superscripts mean significant difference (P<0.05). The same as below.
2.2 不同蛋白质源饲料中添加AKG对杂交鲟幼鱼肝脏抗氧化指标的影响
不同蛋白质源饲料中添加AKG对杂交鲟幼鱼肝脏抗氧化指标的影响见表3。双因素方差分析表明:AKG添加量显著影响肝脏MDA、GSH含量(P<0.05),饲料中添加1% AKG显著降低肝脏MDA含量(P<0.05),显著提高肝脏GSH含量(P<0.05)。蛋白质源显著影响肝脏GSH含量(P<0.05),与SPC+FM作为蛋白质源相比,SPC作为蛋白质源显著提高肝脏GSH含量(P<0.05)。蛋白质源和AKG添加量对肝脏SOD和CAT活性均无显著影响(P>0.05),且蛋白质源和AKG添加量对肝脏各抗氧化指标无显著交互作用(P>0.05)。
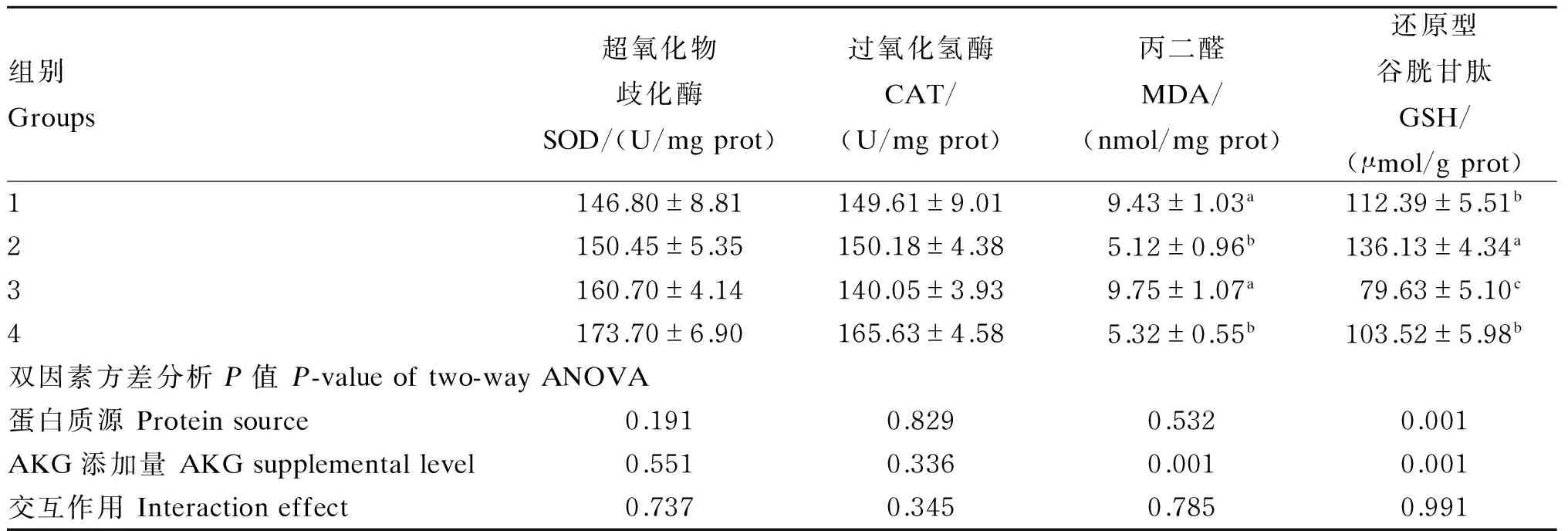
表3 不同蛋白质源饲料中添加AKG对杂交鲟幼鱼肝脏抗氧化指标的影响
2.3 不同蛋白质源饲料中添加AKG对杂交鲟幼鱼肝脏IGF-Ⅰ、GH基因表达的影响
各组杂交鲟幼鱼肝脏IGF-Ⅰ、GH基因的相对表达量见表4。双因素方差分析表明:AKG添加量显著影响肝脏IGF-Ⅰ、GH基因的相对表达量(P<0.05),饲料中添加1% AKG显著提高肝脏IGF-Ⅰ、GH基因的相对表达量(P<0.05)。蛋白质源显著影响肝脏IGF-Ⅰ、GH基因的相对表达量(P<0.05),与SPC+FM作为蛋白质源相比,SPC作为蛋白质源显著提高肝脏IGF-Ⅰ和GH基因的相对表达量(P<0.05)。蛋白质源和AKG添加量对肝脏IGF-Ⅰ、GH基因的相对表达量无显著交互作用(P>0.05)。

表4 不同蛋白质源饲料中添加AKG对杂交鲟幼鱼肝脏IGF-Ⅰ、GH基因相对表达量的影响
3 讨 论
3.1 不同蛋白质源饲料中添加AKG对杂交鲟幼鱼肝脏Gln含量、GS活性和ALP活性的影响

3.2 不同蛋白质源饲料中添加AKG对杂交鲟幼鱼肝脏抗氧化能力的影响
机体抗氧化系统由抗氧化酶系统和非酶抗氧化系统组成。抗氧化酶系统主要包括SOD、谷胱甘肽过氧化物还原酶(GSH-Px)、CAT等,非酶抗氧化系统主要包括GSH、维生素E、维生素C等[18]。动物组织里的MDA能使核酸、蛋白质和脑磷脂发生交联而丧失活性。因此,MDA含量的测定对机体脂质氧化程度有很好的指示作用,而且可以间接地反映出机体细胞组织受损伤程度[19]。GSH主要起到维持机体氧化平衡的作用,是抵抗活性氧损害的主要物质,能够综合反映组织细胞抗氧化应激能力及受氧化损伤程度[20]。AKG作为机体内重要的活性物质,除了参与三羧酸循环外,还参与机体内多种生理生化过程。AKG作为一种抗氧化剂,在机体活性氧自由基清除方面发挥重要作用[21]。体外试验研究表明,AKG可以抑制过氧化氢对人红细胞或神经元诱导的氧化应激[22-23]。在氨氮应激条件下,饲料中添加AKG能显著提高杂交鲟机体SOD、GSH-Px、CAT活性,且降低MDA含量[12]。对大鼠的研究同样表明AKG能提高机体SOD和CAT的活性,其主要是原因由于AKG促进机体脂肪代谢,抑制氧自由基的产生[8],这与本试验研究结果一致。此外,本试验中,饲料中添加1% AKG可提高杂交鲟肝脏中Gln的含量,而Gln可以显著提高杂交鲟的抗氧化酶活性[24]。
3.3 不同蛋白质源饲料中添加AKG对杂交鲟幼鱼肝脏IGF-Ⅰ和GH基因表达的影响
GH对促进动物的生长发育起决定性的作用。GH是通过由垂体分泌的生长因子刺激合成并释放出IGF-Ⅰ作用于靶细胞进而促进机体的生长[25]。IGF-Ⅰ主要由生长因子作用于肝脏,在肝脏的循环代谢中产生的,在机体的生长发育、免疫功能、骨骼增长以及繁殖方面都有积极的促进作用。仔猪血液中IGF-Ⅰ的水平和体重的增长呈正相关趋势[26-27]。有研究表明,AKG摄入到人类体内明显地提高了血浆中一些激素的水平,例如胰岛素、GH和IGF-Ⅰ等[28]。断奶仔猪饲粮中添加AKG能有效改善脂多糖对血清中IGF-Ⅰ水平产生的负面影响[29]。这些研究结果都表明IGF-Ⅰ在机体的生长方面起着积极的促进作用。另有研究表明,IGF-Ⅰ与GH对生长的促进功能具有协同作用[30]。本试验研究表明,1% AKG的添加显著提高了肝脏中IGF-Ⅰ和GH基因的相对表达量,进而促进机体的生长。
4 结 论
杂交鲟幼鱼饲料中添加1% AKG可以通过提高肝脏中GS的活性进而提高Gln的含量,通过提高肝脏中GSH的含量进而降低MDA的含量,并可提高肝脏中生长相关基因GH、IGF-Ⅰ的表达。
[1] NEU J,SHENOY V,CHAKRABARTI R.Glutamine nutrition and metabolism:where do we go from here?[J].The FASEB Journal,1996,10(8):829-837.
[2] WU G Y,BAZER F W,DAVIS T A,et al.Important roles for the arginine family of amino acids in swine nutrition and production[J].Livestock Science,2007,112(1/2):8-22.
[3] LIN Y,XIAO Q Z.Dietary glutamine supplementation improves structure and function of intestine of juvenile Jian carp (Cyprinuscarpiovar. Jian)[J].Aquaculture,2006,256(1/2/3/4):389-394.

[5] CHENG Z Y,BUENTELLO J A,GATLIN Ⅲ D M.Effects of dietary arginine and glutamine on growth performance,immune responses and intestinal structure of red drum,Sciaenopsocellatus[J].Aquaculture,2011,319(1/2):247-252.
[6] CHENG Z Y,GATLIN Ⅲ D M,BUENTELLO A.Dietary supplementation of arginine and/or glutamine influences growth performance,immune responses and intestinal morphology of hybrid striped bass (Moronechrysops×Moronesaxatilis)[J].Aquaculture,2012,362-363:39-43.
[7] AUSSEL C,COUDRAY-LUCAS C,LASNIER E,et al.α-ketoglutarate uptake in human fibroblasts[J].Cell Biology International,1996,20(5):359-363.
[8] VELVIZHI S,DAKSHAYANI K B,SUBRAMANIAN P.Effects of α-ketoglutarate on antioxidants and lipid peroxidation products in rats treated with ammonium acetate[J].Nutrition,2002,18(9):747-750.
[9] YAO K,YIN Y L,LI X L,et al.Alpha-ketoglutarate inhibits glutamine degradation and enhances protein synthesis in intestinal porcine epithelial cells[J].Amino Acids,2012,42(6):2491-2500.
[10] DONG X L,WEI Y Y,YU J,et al.Glutamine precursor supplementation increases glutamine synthetase gene expression in intestine of common carp (Cyprinuscarpio)[J].AquacultureResearch,2014,45(9):1559-1566.


[13] 宋芳杰,王连生,徐奇友.谷氨酰胺及其前体物对松浦镜鲤组织抗氧化能力及血清生化指标的影响[J].动物营养学报,2016,28(2):627-634.
[14] 魏玉强,徐奇友,位莹莹,等.不同蛋白源饲料中添加α-酮戊二酸对松浦镜鲤肌肉成分、血清氨基酸和生化指标的影响[J].东北农业大学学报,2015,46(1):94-100.
[15] 陈迪,王连生,徐奇友.α-酮戊二酸对杂交鲟肠道形态、消化酶活力和抗氧化能力的影响[J].大连海洋大学学报,2015,30(4):363-368.
[16] HAGHIGHAT N,MCCANDLESS D W.Effect of ammonium chloride on energy metabolism of astrocytes and C6-glioma cellsinvitro[J].Metabolic Brain Disease,1997,12:287-298.
[17] WALSH P J,MAYER G D,MEDINA M,et al.A second glutamine synthetase gene with expression in the gills of the Gulf toadfish (Opsanusbeta)[J].Journal of Experimental Biology,2003,206(9):1523-1533.
[18] 赵晶,康世良.健康仔猪口服亚硒酸钠后血液硒浓度与抗氧化系统动态变化规律的研究[J].畜牧兽医学报,2003,34(6):554-557.
[19] 李源,温安祥,骆美琳.谷氨酰胺促泥鳅生长机理的初步研究[J].饲料工业,2014,35(2):37-43.
[20] 齐素萍,宫春凤,马哲,等.微波对急性胰腺炎大鼠氧自由基代谢功能的影响[J].中华物理医学与康复杂志,2004,26(2):77-80.
[21] MAILLOUX R J,SINGH R,BREWER G,et al.α-ketoglutarate dehydrogenase and glutamate dehydrogenase work in tandem to modulate the antioxidant α-ketoglutarate during oxidative stress inPseudomonasfluorescens[J].Journal of Bacteriology,2009,191(12):3804-3810.
[22] DESAGHER S,GLOWINSKI J,PRÉMONT J.Pyruvate protects neurons against hydrogen peroxide-induced toxicity[J].Journal of Neuroscience,1997,17(23):9060-9067.
[23] SOKOLOWSKA M,OLESZEK A,WODEK L.Protective effect of alpha-keto acids on the oxidative hemolysis[J].Polish Journal of Pharmacology,1999,51(5):429-434.

[25] 姚玉妮.牦牛IGF-Ⅰ基因及IGF-ⅠR基因多态性与生长发育性状关系的研究[D].硕士学位论文.兰州:甘肃农业大学,2008.
[26] OWENS P C,GATFORD K L,WALTON P E,et al.The relationship between endogenous insulin-like growth factors and growth in pigs[J].Journal of Animal Science,1999,77(8):2098-2103.
[27] LI J Q,CHEN Z M,LIU D W,et al.Genetic effects ofIGF-1 gene on the performance in Landrace×Lantang pig resource population[J].Acta Genetica Sinica,2003,30(9):835-839.
[28] MOUKARZEL A A,RICOUR C.Growth retardation in children receiving long-term total parenteral nutrition:effects of ornithine alpha-ketoglutarate[J].The American Journal of Clinical Nutrition,1994,60(3):408-413.
[29] 刘坚.α-酮戊二酸对脂多糖刺激仔猪生长性能和肠道结构与功能的影响及机理[D].武汉:武汉工业学院,2009.
[30] SIROTKIN A V,FLORKOVICOVI,MAKAREVICH A V,et al.Oxytocin mediates some effects of insulin-like growth factor-Ⅰ on porcine ovarian follicles[J].Journal of Reproduction and Development,2003,49(2):141-149.
Author, WANG Liansheng, assistant professor, E-mail: wangliansheng@hrfri.ac.cn
(责任编辑 菅景颖)
Effects of Dietary α-Ketoglutarate Supplementation on Liver Glutamine Content, Antioxidant Capacity and the Expressions of Growth Hormone and Insulin-Like Growth Factor Ⅰ Genes of Juvenile Hybrid Sturgeon Fed Different Protein Source Diets
WANG Liansheng1XU Qiyou1CHEN Di1,2ZHENG Rongning3
(1.HeilongjiangRiverFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Harbin150070,China; 2.CollegeofFisheriesandLifeScience,ShanghaiOceanUniversity,Shanghai201306,China; 3.LianyungangJinlingFeedCo.,Ltd.,Lianyungang222313,China)
The aim of this experiment was to study the effects of α-ketoglutarate (AKG) supplementation on liver glutamine (Gln) content, antioxidant capacity and the expressions of growth hormone (GH) and insulin-like growth factor Ⅰ (IGF-Ⅰ) genes of juvenile hybrid sturgeon fed different protein source diets. Four experimental diets were formulated using soybean protein concentrate (SPC) or SPC+fish meal (FM) as protein sources and with 0 or 1% AKG. A total of 500 juvenile hybird sturgeon with an average initial body weight of (7.65±0.04) g were randomly divided into 4 groups with 5 replicates per group and 25 fish per replicate. The experiment lasted for 8 weeks. The results showed that the supplementation of 1% AKG significantly increased the liver Gln content and glutamine synthetase(GS) activity (P<0.05), but had no significant effect on liver alkaline phosphatase (ALP) activity (P>0.05). Protein source had no significant effects on liver Gln content, GS activity and ALP activity (P>0.05), and the protein source and AKG supplemental level had no significant interaction effects on liver Gln content, GS activity and ALP activity (P>0.05). The supplementation of 1% AKG significantly decreased the content of liver malondialdehyde (MDA), and increased the content of liver glutathione (GSH) (P<0.05). Compared with the SPC+FM, SPC as the protein source significantly increased the content of liver GSH (P<0.05). Protein source and AKG supplemental level had no significant effects on liver superoxide dismutase (SOD) and catalase (CAT) activities (P>0.05), and protein source and AKG supplemental level had no significant interaction effects on all liver antioxidant indices (P>0.05). The supplementation of 1% AKG significantly increased the relative expression levels of liverIGF-Ⅰ andGHgenes (P<0.05). Compared with the SPC+FM, SPC as the protein source significantly increased the relative expression levels of liverIGF-Ⅰ andGHgenes (P<0.05). protein source and AKG supplemental level had no significant interaction effects on the relative expression levels of liverIGF-Ⅰ andGHgenes (P>0.05). In conclusion, the supplementation of 1% AKG in juvenile hybrid sturgeon diet increase the content of Gln by increasing the GS activity, reduce the content of MDA by increasing the content of GSH, and can improve the liver growth related geneIGF-Ⅰ andGHexpression.[ChineseJournalofAnimalNutrition, 2016, 28(12):3917-3924]
juvenile hybrid sturgeon; α-ketoglutarate; glutamine; antioxidation;GHgene;IGF-Ⅰ gene
10.3969/j.issn.1006-267x.2016.12.025
2016-05-31
黑龙江水产研究所基本科研业务费专项资金(HSY201408);国家公益性行业(农业)专项(201003055)
王连生(1984—),男,内蒙古丰镇人,助理研究员,博士,研究方向为水产动物营养与饲料科学。E-mail: wangliansheng@hrfri.ac.cn
S963
A
1006-267X(2016)12-3917-08

