依卡倍特钠对反流性食管炎大鼠食管黏膜的保护作用及可能机制
依卡倍特钠对反流性食管炎大鼠食管黏膜的保护作用及可能机制
目的:探讨依卡倍特钠(ES)对反流性食管炎大鼠食管黏膜病变的保护作用及其机制。方法:采用食管十二指肠吻合术建立大鼠RE模型,进行药物干预。HE染色检测各组大鼠食管黏膜损伤情况;ELISA检测各组大鼠血清炎症因子水平;Real-time PCR检测食管内TNFα、IL-1、Cox2 mRNA表达;Western blot检测食管内ERK及P38通路活化。结果:ES低、中、高浓度干预不同程度缓解了食管黏膜病变,降低血清中TNFα、IL-1β水平及食管中TNFα、IL-1、Cox2表达(P<0.05),抑制ERK及P38通路的异常活化(P<0.05)。结论:ES通过抑制MAPK信号通路抑制TNFα、IL-1、Cox2的表达,影响炎症因子的释放和炎症发生,从而缓解食管黏膜病变。
胃食管反流病(Gastroesophageal reflux disease, GERD)严重时可导致Barrett食管及食管癌[1]。反流性食管炎(Reflux esophagitis, RE)是胃食管反流病的一种。依卡倍特钠(Ecabet sodium,ES)作为一种胃黏膜保护剂,可以选择性的在胃黏膜损伤处形成保护层,改善内膜局部血流量,增强防御因子的作用,一直主要用于胃炎、胃溃疡的临床治疗[2],近年来开始进行RE治疗方面的应用。有研究指出其对大鼠RE具有缓解作用[3],但是具体分子机制尚未清楚。有报道指出,ES可能通过MAPK信号途径保护肠上皮细胞损伤[4]。因此,本文拟建立大鼠混合反流性食管炎及依卡倍特钠治疗模型,研究MAPK信号通路及相关细胞因子变化情况,观察ES对RE的治疗作用是否与该信号通路相关,以期寻找临床治疗RE的理想药物。
材料与方法
1 材 料
1.1 实验动物:健康8周龄SD雄性大鼠70只,体重约200 g,购买自辽宁长生生物技术有限公司。
1.2 实验仪器:微量移液器购自美国Eppendorf公司;离心机为美国Sigma公司产品;光学显微镜购自日本OLYMPUS;石蜡切片机购自德国Leica公司;电热恒温鼓风干燥箱购自上海精宏实验设备公司;电热恒温培养箱购自天津泰斯特公司;超纯水系统购自香港Heal Force公司。
1.3 实验试剂:奥美拉唑为广东逸舒制药有限公司产品;依卡倍特钠为天津田边制药有限公司产品;二甲苯、无水乙醇及曙红Y(醇溶)均为国药集团股份有限公司产品;苏木精为Solarbio公司产品;大鼠血清TNFα及IL-1β ELISA检测试剂盒为Boster公司产品;ERK、p-ERK、P38和p-P38抗体为沈阳万类生物科技有限公司产品。
2 方 法
2.1 大鼠混合反流性食管炎模型建立及药物干预:大鼠于实验前在动物房环境中适应3 d,随机分成对照组、假手术组、模型组、ES干预组(低、中、高剂量)及奥美拉唑(疗效对照)组,每组10只,除对照组和假手术组外,其余组均按食管十二指肠吻合术进行反流性食管炎建模。具体方法为:先予10 %水合氯醛麻醉大鼠,将大鼠仰卧位固定于手术台上,消毒后腹部正中切口,将食管下段分离,保留迷走神经,切断食管,胃贲门端作荷包缝合,将胃旷置,距幽门端约l cm处纵行切开十二指肠壁约0.4~0.5 cm,与食管下端行端侧吻合,然后逐层缝合腹部伤口。对照组不作任何处理,假手术组只开腹不做其他处理,15 min后逐层缝合腹部伤口。模型建立后0 d,ES干预组分别以20 mg/kg、50 mg/kg和100 mg/kg给予低、中、高浓度的依卡倍特钠灌胃,疗效对照组以20 mg/kg给予奥美拉唑灌胃,对照组、假手术组、模型对照组给予等体积蒸馏水,每天给药一次连续给药2周。
2.2 苏木精-伊红(HE)染色:各组固定后的食管组织标本,经常规脱水、透明、浸蜡,石蜡包埋,约5 μm厚连续切片,每组随意取10张切片用于HE染色,每组随意抽取5张切片于200倍光镜下观察并拍照。
2.3 ELISA检测血清中炎症因子TNFα、IL-1β的水平:处死各组大鼠后,取血,于室温下放置30 min左右待其凝固后,于离心机上3000 rpm离心10 min,取血清,参照说明书用TNFα及IL-1β ELISA检测试剂盒检测大鼠血清中TNFα、IL-1β的水平。
2.4 RT-PCR检测食管组织TNFα、IL-1、Cox2 mRNA表达水平:取食管组织,正常提取组织总RNA,行Real time PCR扩增,用β-actin做内参。取5 μl的PCR产物,电泳、染色、成像,用Quantity One软件行灰度分析,目的基因mRNA的表达值用基因产物与内参的灰度比值表示。
2.5 Western blot检测ERK、p-ERK、P38、p-P38的表达及磷酸化:取食管组织,正常提取蛋白质,化学发光法显色,对条带进行吸光度积分扫描。用β-actin做内参。采用目的蛋白吸光度值/内参吸光度值的比值进行比较。
结 果
1 各组大鼠食管粘膜损伤程度 食管组织连续切片HE染色结果显示,对照组大鼠食管未见明显的组织学病变。模型组大鼠食管可见鳞状上皮细胞增生,鳞状上皮的黏膜固有层乳头伸长,部分可见黏膜糜烂或溃疡形成。疗效对照组鳞状上皮未见增生,黏膜尚完整,未见明显糜烂、溃疡等病变,固有膜乳头缩短,固有膜内可见少许慢性炎细胞浸润。ES低浓度干预组大鼠食管黏膜部分区域仍可见糜烂,ES中浓度干预组大鼠的食管黏膜损伤有所改善,而高浓度ES干预组大鼠食管鳞状上皮未见明显细胞病变,黏膜较完整,未见糜烂、溃疡等病变,这与疗效对照组相似(图1)。
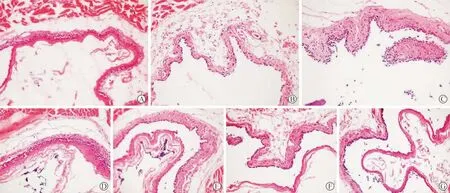
图1 各组大鼠食管粘膜病理形态学观察[HE染色;×200;对照组(A)、假手术组(B)、模型组(C)、低剂量ES干预组(D)、中剂量ES干预组(E)、高剂量ES干预组(F)和疗效对照组(G)]
2 各组大鼠血清TNFα、IL-1β炎症因子水平 模型组血清TNFα、IL-1β炎症因子明显高于正常对照组(P<0.001);对照组TNFα及IL-1β水平明显低于模型组(P<0.01);低浓度ES干预组TNFα的水平明显低于RE模型组(P<0.05),而IL-1β的水平与RE模型组无明显差异;中浓度及高浓度ES干预组TNFα、IL-1β的水平均明显低于RE模型组(P<0.05)。此外,高浓度的ES干预组TNFα的水平明显低于对照组(P<0.01),但IL-1β水平无明显差异(图2)。
3 各组大鼠食管组织TNFα、IL-1、Cox2 mRNA相对表达水平mRNA表达水平 模型组食管组织TNFα、IL-1、Cox2 mRNA表达明显高于对照组(P<0.001);低、中、高浓度ES干预组TNFα、IL-1和Cox2 mRNA的表达均明显低于模型组(P<0.05)。此外,疗效对照组TNFα、IL-1和Cox2 mRNA的表达均明显低于高浓度的ES干预组(P<0.001)(图3)。
4 各组大鼠食管组织ERK、p-ERK、P38、p-P38蛋白水平 模型组ERK的表达明显高于对照组(P<0.001),而P38的表达明显低于对照组(P<0.001),但是p-ERK和p-P38的表达都明显高于对照组(P<0.001)。对照组ERK及P38的表达明显高于对照组(P<0.05),但是其p-ERK和p-P38的表达都明显低于对照组(P<0.001)。中、低浓度ES干预组ERK的表达与模型组相比无明显差异,高浓度ES干预组ERK的表达明显低于模型组(P<0.05),但高、中、低浓度ES干预组p-ERK的表达均明显低于RE模型组(P<0.001);高、中、低浓度ES干预组P38的表达虽然都明显高于模型组(P<0.05或P<0.001),但其p-P38的表达均明显低于模型组(P<0.001)。这与疗效
对组大鼠食管中ERK、p-ERK、P38、p-P38蛋白的表达情况相似(图4)。

图2 各组大鼠血清TNFα、IL-1β炎症因子水平(与对照组相比,*P<0.05,**P<0.01,***P<0.001;与模型组相比,#P<0.05,##P<0.01,###P<0.001;与疗效对照组相比,&P<0.05,&&P<0.01)
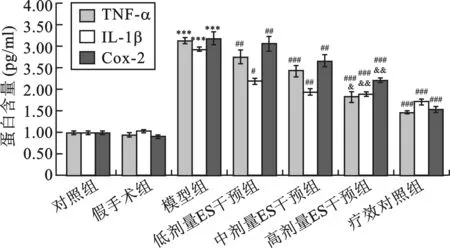
图3 各组大鼠食管组织TNFα、IL-1、Cox2 mRNA表达水平(与对照组相比,*P<0.05,**P<0.01,***P<0.001;与模型组相比,#P<0.05,##P<0.01,###P<0.001;与疗效对照组相比,&P<0.05,&&P<0.01)
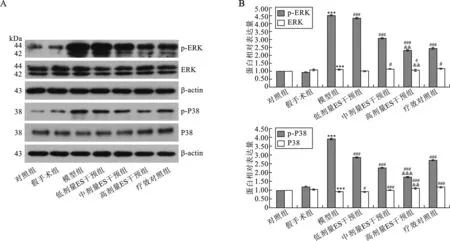
图4 各组大鼠食管组织ERK、p-ERK、P38、p-P38蛋白水平(与对照组相比,*P<0.05,**P<0.01,***P<0.001;与模型组相比,#P<0.05,##P<0.01,###P<0.001;与疗效对照组相比,&P<0.05,&&P<0.01)
讨 论
反流性食管炎(RE)容易长期、反复发作,能够并发溃疡、出血、穿孔以及Barrett食管等,严重者能够发展成食管腺癌,严重影响患者生活质量[5]。
依卡倍特钠(ES)是一种胃黏膜保护剂,主要用于胃炎、胃溃疡的临床治疗[2],近年来有研究指出其对大鼠RE具有缓解作用[3]。奥美拉唑是临床治疗RE的代表药物之一[6],因此选作疗效对照。为探究ES治疗RE的分子机制,本研究采用食管十二指肠吻合术建立大鼠RE模型,比较了ES干预前后各组大鼠食管黏膜的病理学变化。结果显示,与正常对照组相比,模型组呈现明显的食管黏膜炎症表现,说明食管十二指肠吻合术可成功建立大鼠RE模型;经ES干预治疗后,RE模型组上皮增生、糜烂和溃疡均有不同程度减轻。可见,ES对RE模型大鼠受损食管黏膜确有保护和修复作用。研究表明,多种促炎性细胞因子在RE的发生发展中发挥重要作用[7]。Ku等人[8]通过仙茅根茎提取物缓解RE大鼠食管损伤,同时降低了TNFα、IL-1及IL-6的表达。本实验结果显示,ES干预显著降低模型组大鼠血清及食管TNFα、IL-1水平,提示ES可能通过抑制TNFα、IL-1β等炎症因子的表达缓解RE模型中的食管损伤。环氧合酶-2(Cox2)与炎症性疾病的关系非常密切。Hayakawa等[9]的研究证实Cox2在反流性食管炎的致病机制中发挥重要作用。本实验中,ES干预显著降低模型组食管Cox2的升高,提示ES可通过抑制Cox2的表达减少炎症反应,从而缓解RE模型中的食管损伤。文献表明,抑制P38 MAPK信号通路的激活可以缓解RE大鼠的食管粘膜损伤[10],说明P38 MAPK信号通路可能参与RE的病理进程。在本实验中,ES干预能够显著抑制模型组大鼠ERK和P38的异常活化,提示ES可能通过抑制ERK和P38的磷酸化参与RE模型中的食管损伤修复。
综上,ES通过抑制MAPK信号通路影响TNFα、IL-1、Cox2的表达,进而抑制炎症因子的释放和炎性反应,缓解RE模型中的食管黏膜病变。本研究探讨了ES缓解RE食管损伤的分子机制,可为临床预防及治疗RE提供重要的理论依据及实验基础。
[1] Moore M,Afaneh C,Benhuri D,etal. Gastroesophageal reflux disease: A review of surgical decision making[J]. World J Gastrointest Surg,2016,8(1):77-83.
[2] Kim J Y,Bae H J,Choi J,etal. Efficacy of gastro-retentive forms of ecabet sodium in the treatment of gastric ulcer in rats[J]. Arch Pharm Res,2014,37(8):1053-62.
[3] Tsuboi K,Omura N,Yano F,etal. Effects of ecabet sodium on acute mixed reflux esophagitis in rats[J]. Scand J Gastroenterol,2009,44(12):1408-15.
[4] Sasaki K,Iizuka M,Konno S,etal. Ecabet sodium prevents the delay of wound repair in intestinal epithelial cells induced by hydrogen peroxide[J]. J Gastroenterol,2005,40(5):474-82.
[5] Abdel-Aziz H,Schneider M,Neuhuber W,etal. GPR84 and TREM-1 signaling contribute to the pathogenesis of reflux esophagitis[J]. Mol Med,2015.
[6] 杨 芳,柳玉强. 抗焦虑药联合质子泵抑制剂治疗胃食管反流病80例[J]. 陕西医学杂志,2015,44(4):487-488.
[7] Fitzgerald R C,Abdalla S,Onwuegbusi B A,etal. Inflammatory gradient in Barrett's oesophagus: implications for disease complications[J]. Gut,2002,51(3):316-22.
[8] Ku S K,Kim J S,Seo Y B,etal. Effect of Curculigo orchioides on reflux esophagitis by suppressing proinflammatory cytokines[J]. Am J Chin Med,2012,40(6):1241-55.
[9] Hayakawa T,Fujiwara Y,Hamaguchi M,etal. Roles of cyclooxygenase 2 and microsomal prostaglandin E synthase 1 in rat acid reflux oesophagitis[J]. Gut,2006,55(4):450-6.
[10] Zhang L,Liu G,Han X,etal. Inhibition of p38 MAPK activation attenuates esophageal mucosal damage in a chronic model of reflux esophagitis[J]. Neurogastroenterol Motil,2015,27(11):1648-56.
(收稿:2016-03-18)
中国医科大学附属第一医院(沈阳 110001) 杨 柳 孙明军 黄玉红△
Esophageal mucosa protective effects and its mechanism of Ecabet sodium in rat reflux esophagitis
The First Hospital of China Medical University(Shenyang 110001) Yang Liu Sun Mingjun Huang Yuhong
Objective: To inquire into the esophageal mucosa protective effects of Ecabet sodium(ES) in rat reflux esophagitis (RE) and its possible mechanism. Methods: The operation of end-to-side anastomosis of the esophagus and duodenum was performed to establish rat RE model. Esophageal mucosa lesion was examined by HE stain. The level of TNFα and IL-1β in sera was determined by ELISA. The level of TNFα, IL-1 and Cox2 in esophageal tissues were detected by Real-time PCR. The activation of ERK and P38 was detected by western blot. Results: Low, middle and high concentration ES intervention showed different levels of alleviation of esophageal mucosa disease, decreased the level of TNFα and IL-1β in serum and TNFα, IL-1, Cox2 in esophagus (P<0.05). Otherwise, ES inhibited the abnormality activation of ERK and P38(P<0.05). Conclusion: By inhibiting the MAPK signaling pathways and suppress the expression of TNFα, IL-1 and Cox2, ES thereby inhibits the release of inflammatory cytokines and inflammation, and as a result reduces esophageal mucosal lesions in RE model.
Ecabet sodium Reflux Esophagitis/drug therapy Demullents/pharmacology Gastroesophageal reflux @MAPK signaling pathway Rats
食管炎/药物疗法 黏膜保护剂/药理学 胃食管反流 @MAPK信号通路 大鼠
R392.5
A
10.3969/j.issn.1000-7377.2016.11.004
△通讯作者

