藜麦种子皂苷不同提取方法的比较研究
冯焕琴,徐雪风,杨宏伟,沈宝云,胡 静,李朝周,*
(1.甘肃农业大学 生命科学技术学院,甘肃兰州 730070;2.甘肃省作物遗传改良和种质创新重点实验室,甘肃兰州 730070;3.甘肃条山农林科学研究所,甘肃白银 730400)
藜麦种子皂苷不同提取方法的比较研究
冯焕琴1,2,徐雪风1,2,杨宏伟1,2,沈宝云3,胡 静3,李朝周1,2,*
(1.甘肃农业大学 生命科学技术学院,甘肃兰州 730070;2.甘肃省作物遗传改良和种质创新重点实验室,甘肃兰州 730070;3.甘肃条山农林科学研究所,甘肃白银 730400)
目的:比较藜麦种子皂苷的不同提取方法,确定最佳提取条件。方法:采用超声提取法、甲醇回流法和乙醇回流法三种不同方法,在单因素实验的基础上,通过正交实验确定最佳的提取温度、提取时间、提取液浓度和料液比。结果:藜麦种子皂苷提取的最佳方法为超声提取法,最佳提取条件为在60 ℃温度,90%乙醇浓度,1∶15 g/mL的料液比条件下提取1 h,在此条件下皂苷含量为5.06 mg/g。结论:超声提取法适宜提取藜麦种子皂苷,该研究可为藜麦种子皂苷的提取开发利用提供理论依据和技术参考。
藜麦,皂苷,正交实验,超声提取法,甲醇回流法,乙醇回流法
藜麦(Chenopodium quinoa willd)又名南美藜、印第安麦等,为藜科藜属双子叶植物,原产于安第斯山脉地区,已有五千多年的种植历史,是安第斯山脉重要的粮食作物之一[1]。藜麦具有很高的营养价值,被列为全球十大营养食品之一,不仅富含蛋白质及钙、铁、锌和维生素E等微量营养素,而且含有人体所需的全部必需氨基酸,富含多种生物活性物质。研究表明,长期食用藜麦,对心脏病、高血压、高血糖、高血脂等有很好辅助治疗作用,此外还有增强免疫力、修复体力、补充营养、减肥等功效[2-3]。近年来,我国不断从国外引进并种植藜麦,在栽培技术和物质提取方面也取得了一定的进展。
皂苷对人体的作用越来越受到人们的重视,研究表明皂苷对肠道有一定的刺激作用,可以改善人体肠道对多种营养物质和药物的吸收[4-5],Estrada[6]等认为皂苷对病毒性疾病也有一定的抗性,研究者也用不同的方法从人参[7]、大豆[8]及苦瓜[9]等植物中进行了皂苷的提取和含量的测定。据报道,藜麦种子中含有0.1%~5%的皂苷,Bramd[10]等认为热加工工艺处理会降低藜麦粉末中皂苷的含量,Stuardo[11]等认为碱处理后的藜麦外壳中含有大量的皂苷衍生物,对灰霉病具有较强的抗病性。然而,尚未找到国内有关藜麦种子皂苷提取及含量测定方面的研究。
目前关于皂苷得提取方法主要有回流法[12]、超声波提取法[13-14]、闪式提取法[15]以及CO2超临界萃取法[16]。其中,回流提取法和超声波提取法具有操作简便、提取时间短、对设备要求不高等优点,而被广泛应用。张晶[17]等在对人参皂苷进行提取时,发现以乙醇为溶剂时,人参皂苷的提取率(5.25%)明显高于以甲醇为溶剂时的提取率(3.25%)。然而,李维莉等[18]对重楼中皂苷提取的研究表明,甲醇为最佳溶剂。因此,本实验采用超声提取法,甲醇回流提取法和乙醇回流提取法三种不同的提取方法,对藜麦种子总皂苷进行提取。通过单因素实验及正交实验的研究,以总皂苷的含量为指标,选出最佳的提取方法和提取条件,以期为藜麦皂苷的提取和开发利用提供科学的理论依据和技术参考。
1 材料与方法
1.1 材料与试剂
藜麦种子为加拿大Salt spring seed company提供的Kasala quinoa品种,于景泰条山集团种植收获的种子。人参皂苷Rg1对照品 上海源叶生物科技有限公司;乙醇为无水乙醇与去离子水配制;甲醇为99.9%甲醇与去离子水配制;5%香草醛溶液(500 mg香草醛溶于10 mL冰乙酸,现配);冰乙酸、高氯酸、正丁醇、石油醚等试剂均为分析纯。
1740QT超声波清洗仪 北京科玺世纪科技有限公司;HH-6数显恒温水浴锅 国华电器有限公司;QE万能粉碎机 浙江屹立工贸有限公司;SP-752紫外可见分光光度计 上海楚度仪器设备有限公司;JJ200B电子天平 北京尚德利衡电子衡器有限公司;TDZ4-WS低速离心机 长沙高新技术产业开发区湘仪离心机仪器有限公司;RE-5250旋转蒸发仪 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 对照品溶液的制备 精密称取在60 ℃减压干燥至恒重的人参皂苷 Rg1对照品2.42 mg于25 mL量瓶中,加60%甲醇溶解并稀释到刻度,摇匀,即为每毫升含0.0968 mg的对照品溶液[19]。
1.2.2 标准曲线的绘制 精密吸取0.50、0.75、1.00、1.25、1.50、1.75 mL的对照品溶液,分别置于10 mL具塞试管中,挥干溶剂,加入新配制的5%香草醛-冰醋酸溶液0.20 mL,高氯酸0.80 mL,在60 ℃水浴中加热15 min,立即置冷水中冷却,加入冰醋酸5 mL摇匀,放置15 min,相应试剂随行空白对照,测定560 nm处吸收度A,以吸收度为纵坐标,三七皂苷Rg1含量(mg)为横坐标,绘制标准曲线[20]。
1.2.3 供试样品溶液的制备 取样品材料1.00 g(80目),加入一定倍数相应浓度的提取液,在相应温度下提取一定时间后,4000 r/min离心5 min,将滤液移至50 mL容量瓶中,滤渣以同样倍数的提取液混匀,在同样的条件下进行二次提取,离心,将滤液并入上述容量瓶中。在提取工艺中改变相应的参数[21-22]。
在上述溶液中加入15 mL石油醚脱脂后,用水饱和正丁醇萃取4次,每次10 mL,合并正丁醇萃取液,再用正丁醇饱和水洗涤2次(10 mL、5 mL),真空浓缩至干,用甲醇溶解,定容至50 mL,待测[23]。
1.2.4 总皂苷含量的测定 取供试样品溶液0.5 mL,挥干溶剂,按照标准曲线绘制里面的方法显色,测其吸光值,根据标准曲线计算皂苷含量,取3次平均值作为测量结果。
1.2.5 单因素实验 分别以提取温度、提取时间、提取液浓度和料液比为单一因素,研究不同水平下各因素对藜麦种子皂苷含量的影响。
1.2.5.1 提取温度对藜麦种子皂苷含量的影响 取五个三角瓶,分别放入1.00 g藜麦种子粉末,料液比均为1∶5,提取液浓度为60%,控制温度分别为40、50、60、70、80 ℃,回流时间均为0.5 h,按照1.2.2方法测定吸光值。
1.2.5.2 提取时间对藜麦种子皂苷含量的影响 取五个三角瓶,分别放入1.00 g藜麦种子粉末,料液比均为1∶5,提取液浓度为60%,在40 ℃的水浴加热条件下加热回流提取,回流时间分别为0.5、1、1.5、2、2.5 h,提取液浓度为60%。按照1.2.4方法测定吸光值。
1.2.5.3 提取液浓度对藜麦种子皂苷含量的影响 取五个三角瓶,分别放入1.00 g藜麦种子粉末,料液比均为1∶5,在40 ℃的水浴加热条件下回流提取,回流时间均为0.5 h,提取液浓度分别为50%、60%、70%、80%、90%。按照1.2.4方法测定吸光值。
1.2.5.4 料液比对藜麦种子皂苷含量的影响 取五个三角瓶,分别放入1.00 g藜麦种子粉末,提取液浓度为60%,在40 ℃的温度下回流提取,回流时间均为0.5 h,料液比分别为1∶5、1∶10、1∶15、1∶20、1∶25。按照1.2.4方法测定吸光值。
1.2.6 正交实验设计 在单因素实验的基础上,以提取温度、提取时间、提取液浓度和料液比为考察因素,设计L9(34)正交实验来确定超声提取法、甲醇回流法和乙醇回流法的最佳提取条件(表1),并通过比较藜麦种子皂苷含量来确定提取皂苷的最佳方法。
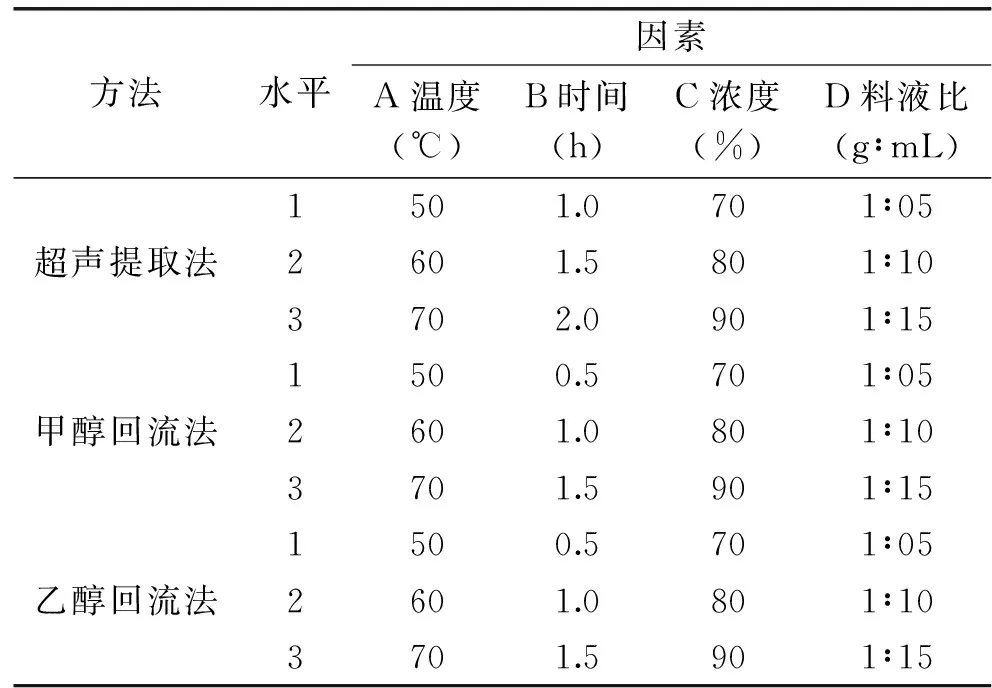
表1 藜麦种子皂苷不同提取法正交实验因素水平表Table 1 Factors and levels of orthogonal test of quinoa seeds saponin by different extraction methods
2 结果与分析
2.1 超声提取法
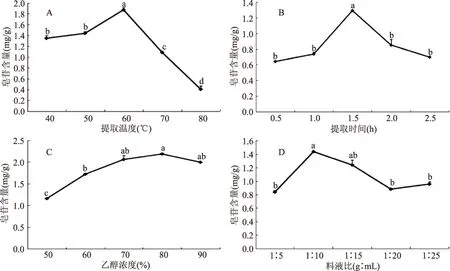
图1 各因素对藜麦种子皂苷含量的影响Fig.1 Effect of each factor on the saponin content of quinoa seeds
2.1.1 单因素实验结果 图1A表示超声温度对藜麦种子皂苷含量的影响,由图可知,随着超声温度的增加,藜麦种子皂苷含量逐渐升高,当温度达到60 ℃左右时,皂苷含量显著增加,从1.35 mg/g增加到1.87 mg/g,因此,藜麦种子超声温度范围选择在50~70 ℃。超声时间对藜麦种子皂苷含量的影响如图1B,随着超声时间的增加,藜麦种子和提取剂接触时间增长,皂苷含量明显升高,当超声时间达到1.5 h时,皂苷含量显著增加并达到最大值1.29 mg/g,因而选择超声时间范围为1~2 h。由图1C可知,随着提取液中乙醇浓度的增加,藜麦种子中更多的皂苷转移到提取液中,皂苷含量逐渐升高,当乙醇浓度为80%时,皂苷含量达到最大值2.19 mg/g,因而选取乙醇浓度范围为70%~90%。由图1D可知,随着料液比的增加,藜麦种子皂苷含量逐渐增高,当料液比达到1∶10时,藜麦种子皂苷含量达到最大值,选取料液比范围为1∶5~1∶15。
2.1.2 正交实验设计结果 单因素确定超声提取法提取藜麦种子皂苷的适宜条件为:超声温度60 ℃,超声时间1.5 h,乙醇浓度为80%,料液比为1∶10,在此基础上以藜麦种子皂苷含量为评价指标进行正交实验,结果见表2、表3。
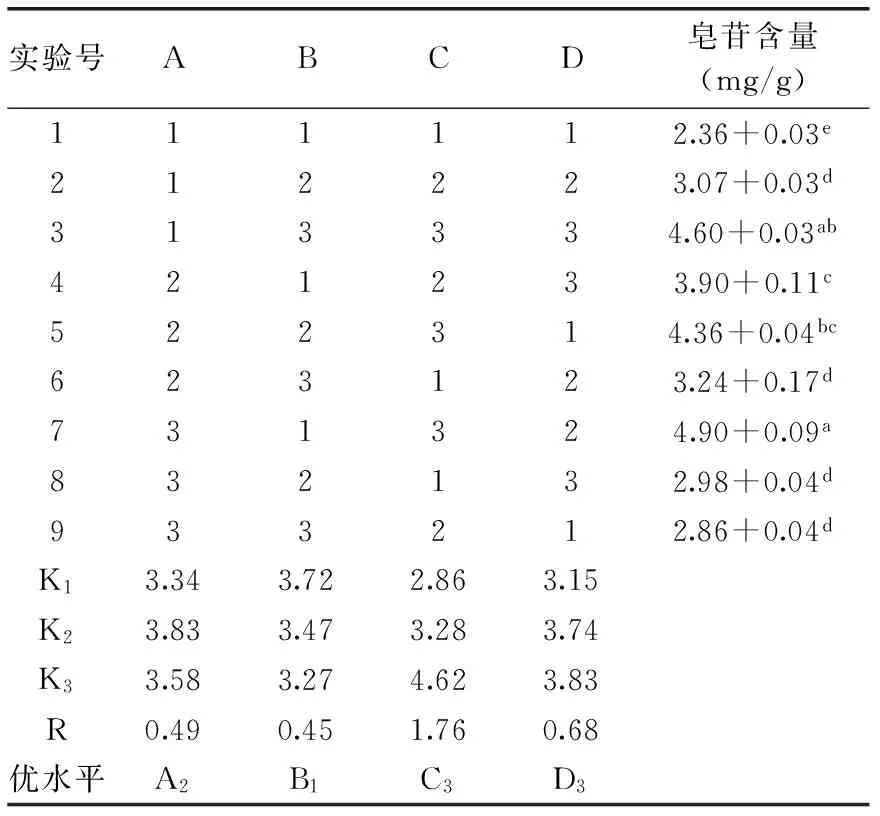
表2 超声提取法提取藜麦种子皂苷正交实验设计及结果Table 2 Orthogonal experiment design and results of extracting saponin from quinoa seeds by ultrasonic extraction

表3 超声提取法提取藜麦种子皂苷正交实验方差分析Table 3 Analysis of variance(ANOVA)of the orthogonal experiment extracting total saponin from quinoa seeds by ultrasonic extraction
由表2的正交实验分析结果可知,在四个因素中,影响藜麦种子总皂苷含量的主次顺序为:乙醇浓度>料液比>超声温度>超声时间。由表3的方差分析也可以看出,提取液浓度和料液比对藜麦种子皂苷含量影响最大,达到显著水平,而超声温度和超声时间这两个因素对藜麦种子皂苷含量的影响则较小,未达显著水平。K值确定的最优组合为A2B1C3D3,即在60 ℃的温度,90%的乙醇浓度,1∶15的料液比条件下提取1 h。
2.2 甲醇回流提取法
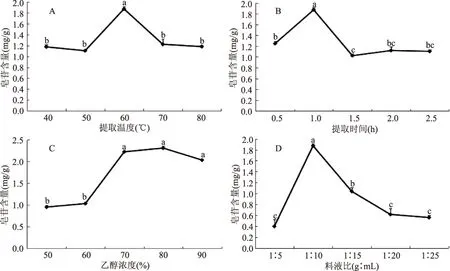
图2 各因素对藜麦种子皂苷含量的影响Fig.2 Effect of each factor on the saponin content of quinoa seeds
2.2.1 单因素实验结果 图2A表示提取温度对藜麦种子皂苷含量的影响,随着提取温度的增加,提取液流动性变大,藜麦种子皂苷含量逐渐增加,在提取温度达到60 ℃的时候显著增加并达到最大值1.87 mg/g,提取温度范围选择为50~70 ℃。由图2B可见,随着时间的增加,藜麦种子皂苷含量逐渐增加,当提取时间达到1 h时皂苷含量达到最大,藜麦种子皂苷提取时间范围选取为0.5~1.5 h。图2C中,随着甲醇浓度的增加,藜麦种子皂苷含量呈现上升趋势,且当甲醇浓度达到80%时,皂苷含量达到最大值。因此,在藜麦种子皂苷提取中,甲醇浓度范围均选取为70%~90%。料液比对藜麦种子皂苷含量的影响见图2D,当液料比为1∶5时,皂苷含量为0.40 mg/g,当料液比达到1∶10时,材料接触面积达到最优,总皂苷含量显著增加并达到1.87 mg/g。因而,确定选取料液比范围为1∶5~1∶15。
2.2.2 正交实验设计结果 单因素确定的甲醇回流法提取藜麦种子皂苷的适宜条件为:提取温度60 ℃,提取时间1 h,甲醇浓度80%,液料比1∶10。在此基础上以藜麦种子皂苷含量为评价指标进行正交实验,见表4,表5。
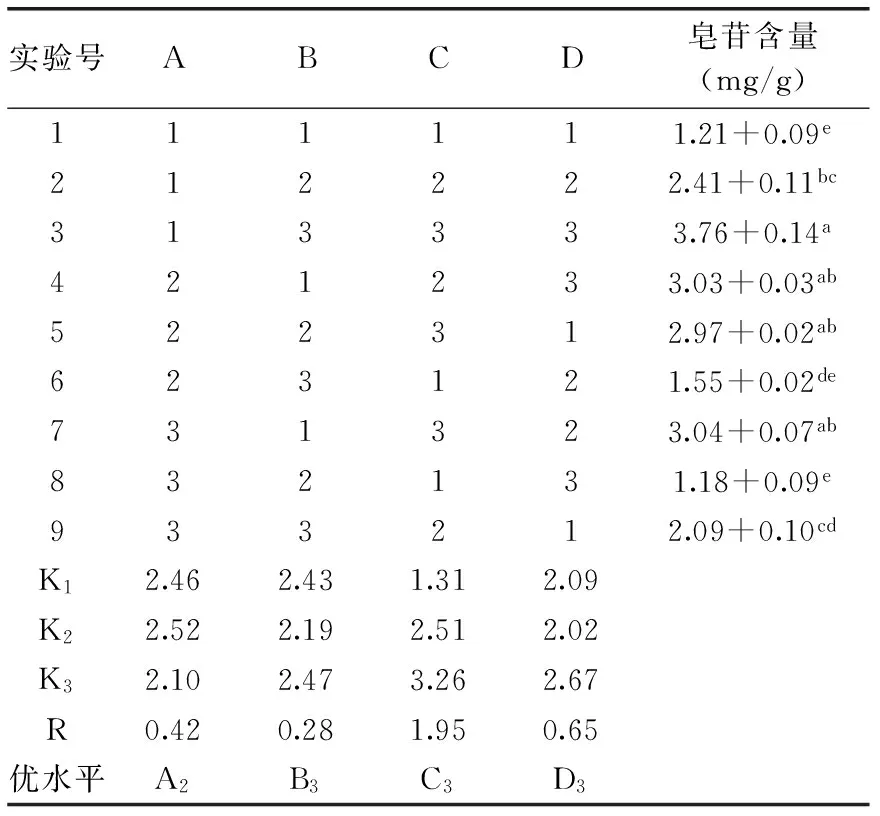
表4 甲醇回流提取法提取藜麦 种子皂苷正交实验设计及结果Table 4 Orthogonal experiment design and results of extracting saponin from quinoa seeds by methanol reflux extraction

表5 甲醇回流提取法提取藜麦种子皂苷正交实验方差分析Table 5 Analysis of variance(ANOVA)of the orthogonal experiment extracting saponin from quinoa seeds by methanol reflux extraction
由表4的正交实验分析结果可知,影响藜麦种子皂苷含量的主次因素为:甲醇浓度>料液比>提取温度>提取时间。由表5的方差分析可知,甲醇浓度对藜麦种子皂苷含量影响最大,且达到显著水平,提取温度,提取时间以及料液比对藜麦种子皂苷含量影响较小,未达显著水平。由K值确定的最优组合为A2B3C3D3,即在60 ℃温度,90%的甲醇浓度和1∶15的液料比条件下提取1.5 h。
2.3 乙醇回流提取法
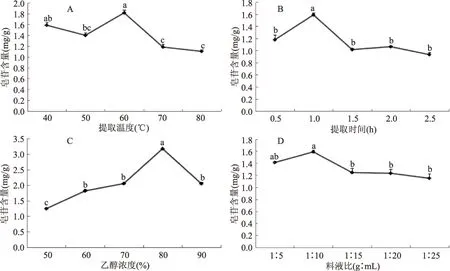
图3 各因素对藜麦种子皂苷含量的影响Fig.3 Effect of each factor on the saponin content of quinoa seeds
2.3.1 单因素实验结果 图3A表示在提取温度对藜麦种子皂苷含量的影响,随着提取温度的变化,在温度达到60 ℃时藜麦种子皂苷含量显著增加并达到最大值1.82 mg/g,随后逐渐下降并基本保持不变。因此,温度范围选择为50~70 ℃。提取时间对藜麦种子皂苷含量的影响趋势见图3B,当提取时间为1 h时,皂苷含量均显著增加达到最大值1.59 mg/g,继续增加时间,皂苷含量逐渐下降。因此,选取提取时间范围为0.5~1.5 h。图3C中,随着提取液中乙醇浓度的增加,藜麦种子皂苷含量逐渐升高,当乙醇浓度达到80%时,皂苷含量显著增加并达到最大值3.17 mg/g。因此,选取乙醇浓度范围为70%~90%。由图3D可知,随着料液比的增加,藜麦种子皂苷含量呈上升趋势,当液料比达到1∶10时,藜麦种子皂苷含量达到最大值,继续增加料液比,皂苷含量逐渐下降。因此,选取料液比范围为1∶5~1∶15。
2.3.2 正交实验设计结果 单因素实验确定乙醇回流提取法提取藜麦种子皂苷的适宜条件为:提取温度60 ℃,提取时间1 h,乙醇浓度80%,料液比为1∶10,在此基础上以藜麦种子皂苷含量为评价指标进行正交实验,结果见表6、表7。
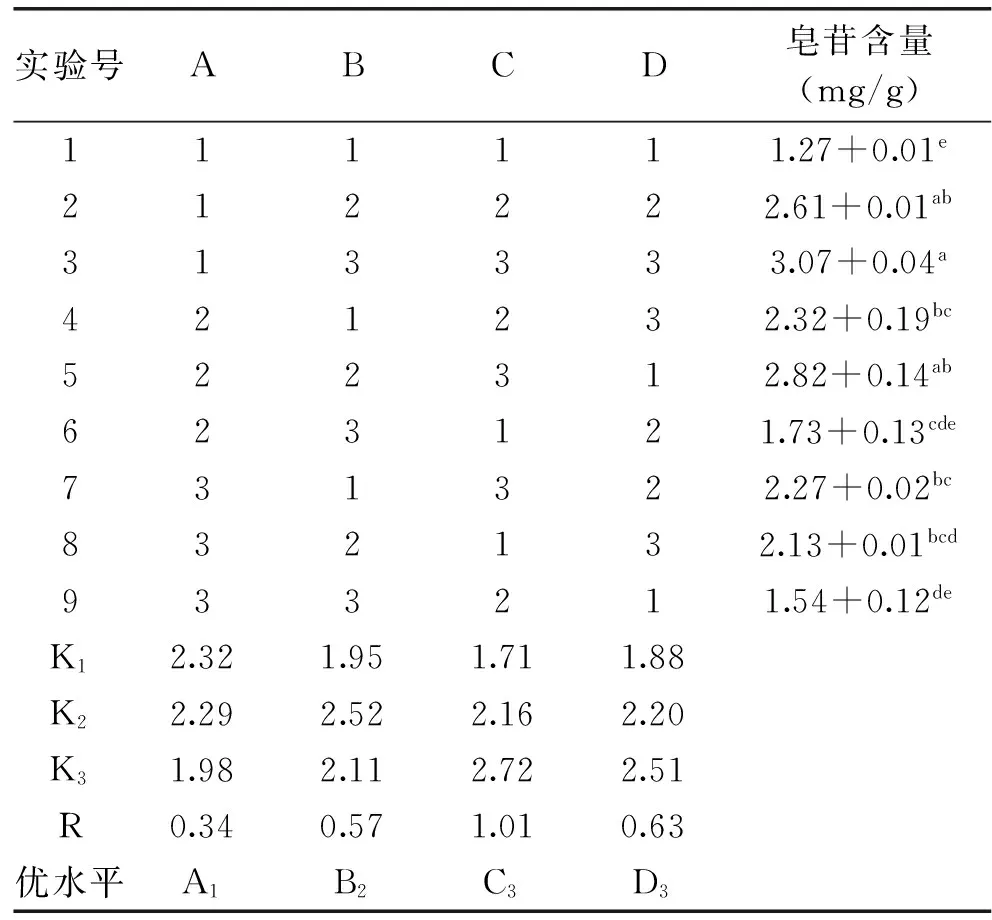
表6 乙醇回流提取法提取藜麦种子 皂苷正交实验设计及结果Table 6 Orthogonal experiment design and results of extracting saponin from quinoa seeds by ethanol reflux extraction
由表6可知,在四个因素中,影响藜麦种子皂苷含量的主次因素顺序为:乙醇浓度>料液比>提取时间>提取温度。表7的方差分析显示,提取液中乙醇浓度对藜麦种子皂苷含量影响最大,达显著水平。确定的最优组合为A1B2C3D3,即在50 ℃温度,90%的乙醇浓度和1∶15料液比的条件下提取1 h。
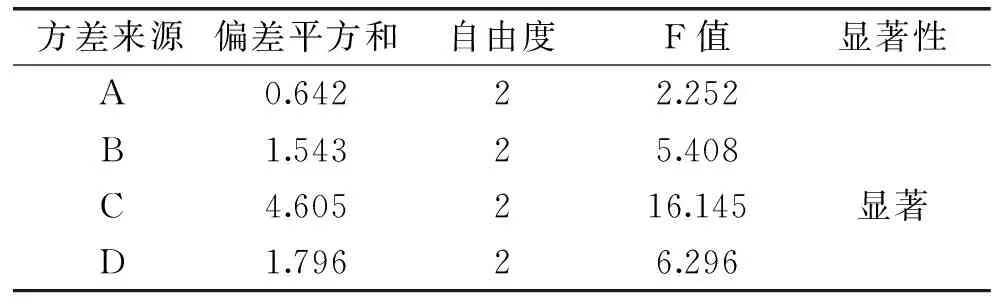
表7 乙醇回流提取法提取藜麦种子 皂苷正交实验方差分析Table 7 Analysis of variance(ANOVA)of the orthogonal experiment extracting saponin from quinoa seeds by ethanol reflux extraction
2.4 验证性实验
通过正交实验可得出超声提取法、甲醇回流法和乙醇回流法的最优提取条件,但因为最优条件在正交实验里没有出现,因而需要做验证性实验,以此来验证正交实验结果的可靠性。从表8可以看出,超声提取法提取藜麦种子皂苷含量比甲醇回流法和乙醇回流法的高,由此可以看出,超声提取法占有相对的优势。
3 讨论
本实验通过三个不同方法对藜麦种子皂苷进行提取,分别对超声提取法、甲醇回流提取法和乙醇回流提取法提取工艺进行了研究。在单因素的基础上,筛选出正交实验所需的最佳提取条件,和单因素相比,由于正交实验中各个因素都处于最优状态,因而皂苷含量显著增加,在不考虑交互作用的情况下,得出超声提取法的各个因素中对藜麦种子皂苷含量影响主次顺序为:乙醇浓度>料液比>超声温度>超声时间,甲醇回流法中的各个因素对藜麦种子皂苷含量影响主次因素为:甲醇浓度>料液比>提取温度>提取时间,乙醇回流法中各因素对藜麦种子皂苷含量影响主次因素顺序为:乙醇浓度>料液比>提取时间>提取温度。这都说明提取液浓度和料液比对藜麦种子皂苷提取有显著差异,表明这两个因素对藜麦种子皂苷含量影响较大。这个结论与孙于杰[24]研究结果相一致,认为乙醇体积分数对皂苷含量影响显著。李健[25]等研究表明,影响皂苷含量的主次因素为:提取时间>乙醇浓度>提取温度>料液比,这可能与提取方法有关。

表8 不同方法提取藜麦种子皂苷的比较Table 8 Comparison among different methods of extracting saponin from quinoa seeds
三种不同方法提取的藜麦种子皂苷含量以乙醇回流提取法最低,超声提取法最高。随着提取温度的升高,皂苷的溶解度增加,但当温度过高时,皂苷被破坏,反而不利于皂苷的提取。超声提取法能在较低温度下提取有效成分,从而避免高温对皂苷成分的破坏[26-27]。在三种提取方法中,皂苷含量达到最大值,分析其原因,是因为超声提取法利用超声波在液体介质中产生巨大的压力,从而对藜麦种子粉末产生巨大的冲击,使得藜麦种子粉末中皂苷更容易转移到提取液中,比另外两种方法更加有效。Woldemichael[28]等研究表明,藜麦种子皂苷含量高达20%~30%,但藜麦中皂苷含量的高低受光照和土壤水分含量不同等因素的影响。本实验测得藜麦种子皂苷含量和Woldemichael等人的研究略有差异,可能是藜麦品种不同以及产地不同等因素所致。
4 结论
通过对超声提取法、甲醇回流提取法和乙醇回流提取法提取藜麦种子皂苷的比较分析,确定超声提取法提取藜麦种子皂苷含量最高,并通过单因素及正交实验确定超声提取法提取藜麦种子皂苷的最佳条件为:提取温度60 ℃,提取时间1 h,提取液浓度90%,料液比为1∶15,在此条件下提取的皂苷含量为5.06 mg/g。
甲醇回流提取法提取的藜麦种子皂苷含量低于超声提取法,且甲醇回流提取法提取时间较长,甲醇毒性较大,因而较难普及。乙醇回流提取法用时虽和超声提取法相当,但其提取的藜麦种子皂苷含量最低,同样不适用于藜麦种子皂苷的提取。
综合分析,超声提取法提取的皂苷含量比甲醇回流法和乙醇回流法都要高,且有研究表明,超声提取法有提取效率高,工艺运行成本低,用时少,综合经济效益显著等优点[29]。因而在藜麦种子皂苷的提取方法中以超声提取法为最佳。
[1]王晨静,赵习武,陆国权,等.藜麦特性及开发利用研究进展[J]. 浙江农林大学学报,2014,31(2):296-301.
[2]Bhargava A,Shukla S,Ohri D. et al. Chenopodium quinoa-An Indian perspective[J]. Industrial Crops and Products,2006,23(1):73-87.
[3]Vega-Gálvez A,Miranda M,Vergara J,et al. Nutrition facts and functional potential of quinoa(Chenopodium quinoa Willd.),an ancient Andean grain:a review[J]. Journal of the Science of Food and Agriculture,2010,90(15):2541-2547.
[4]Gee J M,Price K R,Ridout C L. Saponins of quinoa(Chenopodium quinoa):effects of processing on their abundance in quinoa products and their biological effects on intestinal mucosal tissue[J]. Journal of the Science of Food and Agriculture,1993,63(2):201-209.
[5]Oakenfull D,Sidhu G S. Could saponins be a useful treatment for hypercholesterolaemia[J]. European Journal of Clinical Nutrition,1990,44:79-88.
[6]Estrada A,LI Bing,Laarveld B. Adjuvant action of Chenopodium quinoa saponins on the induction of antibody responses to intragastric and intranasal administered antigens in mice[J]. Comp Immunol Microbiol Infect Dis,1998,21(3):225-236.
[7]杨雨,郑斯文,金银萍,等. 人参皂苷的提取分离方法研究进展[J]. 江苏农业科学,2014,42(5):214-217.
[8]梁晓芳,王步军. 大豆中异黄酮和皂苷的提取、制备研究进展[J]. 大豆科学,2014,33(1):57-59.
[9]张武军,黄颖桢,张玉灿. 超声提取苦瓜皂苷的工艺优化研究[J]. 中国农学通报,2015,31(34):128-134.
[10]Brady k,Ho c t,Rosen R T,et al. Effects of processing on the nutraceutical profile of quinoa[J]. Food Chem,2007,100(3):1209-1216.
[11]Stuardo M,Martin R S. Antifungal properties of quinoa(Chenopodium quinoa Willd.)alkali treated sponins against Botrytis cinerea[J]. Ind Crops Prod,2008,27(3):296-302.
[12]孙逸来. 不同提取方法对黄芪中免疫活性成分提取率的影响[J]. 科技展望,2015,33:181-182.
[13]刘江,段志刚,段宝忠,等. 南重楼中4种重楼皂苷超声提取工艺[J]. 安徽农业科学,2016,07:158-160.
[14]伊长文,叶丽勤,孟敏. 丝瓜皮中总皂苷超声辅助提取工艺研究[J]. 安徽工程大学学报,2016,01:1-4.
[15]郭殷锐,苏雪芬,张广唱,等. 正交实验法优选吴茱萸中吴茱萸碱和吴茱萸次碱的闪式提取工艺[J]. 广州中医药大学学报,2016,03:380-383.
[16]张乐,宋凤瑞,王琦,等. 人参中稀有皂苷超临界二氧化碳提取[J]. 应用化学,2010,27(3):1483-1485.
[17]张晶,陈全成,弓晓杰,等. 不同提取方法对人参皂苷提取率的影响[J]. 吉林农业大学学报,2003,01:71-72.
[18]李维莉,彭永芳,李银,等. 超声法提取重楼中重楼皂苷的研究[J]. 中成药,2010,02:218-220.
[19]谢茵,邢桂琴,刘秀芬. 三七提取液中三七总皂苷的分离纯化工艺研究[J].山西医科大学学报,2006,37(6):613-615.
[20]赵丽,朱善元,黄文强,等. 田七须根总皂苷的提取工艺研究[J]. 黑龙江畜牧兽医,2016,10:160-161+166.
[21]张军武,赵琦. 不同提取方法对黄芪总皂苷含量的影响[J]. 西部中医药,2012,25(4):26-28.
[22]曹珍艳,魏冰,李彬. 醇提浓缩法提取蒺藜皂苷的实验研究[J]. 生物化工,2015,01:26-28.
[23]张中,谢明勇,王远兴,等. 比色法测定苦瓜总皂苷[J]. 南昌大学学报:理科版,2005,29(5):447-449.
[24]孙于杰,王莹,侯林,等. 超声法提取远志中细叶远志皂苷的工艺优选[J]. 中国实验方剂学杂志,2012,18(2):53-55.
[25]李健,陈姝娟,刘宁. 肉桂总皂苷提取工艺的研究[J]. 天然产物研究与开发,2008,20(5):922-925.
[26]纵伟,夏文水. 超声强化提取大叶紫薇叶中总三萜的研究[J]. 食品与机械,2006,22(2):14-16.
[27]张海容,刘露琛. 超声提取青蒿多糖的工艺优化[J]. 食品研究与开发,2006,27(5):46-48.
[28]Woldemichael G M.,Wink M. Identification and biological activities of triterpenoid saponins from Chenopodium quinoa[J]. Agric Food Chem,2001,49(5):2327-2332.
[29]令狐晨,阿依吐伦·斯马义.皂苷提取纯化及其抗氧化活性的研究进展[J]. 广州化工,2015,43(6):7-10.
Comparative studies on different extraction process of saponin from quinoa seeds
FENG Huan-qin1,2,XU Xue-feng1,2,YANG Hong-wei1,2,SHEN Bao-yun3,HU Jing3,LI Chao-zhou1,2,*
(1.College of Life Science and Technology,Gansu Agricultural University,Lanzhou 730070,China;2.Gansu Key Laboratory of Crop Genetics & Germplasm Enhancement,Lanzhou 730070,China;3.Agricultural and Forestal Science Research Institution of Gansu Tiaoshan Group,Baiyin 730400,China)
Objective:Throughthecomparisonofdifferentextractionconditionsofsaponinfromquinoaseedsandselectthebestmethodsandoptimalprocess.Methods:Theeffectsofextractiontemperature,time,extractionconcentrationandratioofmaterialtoliquidonthecontentofsaponinwereinvestigatedbyorthogonaltestbasedonthesinglefactorexperiments,anddifferentmethodsincludingultrasonicextractionmethod,methanolrefluxmethodandethanolrefluxmethodwerecompared.Results:Theoptimumconditionswereextractiontimeof1h,extractiontemperatureof60 ℃,ethanolconcentrationof90%andliquidof1∶15(g∶mL).Underthiscondition,thecontentofsaponinwas5.06mg/g.Conclusion:Ultrasonicextractionmethodisthebestoneinsaponinextractionfromquinoaseeds.Thestudyprovidedascientifictheorysupportandtechnicalreferenceforthesaponinextractionfromquinoaseeds.
quinoa;saponin;orthogonaltest;ultrasonicextraction;methanolrefluxmethod;ethanolrefluxmethod
2016-04-25
冯焕琴(1992- ),女,硕士研究生,研究方向:天然产物的提取与分离,E-mail:1763451352@qq.com。
*通讯作者:李朝周(1963-),男,博士,教授,主要从事植物抗性生理及相关领域的教学和研究,E-mail:licz@gsau.edu.cn。
国家科技支撑计划课题项目(2012BAD06B03);甘肃省农牧厅项目(GNSW-2012-21)。
TS210.4
B
1002-0306(2016)21-0216-07
10.13386/j.issn1002-0306.2016.21.033

