HS-GC法同时测定尼莫地平缓释片中乙醇和丙酮的残留量Δ
胡晓琴,韩 春(长治学院化学系,山西长治 046011)
·药物分析与检定·
HS-GC法同时测定尼莫地平缓释片中乙醇和丙酮的残留量Δ
胡晓琴*,韩 春#(长治学院化学系,山西长治 046011)
目的:建立同时测定尼莫地平缓释片中乙醇和丙酮残留量的方法。方法:采用顶空气相色谱法。色谱柱为以6%氰丙基苯基-94%二甲基聚硅氧烷(DB-624)为固定液的毛细管柱,程序升温,进样口温度为230℃,检测器为氢火焰离子化检测器,检测器温度为250℃,载气为氮气,流速为2.0 ml/min,分流比为5∶1,顶空加热温度为90℃,平衡时间为20 min,顶空进样量为1.0 ml。结果:乙醇、丙酮检测质量浓度线性范围分别为1.25~500.0 μg/ml(r=0.999 9)、0.50~202.0 μg/ml(r=0.999 2);定量限分别为5.01、2.02 μg/ml,检测限分别为1.67、0.67 μg/ml;精密度、稳定性、重复性试验的RSD<3.0%;加样回收率分别为96.81%~102.00%(RSD=1.89%,n=9)、96.64%~102.31%(RSD=1.82%,n=9)。结论:该方法简便、快速、准确,可用于同时测定尼莫地平缓释片中乙醇和丙酮的残留量。
顶空气相色谱法;尼莫地平;乙醇;丙酮;有机溶剂;残留量
尼莫地平(Nimodipine,NMP)是第二代双氢吡啶类钙离子阻滞药,临床上主要用于缺血性脑血管病、阿尔茨海默病、蛛网膜下腔出血等疾病的治疗[1-3],也是近年来治疗高血压的首选药物之一[4]。尼莫地平缓释片较其他普通剂型具有生物稳定性高、作用时间长、不良反应少等特点,近几年在临床上应用广泛[5]。由于其制备过程中用到了有机溶剂乙醇和丙酮[6],可能会出现有机溶剂超标,长期使用会对人体造成严重危害[7]。该药收载于国家新药转正标准WS-(X-068)-2004Z,但该标准未对有机溶剂残留量作要求。因此,笔者根据2015年版《中国药典》(四部)通则0861残留溶剂测定法中对残留溶剂的质量控制要求(乙醇和丙酮的溶剂残留限量应<0.5%)[8],首次建立了采用顶空气相色谱法(HS-GC)同时测定尼莫地平缓释片中乙醇、丙酮残留量的方法,以期为更好地控制该制剂的质量提供参考。
1 材料
1.1 仪器
7890A型气相色谱仪,包括氢火焰离子化检测器(FID)、7694E顶空自动进样装置、7890A色谱工作站(美国Agilent公司);MS204TS型万分之一电子天平(瑞士Mettler-Toledo公司);KQ-100DE型数控超声波清洗器(昆山市超声仪器有限公司,功率:100 W,频率:40 kHz)。
1.2 药品与试剂
尼莫地平缓释片(山西振东制药股份有限公司,批号:20150801、20150802、20150803、20150903,规格:60 mg/片);乙醇对照品(批号:20150911,纯度≥99.8%)、丙酮对照品(批号:20140611,纯度≥99.7%)均购自国药集团化学试剂有限公司;N,N-二甲基甲酰胺(DMF)为色谱纯,水为超纯水。
2 方法与结果
2.1 色谱条件
色谱柱:以6%氰丙基苯基-94%二甲基聚硅氧烷(DB-624)为固定液的毛细管柱(30 m×0.32 mm,1.4 μm);程序升温:初始温度40℃,保持2 min,以10℃/min升温至60℃,再以30℃/min升温至230℃,保持2 min;进样口温度:230℃;检测器:FID;检测器温度:250℃;载气:氮气;流速:2.0 ml/min;分流比:5∶1;顶空加热温度:90℃;平衡时间:20 min;顶空进样量:1.0 ml。
2.2 溶液的制备
2.2.1 混合对照品溶液 精密称取乙醇对照品50.1 mg、丙酮对照品50.6 mg,置于同一100 ml量瓶中,加DMF溶解并定容,摇匀,作为混合对照品贮备液。精密量取上述混合对照品贮备液5.0 ml,置于50 ml量瓶中,加DMF定容,摇匀,经0.22 μm微孔滤膜滤过,取续滤液1.0 ml,置于顶空瓶中,密封,作为混合对照品溶液。
2.2.2 供试品溶液 取样品20片,精密称定,研细,精密称取适量(约含尼莫地平300 mg),置于10 ml量瓶中,加DMF溶解并定容,超声处理10 min,经0.22 μm微孔滤膜滤过,取续滤液1.0 ml,置于顶空瓶中,密封,作为供试品溶液。
2.2.3 空白对照溶液 精密量取DMF 1.0 ml,置于顶空瓶中,密封,作为空白对照溶液。
2.3 系统适用性试验
精密量取“2.2”项下混合对照品溶液、供试品溶液和空白对照溶液各适量,按“2.1”项下色谱条件进样测定,记录色谱,详见图1。由图1可知,在该色谱条件下,乙醇和丙酮均能达到基线分离,分离度均>2.0;理论板数以乙醇峰计为12 567,乙醇、丙酮的保留时间分别为3.926、4.375 min。结果表明,其他成分对测定无干扰。
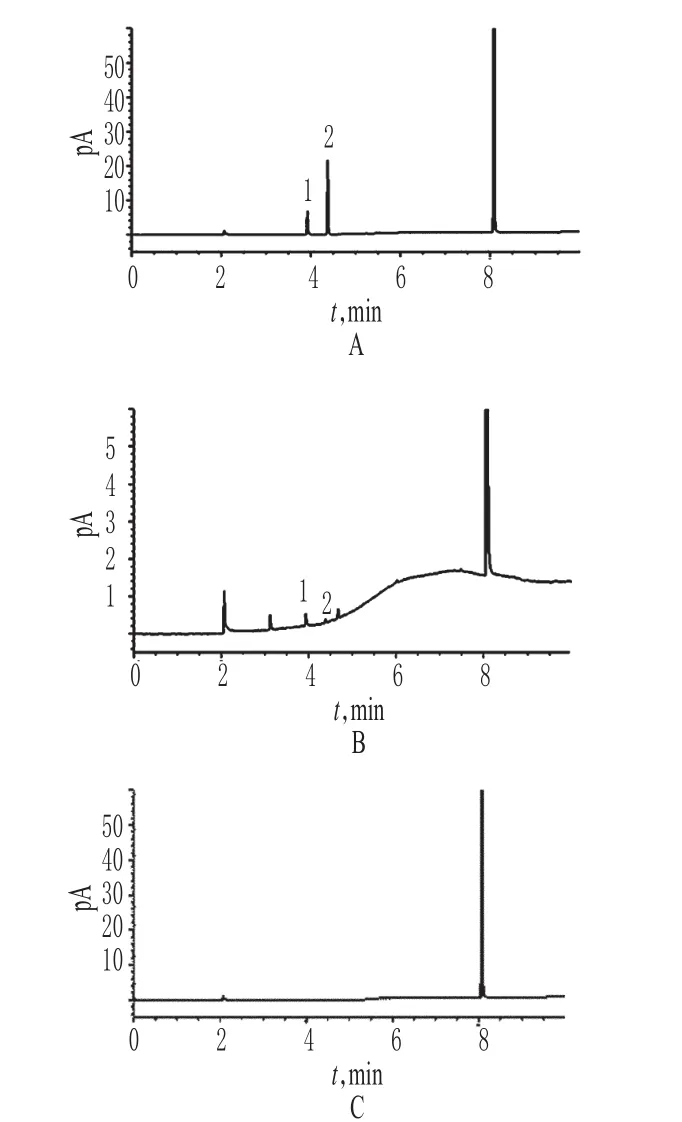
图1 气相色谱图A.混合对照品;B.供试品;C.空白对照;1.乙醇;2.丙酮Fig 1 GC chromatogramsA.mixed reference substance;B.test sample;C.blank control;1.ethanol;2.acetone
2.4 线性关系考察
精密称取乙醇对照品25.0 mg、丙酮对照品10.1 mg,置于同一10 ml量瓶中,加DMF溶解并定容,摇匀,制成乙醇和丙酮质量浓度分别为2.50、1.01 mg/ml的线性溶液。精密量取上述线性溶液0.005、0.01、0.1、0.2、0.6、1.0、1.5、2.0 ml,分别置于10 ml量瓶中,加DMF定容,摇匀,按“2.1”项下色谱条件进样测定,记录峰面积。以待测成分质量浓度(x,μg/ml)为横坐标、峰面积(y)为纵坐标进行线性回归,得乙醇回归方程为y=1 312.4x-23.98(r=0.999 9),丙酮回归方程为y=2 883.7x-4.503(r=0.999 2)。结果表明,乙醇、丙酮检测质量浓度线性范围分别为1.25~500.0、0.50~202.0 μg/ml。
2.5 定量限与检测限考察
取“2.2.1”项下混合对照品溶液适量,等倍逐步稀释,按“2.1”项下色谱条件连续进样测定6次,记录峰面积。当信噪比为10∶1时,得乙醇、丙酮的定量限分别为5.01、2.02 μg/ml;当信噪比为3∶1时,得乙醇、丙酮的检测限分别为1.67、0.67 μg/ml。
2.6 精密度试验
精密量取“2.2.1”项下混合对照品溶液适量,按“2.1”项下色谱条件连续进样测定6次,记录峰面积。结果,乙醇、丙酮峰面积的RSD分别为1.78%、1.83%(n=6),表明仪器精密度良好。
2.7 稳定性试验
取“2.2.2”项下供试品溶液(批号:20150801)适量,分别于室温下放置0、1、2、4、6、8 h时按“2.1”项下色谱条件进样测定,记录峰面积。结果,乙醇、丙酮峰面积的RSD分别为2.48%、1.88%(n=6),表明供试品溶液在室温下8 h内稳定性良好。
2.8 重复性试验
取同一批样品(批号:20150801)适量,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积。结果,乙醇、丙酮峰面积的RSD分别为1.91%、2.99%(n=6),表明本方法重复性良好。
2.9 加样回收率试验
取样品(批号:20150903)适量,研细,精密称取1.45 g(约含尼莫地平300 mg),共9份,分别置于10 ml量瓶中,再分别加入低、中、高质量浓度的乙醇、丙酮对照品,每组3份,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表1。
2.10 样品中残留溶剂的测定
取4批样品适量,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算乙醇、丙酮的残留量,结果见表2。
3 讨论
3.1 溶剂的选择
为保证待测样品中的乙醇、丙酮完全释放,必须选择适合的溶剂来完全溶解待测样品。笔者分别参考了水、二甲基亚砜(DMSO)和DMF[8],结果尼莫地平不溶于水,不能保证乙醇、丙酮的有效溶出;但其在DMSO和DMF中均能溶解,经试验验证,当DMF作为溶剂时,乙醇、丙酮的分离度良好、峰形对称、灵敏度高。故本试验选择DMF为溶剂。
3.2 色谱柱的选择
为了使待测残留溶剂获得较好的分离度,笔者分别考察了非极性色谱柱Rtx®-1(50 m×0.53 mm,10 μm)、弱极性色谱柱HP-5(30 m×0.32 mm,0.50 μm)、中等极性色谱柱以DB-624为固定液的毛细管柱(30 m×0.32 mm,1.4 μm)和极性色谱柱Rtx®-wax(20 m×0.18 mm,0.4 μm)对样品的处理。结果,采用Rtx®-1、HP-5时,乙醇、丙酮保留时间较长;采用Rtx®-wax时,分离度较差;以DB-624为固定液的毛细管柱时,保留时间短、分离度好、峰形对称。故选择以DB-624为固定液的毛细管柱为本试验的色谱柱。

表1 加样回收率试验结果(n=9)Tab 1 Results of recovery tests(n=9)
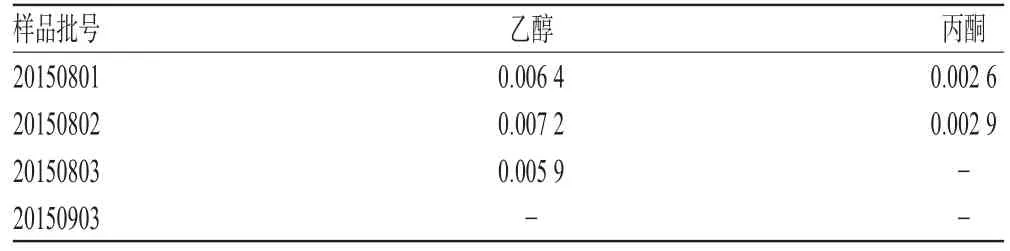
表2 样品中残留溶剂测定结果(n=3,%)Tab 2 Determination results of residual solvents in samples(n=3,%)
3.3 样品处理的优化
目前,残留溶剂的检查,只强调原料药中有机溶剂的残留情况,而对制剂过程中使用的有机溶剂没有引起足够的重视[9],尤其是在脂质体[10-11]、缓(控)释[12-13]、微丸包衣[14-15]等过程中使用的有机溶剂。本试验对样品的处理采用将药片研细,并进行超声处理,保证了药片充分溶于溶剂中,使得最终测量结果能够真实反映药物制剂中的有机溶剂残留量。
综上所述,本方法简便、快速、准确,可用于同时测定尼莫地平缓释片中乙醇和丙酮的残留量。
[1] 邹普汉,林碧红.尼莫地平治疗脑出血后缺血性脑损伤的疗效分析[J].当代医学,2012,18(31):16.
[2] 刘学文,田步先,蔡爱民,等.尼莫地平2种给药途径治疗蛛网膜下腔出血后脑血管痉挛的疗效观察[J].中国药房,2010,21(16):1 490.
[3] 徐雄波,潘育方,黄志军,等.鼻腔给药尼莫地平纳米乳的制备及脑组织靶向性初步评价[J].中国药学杂志,2012,47(8):594.
[4] 李向平,王焕.2002-2004年我院抗高血压药物应用分析[J].中国新药杂志,2006,15(7):563.
[5] 毛丽超.尼莫地平缓释片研究[D].长春:吉林大学,2013:17.
[6] 李菲,曹娟,张娜,等.尼莫地平缓释片的制备及体外释药特性[J].中国医院药学杂志,2010,30(15):1 291.
[7] 相莉,张宇佳,陈少华,等.气相顶空色谱法测定尼莫地平脂质体中有机溶剂残留[J].中国药师,2014,17(2):227.
[8] 国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:105-109.
[9] 时涛,陈振德.顶空气相色谱法测定制剂包衣中乙醇和二氯甲烷残留量[J].西北药学杂志,2009,24(4):251.
[10] 向俊霖,张莉,王晓辉,等.尼莫地平脂质体的制备及体外透皮研究[J].中国药房,2009,20(1):36.
[11] 刘晓谦,王锦玉,仝燕,等.脂质体制备技术及其研究进展[J].中国药学杂志,2011,46(14):1 084.
[12] 魏凤环,田景振,王怀忠.缓释控释技术[J].山东中医杂志,2000,19(9):554.
[13] 吴旖.百部总生物碱的化学成分研究及其缓释片的研制[D].广州:暨南大学,2015:3.
[14] 王智军,李红英,唐星.尼莫地平速释微丸及缓释微丸的制备[J].沈阳药科大学学报,2007,24(2):74.
[15] 林杨,李娟.包衣技术在微丸制备中的应用[J].亚太传统医药,2015,11(15):63.
Residual Determination of Ethanol andAcetone in Nimodipine Sustained-release Tablet by HS-GC
HU Xiaoqin,HAN Chun(Dept.of Chemistry,Changzhi College,Shanxi Changzhi 046011,China)
OBJECTIVE:To establish a method for the residual determination of ethanol and acetone in Nimodipine sustained-release tablet.METHODS:Headspace GC was on the column of capillary column with fixative solution of 6%cyanopropyl phenyl-94%dimethyl polysiloxane(DB-624)by temperature programming,injector temperature was 230℃,detector was a flame ionization detector,detector temperature was 250℃,carrier gas was nitrogen gas,flow rate was 2.0 ml/min,split ratio was 5∶1,equilibrium temperature was 90℃,equilibrium time was 20 min,and volume of sample was 1.0 ml.RESULTS:The linear range was 1.25-500.0 μg/ml for ethanol(r=0.999 9)and 0.50-202.0 μg/ml for acetone(r=0.999 2);limits of quantitative were 5.01,2.02 μg/ml,limits of detection were 1.67,0.67 μg/ml,respectively;RSDs of precision,stability and reproducibility tests were lower than 3.0%;recoveries were 96.81%-102.00%(RSD=1.89%,n=9),96.64%-102.31%(RSD=1.82%,n=9),respectively. CONCLUSIONS:The method is simple,rapid,accurate,and can be used for simultaneous residual determination of ethanol and acetone in Nimodipine sustained-release tablet.
HS-GC;Nimodipine;Ethanol;Acetone;Organic solvent;Residue
R917
A
1001-0408(2016)33-4686-03
2016-01-08
2016-08-31)
(编辑:刘 柳)
国家自然科学基金资助项目(No.21402012);国家自然科学项目子项目(No.GJZXM201605)
*助教,硕士。研究方向:药物分析。电话:0355-2178113。E-mail:244174693@qq.com
#通信作者:副教授,博士。研究方向:药物合成与分析。电话:0355-2178113。E-mail:coldspringfibre@126.com
DOI 10.6039/j.issn.1001-0408.2016.33.26

