薯蓣属植物化学成分及药理活性的研究进展
曾 涌,罗建军,何文生,陈卫琼,李 航,杜 航(重庆市大足区人民医院药剂科,重庆 402360)
薯蓣属植物化学成分及药理活性的研究进展
曾 涌*,罗建军,何文生#,陈卫琼,李 航,杜 航(重庆市大足区人民医院药剂科,重庆 402360)
目的:为薯蓣属植物的开发利用提供科学依据。方法:以“薯蓣属”“化学成分”“药理作用”“生物活性”“Dioscorea”“Chemical constituents”“Pharmacological activities”“Biological activities”等为关键词,组合查询2009-2015年在PubMed、中国知网等数据库中的相关文献,对薯蓣属植物的化学成分及药理活性研究进行综述。结果与结论:共检索到相关文献265篇,其中有效文献58篇。薯蓣属植物化学成分以甾体为主,共98个,其中新化合物43个;黄酮类13个;二萜类27个,其中新化合物13个;二苯乙烷(烯)类21个,其中新化合物6个;菲类28个,其中新化合物9个;二苯庚烷类19个;其他类如苯丙素、蒽醌、含氮化合物、有机酸、酯等53个,其中新化合物9个。以上化学成分主要有抗肿瘤、保护心血管、调节神经系统、抗氧化、降血脂、降血糖等药理作用。目前对其的研究主要围绕盾叶薯蓣、穿龙薯蓣、黄山药、黄独、薯蓣等少数植物展开,且多属基础性研究,对于其临床应用报道较少,下一步应扩大基础研究和活性化合物的临床研究。
薯蓣属;化学成分;药理活性
薯蓣科薯蓣属(Dioscorea L.)植物有600多种,广泛分布于热带及温带地区;我国约有49种,主产于西南和东南部[1]。本属植物常供药用,其中,山药可补脾养胃、生津益肺、补肾涩精;黄山药能理气止痛、解毒消肿;穿山龙有祛风除湿、舒筋通络、活血止痛、止咳平喘等功效[2]。现代药理研究表明,本属植物具有抗肿瘤、保护心血管、调节神经系统、抗氧化、降血脂、降血糖等作用。为更好地开发利用本属植物,进而更好地服务于临床,笔者以“薯蓣属”“化学成分”“药理作用”“生物活性”“Dioscorea”“Chemical constituents”“Pharmacological activities”“Biological activities”等为关键词,组合查询2009-2015年在PubMed、中国知网等数据库中的相关文献。结果,共检索到相关文献265篇,其中有效文献58篇。现对薯蓣属植物的化学成分及药理活性研究进行综述,以期为薯蓣属植物的开发利用提供科学依据。
1 薯蓣属植物的化学成分
薯蓣属植物化学成分丰富。2009-2015年,从薯蓣属植物中共分离得到260个化合物,以甾体为主,此外还包括黄酮类、二萜类、二苯乙烷(烯)类、菲类、二苯庚烷类、其他类等。
1.1 甾体(化合物1~98)
甾体成分是薯蓣属植物的主要活性成分,该类化合物种类繁多,结构中多具有环戊烷骈多氢菲甾核。本属植物共分离得到98个甾体成分,以甾体皂苷及其苷元为主,详见表1[3-32]。

表1 薯蓣属植物中甾类化合物

续表1

续表1
1.1.1 甾体皂苷(元) 甾体皂苷(元)广布于植物中,是天然产物中一类重要的活性成分。20世纪60-70年代,国内外学者对此作了大量研究,以期寻找开发用于合成甾体避孕药和激素药的原料。2009-2015年,本属植物中分离得到32个新甾体皂苷(元),多来自黄独、D.bulbifera L.var sativa。其中,异螺甾烷醇类21个,呋甾烷醇类8个,变形螺甾烷醇类3个。
1.1.2 其他甾体类 除甾体皂苷外,薯蓣属植物还含有其他类型的甾体化合物,特别是近几年来,从本属植物中分离得到11个新非甾体皂苷类成分,多来自黄山药。
1.2 黄酮类(化合物99~111)
黄酮类成分泛指2个具有酚羟基的苯环通过中央三碳相互联接而成的一系列化合物。本属植物中共分离得到13个该类化合物,且多以黄酮醇为主,详见表2[13,28,33-37]。

表2 薯蓣属植物中黄酮类化合物
1.3 二萜类(化合物112~138)
二萜类成分结构显示多样性,但生源上都是由前体物焦磷酸香叶酯衍生而成。2009-2015年,从薯蓣属植物中共分离得到27个该类成分,其中13个为新二萜,多来自黄独,详见表3[29,34-35,38-42]。
1.4 二苯乙烷(烯)类(化合物139~159)
薯蓣属植物中共分离得到二苯乙烷类17个(化合物139~155),其中新化合物6个,多来自穿龙薯蓣;二苯乙烯类4个(化合物156~159),详见表4[24,28,33-37]。
1.5 菲类(化合物160~187)
2009-2015年,有关薯蓣属植物的文献就报道了28个此类成分,其中新化合物9个,主要来源于穿龙薯蓣,详见表5[12-13,33-34,36-37,43-47]。

表3 薯蓣属植物中二萜类化合物
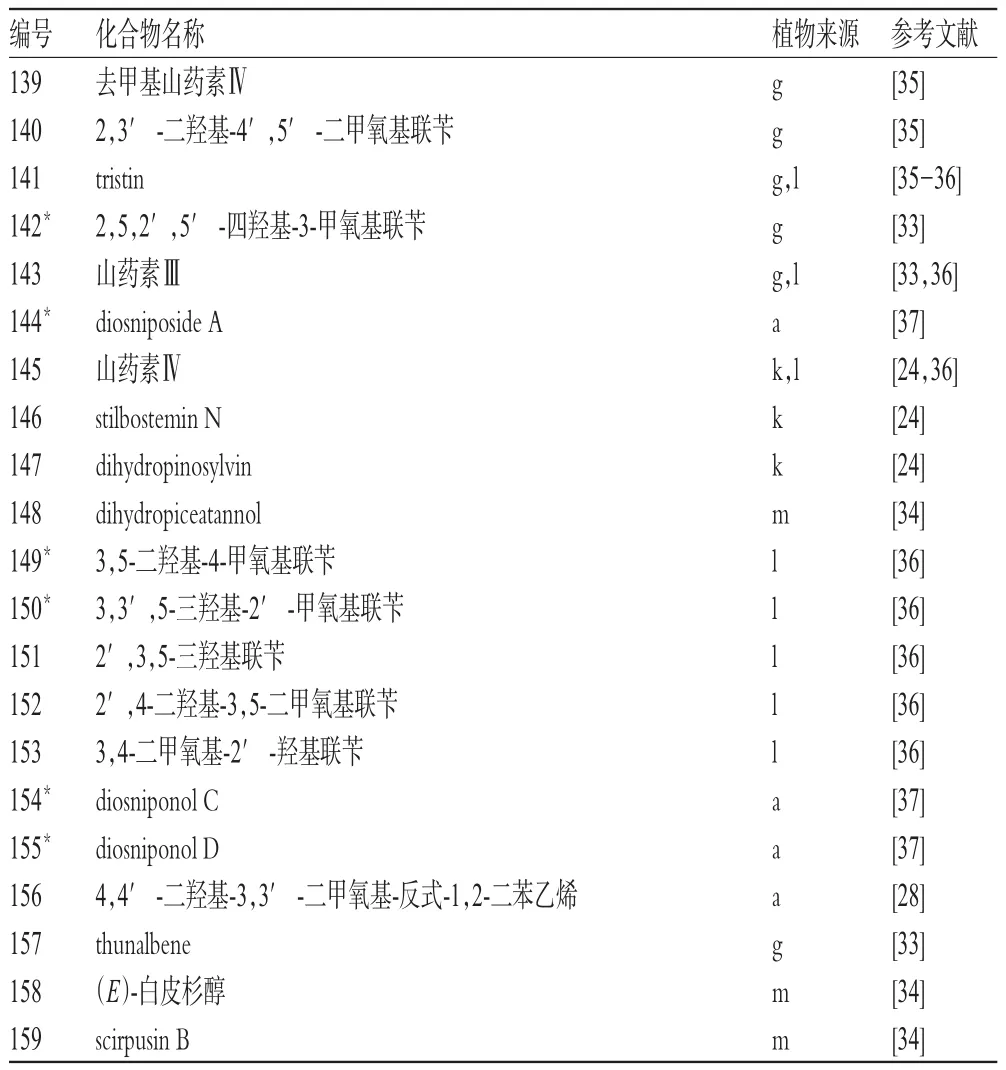
表4 薯蓣属植物中二苯乙烷(烯)类化合物
1.6 二苯庚烷类(化合物188~206)
本属植物中共分离到19个二苯庚烷类化合物,主要来自穿龙薯蓣、薯蓣、D.villosa等植物,详见表6[13,24,28,35-36,48-49]。
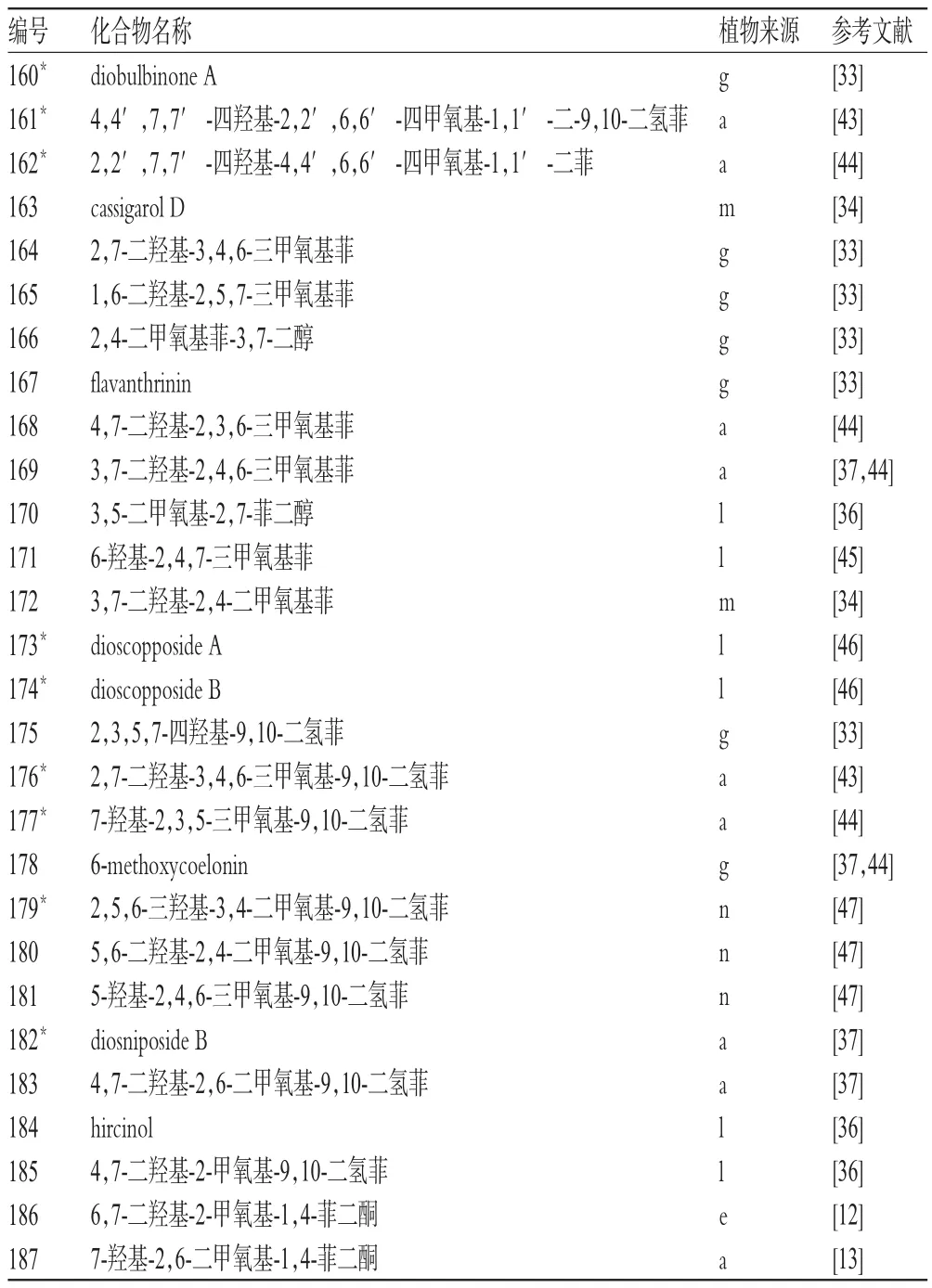
表5 薯蓣属植物中菲类化合物
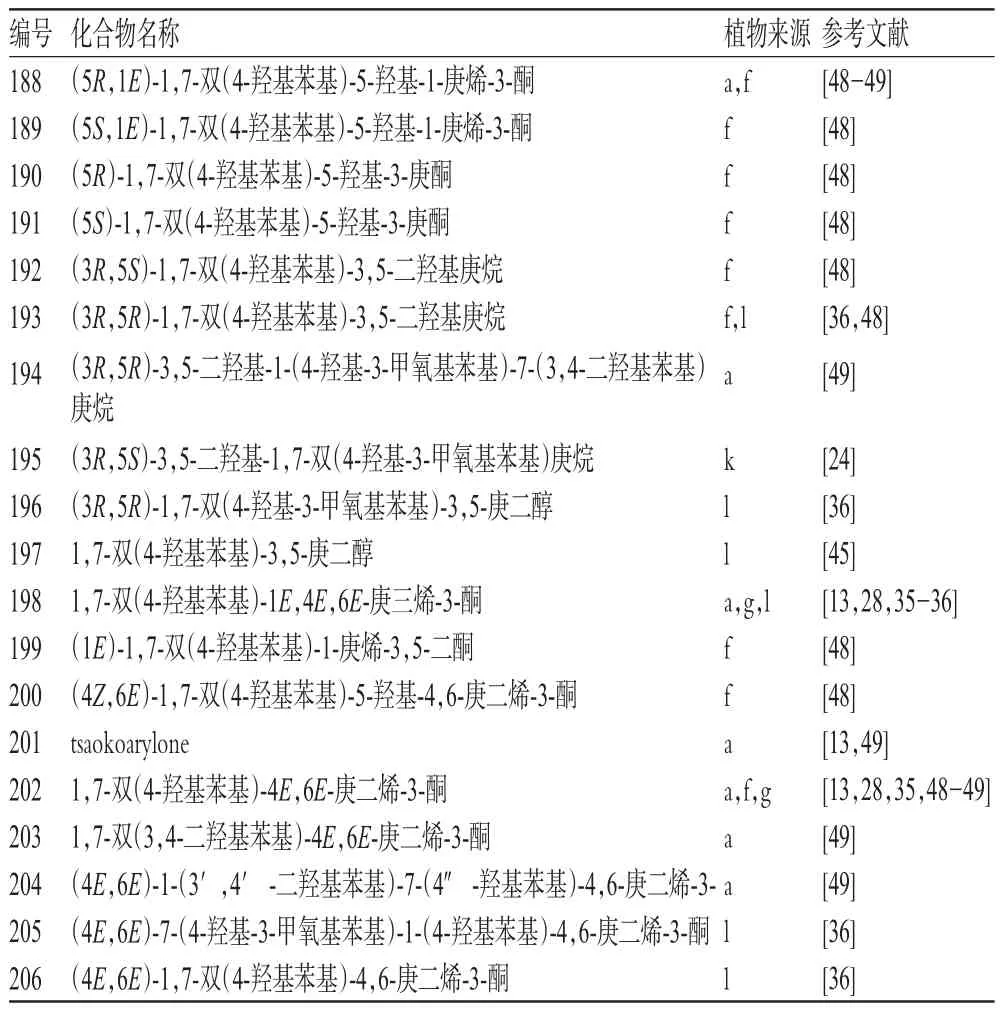
表6 薯蓣属植物中二苯庚烷类化合物
1.7 其他类(化合物207~259)
除以上化合物外,薯蓣属植物中还含有其他成分,如苯丙素、蒽醌、含氮化合物、有机酸、酯等53个,其中新化合物9个,详见表7[12-13,17,24,27-29,33,35-37,45,48-49]。
2 薯蓣属植物的药理活性
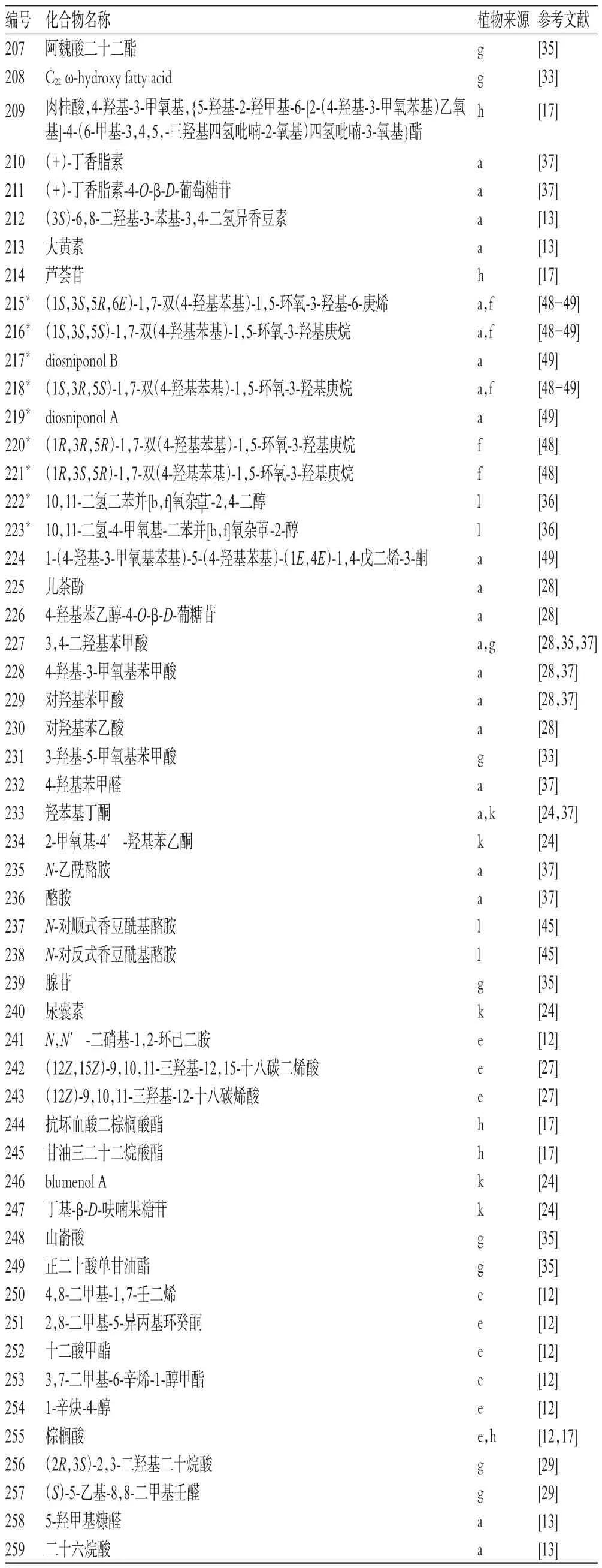
表7 薯蓣属植物中其他类化合物
2.1 抗肿瘤作用
赵庆兵等[9]研究表明,化合物10能明显抑制人肝癌细胞HepG2的增殖,其半数抑制浓度(IC50)为(5.50±1.06)μmol/L。 Tong QY等[11]发现,化合物4能够抑制一组已知的人和鼠类癌细胞的增殖,其细胞毒活性几乎接近于多柔比星对鼠结肠癌细胞C26的活性。Liu H等[15,19]发现,化合物3、11、16、17对人类肝癌细胞Bel-7402、SMMC7721均有抑制作用。Tapondjou LA等[21]研究发现,化合物41、43、48对膀胱癌细胞ECV-304具有中度细胞毒活性。Kim KH等[31]从日本薯蓣的块茎中提取并鉴定出2个新的化合物92、93,两者的细胞毒活性通过其对4种人类肿瘤细胞株(人肺腺癌细胞A549、人卵巢癌细胞SKOV-3、人皮肤黑色素瘤细胞SK-MEL-2、人结肠癌细胞HCT15)和1个人类正常细胞株(人脐静脉内皮细胞HUVEC)的抑制效果来评定。结果显示,化合物92、93对以上4种肿瘤细胞株均有细胞毒活性(IC50为6.3~26.9 μmol/L),对人类正常细胞株HUVEC几乎无细胞毒性(IC50为27.1~28.8 μmol/ L)。这提示化合物92、93的细胞毒活性在肿瘤细胞和正常细胞之间具有一定的选择性。Itharat A等[47]从D.membranacea根茎中分离得到化合物179、180、181,并对其作了活性测试。结果发现,化合物180对肺癌细胞COR-L23、乳腺癌细胞MCF-7和前列腺癌细胞PC3均有最强的抗肿瘤活性,化合物181对前列腺癌细胞PC3具有选择性抗癌活性,化合物179仅对乳腺癌细胞MCF-7有选择性抗癌活性;而该植物的粗提取物对正常人肺细胞MRC-5几乎无毒性。
2.2 保护心血管作用
赵娜夏等[4]采用大鼠静脉旁路血栓形成的方法,测定了穿龙薯蓣中部分化合物的抗血栓形成活性。结果显示,化合物3、9具有一定的抗血栓活性,作用强度接近阿司匹林。Li H等[16]研究盾叶薯蓣根茎中提取的总甾体皂苷(TSS)的抗血栓作用时发现,TSS可抑制大鼠血小板聚集、血栓形成及延长活化部分凝血活酶时间、凝血酶时间、凝血酶原时间活性,该抑制活性呈剂量依赖性;同时TSS也可呈剂量依赖性地延长小鼠的出血时间和凝血时间。于文喜等[50]报道了盾叶薯蓣中水溶性成分对乳鼠心肌细胞缺血/再灌注损伤有显著的保护作用。刘方永等[51]研究发现,穿山龙总皂苷对反复脑缺血再灌注损伤小鼠的学习记忆功能具有改善作用,其机制可能与增强脑组织中超氧化物歧化酶活力、降低丙二醛和一氧化氮(NO)含量有关。
2.3 调节神经系统作用
Kim KH等[24]研究发现,日本薯蓣中化合物61、147、195、246、247对C6大鼠神经胶质瘤细胞系神经生长因子(NGF)有正性调节作用,且无明显细胞毒性。Woo KW等[37,49]报道了穿龙薯蓣提取物的抗神经炎症活性。该抗炎活性通过分离所得化合物对小鼠神经小胶质细胞BV-2中NO生成的效果来评价。结果发现,化合物201、204能显著抑制NO生成(IC50分别为13.36、14.36 μmol/L),且对脂多糖活化的BV-2细胞系未产生细胞毒性。进一步发现,化合物169为潜在的NGF诱导物,并且能有效降低NO水平。Zheng KY等[46]指出,D.opposita中化合物173、174能抑制脂多糖诱导产生的NO,其IC50分别为5.8、7.2 μmol/L。
2.4 抗氧化作用
Liu H等[33]测试了黄独中2个新化合物的抗氧化能力,结果显示,化合物142在亚铁还原能力实验(FRAP)和DPPH实验中均显示出较强的抗氧化活性和自由基清除活性;在1 mmol/L浓度下,其吸光度为0.52±0.01,半数有效浓度为(2.57±0.06)mmol/L。Yang MH等[36]实验显示,化合物141、152、170、184、185、196、205具有清除自由基的活性;且化合物150、151、185、205、206、222还具有选择性抑制环氧化酶2(COX-2)的活性。Murugan M等[52]报道了D.esculenta(Lour). Burkill甲醇提取物在体外试验中的抗氧化活性,指出这可能与其丰富的酚类及黄酮成分有关。Chiu CS等[53]发现,D.japonica Thunb.var.pseudojaponica乙醇提取物既能减少巨噬细胞(RAW264.7)中脂多糖诱导的NO产生,又可减少诱导型一氧化氮合酶和COX-2在细胞中的表达,具有作为天然抗氧化剂及抗炎剂的潜力。李培源等[54]研究发现,萆薢的乙酸乙酯、丙酮、乙醇提取物均有较强的抗氧化活性,且与提取物总黄酮含量顺序一致,提示其优异的抗氧化能力与总黄酮含量有关。
2.5 降血脂作用
Wang T等[23,55]研究发现,患有高脂血症的大鼠经化合物53干预后,其血液凝固时间明显缩短,其血中三酰甘油、胆固醇、低密度脂蛋白和高密度脂蛋白的浓度也都相应地发生了改变。之后,又对化合物9的降血脂功效进行了研究,结果发现,经腹腔注射化合物9的高脂血症大鼠,其血中胆固醇、三酰甘油、低密度脂蛋白和高密度脂蛋白水平均恢复正常,出血时间和凝血时间也显著改善。
2.6 降血糖作用
赵小亮研究指出,黄山药中化合物1、69、97对α-葡萄糖苷酶具有较好的抑制活性,其IC50分别为(0.11±0.04)、(0.09± 0.01)、(0.04±0.01)mmol/L[8]。Shan XQ等[32]报道了黄山药中化合物94、95对地塞米松诱导胰岛素抵抗的脂肪细胞的影响。结果显示,以10 mg/ml的罗格列酮对胰岛素增敏作用为100%为参考,10 mg/ml的化合物94、95对胰岛素增敏率分别为84.8%、89.4%,显示其潜在的胰岛素增敏作用。苏瑾等[56]研究发现,山药多糖能改善HepG2细胞的葡萄糖消耗能力,并且可以增强细胞对胰岛素的敏感性,具有体外降糖作用。
2.7 其他作用
罗鼎天等[57]报道了怀山药多糖良好的胃黏膜保护作用,指出该机制可能与上调胃溃疡大鼠胃组织碱性成纤维细胞生长因子(bFGF)含量和胃黏膜bFGF受体表达水平有关。单海丽等[58]研究发现,穿山龙醇提物对直接注射尿酸诱导的小鼠高尿酸血症,或是由次黄嘌呤和氧嗪酸钾诱导的小鼠高尿酸血症,均具有显著治疗效果。
3 结语
薯蓣属植物资源丰富、药理活性多样,但目前对其的研究主要围绕盾叶薯蓣、穿龙薯蓣、黄山药、黄独、薯蓣等少数植物展开,且多属基础性研究,对于其临床应用报道较少。下一步应扩大基础研究范围,为寻找以甾体为先导化合物的心血管药物和抗肿瘤药物提供新的思路;同时,应加强活性化合物的临床研究,为进一步合理开发利用薯蓣属植物资源提供科学依据。
[1] 中国科学院中国植物志编辑委员会.中国植物志:第16卷:第1分册[M].北京:科学出版社,1985:54-55.
[2] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:28-301.
[3] 张园园,潘激扬,莫愁,等.穿龙薯蓣中甾体皂苷的分离与鉴定[J].中南药学,2012,10(6):443.
[4] 赵娜夏,韩英梅,张士俊.穿龙薯蓣中抗血栓活性成分研究[J].中草药,2011,42(4):652.
[5] Ali Z,Smillie TJ,Khan IA.Two spirostan steroid glycoside fatty esters from Dioscorea cayenensis[J].Nat Prod Commun,2013,8(3):323.
[6] Ali Z,Smillie TJ,Khan IA.7-oxodioscin,a new spirostan steroid glycoside from the rhizomes of Dioscorea nipponica[J].Nat Prod Commun,2013,8(3):319.
[7] Zhao XL,Jing WG,Han SY,et al.Two new steroidal saponins from Dioscorea panthaica[J].Phytochem Lett,2011,4(3):267.
[8] 赵小亮.荷叶化学成分和黄山药皂苷类化学成分及生物活性的研究[D].北京:北京协和医学院,2011:105-137.
[9] 赵庆兵,黄文,吴文芳,等.盾叶薯蓣难溶性甾体皂苷的提取及其抑制人肝癌细胞HepG2增殖的研究[J].华西药学杂志,2010,25(5):527.
[10] Ali Z,Smillie TJ,Khan IA.Cholestane steroid glycosides from the rhizomes of Dioscorea villosa(wild yam)[J]. Carbohydr Res,2013,doi:10.1016/j.carres.2012.12.022.
[11] Tong QY,He Y,Zhao QB,et al.Cytotoxicity and apoptosis-inducing effect of steroidal saponins from Dioscorea zingiberensis Wright against cancer cells[J].Steroids,2012,77(12):1 219.
[12] 姜哲,李雪征,李宁,等.绵萆薢化学成分研究[J].中草药,2009,40(7):1 024.
[13] 李淑青.粉萆薢化学成分、皂苷制备工艺及其质量控制方法研究[D].北京:北京中医药大学,2013:37-44.
[14] 王辉,胡长鹰,庞自洁,等.盾叶薯蓣中甾体皂苷的研究[J].中草药,2009,40(1):36.
[15] Liu H,Chou GX,Wang JM,et al.Steroidal saponins from the rhizomes of Dioscorea bulbifera and their cytotoxic activity[J].Planta Med,2011,77(8):845.
[16] Li H,Huang W,Wen Y,et al.Anti-thrombotic activity and chemical characterization of steroidal saponins from Dioscorea zingiberensis C.H.Wright[J].Fitoterapia,2010,81(8):1 147.
[17] 宋文平.大青薯化学成分及药效学研究[D].福州:福建农林大学,2012:35-40.
[18] Zheng L,Zhou Y,Zhang JY,et al.Two new steroidal saponins from the rhizomes of Dioscorea zingiberensis[J]. Chin J Nat Med,2014,12(2):142.
[19] Liu H,Chou GX,Wu T,et al.Steroidal sapogenins and glycosides from the rhizomes of Dioscorea bulbifera[J].J Nat Prod,2009,72(11):1 964.
[20] Tabopda TK,Mitaine-Offer AC,Tanaka C,et al.Steroidal saponins from Dioscorea preussii[J].Fitoterapia,2014,doi:10.1016/j.fitote.2014.06.006.
[21] Tapondjou LA,Jenett-Siems K,Böttger S,et al.Steroidal saponins from the flowers of Dioscorea bulbifera var.sativa[J].Phytochemistry,2013,doi:10.1016/j.phytochem. 2013.07.020.
[22] 杨如同,佟海英.盾叶薯蓣鲜根茎中甾体皂苷成分研究[J].中药材,2010,33(1):62.
[23] Wang T,Choi RCY,Li J,et al.Antihyperlipidemic effect of protodioscin,an active ingredient isolated from the rhizomes of Dioscorea nipponica[J].Planta Med,2010,76(15):1 642.
[24] Kim KH,Kim MA,Moon E,et al.Furostanol saponinsfrom the rhizomes of Dioscorea japonica and their effects on NGF induction[J].Bioorg Med Chem Lett,2011,21(7):2 075.
[25] Zhao XL,Ma XJ,Jing WG,et al.A new steroidal saponin from Dioscorea panthaica[J].J Asian Nat Prod Res,2011,13(7):659.
[26] 徐德平,胡长鹰,王琳,等.盾叶薯蓣中新甾体皂苷的研究[J].药学学报,2009,44(1):56.
[27] Liu XT,Wang ZZ,Xiao W,et al.Cholestane glycosides and trihydroxy fatty acids from the rhizomes of Dioscorea septemloba[J].Planta Med,2010,76(3):291.
[28] 卢丹,刘金平,赵轶卓,等.穿龙薯蓣地上部分的化学成分(Ⅱ)[J].中草药,2010,41(5):700.
[29] 邱军强,李春峰,苗晶囡,等.黄药子的化学成分研究[J].中医药学报,2013,41(5):14.
[30] 单晓庆,梁健,丁立生,等.黄山药根茎中一个新睡茄内酯苷[J].有机化学,2013,33(6):1 349.
[31] Kim KH,Choi SU,Choi SZ,et al.Withanolides from the rhizomes of Dioscorea japonica and their cytotoxicity[J]. J Agric Food Chem,2011,59(13):6 980.
[32] Shan XQ,Peng SL,Shi HL,et al.Panthogenins A and B,two novel norergostanol steroids from Dioscorea panthaica [J].Chin Chem Lett,2014,25(9):1 256.
[33] Liu H,Tsim KWK,Chou GX,et al.Phenolic compounds from the rhizomes of Dioscorea bulbifera[J].Chem Biodivers,2011,8(11):2 110.
[34] Rakotobe L,Mambu L,Deville A,et al.Clerodane and 19-norclerodane diterpenoids from the tubers of Dioscorea antaly[J].Phytochemistry,2010,71(8/9):1 007.
[35] 王刚,林彬彬,刘劲松,等.黄药子化学成分研究[J].中国中药杂志,2009,34(13):1 679.
[36] Yang MH,Yoon KD,Chin YW,et al.Phenolic compounds with radical scavenging and cyclooxygenase-2(COX-2)inhibitory activities from Dioscorea opposita[J].Bioorg Med Chem,2009,17(7):2 689.
[37]Woo KW,Kwon OW,Kim SY,et al.Phenolic derivatives from the rhizomes of Dioscorea nipponica and their antineuroinflammatory and neuroprotective activities[J].J Ethnopharmacol,2014,155(2):1 164.
[38] Wang G,Liu JS,Lin BB,et al.Two new furanoid norditerpenes from Dioscorea bulbifera[J].Chem Pharm Bull,2009,57(6):625.
[39] Tang Y,Xue YB,Zhou L,et al.New norclerodane diterpenoids from the tubers of Dioscorea bulbifera[J].Chem Pharm Bull,2014,62(7):719.
[40] Liu H,Chou GX,Guo YL,et al.Norclerodane diterpenoids from rhizomes of Dioscorea bulbifera[J].Phytochemistry,2010,71(10):1 174.
[41] Kidyu K,Thaisuchat H,Meepowpan P,et al.New clerodane diterpenoid from the bulbils of Dioscorea bulbifera [J].Nat Prod Commun,2011,6(8):1 069.
[42] Teponno RB,Ponou BK,Tapondjou LA,et al.Bafoudiosbulbin H,a new clerodane diterpene from the flowers of Dioscorea bulbifera L.var sativa[J].Phytochem Lett,2013,6(2):310.
[43] Lu D,Liu J,Li P.Dihydrophenanthrenes from the stems and leaves of Dioscorea nipponica Makino[J].Nat Prod Res,2010,24(13):1 253.
[44] Lu D,Liu JP,Li HJ,et al.Phenanthrene derivatives from the stems and leaves of Dioscorea nipponica Makino[J].J Asian Nat Prod Res,2010,12(1):1.
[45] Zhang L,Bai B,Liu X,et al.α-Glucosidase inhibitors from Chinese Yam(Dioscorea opposita Thunb.)[J].Food Chem,2011,126(1):203.
[46] Zheng KY,Zhang ZX,Zhou W,et al.New phenanthrene glycosides from Dioscorea opposita[J].J Asian Nat Prod Res,2014,16(2):148.
[47] Itharat A,Thongdeeying P,Ruangnoo S.Isolation and characterization of a new cytotoxic dihydrophenanthrene from Dioscorea membranacea rhizomes and its activity against five human cancer cell lines[J].J Ethnopharmacol,2014,doi:10.1016/j.jep.2014.08.009.
[48] Dong SH,Nikolić D,Simmler C,et al.Diarylheptanoids from Dioscorea villosa(Wild Yam)[J].J Nat Prod,2012,75(12):2 168.
[49]Woo KW,Moon E,Kwon OW,et al.Anti-neuroinflammatory diarylheptanoids from the rhizomes of Dioscorea nipponica[J].Bioorg Med Chem Lett,2013,23(13):3 806.
[50] 于文喜,胡长鹰,王彦平,等.盾叶薯蓣提取物对乳鼠心肌细胞缺血/再灌注损伤的保护作用[J].中药材,2010,33(3):414.
[51] 刘方永,李传磊,高红莉.穿山龙总皂苷对反复脑缺血再灌注小鼠学习记忆能力的影响[J].中华中医药学刊,2015,33(7):1 676.
[52] Murugan M,Mohan VR.In vitro antioxidant studies of Dioscorea esculenta(Lour).Burkill[J].Asian Pac J Trop Biomed,2012,2(3):1 620.
[53] Chiu CS,Deng JS,Chang HY,et al.Antioxidant and antiinflammatory properties of taiwanese yam(Dioscorea japonica Thunb.var.pseudojaponica(Hayata)Yamam.)and its reference compounds[J].Food Chem,2013,141(2):1 087.
[54] 李培源,卢汝梅,苏炜,等.萆薢总黄酮含量测定及其抗氧化活性研究[J].时珍国医国药,2015,26(6):1 303.
[55] Wang T,Choi RCY,Li J,et al.Trillin,a steroidal saponin isolated from the rhizomes of Dioscorea nipponica,exerts protective effects against hyperlipidemia and oxidative stress[J].J Ethnopharmacol,2012,139(1):214.
[56] 苏瑾,焦钧,于莲,等.山药多糖对人肝癌HepG2细胞葡萄糖消耗能力及胰岛素抵抗的影响[J].中国药房,2015,26(4):458.
[57] 罗鼎天,陆其明,杨志宏,等.怀山药多糖对大鼠胃溃疡的疗效及胃组织碱性成纤维因子及其受体水平的影响[J].中华中医药学刊,2015,33(3):712.
[58] 单海丽,单瑞平,傅旭春.穿山龙醇提取物对高尿酸血症小鼠的治疗作用[J].浙江大学学报:医学版,2015,44(1):49.
(编辑:余庆华)
R284;R285
A
1001-0408(2016)31-4454-06
2016-04-12
2016-07-25)
*药师,硕士。研究方向:天然药物化学、医院药学。电话:023-43780213。E-mail:zengy815@163.com
#通信作者:副主任中药师。研究方向:中药化学、药事管理。E-mail:346809650@qq.com
DOI 10.6039/j.issn.1001-0408.2016.31.39

