山荆子叶总黄酮体外抗氧化活性研究
杨秀东,郭永真,张嫔妹,周鸿立*
(1.吉林化工学院化学与制药工程学院;2.吉林化工学院图书馆,吉林吉林132022)
山荆子叶总黄酮体外抗氧化活性研究
杨秀东1,郭永真1,张嫔妹2,周鸿立1*
(1.吉林化工学院化学与制药工程学院;2.吉林化工学院图书馆,吉林吉林132022)
采用水提醇沉法及溶剂萃取法提取山荆子叶,测定不同提取物的总黄酮含量。通过对DPPH自由基、ABTS自由基和超氧阴离子清除作用研究了山荆子叶体外抗氧化活性。结果显示,山荆子叶水提取物、氯仿萃取物、乙酸乙酯萃取物、正丁醇萃取物及水萃取物中的总黄酮含量分别为0.98%、1.62%、4.23%、1.46%和0.313%。体外抗氧化实验结果表明,山荆子叶乙酸乙酯萃取物具有较强的DPPH自由基、ABTS自由基活性以及超氧阴离子清除能力。山荆子叶可以作为天然抗氧化剂,为山荆子的综合利用与开发奠定基础。
总黄酮;山荆子;抗氧化;DPPH;ABTS
山荆子(Malus baccata(Linn)Borkh),为蔷薇科(Rosaceae)苹果属多年生木本植物,主要分布于我国东北、华北和西南地区,在蒙古、朝鲜、俄罗斯西伯利亚等地也有分布[1],吉林省内大部分山区都有分布。随着绿色食品的快速发展,其果实在食品工业中是酿酒和调制纯绿色饮品的原料,多用于加工果脯、蜜饯和清凉饮料等[2]。其叶在我国很多地区可以煮茶用来减肥[3]。目前,国内针对山荆子果实和叶的化学成分及药理作用研究还鲜有报道,其果实中的主要化学成分包括萜类、酯类、烯烃类、多酚类以及黄酮类化合物,同时还含有锰、硒和锌等微量元素[4,5]。而叶中的主要成分为多酚类和黄酮类化合物[6]。与此同时,现代药理作用研究表明,山荆子果实中的多酚类成分具有对辐射诱导的机体氧化损伤的保护作用[7],山荆子不同溶剂提取物具有明显的抗氧化活性,且其中乙酸乙酯提取物和丙酮提取物分别对人类子宫癌HeLa细胞和肝癌HepG2细胞增殖具有抑制作用[8]。另外,山荆子叶提取物对脂肪酸合酶具有抑制作用,显示其可能应用于减肥[3]。叶提取物还能够明显的改善糖尿病小鼠血糖和血脂的紊乱[6],并对CCl4诱导的小鼠肝损伤具有较好的保护作用[9]。本研究对山荆子叶不同溶剂萃取物的总黄酮含量进行测定,对提取物的体外抗氧化活性进行比较,并初步探讨其黄酮含量与体外抗氧化活性的关系,为开发和利用山荆子资源提供科学依据。
1 材料与方法
1.1材料与试剂
山荆子叶于2015年10月采于长春市郊,经长春中医药大学药学院教授李勇鉴定为蔷薇科(Rosaceae)苹果属(Malus)植物山荆子的干燥叶。芦丁标准品:中国药品生物制品鉴定所;1,1-二苯基 -2-苦肼基自由基(DPPH),ABTS购自美国sigma公司;Vitamin C中国医药集团上海化学试剂公司;无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠、焦性没食子酸、过硫酸钾、硫酸亚铁等药品均为分析纯试剂购自国药集团化学试剂公司。
1.2仪器与设备
TU-1810型紫外可见分光光度计,北京普析通用仪器有限责任公司;SpectraMax Plus384型酶标仪。美国 Molecular Devices公司;RE-3000型旋转蒸发器,上海亚荣生化仪器厂;KQ-118型数控超声波清洗器,昆山市超声仪器有限公司;SHB-ⅢA型循环水式多用真空泵,郑州长城科工贸有限公司;FA2004N型分析天平,上海精密科学股份有限公司;HH-S型恒温水浴锅,江苏省金坛市正基仪器有限公司。
1.3实验方法
1.3.1提取阶段 精确称取50克干燥后山荆子阴干叶,剪碎,置于1000毫升圆底烧瓶中,加入500毫升蒸馏水,浸泡过夜,加热回流2次,每次2小时。提取液减压浓缩至400毫升。加入95%乙醇至醇浓度为80%,静置过夜,抽滤,上清液减压浓缩至体积为400毫升,然后依次将提取液分次用等体积的氯仿、乙酸乙酯和正丁醇萃取各萃取2次,不同溶剂萃取液减压浓缩,干燥后得浸膏,浸膏质量分别为:氯仿部分376.24毫克,乙酸乙酯部分34.31毫克,正丁醇437.79毫克,水提液1232.37毫克。
1.3.2总黄酮含量测定 总黄酮含量测定方法参照胡卫成等的方法制作芦丁标准曲线。精密配制0.2毫克/毫升对照品芦丁的标准液,精密吸取芦丁对照品溶液0.5、1.0、2.0、2.5、3.0、4.0毫升分别置于10毫升容量瓶中,然后加入5%NaNO2溶液0.3毫升,摇匀,放置6分钟,加入10%Al(NO3)3溶液0.3毫升,摇匀,放置6分钟,加入4%NaOH溶液4.0毫升,最后加入80%乙醇溶液定容至刻度,摇匀,放置15分钟。以80%乙醇溶液为空白对照,用紫外分光光度法于515纳米波长处测定上述标准溶液吸光度,制作标准曲线。计算总黄酮含量。山荆子叶提取液和不同溶剂萃取物按上述方法进行实验,与515纳米波长处测定吸光度,计算总黄酮含量。
1.3.3抗氧化活性的测定
1.3.3.1清除DPPH自由基活性实验 DPPH用甲醇溶解配制成0.16毫摩尔/升DPPH甲醇溶液。取不同浓度的样品甲醇溶液和Vc甲醇溶液100微升分别加入96孔板并加入100微升的DPPH溶液,空白用甲醇代替样品溶液。于波长517纳米下测定其吸光度。每份样品平行操作3次。
清除率(%)=[A空白-A样品]/A空白×100
提取物的半数抑制率用IC50值表示
1.3.3.2清除ABTS自由基活性的测定ABTS阳离子自由基的产生是通过ABTS原液与过硫酸钾在室温黑暗中反应12~16小时完成,在供氢抗氧化剂存在的情况下,ABTS+自由基会减少。将5毫升,7毫摩尔/升ABTS+和88微升140毫摩尔/升的过硫酸钾(终浓度)混合,在室温避光条件下静止过夜,将生成的ABTS+工作液用水稀释20~40倍,使其在734微升波长下的吸光度为0.7±0.02,即得到ABTS+工作液。取不同浓度的山荆子样品溶液和Vc甲醇溶液10微升放入96孔板,并加入190微升的ABTS+工作液,空白用甲醇代替样品溶液。室温避光放置6分钟,于波长734纳米下测定其吸光度。每份样品平行操作3次。
计算公式为清除率(%)=[A空白-A样品]/A空白×100
提取物半数抑制浓度用IC50值表示
1.3.3.3超氧阴离子清除实验 稍作超氧阴离子清除实验反应体系包括:200微升的50毫摩尔/升Tris-HCl缓冲溶液,20微升不同浓度的山荆子样品溶液或Vc溶液,20微升的25毫摩尔/升邻苯三酚溶液,混合后立即放入酶标仪中,连续测定4分钟,以吸光度变化率计算样品对超氧阴离子的清除率。
2 结果与讨论
2.1总黄酮含量
以吸光度A为纵坐标,芦丁对照品溶液的浓度C为横坐标,进行直线回归,制备标准曲线,回归方程为 A=13. 07C-0.0075,R2=0.9993,结果表明芦丁在 0.0103~0.0824毫克/毫升浓度范围内呈良好的线性关系。山荆子的总水提取物、氯仿萃取物、乙酸乙酯萃取物、正丁醇萃取物和水萃取物的总黄酮含量分别为生药材的0.98%、1.62%、4.23%、1.46%和0.31%。实验结果表明,山荆子乙酸乙酯萃取物的总黄酮含量最高,其次是氯仿提取物。
2.2山荆子叶的不同提取物对DPPH自由基的清除能力
由图1可知,山荆子叶不同提取物在测试浓度范围内对DPPH自由基均具有一定的清除作用,且其清除作用与浓度呈现剂量依赖关系,其中乙酸乙酯萃取物对DPPH自由基清除作用最强,在浓度为0.1毫克/毫升和0.2毫克/毫升时,对DPPH自由基的清除率分别为76.2%和83.6%。其次为正丁醇萃取物,其DPPH清除作用仅次于乙酸乙酯提取物。而其他提取物也显示了不同程度的DPPH清除活性。结果证明,山荆子叶具有较强的DPPH自由基清除作用。
2.3山荆子叶的不同提取物对ABTS自由基的清除能力
山荆子叶不同提取物对ABTS清除作用如图2所示,在实验浓度范围内,山荆子叶不同提取物都显示了一定的 ABTS清除作用,且其清除作用随着样品浓度增大而增加。其中以乙酸乙酯萃取物的ABTS自由基清除率最高,当其浓度达到0.200毫克/毫升时,ABTS自由基清除率达到最高,最高值为 77.1%,表明ABTS自由基基本被清除。而在此浓度下,正丁醇层的ABTS清除率仅次于乙酸乙酯层,清除率为72.7%。结果证明,总黄酮含量较高的乙酸乙酯萃取物能够较好的清除ABTS。

图1 山荆子不同提取物DPPH清除率

图2 山荆子不同提取物对ABTS自由基清除作用
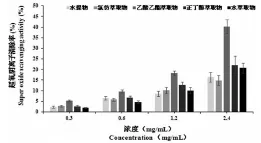
图3 山荆子不同提取物对超氧阴离子自由基清除率
2.4山荆子叶不同提取物对超氧阴离子自由基清除能力
由图3可知,山荆子叶不同提取物对超氧阴离子自由基的清除能力呈浓度依赖关系,而其中乙酸乙酯萃取物对超氧阴离子自由基的清除能力明显高于其他提取物,当浓度为2.4毫克/毫升时,其清除率达到40.3%,相同浓度下,其他提取物的清除率均低于25%。
3 结论
黄酮类化合物是广泛存在于植物界中的一类天然多酚类成分,具有广谱的药理作用,近年来已经成为国内外植物药的开发热点。本实验采用水提醇沉法提取了山荆子阴干叶,并进一步用不同溶剂进行萃取,其中各萃取物总黄酮含量测定结果显示乙酸乙酯萃取物的总黄酮含量最高,其次为氯仿提取物和正丁醇萃取物,而水提取物和水萃取物含量最低。
山荆子叶不同提取物抗氧化活性研究表明,乙酸乙酯萃取物对DPPH、ABTS和超氧阴离子的清除作用明显高于其他提取物,结合其含量测定结果,其抗氧活作用与黄酮类物质含量相关。与此同时,正丁醇萃取物的抗氧化活性较氯仿萃取物和水萃取物的作用强,可能由于山荆子叶中还含有其他多酚类物质,而多酚类物质同样是具有抗氧化活性,因此正丁醇萃取物的抗氧化活性可能与多酚类物质有关。本研究结果表明,山荆子叶是一种潜在的天然抗氧化剂,具有广阔的开发和利用前景。
[1]冯章丽,于文全,顾广军,刘畅,卜海东,刘延杰,程显敏,董雪梅,刑星.山荆子野生资源的研究及利用进展[J].中国林副特产,2016(03):98-101.
[2]吕娜,刘阳,崔艳艳,夏海洋,赵丽丹,陈俊霞.响应面法优化超声波提取山荆子总黄酮工艺[J].中国酿造,2014,33(02):71-74.
[3]Wei X,Zhao R,Sun YH,Cong JP,Meng FG,Zhou HM.The leaf extract of Siberian crabapple(Malus Baccata(Linn.) Borkh)contains potential fatty acid synthase inhibitors[J].Journal ofEnzymeInhibition&MedicinalChemistry.2009,24(01): 234-240.
[4]李伟.顶空固相微萃取-气相色谱质谱法分析山荆子花和叶中的挥发性成分[J].天然产物研究与开发,2012(24):490-493.
[5]丁传波,赵婷,董岭,陈大勇,李慧萍,高畅,李伟,郑毅男,刘文丛.山荆子中根皮苷和黄酮含量的测定及其乙醇提取物的抗氧化活性[J].西北农林科技大学学报(自然科学版).2014, 42(06):161-167.
[6]丁传波,刘璐璐,赵婷,董岭,王洲婷,韩佳彤,郑毅男,刘文从.山荆子叶总黄酮对糖尿病小鼠血糖、血脂的作用[J].食品科学.2014,35(17):226-230.
[7]王璐.山荆子多酚分离及对γ辐射诱导氧化损伤的防护作用[D].2013,哈尔滨工业大学.
[8]王璐,王振宇,李小雨,左丽丽.山荆子不同溶剂提取物的体外抗氧化及抗癌活性[J].食品科技.2013,38(09):201-204.
[9]胡卫成,王新风,沈婷,王毓宁,陈铭,尤龙,纪丽莲,李鹏霞.响应面试验优化莲蓬壳总黄酮超声提取条件及其抗氧化活性[J].食品科学,2015,36(24):51-56.
吉林化工学院博士科研启动基金(批准号:2016007)
R284.2;R285.5
ADOI编号:10.14025/j.cnki.jlny.2016.22.033
杨秀东,博士,吉林化工学院化学与制药工程学院,讲师,研究方向:天然产物及其生物活性研究。
周鸿立,吉林化工学院化学与制药工程学院,教授,研究方向:天然产物研究与开发。

