低共熔溶剂中温度对钒离子氧化还原特性的影响
徐谦,秦立宇,苏华能,徐丽,李华明
低共熔溶剂中温度对钒离子氧化还原特性的影响
徐谦1,秦立宇2,苏华能1,徐丽1,李华明1
(1江苏大学能源研究院,江苏镇江212013;2江苏大学能源与动力工程学院,江苏镇江212013)
相比于传统水系电解质,低共熔溶剂(DES)因其所具有的独特优势,越来越多地被作为液流电池的电解液进行研究。DES的物理属性和电化学特性对温度较为敏感,但迄今为止对其研究较少。报道了温度对VCl3在DES中的物理化学特性的影响。在100 mV·s-1的扫速时,循环伏安(CV)曲线说明在25℃时,钒离子呈现准可逆的状态;随着温度从室温升高至55℃,氧化峰与还原峰之差从0.271 V降低至0.249 V。随着温度的增加,电导率也明显增加,从室温时的2.2 mS·cm-1升高至55℃时的11.16 mS·cm-1,而且黏度出现较大的下降。结果表明温度对DES特性的影响巨大,有必要更加深入研究温度对非水系电解液液流电池性能的影响。
低共熔溶剂;钒离子;电化学;温度效应;电解质
引 言
相比于传统的水系溶液,离子液体具有更宽的电化学窗口,不易挥发,并且其自身的电导率比水体系电解质高[1]。由于其独特的物理和化学特性,离子液体拥有很大的应用前景。例如,一些离子液体被开发作为无水氧化还原液流电池的电解液,并展现出明显的优势[2-3]。Zhang等[4]的研究表明非水液流电池[V(acea)3]在测试过程中呈现出良好的性能,库仑效率在50%左右。离子液体的优势还在于它可被设计用于增强电化学的稳定性,允许较高的电池电压。另外,由于在离子液体中离子扩散系数会变得更低,所以交叉污染便不再是个问题。同时,电活性物质在离子液体中更高的溶解度可以提高电池的能量密度(例如,基于过渡金属乙醇胺阳离子复合物和离散有机阴离子在液态离子中电活性浓度高达6.5 mol·L-1[5]),对减小系统体积、降低成本有着重要的意义。
在基于离子液体的氧化还原液流电池大规模商业化之前,必须解决几个主要的挑战。高昂的成本和有限的可得性是要克服的最大障碍。此外,准备过渡金属盐溶液需要一个复杂的转化,这是为了能够从质子化了的阴离子中得到需要的金属盐。为了解决这些问题,一种特殊的离子液体——低共熔溶剂被提了出来。一定化学计量比的有机卤化物盐与一种能够形成复杂卤化物的材料相混合,二者通过氢键的作用形成一种在环境温度下是液体的材料[6-7]。最普遍使用的低共熔溶剂是由氯化胆碱(作为卤盐)和其他不同的络合剂组成,如尿素(这种低共熔溶剂叫做氯化胆碱-尿素)、酰胺、丙二酸、乙二醇(这种低共熔溶剂命名为ethaline)[8]。低共熔溶剂显示出类似多氯离子液体的性能,但制备更加简单。它们通常是无毒的、可生物降解的,而且其价格要比离子液体低一个数量级。
前期的研究人员已经对低共熔溶剂(DES)进行了一些研究。其中,Lloyd等[9]对铜配合物在低共熔溶剂的电化学特性作了报道;Sanz等[10]利用ethaline低共熔溶剂发明了一种铜混合氧化还原流体电池。这种所有工作表面具有低共熔溶剂铜的氧化还原流体电池能够以较高效率进行循环。由于铁是一种容易获得的金属,所以Fe(Ⅱ)/Fe(Ⅲ)在DES中的氧化还原特性最近也被研究过[11]。Lloyd等[5]在ethaline低共熔溶剂里发明了一种Zn-Fe氧化还原液流电池。当使用FeCl3时,在低共熔溶剂电解质中发现了FeCl4复合体,整个电池的能源效率为78%,并且电流密度达到了0.5 mA·cm-2。
在所有的低共熔溶剂中,氯化胆碱-尿素低共熔溶剂已经被用于室温下不同的电化学系统中,这主要是因为在室温下由于氢键的作用,氯化胆碱-尿素低共熔溶剂呈液态而且其中的尿素不会分解[12]。先前的实验大多是在不同的离子液体的环境下,测试vanadium acetylacetonate[V(acea)3]的电化学性能:Bahadori等[13]在实验中采用了14种不同DES体系并进行性能对比;Zhang等[4]在acetonitrile(CH3CN)的体系中,采用了两种不同的支持电解质,对钒离子的电化学特性做了报道。但是鲜有文章研究温度对无水体系性能的影响。由于DES的物理化学特性对温度的敏感性,通过控制运行温度,探求DES随温度变化的规律,能增强人们对于无水体系液流电池的认识,对大力推广无水液流电池的应用是非常重要的[14]。本文采用氯化胆碱和尿素的混合溶液作为电解质,正极的电化学活性物质采用FeCl3,负极使用VCl3。之前相关报道已经对铁离子的电化学性能做了探究[11],所以本文主要探究温度对钒离子在该类DES中特性的影响。实验分别从物理化学两个方面对VCl3做了研究,测量了黏度、电导率、电化学性能随温度的变化。
1 实 验
1.1 电解质的准备
实验所用的电解液是用氯化胆碱(Aladdin, 98%)和尿素(国药试剂57-13-6,99%)按1:2的摩尔比混合得到的低共熔溶剂(DES),然后在密封烧杯中保持100℃并持续搅拌直至形成无色透明液体,再冷却至室温。长期不使用的DES溶剂会出现白色晶状沉淀,因此在实验前要提前对DES进行加热,加热温度一般在50℃以上,加热时间一般为30 min左右,加热过程中用玻璃棒搅拌以促进结晶沉淀的溶解。实验结束后,使用后的DES要及时采取密封隔绝空气的处理措施,防止空气中的水蒸气和氧气污染溶液。可以用保鲜膜等覆盖在装有DES的烧杯上进行密封处理。实验测试的电解质为VCl3(沃凯,97%),其浓度为0.1 mol·L-1,保持70℃并不断搅拌,直至形成一种墨绿色的均匀液体为止。
1.2 电导率和黏度的测试
电导率和黏度的测试分别采用电导率仪(DDS-307A型)和黏度测试仪(数字式黏度计)。电解质放置在恒温水槽里,通过热电偶检测溶液温度的状况,确保电解质均匀地达到设定温度,迅速取出,测量其值。所有测量数据均在同一状况下测量。分别测量室温(25℃±1℃)、30℃、35℃、40℃、45℃、50℃、55℃的值,每一测温点测量3次并取平均值记录,所有的实验数据均是在配制完成后24 h内测量所得。
1.3 电化学测量
在电化学工作站(辰华CHI600)上采用三电极体系测量V(Ⅲ)/V(Ⅱ)的电化学特性。工作电极使用直径为5 mm的玻碳电极(GCE),铂电极作为对电极,饱和甘汞为参比电极(SCE)。实验之前,玻碳电极在鹿皮上使用0.2 mm铝粉进行抛光,然后将抛光后的电极放入去离子水中,用超声波进行清洗。在-0.5~1.5 V的范围内对0.1 mol·L-1的VCl3进行CV扫描。在测量之前,电解质溶液预先通入氮气15 min,去除溶解在溶液中的氧气,整个实验均在氮气的氛围中进行,分别测量在室温(25℃±1℃)、35℃、45℃、55℃状态下的CV图,每个温度进行3次实验。
2 结果和讨论
2.1 GCE上V(Ⅲ)/V(Ⅱ)氧化还原反应的特性
在实验开始之前,空白的DES在室温下进行了测试,结果如图1所示。在-1.2~0 V的范围中(Hg/Hg2Cl2),DES并没有出现明显的氧化还原峰,这说明DES相比于传统的水体系,提供了一个更宽的电化学窗口。在-0.8 V时,电流出现一些增加可以解释为DES的分解所造成的[11]。
图2是在不同温度不同扫速下,0.1 mol·L-1的VCl3的CV图。从图中可以明显看出一对氧化还原峰,其中在-1.35 V出现的峰电流,结合图1可以看出为DES分解造成的。在给定的扫速下,温度的升高对钒离子的电化学特性起积极的作用。在100 mV·s-1的扫速下,室温下阳极电流为0.287 mA·cm-2,当温度升高至55℃时峰电流值达到0.933 mA·cm-2。说明随着温度的升高反应速率得到了提升,离子的运动更加剧烈,离子间的碰撞更加频繁,离子碰撞克服活化能的概率随着温度的升高不断提升[15]。

图1 空白DES的CV图

图2 不同扫速下0.1 mol·L-1VCl3的CV曲线
电化学反应的反应速率是与温度相关的,并可以通过Arrhenius方程计算得到,计算式如下[16]

2.2 DES中钒离子的传输性能
2.2.1 VCl3在DES中的扩散系数 图3展示了在不同温度下0.1 mol·L-1的VCl3在玻碳电极上的CV图。从图中可以看出在DES中,钒离子呈现了一种准可逆的状态。理论上,对于准可逆反应的扩散系数是介于完全可逆()和完全不可逆扩散系数()之间的。对于一个完全可逆的氧化还原反应,其峰电流可通过式(2)给出[17]

式中,表示在电极反应过程中转移的电子数,是反应电极的面积,是溶液的体浓度,是电解质溶液的扩散系数,是扫描速率。


式中,P和P/2分别是峰电流和半峰电流的电势。

图3 不同温度不同扫速下0.1 mol·L-1 VCl3的CV曲线
图4展示了阳极峰电流与扫速平方根的关系。可以看出,阳极电流与扫速的平方根近似呈直线关系,并且直线的斜率随着温度的降低持续减少。表1展示了通过式(2)和式(3)估算出来的钒离子的扩散系数。
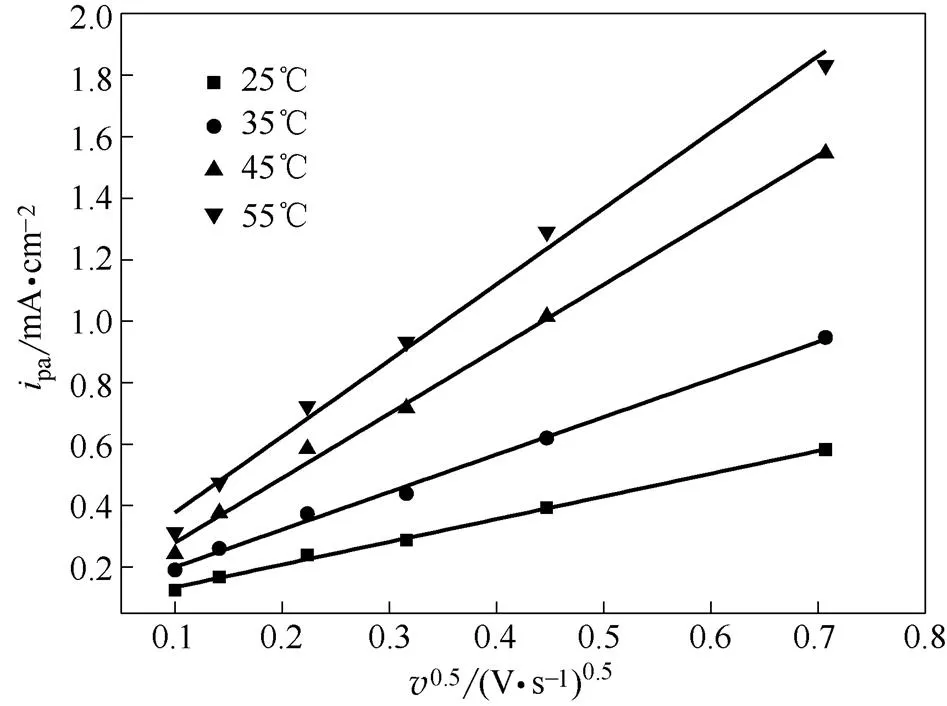
图4 阳极峰电流与扫速平方根的关系

表1 0.1 mol·L-1 V(Ⅲ)的扩散系数
从表1中看出随着温度的增加,扩散系数不断增加,在室温时为7.56×10-10cm2·s-1,在55℃时达到了8.45×10-9cm2·s-1,提升了一个数量级,传质的效果得到了显著的提升。但是相比于在水体系中的扩散系数[19],相同温度下,DES中的扩散系数仍然要小一个数量级以上,这可能是由于DES的黏度较大,离子间相互作用较强使得传质受阻。在非水体系的液流电池中,活性物质在电解液中的质量传输将会是限制电池性能的一个关键性问题。
2.2.2 VCl3在DES溶液中的电导率 图5(a)展示了在DES中0.1 mol·L-1的VCl3和空白的DES溶液的电导率。在室温下,电解质的电导率为2.2 mS·cm-1,随着温度分别升高至45℃和55℃,电导率达到了7.54 mS·cm-1和11.16 mS·cm-1。显然,由于温度的增加使得离子的电迁移得到了增强。电解质的电导率适用如下公式[20]


图5 0.1 mol·L-1 VCl3和空白DES的电导率(a)及电导的活化能(b)
2.2.3 VCl3在DES溶液中的黏度 图6展示了黏性液体黏度随温度变化的曲线,在室温时0.1 mol·L-1VCl3的黏度为312 mPa·s,当温度达到55℃时,黏度仅为最初的1/6,为56.2 mPa·s。

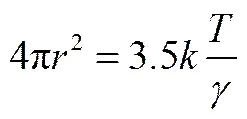
其中,是Boltzmann常数;是空穴的平均半径;是液体的表面张力;是热力学温度。通过空穴理论,在室温下液体的黏度可以通过式(8)计算得到[21]

溶液的黏度是电解质的一项重要参数,因为它会影响通过电极的压力损失[22]

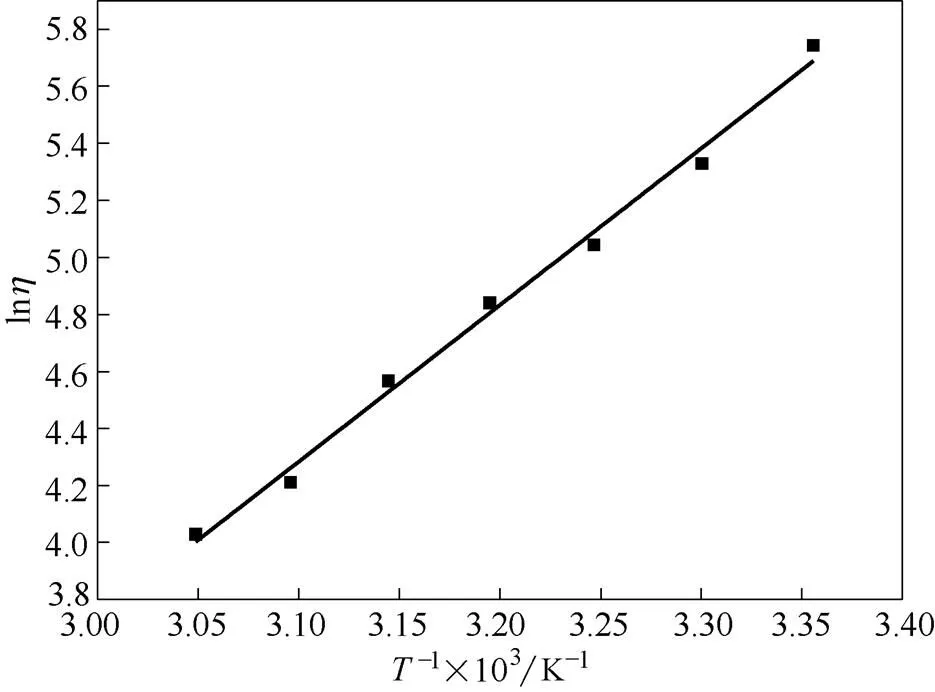
图6 电解液的黏度随温度的变化
3 结 论
本文对温度作用于非水体系电解质的物理化学特性做了研究,分别测量了从室温至55℃时电解质的性能。循环伏安曲线显示,在室温下,氧化峰和还原峰电势之差为0.271 V,当温度提升到55℃时,电势差减小到0.249 V。阳极电流和阴极电流分别从室温时的0.287 mA·cm-2和-0.281 mA·cm-2升高至0.933 mA·cm-2和-0.787 mA·cm-2。这说明升高温度不仅使钒离子的氧化还原性能得到提升,也加快了反应的速率。在物理性能方面,电导率从室温时的2.2 mS·cm-1升高至55℃时的11.16 mS·cm-1,黏度从312 mPa·s降至56.2 mPa·s。上述结果说明通过控制液流电池的运行温度,可以减少液流电池的内部损耗,提高其效率。故在优化非水体系液流电池系统时,对运行温度进行控制是一种有效的途径。
[1] LLOYD D, VAINIKKA T, KONTTURI K. The development of an all copper hybrid redox flow battery using deep eutectic solvents [J]. Electrochimica Acta, 2013, 100: 18-23.
[2] HIRAO M, SUGIMOTO H, OHNO H. Preparation of novel room-temperature molten salts by neutralization of amines [J]. Journal of the Electrochemical Society, 2000, 147 (11): 4168-4172.
[3] SCORDILIS-KELLEY C, FULLER J, CARLIN R T,. Alkali metal reduction potentials measured in chloroaluminate ambient- temperature molten salts [J]. Journal of the Electrochemical Society, 1992, 139 (3): 694-699.
[4] ZHANG D, LIU Q, SHI X,. Tetrabutylammonium hexafluorophosphate and 1-ethyl-3-methyl imidazolium hexafluorophosphate ionic liquids as supporting electrolytes for non-aqueous vanadium redox flow batteries [J]. Journal of Power Sources, 2012, 203: 201-205.
[5] LLOYD D, VAINIKKA T, RONKAINEN M,. Characterisation and application of the Fe(Ⅱ)/Fe(Ⅲ) redox reaction in an ionic liquid analogue [J]. Electrochimica Acta, 2013, 109: 843-851.
[6] CHAKRABARTI M H, MJALLI F S, ALNASHEF I M,. Prospects of applying ionic liquids and deep eutectic solvents for renewable energy storage by means of redox flow batteries [J]. Renewable and Sustainable Energy Reviews, 2014, 30: 254-270.
[7] ABBOTT A P, CAPPER G, SWAIN B G,. Electropolishing of stainless steel in an ionic liquid [J]. Transactions of the IMF, 2013, 83 (1): 51-53.
[8] LI W, ZHANG Z, HAN B,. Switching the basicity of ionic liquids by CO2[J]. Green Chemistry, 2008, 10 (11): 1142-1145.
[9] LLOYD D, VAINIKKA T, MURTOMÄKI L,. The kinetics of the Cu2+/Cu+redox couple in deep eutectic solvents [J]. Electrochimica Acta, 2011, 56 (14): 4942-4948.
[10] SANZ L, LLOYD D, MAGDALENA E,. Description and performance of a novel aqueous all-copper redox flow battery [J]. Journal of Power Sources, 2014, 268: 121-128.
[11] XU Q, ZHAO T S, WEI L,. Electrochemical characteristics and transport properties of Fe(Ⅱ)/Fe(Ⅲ) redox couple in a non-aqueous reline deep eutectic solvent [J]. Electrochimica Acta, 2015, 154: 462-467.
[12] ABBOTT A P, BARRON J C, RYDER K S,. Eutectic-based ionic liquids with metal-containing anions and cations [J]. Chemistry—A European Journal, 2007, 13 (22): 6495-6501.
[13] BAHADORI L, HASHIM M A, MANAN N S A,. Investigation of ammonium-and phosphonium-based deep eutectic solvents as electrolytes for a non-aqueous all-vanadium redox cell [J]. Journal of the Electrochemical Society, 2016, 163 (5): A632-A638.
[14] ABBOTT A P, CAPPER G, DAVIES D L,. Solubility of metal oxides in deep eutectic solvents based on choline chloride [J]. Journal of Chemical & Engineering Data, 2006, 51 (4): 1280-1282.
[15] ZHANG C, ZHAO T S, XU Q,. Effects of operating temperature on the performance of vanadium redox flow batteries [J]. Applied Energy, 2015, 155: 349-353.
[16] SUM E, SKYLLAS-KAZACOS M. A study of the V(Ⅱ)/V(Ⅲ) redox couple for redox flow cell applications [J]. Journal of Power sources, 1985, 15 (2/3): 179-190.
[17] BARD A J, FAULKNER L R, LEDDY J,. Electrochemical Methods: Fundamentals and Applications [M]. New York: Wiley, 1980.
本文是一篇极佳的刻画人物的描写文。作者行文极具匠心,结构巧妙严谨,文字简洁有力。在谋篇上引而不发,恰到好处地揭秘点题。(张伊娜,224)使一个怪异,猥琐,令人生厌的形象跃然于纸上。文章运用多种修辞和技巧,如排比,夸张,倒装,最高级,独立主格结构等不胜枚举。在讲授本文时候,教师一定要以读者的角度来帮助学生细致分析,深入理解,使学生能更好地理解原文,体会作者的良苦用心,从而能够熟悉作者使用的各种修辞手法以达到提高学生自身写作能力的目的。
[18] CASAS J M, CRISÓSTOMO G, CIFUENTES L. Speciation of the Fe(Ⅱ)-Fe(Ⅲ)-H2SO4-H2O system at 25 and 50℃ [J]. Hydrometallurgy, 2005, 80 (4): 254-264.
[19] XIAO S, YU L, WU L,. Broad temperature adaptability of vanadium redox flow battery (1): Electrolyte research[J]. Electrochimica Acta, 2016, 187: 525-534.
[20] BOCKRIS J O, REDDY A K N. Modern Electrochemistry: Vol. 1 [M]. New York, 1970: Chapter 6.
[21] ABBOTT A P. Application of hole theory to the viscosity of ionic and molecular liquids [J]. Chem. Phys. Chem., 2004, 5 (8): 1242-1246.
[22] TANG A, BAO J, SKYLLAS-KAZACOS M. Studies on pressure losses and flow rate optimization in vanadium redox flow battery [J]. Journal of Power Sources, 2014, 248: 154-162.
Effect of temperature on characteristics of V(Ⅲ)/V(Ⅱ) redox couple in non-aqueous deep eutectic solvent
XU Qian1, QIN Liyu2, SU Huaneng1, XU Li1, LI Huaming1
(1Institute for Energy Research, Jiangsu University, Zhenjiang 212013, Jiangsu, China;2School of Energy and Power Engineering, Jiangsu University, Zhenjiang 212013, Jiangsu, China)
Compared with conventional aqueous electrolyte, deep eutectic solvent (DES) has been studied as the electrolyte of flow battery for its unique advantages. However, its physical and electrochemical properties are more sensitive to the temperature and related researches can hardly be found in open literature. The aim of the work is to study the physical and electrochemical properties of vanadium ions in DES through varying the operating temperatures. The curves of cyclic voltammetry indicate that vanadium ions show a quasi-reversible reaction. As the temperature increased from ambient temperature to 55℃, the difference between oxidation and reduction peaks decreases from 0.271V to 0.249 V at the scan rate of 100 mV·s-1. At the same time, both the anodic and the cathodic peak current densities of the V(Ⅱ)/V(Ⅲ) have the similarly incremental trend. The conductivity also has an obvious increment from 2.2 mS·cm-1at ambient temperature to 11.16 mS·cm-1at 55℃, but the viscosity of DES vanadium ions have a huge drop. The results prove that the operating temperature plays a vital effect on the characteristics of DES and it deserves a further study.
deep eutectic solvent; vanadium ion; electrochemistry; temperature effect; electrolytes
date: 2016-07-21.
XU Qian, xuqian@ujs.edu.cn
10.11949/j.issn.0438-1157.20161025
TK 02
A
0438—1157(2016)12—5298—07
国家自然科学基金项目(51306076);中国博士后基金项目(2015M571685)。
supported by the National Natural Science Foundation of China (51306076) and the Post- doctoral Fund of China (2015M571685).
2016-07-21收到初稿,2016-08-21收到修改稿。
联系人及第一作者:徐谦(1981—),男,博士,副教授。

