吡啶-2,6-二[N-(1′-羟乙基)酰胺]对Cr(Ⅲ)离子识别性能研究
陈晓靓,罗显华,罗世霞
(1 贵阳护理职业学院,贵州 贵阳 550081;2 贵州师范大学化学与材料科学学院,贵州 贵阳 550001)
吡啶-2,6-二[N-(1′-羟乙基)酰胺]对Cr(Ⅲ)离子识别性能研究
陈晓靓,罗显华,罗世霞
(1 贵阳护理职业学院,贵州 贵阳 550081;2 贵州师范大学化学与材料科学学院,贵州 贵阳 550001)
通过设计合成的吡啶双酰胺配体来研究对重金属Cr(Ⅲ)离子的识别作用。通过紫外-可见光谱分析方法,考察了配体吡啶-2,6-二[N-(1′-羟乙基)酰胺]对重金属Cr(Ⅲ)离子的选择性识别作用。结果表明:配体吡啶-2,6-二[N-(1′-羟乙基)酰胺]对Cr3+的响应具有较高的选择性,且不受碱金属、碱土金属以及其它过渡金属离子的干扰,可形成配位模式为1:2型的稳定络合物。
吡啶-2,6-双酰胺;铬(Ⅲ)离子;离子识别
金属离子与生命科学、环境科学、医学等领域有着密不可分的联系,对其识别及检测方法一直是人们关注的焦点[1-4]。因此,设计合成具有高灵敏度识别重金属离子的化学物质十分重要,建立快速、高效、实时的重金属离子检测方法具有潜在的应用价值[5-6]。吡啶-2,6-双酰胺化合物作为一类新颖的配体分子,凭借其独特的结构可修饰性、多样的拓扑结构,在离子交换、吸附、分子识别、催化以及环境污染分析等领域的具有巨大的应用潜力[7-10]。因此本文利用紫外-可见光谱方法研究了氨基醇基结构修饰的吡啶-2,6-双酰胺配体吡啶-2,6-二[N-(1′-羟乙基)酰胺](L,结构式见图1)对重金属离子Cr3+的识别作用,为吡啶-2,6-双酰胺在重金属离子分离分析理论及应用研究提供有益的基础数据。
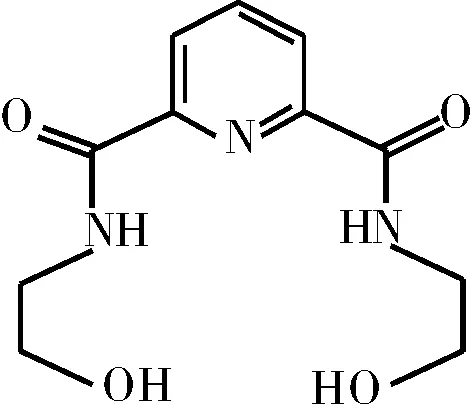
图1 吡啶-2,6-二[N-(1′-羟乙基)酰胺] (L)的结构式
1 实 验
1.1 试剂与仪器
试剂:所有药品均为分析纯,购于国药集团化学试剂有限公司和STREM CHEMICALS公司;金属离子溶液由其硫酸盐、硝酸盐以及醋酸盐配制,实验用水为二次蒸馏水。
标准溶液:配体L的储备液(1.00×10-3mol/L):称取25.6 mg配体 L用乙醇溶解,配置成100 mL溶液。金属盐均配制成水溶液(1.00×10-3mol/L)。
仪器:UV-2450紫外光谱仪,上海岛津国际贸易有限公司;SHA-B型恒温振荡器,金坛市富华仪器有限公司;QC-10260C型超声清洗仪,上海瑞成实业有限公司。
1.2 实验方法
1.2.1 配体L对重金属离子Cr3+的识别实验
先取1.00 mL的配体L(1.00×10-3mol/L)溶液,置于10.0 mL容量瓶中,再分别加入不同金属离子Mn+(Li+,K+,Na+,Mg2+,Al3+,Mn2+,Co2+,Ni2+,Zn2+和Cr3+)的储备液(1.00×10-3mol/L,1.00 mL)。用乙醇-水(V/V,1/9)的混合液定容刻度,摇匀,处于恒温振荡器(T=50.0 ℃)中振荡60 min,在室温下放置2 h。在温度为298 K,波长范围为190~400 nm之间的测试条件下,测定样品的紫外-可见吸收光谱,评价配体L对不同重金属离子的选择性识别。
1.2.2 络合物组成的测定
取13只10.0 mL容量瓶,分别加入1.00 mL 1.0×10-3mol/L [Mn+]标准溶液,依次加入不同体积的浓度为1.0×10-3mol/L配体[L],即固定[Mn+]而改变[L],使得[L]/[Mn+]分别为0.25,0.50,0.75,1.00,1.25,1.50,1.75,2.00,2.25,2.50,3.00,3.50,4.00,然后在配体L最大吸收波长处测定各组不同[L]/[Mn+]值的吸光度。以吸光度(A)对[L]/[Mn+]作图,将曲线直线部分延长并相交,根据交点位置确定络合物的配位数n。1.2.3 其他金属离子对配体L识别重金属离子Cr3+的干扰测试
取10份配体溶液,每份1.00 mL分别于10 mL容量瓶中,加入1.00 mL识别重金属离子Cr3+以及其他不同金属离子(Li+,K+,Na+,Mg2+,Al3+,Mn2+,Co2+,Ni2+和Zn2+)溶液各2.00 mL,混合后,用乙醇-水(V/V,1/9)的混合液定容至刻度,使配体分子、识别重金属离子和其他各种金属离子浓度均为1.0×10-4mol/L,静置2 h待用。待测样品中,第一组为只含有配体L与识别重金属离子的混合溶液;第二组为配体、识别重金属离子与其他金属离子的混合溶液。在温度298 K,配体L的最大吸收波长下,测定样品的吸光度值,研究其他金属离子对识别重金属离子的干扰程度。
2 结果与讨论
2.1 配体L对重金属离子Cr3+的选择性识别
配制配体L溶液,向该体系中加入不同金属离子,考察不同金属离子与配体L的相互作用。图2为配体L以及配体L与不同金属离子作用的紫外吸收光谱图。
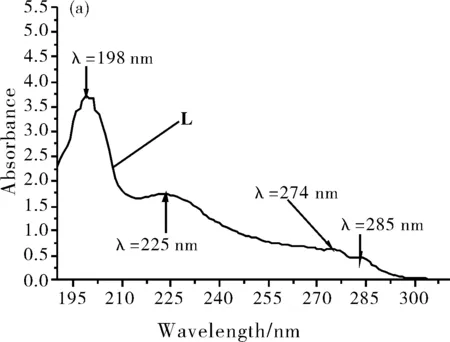
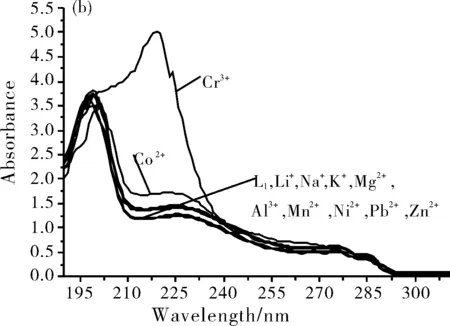
图2 配体L的吸收谱图(a)和配体L与不同金属离子作用的吸收光谱(b)
从图2(a)中可以看出,在不加金属离子时,浓度为1.0×10-4mol/L配体L在198 nm、225 nm、274 nm和285 nm处出现四个吸收峰,其中最大吸收波长为198 nm。从图2(b)中观察到,当加入浓度1.0×10-4mol/L的Cr3+离子时,配体L在198 nm处峰形和吸光度明显增强,并出现红移现象,分别红移至 215 nm处,且使配体L在225 nm处的吸收峰消失。除加入Co2+时,吸收峰强度在225 nm处有所提高,其他金属离子Li+,K+,Na+,Mg2+,Al3+,Mn2+,Zn2+和Ni2+等在该条件下都尚未发生最大吸收波长的红移现象。由此可见,配体L对重金属离子Cr3+有较好的识别能力。
2.2 配体L和重金属Cr3+形成络合物的组成测定(摩尔比法)
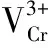
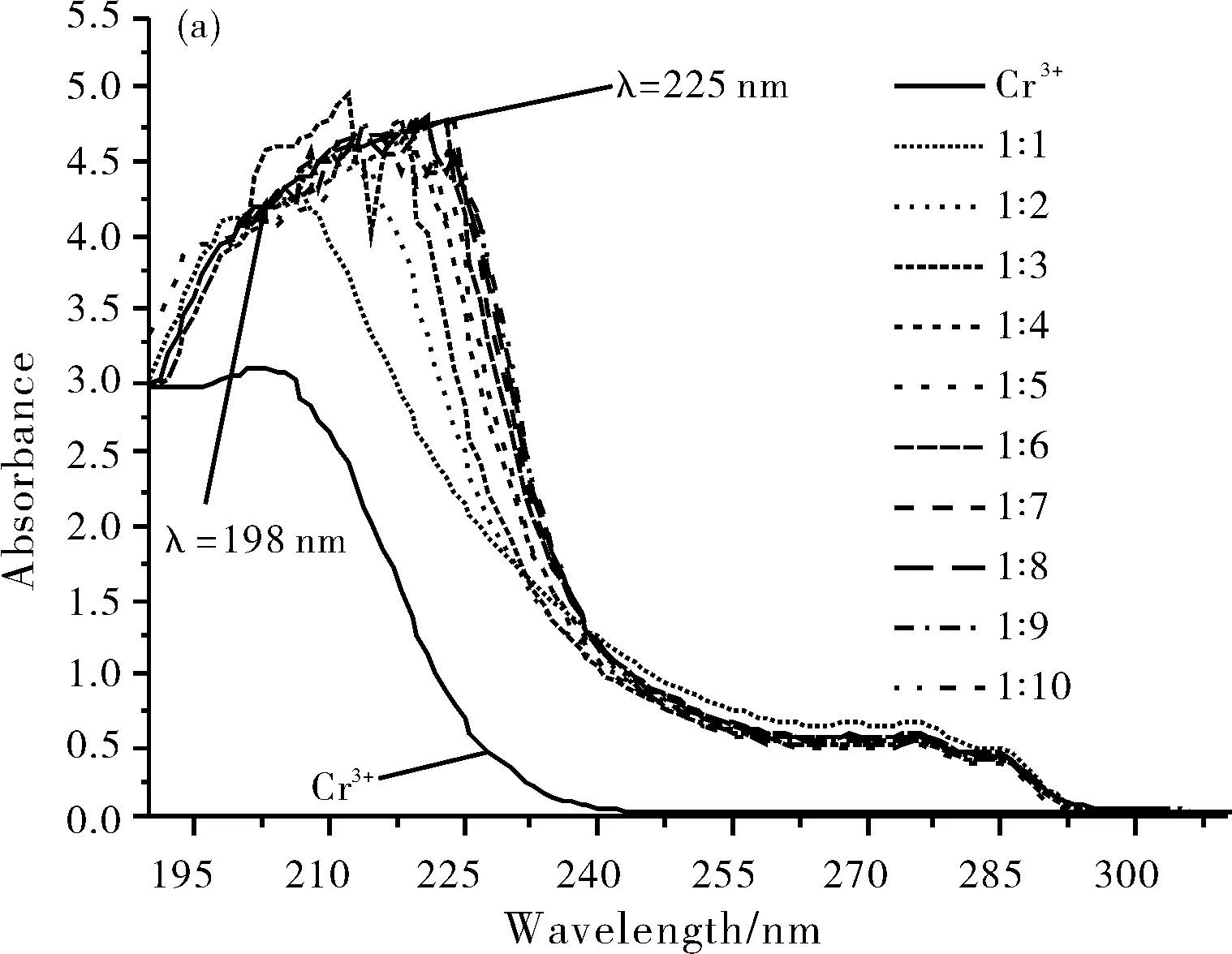

图3 配体L的吸收光谱随Cr3+浓度的变化(a)和198 nm处[L]/[Cr3+]不同浓度比与吸光度值的关系(b)
2.3 其他金属离子对配体L识别Cr3+的干扰测试
在金属离子识别过程中,如果不同金属离子之间有干扰,势必会影响识别作用的可靠性。为了考察常见金属离子的共存对响应离子的干扰,本文将响应金属离子Cr3+的浓度配为1.0×10-4mol/L,常见金属离子Li+、K+、Na+、Mg2+、Al3+、Mn2+、Ni2+、Zn2+和Co2+浓度配为2.0×10-4mol/L,分别考察了配体L识别Cr3+的干扰测试。图4为不同金属离子对配体L识别Cr3+的干扰测试图,结果表明在相同实验条件下,在Cr3+-L溶液中加入相对于Cr3+浓度2倍的上述金属离子时,对配合物的紫外吸收强度的影响的相对标准偏差在5%以内,可见配体L对Cr3+的识别几乎不受上述共存离子的影响,具有较高的选择性。
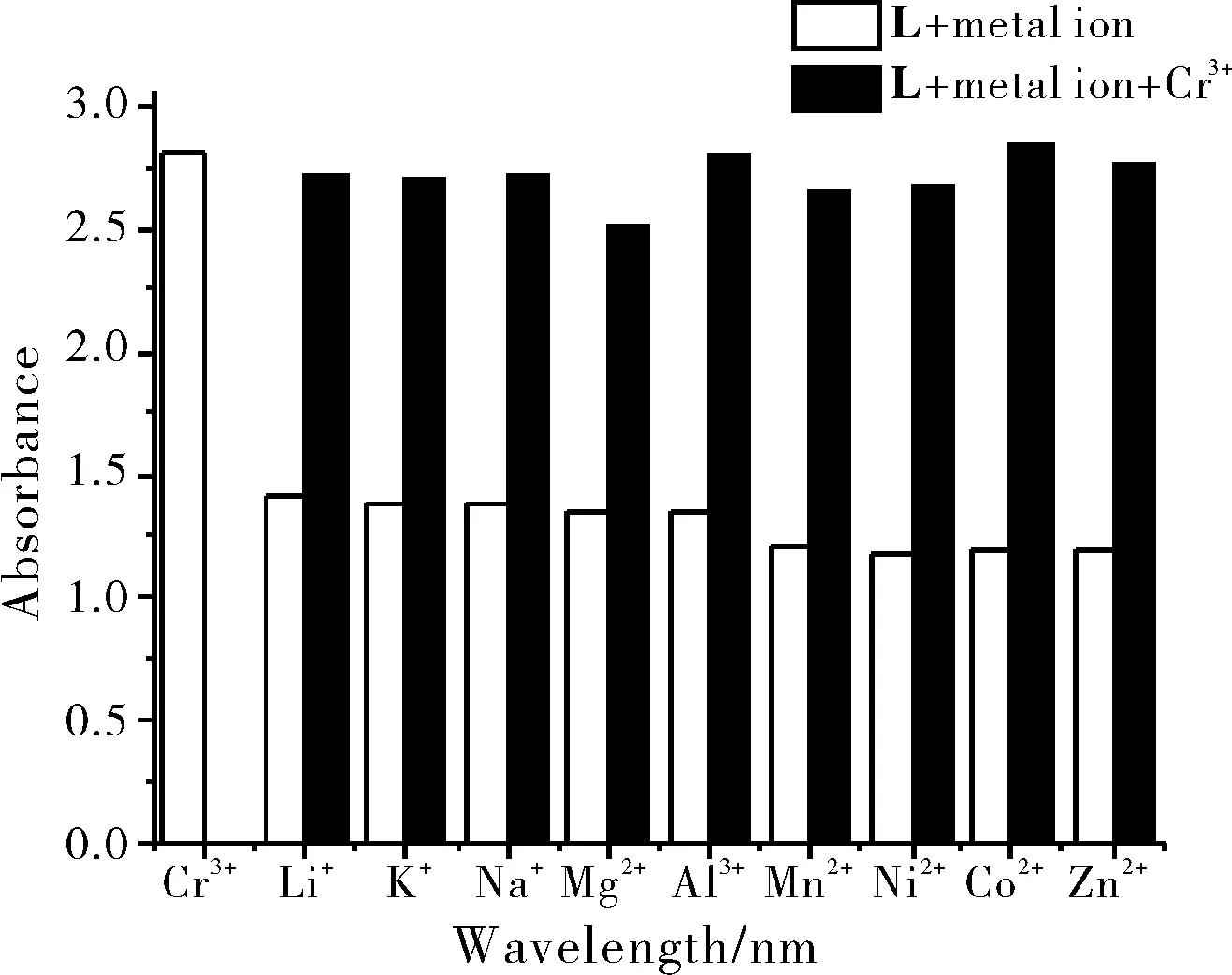
图4 不同金属离子对配体L识别Cr3+性能的影响
3 结 论
本文利用紫外-可见光谱分析方法研究氨基醇基结构修饰的吡啶-2,6-二[N-(1′-羟乙基)酰胺]对于重金属Cr3+离子识别性能,通过摩尔比法初步考察了其中发生离子键合识别作用的配位化学行为。实验结果表明,吡啶-2,6-二[N-(1′-羟乙基)酰胺]对Cr3+的响应具有较高的选择性,并形成1:2型的稳定配合物。同时,吡啶-2,6-二[N-(1′-羟乙基)酰胺]对识别重金属Cr3+的选择性识别不受碱金属、碱土金属以及其它过渡金属离子的干扰,为吡啶-2,6-双酰胺在重金属离子分离分析理论及应用研究提供了科学依据。
[1] 颜振宁,姜伟,冶保献,等. 2,6-二(5-甲基噁二唑)吡啶的电化学性质及离子识别性能研究[J]. 分析测试学报,2008,27(3): 253-255.
[2] 陆艳琦,颜振宁,冶保献,等. 2,5-二(α-硫甲基吡啶)1,3,4噻二唑的电化学性质及离子识别性能研究[J]. 河南师范大学学报:自然科学版,2008,36(1): 73-76.
[3] 冯文浩,乔纯杰,冉春玲,等. 新型1,1’-二取代二茂铁双二氨基硫脲腙席夫碱化合物的合成及其对金属离子的电化学识别[J]. 合成化学,2010,28(4):31-32.
[4] 吴璘华,拓宏桂,钟春龙. 2-羟基-1-萘甲醛缩-2-萘甲酰腙对Zn2+的选择性识别[J]. 应用化学,2010,27(6): 632-635.
[5] 张华,徐孝武,吴芳英.苯乙烯三嗪衍生物的合成及在重金属离子识别中的应用[J]. 无机化学学报,2013,29(11):2394-2398.
[6] 王志强,陈嘉勋,蔡大川,等. 重金属离子识别材料的研究进展[J]. 广州化工,2016, 44(2): 22-23.
[7] 罗世霞,陈晓靓,朱淮武. 2,6-双[N-(1′,1′-二甲基-2’-羟基)甲酰胺]吡啶及镍(Ⅱ)配合物的合成与光谱学研究[J].光谱学与光谱分析,2012,32(3): 805-808.
[8] 陈晓靓,罗世霞,朱淮武. 2,6-双[N-(5′-羟基-3′-氮杂戊基)甲酰胺]吡啶及钴(Ⅲ)配合物的合成与光谱性质[J].化学研究与应用,2011,23(12):1698-1702.
[9] Nathaniel W Alcock, Guy Clarkson, Peter B Glover. Complexes of 2,6-bis[N-(2’-pyridylmethyl)carbam: formation of mononuclear complexes, and self-assembly of double helical dinuclear and tetranuclear copper(Ⅱ) and trinuclear nickel(Ⅱ) complexes[J]. Dalton Trans, 2005: 18-527.
[10]罗世霞,陈晓靓,朱淮武.手性吡啶-2,6-双酰胺钴(Ⅲ)配合物的合成与光谱分析[J].分析测试学报,2012,31(2):211-215.
Ion Recognition of Cr(Ⅲ) with 2,6-bis[N-(1′-hydroxyethyl)carbamyl]pyridine
CHENXiao-jing1,LUOXian-hua1,LUOShi-xia2
(1 Guiyang Nursing Vocational College, Guizhou Guiyang 550081; 2 School of Chemistry and Materials Science,Guizhou Normal University, Guizhou Guiyang 550001, China)
The identification of heavy metal Cr(Ⅲ) ions was studied by designing a synthesis of pyridine-2,6-diamides. The ion recognition of 2,6-bis[N-(1′-hydroxyethyl)carbamyl]pyridine with Cr(Ⅲ) ion was investigated by the ultraviolet spectrophotometry. The results showed that 2,6-bis[N-(1′-hydroxyethyl)carbamyl]pyridine had good ion recognition for Cr(Ⅲ) ion. Free from interference with alkali metals, alkaline earth metals and other transition metal ions, their coordination binding stoichiometry was 1:2.
pyridine-2,6-diamides; Cr(Ⅲ); ion recognition
贵州省科学技术基金项目《功能有机分子吡啶酰胺的合成及其对金属离子的识别、液膜传输及萃取性能研究》(黔科合LH字[2015]7782号)。
陈晓靓(1983-),女,讲师,主要研究方向:有机合成及配位化学。
O614.24
A
1001-9677(2016)022-0036-03

