新生态二氧化锰(δ-MnO2)吸附溶液中U(VI)的性能研究
李小燕, 刘义保, 张 明, 李 寻, 杨 波, 花 榕, 刘云海
(东华理工大学核资源与环境省部共建国家重点实验室培育基地,江西 南昌 330013)
新生态二氧化锰(δ-MnO2)吸附溶液中U(VI)的性能研究
李小燕, 刘义保, 张 明, 李 寻, 杨 波, 花 榕, 刘云海
(东华理工大学核资源与环境省部共建国家重点实验室培育基地,江西 南昌 330013)
采用KMnO4氧化MnSO4的方法制备了新生态二氧化锰(δ-MnO2) 并运用SEM,XRD,FT-IR进行了表征研究,分析了δ-MnO2吸附U(VI)的机理,探讨了溶液pH、吸附剂用量、反应时间、U(VI)初始质量浓度等因素对δ-MnO2吸附溶液中U(VI)效果的影响。研究结果表明,新制备的δ-MnO2颗粒为准球型, 分散性较好, 团聚少, 表明光滑,物质组成主要由Mn,O,C,K元素组成,具有丰富的表面羟基,故对溶液中的U(VI)有很好的吸附效果。pH值对吸附效果有显著影响,当溶液pH为4.5、吸附剂用量为0.6 g/L、吸附时间为140 min、U(VI)初始质量浓度为35 mg/L时,U(VI)的去除率达到了97.65%。
新生态二氧化锰;铀;吸附
李小燕,刘义保,张明,等.2016.新生态二氧化锰(δ-MnO2)吸附溶液中U(VI)的性能研究[J].东华理工大学学报:自然科学版,39(3):283-287.
Li Xiao-yan, Liu Yi-bao, Zhang Ming,et al.2016.Adsorption of U (VI) in Aqueous Solution Using δ-MnO2[J].Journal of East China University of Technology (Natural Science), 39(3):283-287.
随着全球核能的发展,对铀资源的需求不断增长,世界各国都加大了对铀的采冶力度,随之而来的是在采冶过程中产生了大量低浓度的含铀废水。对放射性含铀废水的处理,人们几乎尝试了各种处理工艺,包括化学沉淀、离子交换、蒸发浓缩及吸附等传统处理方法,以及膜处理法、植物修复法、可渗透反应墙治理技术及微生物处理等新技术(谭文发等,2015;李小燕等,2010;张志宾等,2013)。目前这些方法在应用过程中仍存在一定的问题,如产生的污泥量大,给后续处理带来困难;热能消耗大, 运行成本较高等问题。吸附法是一种很有潜力的方法,能克服传统方法的诸多不足,更适合低浓度含铀废水的处理。而经济高效的吸附材料选择是吸附法的关键,故开发高效、廉价的吸附剂成为当前研究的重点。新生态MnO2是高锰酸钾与硫酸锰在水溶液中反应得到的产物,属于水合氧化物,比表面积大且表面富含羟基,对重金属离子具有较强的亲和力,表面的羟基能与重金属离子发生络合作用,在整个吸附过程中起重要作用(Tonkin et al.,2004; Agrawal et al.,2006)。MnO2表面电荷为可变电荷,随着溶液的pH值变化而变化,当溶液pH值大于其等电点pHZPC时,MnO2表面带负电,反之带正电。而David等(2010)测得δ-MnO2的等电点pHZPC为=2.3 ± 0.2。目前,二氧化锰在环境中的研究主要体现在吸附重金属离子方面。Bhagyashree等(2013)用实验证明了δ-MnO2能氧化环境中的Se(III),Pu(VI),Ce(III),Fe(II),Cr(III),Co(II)等金属离子。以δ-MnO2为吸附剂,用静态批实验法研究其对U(VI)的吸附性能,探讨溶液pH值、吸附剂用量、铀的初始浓度、反应时间等因素对吸附过程的影响,并对吸附前后的样品进行表征分析,探讨其吸附铀的机理,研究结果可为铀矿山及铀矿企业产生的含铀放射性废水处理提供参考。
1 实验材料和方法
1.1 试剂与材料
硝酸、氢氧化钠、偶氮胂Ⅲ、高锰酸钾、无水乙醇、2-4-二硝基酚、乙酸、乙酸钠等均为分析纯,试剂均购自国药集团化学试剂有限公司。铀储备液配制:用化学纯八氧化三铀配制浓度为1 000 mg/L的铀标准溶液,将该溶液稀释后进行实验。纳米二氧化锰的制备参照Agrawal等(2006)。
1.2 分析测试仪器
722型分光光度计(浙江托普仪器有限公司);THZ82A型恒温水浴振荡器(江苏金坛仪器厂);pHS3C型酸度计(上海雷磁仪器厂);JA1003型十万分之一电子天平(上海垒固仪器有限公司);FTIR-650型傅里叶变换红外光谱仪(博津仪器(上海)有限公司),S-520HTACHI型扫描电镜。
1.3 吸附实验
准确称取一定量δ-MnO2于250 mL锥形瓶中,加入50 mL质量浓度C0为(35±0.05) mg/L的U(VI)溶液,用0.5 mol/L HNO3或NaOH调节溶液pH为5.0,置于振荡器上振荡反应一定时间后静止沉降,取上清液,用偶氮胂Ⅲ分光光度法测溶液中U(VI)的剩余浓度Ct。U(VI)的去除率R%和吸附量Q(mg/g)按下式计算:
(1)
(2)
式中,Ct为t时刻溶液中的U(VI)浓度(mg/L);C0为U(VI)初始浓度(mg/L);V为溶液的体积(L);m为吸附剂的质量(g)。
实验条件如下:pH为2.5,3.0,3.5,4.0,4.5,5.0,5.5,6.0,6.5,7.0,7.5;δ-MnO2加入质量浓度ρm为0.6 g/L;温度t为30 ℃,反应120 min时取样分析溶液中U(VI)浓度Ct。
2 结果与讨论
2.1 二氧化锰的表征结果分析
(1)二氧化锰扫描电镜分析(SEM)。将真空干燥后的样品粘于载物台上,在试样表面喷涂一层金膜,然后用S-520HTACHI型扫描电镜进行固体表观形貌和能谱分析,结果见图1。
从图1a可以看出,所制的δ-MnO2颗粒为准球型, 分散性较好, 团聚少, 表明光滑。从能谱图可以看出,新制备的δ-MnO2主要由Mn,O,C,K元素组成。其中的K元素可能是样品洗涤不彻底造成。而从图1b可以看出,反应后δ-MnO2粒径变大,表面变粗糙,物质成分主要为Mn,O,C,K,U。
(2)二氧化锰XRD结果分析。图2为二氧化锰颗粒的X射线衍射图,扫描的2θ角度为10°~80°,入射波的波长为0.154 nm。图2的 XRD 中衍射线位置和相对强度与 JCPDS 00-18-0802标准卡片基本一致,证明制备的产物为δ-MnO2型粒子(Duan et al.,2014),在37.4°和68.9°处各有一强吸收峰,对应的密勒指数为(211)和(541),表明制备的δ-MnO2是典型的单晶结构,但结晶度较差(刘灿波,2008;Dong et al.,2012)。
(3)二氧化锰FT-IR结果分析。图3为新生态二氧化锰的红外谱图。波数525 cm-1附近的弱吸收峰,对应Mn-O-Mn键的特征伸缩振动峰,反应前3 426 cm-1范围内出现的典型吸收谱带为存在于晶格当中的水分子H—O—H键的伸缩振动及羟基OH-吸收带,而吸附反应后则移向3 448 cm-1,表明UO22+与自由羟基和羧基上的离子化O—H发生了络合反应。1 120 cm-1出吸收峰的变化主要是O—H键的伸缩振动以及金属氧化物表面的羟基(M—OH)(Liu et al.,2013)。而1 516 cm-1左右处的吸收峰则表示水分子H—O—H键的弯曲振动和MnO2表面的羟基Mn—OH官能团(Ren et al.,2012),以上分析表明δ-MnO2具有丰富的表面羟基,这是δ-MnO2极强的化学吸附活性的结构基础。
2.2 pH对吸附效果的影响
δ-MnO2用量为0.6 g/L、铀初始浓度为35 mg/L、吸附温度为30 ℃、吸附时间为120 min时,pH值对吸附的影响见图4。

图1 δ-MnO2反应前后扫描电镜和能谱图Fig.1 SEM and EDS spectrum of δ-MnO2a.反应前;b.反应后
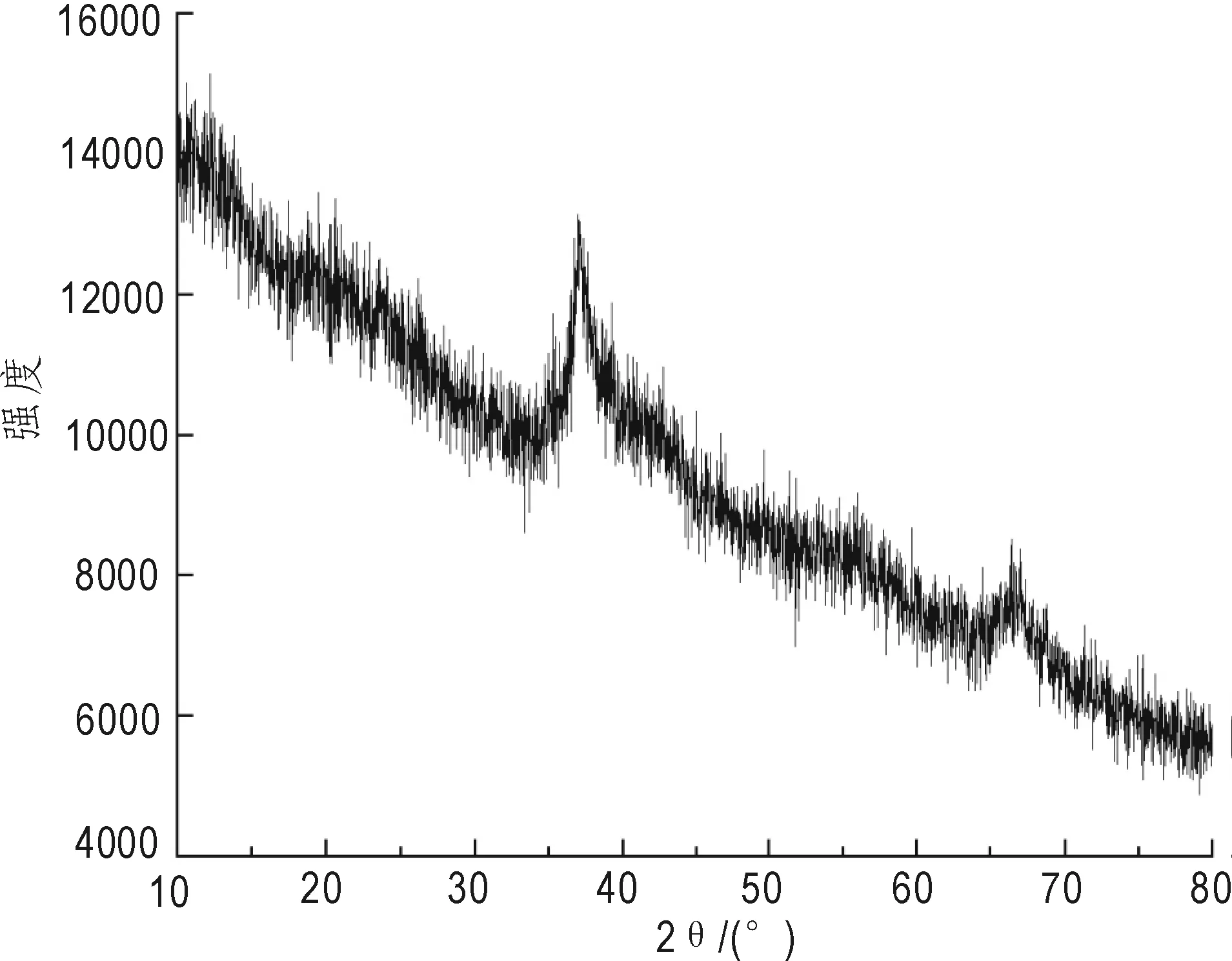
图2 新生态二氧化锰X射线衍射图Fig.2 X-ray diffraction photograph of δ-MnO2
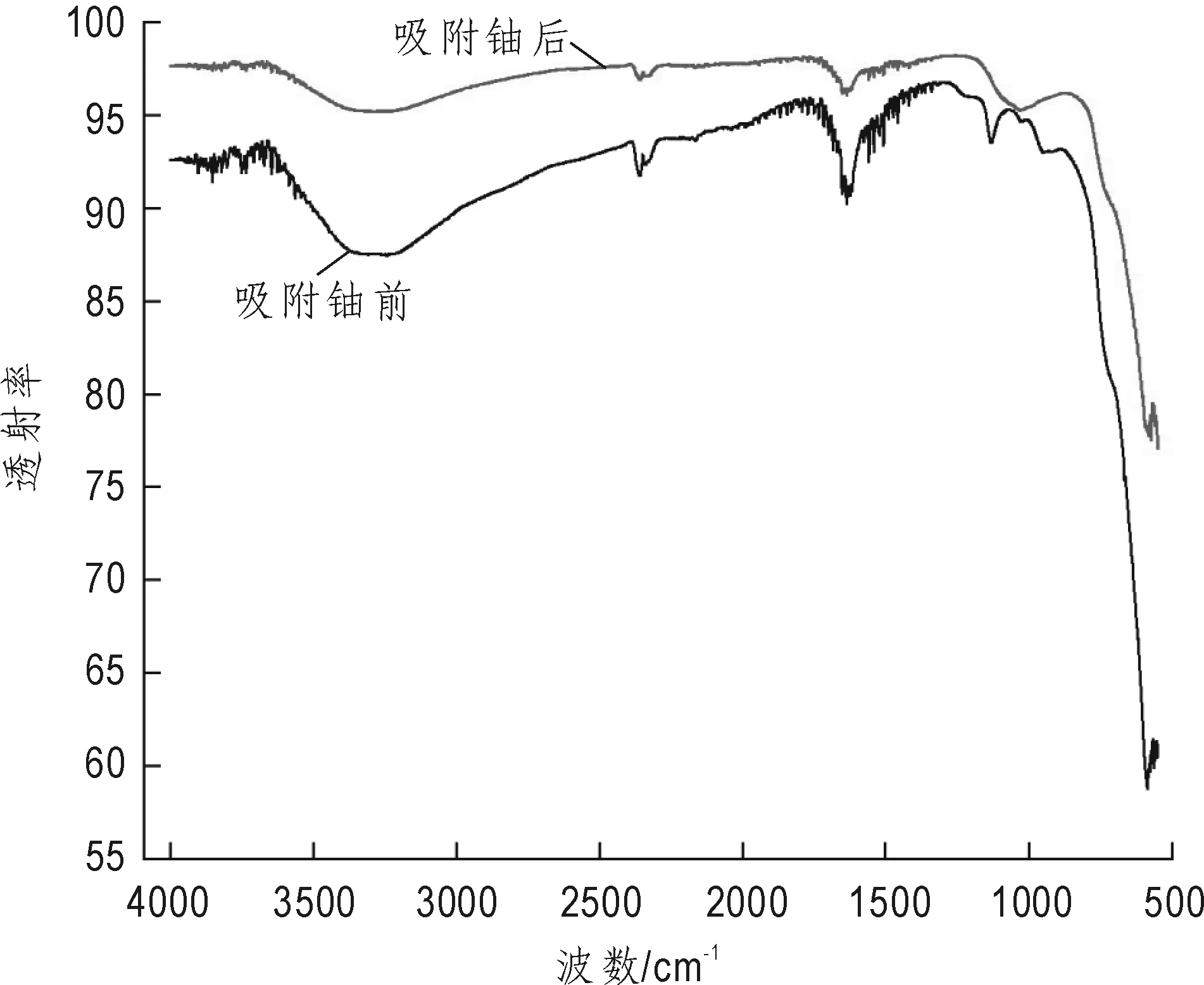
图3 新生态二氧化锰红外光谱图Fig.3 FT-IR spectrum of (δ-MnO2)
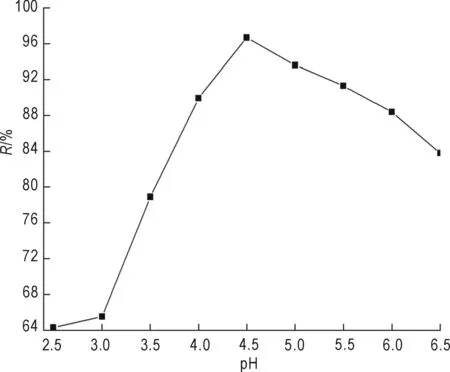
图4 pH值对U(VI)吸附效果的影响Fig.4 Effect of pH on adsorption of U(VI)
从图4可以看出,pH值对新生态MnO2吸附铀有较大的影响,在pH=2.5~4.5范围内,随着pH值的增大,U(VI)去除率一直在增大,当pH=4.5时,去除率达到最大值,之后随着pH值的增大,去除率开始下降。这主要是因为pH影响MnO2表面电荷、电离度及U(VI)的存在形态。新生态MnO2的等电点pHZPC约为2.6,在pH大于pHZPC的情况下,新生态MnO2表面带负电荷,而且随着pH值的增大,表面所带的负电荷数量就越多,所以去除率在逐渐增大(Ren et al.,2011)。当pH大于4.5时,溶液中的铀离子开始发生水解,所以去除率有所下降。所以本实验最佳溶液pH为4.5。
2.3 吸附剂用量对吸附效果的影响
在溶液pH为4.5、铀初始浓度为35 mg/L、吸附温度为30 ℃、吸附时间为120 min的条件下,吸附剂用量对吸附效果的影响见图5。
从图5可以看出,随着吸附剂浓度的增加,R在逐步增加,而Q一直在减小。当吸附剂用量为0.6 g/L时,R达到最大值,以后再增加吸附剂用量,R不再明显增加。这可能是因为当U(VI)浓度一定,δ-MnO2用量低时,δ-MnO2能够很快分散到溶液中,δ-MnO2之间相互作用较弱,此时溶液中U(VI)离子相对较多,属于吸附剂被吸附质“包围”的状态,吸附剂能够充分吸附吸附质,故随着δ-MnO2用量的增加,去除率增加。当增加到一定量时,去除率的增加不明显,这是因为随着δ-MnO2用量的增加,δ-MnO2之间发生团聚,导致δ-MnO2表面的吸附位点并没有增加(曾玉彬等,2015),故U(VI)去除率增加不明显。而Q随着吸附剂用量的增加一直下降,这是由于溶液中U(VI)的量是一定的,所以增加吸附剂用量使单位质量表面积上的吸附量呈下降趋势。综合考虑去除率和吸附量,确定0.6 g/L进行后续的实验。
2.4 反应时间对吸附效果的影响
在溶液pH为4.5、δ-MnO2用量为0.6 g/L、吸附温度为30 ℃、U(VI)初始浓度为35 mg/L,接触时间对吸附效果的影响见图6。
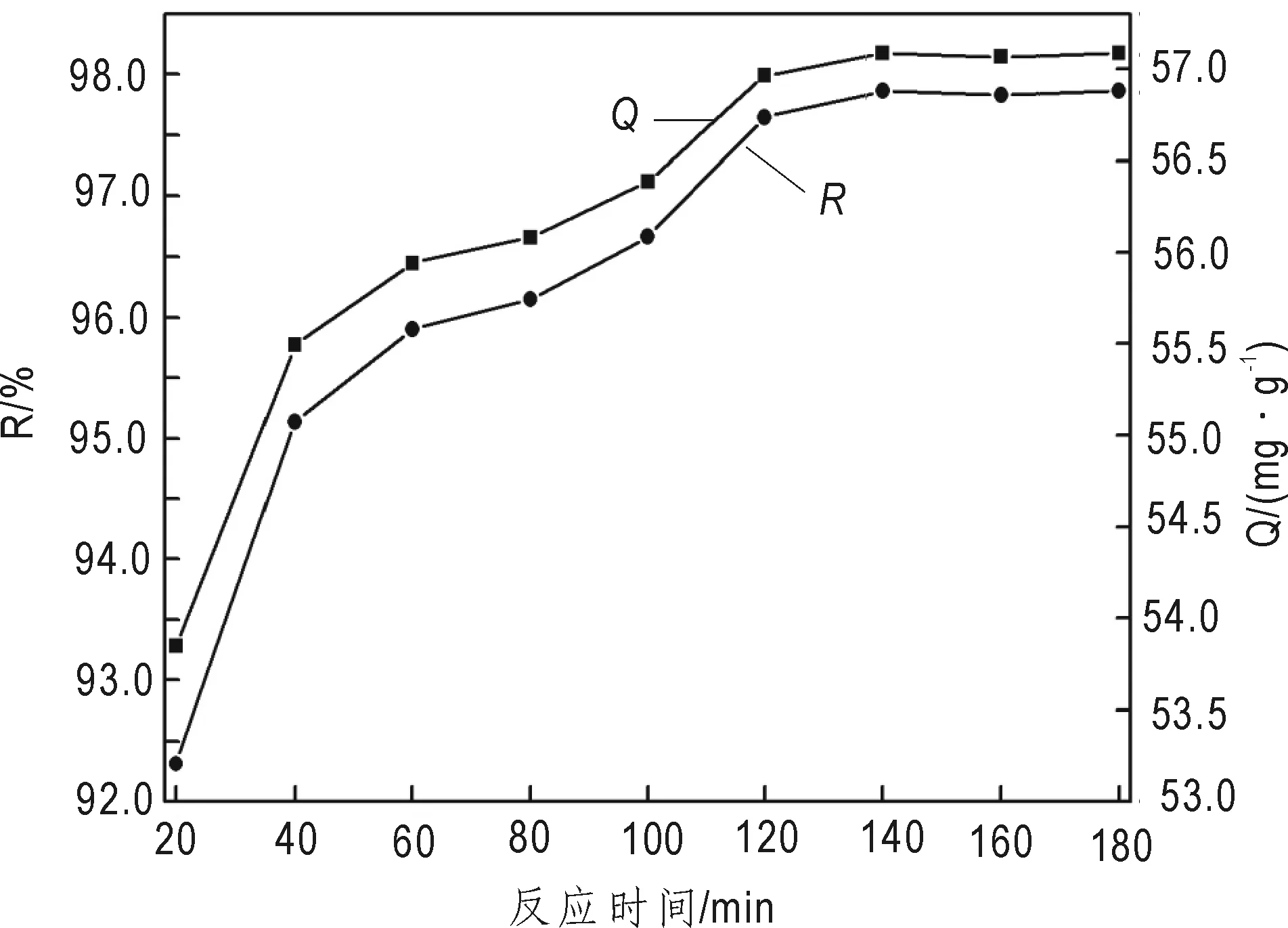
图6 反应时间对吸附的影响Fig.6 Effect of contact time on adsorption
从图6可以看出,随着时间的增加,R和Q随着反应时间的延长都在增加,反应到140 min时,R和Q均达到了最大,分别为97.65%和57.16 mg/g。随后再延长吸附时间,R和Q的增加都比较缓慢,说明吸附已接近平衡。这主要是因为吸附初期,δ-MnO2外层吸附位点比较多,有利于铀酰离子与δ-MnO2表面的羟基等阴离子基团结合,所以开始时吸附速度快。随着吸附过时间的延长,表面吸附位点接近饱和,铀酰离子很难再吸附上,所以吸附速度逐渐降低,直至达到吸附平衡状态。
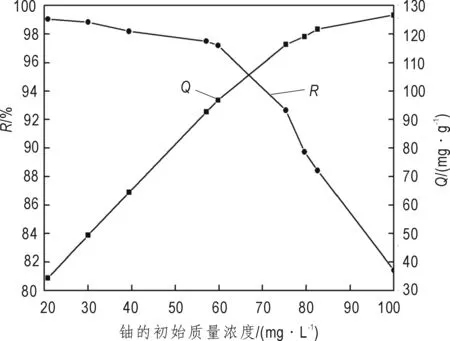
图7 铀初始质量浓度对吸附的影响Fig.7 Effect of initial concentration on adsorption
2.5 U(Ⅵ)的初始质量浓度对吸附效果的影响
在溶液pH为4.5、δ-MnO2的用量为0.6 g/L、吸附温度为30 ℃、吸附时间为140 min时,铀初始质量浓度对吸附效果的影响见图7。
从图7可以看出,随着铀初始质量浓度的增加,R一直在下降,而Q一直在增加。这是由于δ-MnO2的量一定时,其含有的活性吸附位点的数量也一定,当U(VI)的初始质量浓度较低时,溶液中的铀酰离子可以与吸附材料充分接触并被吸附,从而R较高。可是,当U(VI)的初始质量浓度增加时,会相应增大溶液中未被吸附的铀酰离子的数量,从而导致R降低。而Q一直增大是因为随着U(VI)的初始质量浓度增加,溶液提供的铀酰离子量也在增加,使吸附剂表面活性基团和铀酰离子会有更多的接触机会,所以使单位面积上吸附铀酰离子的量增加,从而使总吸附量增加。
3 结论
(1)表征分析结果表明,新制备的δ-MnO2颗粒为准球型, 分散性较好, 团聚少, 表明光滑,物质组成主要由Mn,O,C,K元素组成,具有丰富的表面羟基;
(2)吸附实验表明,δ-MnO2对溶液中的U(VI)有很好的吸附能力,吸附作用强烈依赖体系的pH值,当溶液pH=4.5、吸附时间为140 min、吸附剂用量为0.6 g/L、U(VI)初始质量浓度为35 mg/L时,U(VI)去除率达到了97.65%。在去除率88%左右时,U(VI)的吸附容量可达到120 mg/g,而与其他天然无机矿物如膨润土、高岭土等和生物吸附剂如植物、微生物相比,在同等去除率条件下,对铀的吸附容量明显提高。
李小燕,张叶. 2010.放射性废水处理技术研究进展[J].铀矿冶,29(3):153-156.
刘灿波. 2008.新生态二氧化锰净水作用及机理研究[D].青岛:青岛理工大学:12-14.
谭文发,吕俊文,唐东山. 2015.生物技术处理含铀废水的研究进展[J].生物技术通报, 31(3):82-87.
曾玉彬,沈全平,汪军林,等. 2015.新生态二氧化锰对水中腐殖酸的吸附性能[J].水处理技术, 41(4):25-30.
张志宾,熊国宣,刘云海,等.2013.季胺盐阳离子插层蒙脱土对铀吸附性能的研究[J].东华理工大学学报:自然科学版,36(4):400-405.
Agrawal A, Sahu K K. 2006.Kinetic and isotherm studies of cadmium adsorption on manganese nodul reside[J]. Journal of hazardous materials, 137(1):915-924.
Bhagyashree K, Mishra R K, Shukla R, et al. 2013.Tomar. Sorption of plutonium from low level liquid waste using nano MnO2[J]. J Radioanal Nucl Chem. 295:1561-1566.
David M S, Caroline L P. 2010.Surface complexation of Cu on birnessite (δ-MnO2): Controls on Cu in the deep ocean[J]. Geochimica et Cosmochimica Acta, 74:6721-6730.
Dong Nguyen Thanh,Mandeep Singh,Pavel Ulbrich,et al. 2012.As(V) removal from aqueous media using a -MnO2nanorods-impregnated lateritecomposite adsorbents[J]. Materials Research Bulletin, 47:42-50.
Dua Yucheng, Zheng Guangwei, Wang Jinshu,et al. 2014.MnO2nanowires in situ grown on diatomite: Highly efficient absorbents for the removal of Cr(VI) and As(V) [J]. Microporous and Mesoporous Materials, (200):27-34.
Liu Yang,Xu Jinzhang. 2013.Effect of environmental conditions on 109Cd(II) sorption to MnO2[J]. J Radioanal Nucl Chem,295:1001-1008.
Ren Yueming, Yan Ni, Wen Qing, et al. 2011.Graphene/δ-MnO2composite as adsorbent for the removal of nickel ions from wastewater[J]. Chemical Engineering Journal,175: 1-7.
Ren Yueming,Yan Ni, Feng Jing, et al. 2012.Adsorption mechanism of copper and lead ions onto graphene nanosheet/δ-MnO2[J]. Materials Chemistry and Physics,136:538-544.
Tonkin J W, Balistrieti L S, Murry J W. 2004.Modeling sorption of divalent metal cations on hydrous manganese oxide using the diffuse double layer model[J]. Applied geochemistry, 19(1): 29-53.
Adsorption of U (VI) in Aqueous Solution Using δ-MnO2
LI Xiao-yan, LIU Yi-bao, ZHANG Ming, LI Xun, YANG bo, HUA Rong, LIU Yun-hai
(Environment and Fundamental Science on Radioactive Geology and Exploration Technology
Laboratory,East China Institute of Technology,Nanchang,JX 330013,China)
Nascent state manganese dioxide was prepared by KMnO4oxidation on MnSO4and characterized with SEM,XRD and FT-IR, analysised the adsorption mechanism of U(VI) by δ-MnO2. Effect factors including adsorption time, dosage of δ-MnO2, pH of solution and initial concentration of U(VI) in solution was investigated. The results showed that newδ-MnO2was spherical, good dispersivity, less reunion and smooth, composed of Mn, O, C and K element and has good adsorption effect on U(VI) in solution for wealth of surface hydroxyl. The removal rate of U(VI) could reach 97.65% when pH of solution was 4.5,dosage of δ-MnO2was 0.6 g/L, initial concentration of U(VI) was 35 mg/L and adsorption time was 140 min.
nascent state manganese dioxide; uranium; adsorption
2015-06-15
国家自然基金项目(11205030,11465002,41201500,11205031); 江西省教育厅项目(GJJ14478);核资源与环境省部共建国家重点实验室项目(NRE1320)
李小燕(1974—),女,博士,副教授, 主要从事放射性废物处理与处置研究。E-mail:xyli@ecit.cn
10.3969/j.issn.1674-3504.2016.03.013
X591
A
1674-3504(2016)03-0283-05

