3种典型有机氯农药对锦鲤幼鱼的雌激素效应及其体内富集
于瑞莲,林承奇,林喜燕,胡恭任
华侨大学 化工学院,厦门 361021
3种典型有机氯农药对锦鲤幼鱼的雌激素效应及其体内富集
于瑞莲,林承奇,林喜燕,胡恭任
华侨大学 化工学院,厦门 361021
为研究3种典型有机氯农药(α-六六六、p,p′-DDT和七氯)低浓度暴露对锦鲤幼鱼的雌激素效应及其体内富集效应,将锦鲤幼鱼暴露于有机氯农药的6个浓度组中进行20 d慢性毒性试验,测量血清中游离钙和蛋白结合磷含量及体内各组织有机氯农药残留。结果表明,在低浓度暴露20 d后,锦鲤幼鱼血清中游离钙和蛋白结合磷含量均随暴露浓度增加而呈先增后减之势,产生了明显的雌激素效应。p,p′-DDT在鱼体各组织中的富集能力远高于α-六六六和七氯;p,p′-DDT主要在鱼油中富集,其次为鱼肝、鱼鳃和鱼皮;α-六六六和七氯主要在鱼肝中富集,其次为鱼皮、鱼鳃和鱼油;3种有机氯农药在鱼肉中的富集相对较少。
有机氯农药;锦鲤幼鱼;雌激素效应;生物富集
有机氯农药(OCPs)是具有持久性、高毒性和生物蓄积性的一类有机污染物,因其高效、广谱而曾被广泛应用于农牧渔业病虫害的防治[1-2]。虽然目前OCPs在全球大部分国家和地区已禁止生产和使用,但因其在环境中不易分解、残留期长而在不同环境介质中仍能被不同程度的检出[3-5]。水生生态系统是许多污染物的汇,鱼类是研究水环境污染常用的水生动物。
OCPs具有内分泌干扰作用,可通过与雌激素受体结合而影响动物的生殖和发育。卵黄蛋白原(VTG)作为检测外源雌激素作用的生物标志物而被广泛应用于环境激素的筛选与评价[6]。VTG是一种钙结合脂磷蛋白,鱼体血清钙和磷含量会随VTG增加而增加,且呈较好的相关性,因此可通过测定血清中游离钙和蛋白结合磷含量的变化来间接反映VTG含量变化情况,以评价鱼类受雌激素影响程度,并对化学物质的雌激素效应进行筛选和评价[7]。
本文以3种典型OCPs(α-六六六、p,p′-DDT和七氯)为研究目标化合物,以锦鲤幼鱼为受试生物,通过测定锦鲤幼鱼血清中的游离钙(Ca2+)和蛋白结合磷(VTG-P)含量来间接反映VTG的变化趋势,分析上述OCPs在低浓度暴露水平下对锦鲤幼鱼的雌激素效应及其在鱼体内各组织的富集情况,旨在为农药类环境激素影响机制研究及生态效应数据库的建立提供基础数据。
1 材料与方法 (Materials and methods)
1.1 实验材料与试剂
锦鲤幼鱼购自当地水族馆,体长(11.0±1.0) cm,体重(23.3±2.2) g,健康活泼。经5%食盐水消毒后于水族箱中驯养10 d,驯养期间每天喂食1次,换水1次,锦鲤幼鱼死亡率不超过5%。驯养及暴露实验水质均符合渔业水质标准GB11607-89要求。
α-六六六、p,p′-DDT和七氯标准样均购自农业部环境保护科研监测所,浓度100 μg·mL-1,介质为石油醚。石油醚(馏程60 ℃~90 ℃)和丙酮为色谱纯。测定磷和钙所用试剂均为分析纯。
1.2 暴露实验
根据联合国环境规划署规定的保护水生生物淡水中农药最大允许浓度,按等对数间距设1个空白对照和5个低剂量浓度梯度暴露组。采用半静态暴露实验,实验容器为Ф 35 cm×40 cm的塑料桶,每桶(装4 L暴露溶液)放入5条锦鲤幼鱼,暴露20 d后,测定血清中游离钙和蛋白结合磷含量。为确保药物浓度和溶解氧含量,每天更换25%的暴露溶液。暴露期间不喂食。
1.3 血清中游离钙和蛋白结合磷含量测定
采用断尾取血并离心后获得锦鲤幼鱼血清,用移液枪吸取0.5 mL血清至玻璃消化管中,加入5 mL混合消解液(V蒸馏水:V硝酸:V过氧化氢= 5:3:2),于沸水浴中消煮60 min,冷却后用1% HNO3溶液定容至25 mL,用火焰原子吸收分光光度法(AAS)测定钙含量。另取0.5 mL血清,按林浩然等[8]的方法测定碱不稳定性蛋白结合磷。以上两指标的消解及测定过程均做平行试剂空白。
1.4 鱼体内农药残留量的测定
1.4.1 样品制备
取上述实验后的空白组与100 ng·L-1α-六六六、20 ng·L-1p,p′-DDT、80 ng·L-1七氯暴露组的幼鱼用于测定鱼体各组织的农药残留。将同一暴露组5条鱼的同种器官或组织混合为1个样品,分别制备成鱼肉、鱼头、鱼皮、鱼鳃、鱼油和鱼肝等组织的样品。经洗净,滤纸擦干后称湿重,装入塑料离心管中,用纱布封口后于冷冻干燥仪中于-80 ℃下冷冻干燥24 h。取出干燥好的样品称其干重,并用研钵研磨成固体粉末,密封后放入干燥器内保存备用。
1.4.2 样品提取与净化
将各组织样品粉末倒入250 mL锥形瓶中,加入15 mL丙酮和15 mL石油醚混匀,置于40 ℃超声水浴中提取15 min,静置后取澄清液转移到另一250 mL锥形瓶中,再次加入10 mL丙酮和10 mL石油醚至有沉渣的锥形瓶中超声提取15 min,合并2次提取液并用中性滤纸过滤,滤液用旋转蒸发仪浓缩至近干,用石油醚转移到具塞比色管中,定容至5 mL,加入1 mL浓硫酸,盖上试管塞,振摇1 min,以6 000 r·min-1离心10 min,用移液枪小心吸取上清液1 mL至样品瓶中,供气相色谱分析用。
1.4.3 气相色谱分析
OCPs定量分析在Agilent 6890N型气相色谱仪上进行,检测器为微池电子捕获电测器(μ-ECD),温度320 ℃,色谱柱为石英弹性毛细管柱 HP-5 (30.0 m×320 μm×0.25 μm),载气为高纯氮气,流速3 mL·min-1,进样口温度220 ℃,柱温程序:80 ℃保持1 min,然后以30 ℃·min-1的速度升至180 ℃,再以3 ℃·min-1的速度升至205 ℃,保持4 min,最后以20 ℃·min-1升至290 ℃,保持2 min。进样量为1 μL,不分流进样。
1.4.4 方法精密度与加标回收率
配制上述3种OCPs的低浓度标准工作液,以3倍信噪比计算方法检测限,其最低检测限为0.002~0.005 mg·L-1;实验分别对3种OCPs标准工作液进行3次平行测定,其相对标准偏差≤5.88%;每批样品测定时,同时做标准曲线、空白样品和加标回收实验,方法加标回收率为106%~109%,均符合EPA对回收率要求。
2 结果(Results)
2.1 锦鲤幼鱼血清中游离钙和蛋白结合磷含量
锦鲤幼鱼在低浓度的3种典型有机氯农药溶液中暴露20 d,暴露期间,锦鲤幼鱼均无死亡。暴露20 d后,锦鲤幼鱼血清中游离钙和蛋白结合磷的含量见图1。锦鲤幼鱼血清中游离钙和蛋白结合磷的含量总体上随暴露剂量升高呈先升高而后又降低的变化趋势。α-六六六暴露实验中,锦鲤幼鱼血清中游离钙含量范围40~184 mg·L-1,蛋白结合磷含量范围72~217 mg·L-1,两者的最高值均出现在50 ng·L-1暴露组;p,p′-DDT暴露实验中,锦鲤幼鱼血清中游离钙含量范围61~253 mg·L-1,蛋白结合磷含量范围103~301 mg·L-1,两者的最高值均出现在10 ng·L-1暴露组;七氯暴露实验中,锦鲤幼鱼血清中游离钙含量范围80~230 mg·L-1,蛋白结合磷含量范围198~406 mg·L-1,两者的最高值均出现在40 ng·L-1暴露组。
2.2 锦鲤幼鱼各组织中有机氯农药残留量
分别于100 ng·L-1α-六六六、20 ng·L-1p,p′-DDT和80 ng·L-1七氯中暴露20 d后的锦鲤幼鱼各组织器官中3种有机氯农药含量见表1。各组织中α-六六六含量范围20.93~964.9 ng·g-1,含量大小顺序为鱼肝>鱼皮>鱼鳃>鱼油>鱼头>鱼肉;各组织中p,p′-DDT含量范围41.88~10 329 ng·g-1,含量大小顺序为鱼油>鱼肝>鱼鳃>鱼皮>鱼头>鱼肉;各组织中七氯含量范围5.989~3 536 ng·g-1,含量大小顺序为鱼肝>鱼皮>鱼鳃>鱼油>鱼头>鱼肉。
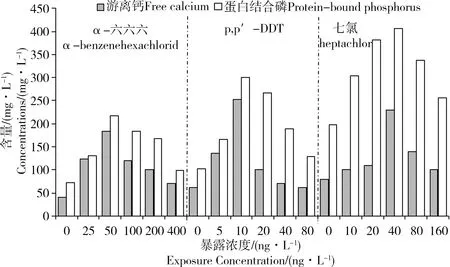
图1 低浓度有机氯农药暴露20 d后锦鲤幼鱼血清中游离钙和蛋白结合磷含量Fig. 1 Contents of Ca2+ and VTG-P in the serum of juvenile Cyprinus carpio after low concentration exposure to OCPs for 20 d

表1 低浓度暴露20 d后3种有机氯农药在锦鲤幼鱼各组织中的含量
3 讨论(Discussion)
3.1 三种有机氯农药对锦鲤幼鱼的雌激素效应
VTG是由性成熟雌鱼肝脏合成的一种特异性蛋白,为正在发育的胚胎提供氨基酸、脂肪、碳水化合物、维生素等营养及功能性物质[9]。VTG的顺利合成需要有雌激素的诱导,一般认为,性成熟的雌性卵生脊椎动物可合成大量VTG,而幼鱼肝脏中也具有雌激素受体(ER)的基因,但由于缺少雌激素的刺激,因而不能生成VTG。已有研究表明,当雄鱼或幼鱼受到外源性低剂量的类雌激素刺激,能诱导体内VTG的生成[10]。本研究锦鲤幼鱼暴露于低浓度的上述3种典型OCPs中20 d后,血清中游离钙和蛋白结合磷的含量总体上先随暴露浓度的升高而升高,而后又降低,呈现倒U字型的变化趋势。根据李云等[7]的研究,VTG是一种钙结合脂磷蛋白,在卵黄发生的雌体血浆中能检测出高水平的蛋白结合磷,测定蛋白结合磷也就间接测定了VTG含量。同时,根据赵兵等[11]的研究,对于同种鱼,血清中钙和磷含量随VTG含量的增加而增加,且呈较好的相关性。因此,锦鲤幼鱼血清中游离钙和蛋白结合磷含量呈现倒U字型的变化趋势间接反映了VTG的含量呈现倒U字型的变化趋势。环境内分泌干扰物的作用特点之一是剂量-反应曲线并不具有线性特征,即刚开始反应随暴露浓度上升而增强,达到最大反应值后,暴露浓度上升反而会导致生物反应减弱[12]。本研究结果与环境内分泌干扰物的作用特点相符。可见,α-六六六、p,p′-DDT和七氯这3种典型OCPs对锦鲤幼鱼表现出较明显的雌激素效应。
锦鲤幼鱼血清中游离钙和蛋白结合磷含量随暴露浓度升高而先升高后降低的现象可能是由于过量吸收农药引起机体伤害所致。许多研究表明,在正常情况下鱼体内超氧化物歧化酶(SOD)活性和活性氧自由基(ROS)的含量会达到一定的动态平衡,当生物体受到轻度逆境胁迫时,鱼体内产生过量的ROS可诱导SOD活性提高,清除自由基的能力相应增强,对肝细胞的毒性损害较小;而当受到重度逆境胁迫时,SOD活性通常降低,使生物体内积累了过量的活性氧,抑制了酶的活性[13],破坏了细胞的正常代谢,对肝细胞产生了较大的损害,阻碍了肝脏中VTG的合成,从而导致了血清中游离钙和蛋白结合磷含量的下降。
3.2 三种有机氯农药在锦鲤幼鱼各器官的分布与富集
研究发现,某些化学品剂量虽属于急性和慢性毒性测试标准规定的生物安全水平,却能在水生生物体内富集至较高浓度,并通过食物链对其他生物产生危害,例如OCPs在鱼体内富集,导致以鱼为食的鸟类的减少[14]。从锦鲤幼鱼各组织中3种典型OCPs残留量测定结果(表1)可知,上述3种OCPs在鱼体各组织中有不同程度的富集。
生物富集效应通常用富集系数表示,即富集系数(BCF)=鱼体组织中的含量(mg·kg-1)/试验液中农药的浓度(mg·L-1)[15]。3种有机氯农药的富集系数如图2,α-六六六主要在鱼肝、鱼皮、鱼鳃和鱼油中富集,富集系数分别为9 649、3 572、3 077和1 265;p,p′-DDT主要在鱼油、鱼肝、鱼鳃和鱼皮中富集,富集系数分别为516 450、340 350、97 550和89 800;七氯主要在鱼肝、鱼皮、鱼鳃和鱼油中富集,富集系数分别为44 210、3 993、3 493和2 496。3种有机氯农药在鱼肉中的富集相对较少。

图2 低浓度暴露20 d后锦鲤幼鱼各组织中3种有机氯农药的富集系数Fig. 2 BCFs of three OCPs in the tissues of juvenile Cyprinus carpio after low concentration exposure for 20 d
同种有机氯农药在锦鲤幼鱼各组织中的富集程度不同,鱼肝表现出高富集主要是因为肝脏是有机氯农药作用的靶器官之一,同时也与肝脏的解毒和代谢机制有关;鱼油的高富集是因为其脂肪含量高,而有机氯农药的脂溶性特征使其极易在生物体内积累,且蓄积库为脂肪组织[16];鱼皮和鱼鳃的高富集是因为鱼皮和鱼鳃与水环境直接接触,可直接从水环境中富集OCPs[17]。
不同有机氯农药在鱼体内各组织的富集程度不同,其中p,p′-DDT的富集能力远高于α-六六六和七氯,这与有机氯农药的正辛醇-水分配系数有关。有机氯农药在生物体内的富集程度与其正辛醇-水分配系数具有正相关性[18]。查询《有机化合物环境数据简表》可知,α-六六六、p,p′-DDT和七氯的正辛醇-水分配系数的对数分别为3.8、6.91和6.10,与富集程度结果较相符。
[1] El-Shahawi M S, Hamza A, Bashammakh A S, et al. An overview on the accumulation, distribution, transformations, toxicity and analytical methods for the monitoring of persistent organic pollutants [J]. Talanta, 2010, 80(5): 1587-1597
[2] 王莹, 仇雁翎, 费勇, 等. 养殖鳜鱼体内典型有机氯化合物的检测与人体健康风险评估初探[J]. 环境科学, 2011, 32(8): 2385-2390
Wang Y, Qiu Y L, Fei Y, et al. Measurement and preliminary human health risk assessment of representative organochlorines in farmed mandarin fish [J]. Environmental Science, 2011, 32(8): 2385-2390 (in Chinese)
[3] 张家泉, 祁士华, 邢新丽, 等. 闽江干流沿岸土壤及河口沉积柱中有机氯农药分布特征[J]. 环境科学, 2011, 32(3): 673-679
Zhang J Q, Qi S H, Xing X L, et al. Distribution characteristics of organochlorine pesticides in bank soil samples and estuarial sediment core of the Minjiang River, Southeast China [J]. Environmental Science, 2011, 32(3): 673-679 (in Chinese)
[4] Yu Y, Li Y, Shen Z, et al. Occurrence and possible sources of organochlorine pesticides (OCPs) and polychlorinated biphenyls (PCBs) along the Chao River, China [J]. Chemosphere, 2014, 114: 136-143
[5] Shoiful A, Fujita H, Watanabe I, et al. Concentrations of organochlorine pesticides (OCPs) residues in foodstuffs collected from traditional markets in Indonesia [J]. Chemosphere, 2013, 90(5): 1742-1750
[6] 翟丽丽, 张育辉. 基于环境雌激素评估的卵黄蛋白原研究进展[J]. 生态毒理学报, 2009, 4(3): 332-337
Zhai L L, Zhang Y H. Review on vitellogenin based on estimating environmental estrogen [J]. Asian Journal of Ecotoxicology, 2009, 4(3): 332-337 (in Chinese)
[7] 李云, 朱志强, 叶勤, 等. 17 β-雌二醇对雄性瓦氏黄颡鱼(Pelteobagrus vachelli)的雌激素效应[J]. 海洋与湖沼, 2009, 40(2): 195-200
Li Y, Zhu Z Q, Ye Q, et al. Estrogenic effect of 17 β-estradiol on male bagrid catfish Pelteobagrus vachelli [J]. Oceanologia et Limnologia Sinica, 2009, 40(2): 195-200 (in Chinese)
[8] 林浩然, 刘晓春. 鱼类生理学实验技术和方法[M]. 广州: 高等教育出版社, 2006: 64-65
[9] 贾毅娜, 梁刚. 环境雌激素对生殖腺及卵黄蛋白原影响的研究进展[J]. 生物技术通报, 2013(6): 46-52
Jia Y N, Liang G. Research progression of animal gonad and vitellogenin under the influence of environmental estrogens [J]. Biotechnology Bulletin, 2013(6): 46-52 (in Chinese)
[10] Genovese G, Regueira M, Cua R H D, et al. Nonmonotonic response of vitellogenin and estrogen receptor α gene expression after octylphenol exposure of Cichlasoma dimerus (Perciformes, Cichlidae) [J]. Aquatic Toxicology, 2014, 156: 30-40
[11] 赵兵, 刘征涛, 徐章法, 等. E2诱导的鲫鱼幼鱼血清中卵黄蛋白原和钙含量相关性研究[J]. 环境科学研究, 2006, 19(2): 23-30
Zhao B, Liu Z T, Xu Z F, et al. Studies on the correlation between serum VTG and serum calcium of juvenile Carassius auratus after exposure to E2 [J]. Research of Environmental Sciences, 2006, 19(2): 23-30 (in Chinese)
[12] 王有基, 胡梦红. 环境内分泌干扰物对鱼类影响的研究进展[J]. 渔业现代化, 2006, 3: 41-44
Wang Y J, Hu M H. Effects of environmental endocrine disruptors on fish [J]. Fishery Modernization, 2006, 3: 41-44 (in Chinese)
[13] 吴红松. 2,6-二氯酚对鲤鱼超氧化物歧化酶和过氧化物酶活性的影响[J]. 毒理学杂志, 2012, 26(4): 319-321
[14] 王连生. 有机污染化学[M]. 北京: 高等教育出版社, 2004: 253
[15] 丘耀文, 张干, 郭玲利, 等. 大亚湾海域典型有机氯农药生物累积特征及变化因素研究[J]. 海洋学报: 中文版, 2007, 29(2): 51-58
Qiu Y W, Zhang G, Guo L L, et al. Study of typical organochlorine pesticides bioaccumulation and influence factors in Daya Bay [J]. Acta Oceanologica Sinica, 2007, 29(2): 51-58 (in Chinese)
[16] Zhang G, Pan Z, Bai A, et al. Distribution and bioaccumulation of organochlorine pesticides (OCPs) in food web of Nansi Lake, China [J]. Environmental Monitoring and Assessment, 2014, 186(4): 2039-2051
[17] 张小辉, 贾海燕, 祁士华, 等. 汉江水体和鱼体内有机氯农药残留水平及积累特征分析[J]. 安全与环境工程, 2014, 21(2): 40-45
Zhang X H, Jia H Y, Qi S H, et al. Analysis of the residual levels and accumulation characteristics of organochlorine pesticides in water and fish in Han River [J]. Safety and Environmental Engineering, 2014, 21(2): 40-45 (in Chinese)
[18] 韦朝海, 张小璇, 任源, 等. 持久性有机污染物的水污染控制: 吸附富集、生物降解与过程分析[J]. 环境化学, 2011, 30(1): 300-309
Wei C H, Zhang X X, Ren Y, et al. Pollution control of persistent organic pollutants in water system: Adsorption /enrichment, biodegradation and process analysis [J]. Environmental Chemistry, 2011, 30(1): 300-309 (in Chinese)
◆
Eestrogen Effect and BioaccumulationinVivoof Three Typical Organochlorine Pesticides on JuvenileCyprinuscarpio
Yu Ruilian*, Lin Chengqi, Lin Xiyan, Hu Gongren
College of Chemical Engineering, Huaqiao University, Xiamen 361021, China
Received 27 October 2015 accepted 22 December 2015
Juvenile Cyprinus carpio was chosen as the tested aquatic animal and exposed to six different concentrations of three typical organochlorine pesticides (OCPs) (α-benzenehexachlorid, p,p′-DDT and heptachlor) for 20 d chronic toxicity test to study the estrogen effect and bioaccumulation of the OCPs. After the exposure test, the concentrations of free calcium and protein-bound phosphorus in the serum of Cyprinus carpio and the residual OCPs contents in vivo were determined. The results demonstrated that the contents of free calcium and protein-bound phosphorus in the serum of juvenile Cyprinus carpio increased first and then decreased with the exposure concentration after low concentration exposure for 20 days. This phenomenon indicated that the above three OCPs presented obvious estrogen effect on the juvenile Cyprinus carpio. The bioaccumulation of p,p′-DDT in different tissues of the juvenile Cyprinus carpio was far higher than those of α-benzenehexachlorid and heptachlor. p,p′-DDT was mostly accumulated in the oil, followed by liver, gills and skin, while α-benzenehexachlorid and heptachlor were mostly accumulated in the liver, followed by skin, gills and oil. The accumulation of above three OCPs in the muscle of juvenile Cyprinus carpio was relatively less.
organochlorine pesticides; juvenile Cyprinus carpio; estrogen effect; bioaccumulation
10.7524/AJE.1673-5897.20151027002
福建省自然科学基金项目(2007J017);华侨大学研究生科研创新能力培育计划资助项目(423)
于瑞莲(1970-),女,博士,研究方向为环境污染化学,E-mail: ruiliany@hqu.edu.cn
*通讯作者(Corresponding author), E-mail: ruiliany@hqu.edu.cn
2015-10-27 录用日期:2015-12-22
1673-5897(2016)2-3748-06
X171.5
A
简介:于瑞莲(1970—),女,环境科学博士,教授,主要研究方向环境污染化学,发表学术论文50余篇。
于瑞莲, 林承奇, 林喜燕, 等. 3种典型有机氯农药对锦鲤幼鱼的雌激素效应及其体内富集[J]. 生态毒理学报,2016, 11(2): 374-379
Yu R L, Lin C Q, Lin X Y, et al. Eestrogen effect and bioaccumulation in vivo of three typical organochlorine pesticides on juvenile Cyprinus carpio [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 374-379 (in Chinese)

