楔形两极虫(黏体门,双壳目)的形态学重描述及其近缘种的分子系统学研究
李超, 索栋, 杨承忠, 赵元莙
(重庆师范大学生命科学学院,动物生物学重庆市重点实验室,重庆401331)
楔形两极虫(黏体门,双壳目)的形态学重描述及其近缘种的分子系统学研究
李超, 索栋, 杨承忠*, 赵元莙
(重庆师范大学生命科学学院,动物生物学重庆市重点实验室,重庆401331)
两极虫属Myxidium和楚克拉虫属Zschokklella在形态上非常相似,形态鉴定界限模糊。为进一步厘清两者的分类学关系,本研究对采自涪江重庆市潼南县江段的楔形两极虫M.cuneiformeFujita,1924进行了形态学重描述,并对其分子系统学进行了研究。楔形两极虫孢子壳面观呈长条形,中部稍凹陷或孢子一边突出,壳瓣上有6~8条与缝嵴平行的条纹;缝嵴直,缝面观呈梭形。孢子长12.5 μm±0.3 μm,宽5.4 μm±0.3 μm(n=20)。极囊2个,呈梨形,分布于孢子两极端;极囊长4.3 μm±0.2 μm,宽3.1 μm±0.2 μm(n=20),极丝细长且明显,盘曲5~6圈。以18S rDNA为分子标记,对楔形两极虫及其近缘种进行了保守区变异、遗传距离、序列相似度和分子系统发育分析,结果表明:两极虫属和楚克拉虫属均非单系发生,两属间物种相互交叉聚支;两极虫属与楚克拉虫属物种间具有很近的亲缘关系。本文基于形态和分子数据的研究结果支持将两极虫属和楚克拉虫属合并为一个属的观点。
楔形两极虫;近缘种;18S rDNA;分子系统学
Bütschli(1882)从淡水的白斑狗鱼Esoxlucius膀胱中检获并报道李氏两极虫Myxidiumlieberkuehni,从而建立了两极虫属Myxidium。两极虫孢子一般是纺锤形、直线形或新月形,甚至是S形,末端稍尖;壳瓣表面光滑或具条纹,孢子缝线直,极囊梨形,位于孢子的两极端,极丝细长,极丝在极囊内横向盘曲;孢子质位于两极囊之间(Lom & Dyková,2006)。迄今,该属已记述232种,是粘孢子虫中继碘泡虫属MyxobolusBütschli,1882之后最大的一属(Eirasetal.,2011)。其主要营腔寄生,少数可行组织寄生。两极虫多寄生于海、淡水鱼类,两栖动物、爬行动物和哺乳动物则鲜有报道(宋微波等,2003;Canning & Okamura,2004;Prunescuetal.,2007)。
因技术条件限制,过去两极虫的分类鉴定主要以成熟孢子的形态特征作为依据。但是,粘孢子虫种类繁多,种间相似度高,加之在形态判定上主观因素的干扰,其分类及系统地位研究虽历史悠久但混乱较多。两极虫属、楚克拉虫属Zschokklella和弧形虫属Sphaeromyxa物种形态较为相似,其中,两极虫与楚克拉虫形态尤为相似,用于物种鉴定的形态特征常常不能将两者有效区分,这点已有学者对其提出了不同的看法(Diamantetal.,1994;Whipps & Zhao,2015)。
18S rDNA分布于所有的细胞生物体内,并且具有相对缓慢的进化历程。其中,保守区可用于构建所有生命的进化树,而变异区可用来区分属或者种。18S rDNA长度适中,通常为1 200~1 900 bp,其信息量充足,但又不过长且容易获得。因此,在不同物种的研究领域中得到了广泛应用。以18S rDNA为分子标记,学者们对包括粘孢子虫在内的低等动物的分类学和系统学问题进行了大量研究,解决了许多悬疑问题(Wrightetal.,1997;Kentetal.,2001;钟霞等,2007;Zhaoetal.,2013)。众多研究表明,18S rDNA是一种粘孢子虫等低等动物分类和系统发生研究的良好分子标记(Micheletal.,2003;鲁义善,聂品,2004;Lom & Dyková,2006;Bartošováetal.,2009)。
本研究在对采自涪江重庆市潼南县江段的楔形两极虫MyxidiumcuneiformeFujita,1924进行形态学重描述的基础上,利用18S rDNA为分子标记对其分子系统学进行研究,以期进一步厘清两极虫与楚克拉虫的分类学关系。
1 材料与方法
1.1 标本采集与虫种鉴定
宿主鲤Cypyinuscarpio于2008年11月采自涪江重庆市潼南县江段。20条鱼体中12条被感染粘孢子虫,感染率为60%。寄生粘孢子虫(楔形两极虫)标本的检获、观察、处理、测量、鉴定方法及相关术语参照赵元莙等(2001)完成。
1.2 DNA的提取、扩增和测序
1.2.1 DNA的提取 从鲤胆囊获得游离的粘孢子虫经冲洗收集、离心富集,DNA提取前采用低速离心的方法,用灭菌蒸馏水清洗悬浮液2~3次以除去杂质。DNA抽提采用Dneasy Tissue Kit(QIAGEN)试剂盒,操作步骤均按照厂家提供的说明书进行。提取的基因组DNA置于-20 ℃冰箱保存备用。
1.2.2 DNA扩增和测序 选取粘孢子虫通用扩增引物:ERIB1(5’-ACCTGGTTGATCCTGCCAG-3’)和ERIB10(5’-CTTCCGCAGGTTCACCTACGG-3’)(Ba-rtaetal.,1997),对样本进行18S rDNA扩增。50 μL的PCR反应体系包括5 μL 10×Ex Taq buffer,40 μmol·L-1dNTPs,20 μmol·L-1引物各1 μL,100 ng的模板DNA,1.5 μL Ex Taq酶(5 U·μL-1)(TaKaRa),用灭菌双蒸水补足至终体积50 μL。反应程序为:95 ℃预变性5 min;95 ℃变性1 min,48 ℃退火1 min,72 ℃延伸2 min,循环35次;最后72 ℃延伸10 min,反应完成后12 ℃保温。取3 μL扩增产物于1%的琼脂糖凝胶电泳检测,然后将PCR产物用胶回收试剂盒Gel Extraction Kit(OMEGA)进行纯化回收。最后将纯化产物送上海英骏生物技术有限公司测序(测序仪为ABI,3730XL)。
1.3 序列选取和系统分析
将本研究的楔形两极虫重庆种群18S rDNA片段在GenBank中通过BLAST进行序列同源性比对。根据比对结果,选取同源性较高的序列以及其他相关类群的11条DNA序列(表1),序列所涉及物种有两极虫属、楚克拉虫属、弧形虫属和鼩粘虫属Soricimyxum等4个属的种类,另选取鲑四囊虫Tetracapusuloidesbryosalmonae作为外群构建系统发育树。通过Clustal W程序按照缺省参数进行序列多重比对,采用PAUP 4.0(Swofford,2001)基于GTR模型按照缺省参数完成最大似然(ML)系统树的构建,ML树运算100代。贝叶斯(BI)树通过MrBayes3.0b4(Ronquist & Huelsenbeck,2003)基于GTR模型构建而成,BI树运算1 000 000代,由Treeview32和Photoshop完成系统树的绘制。
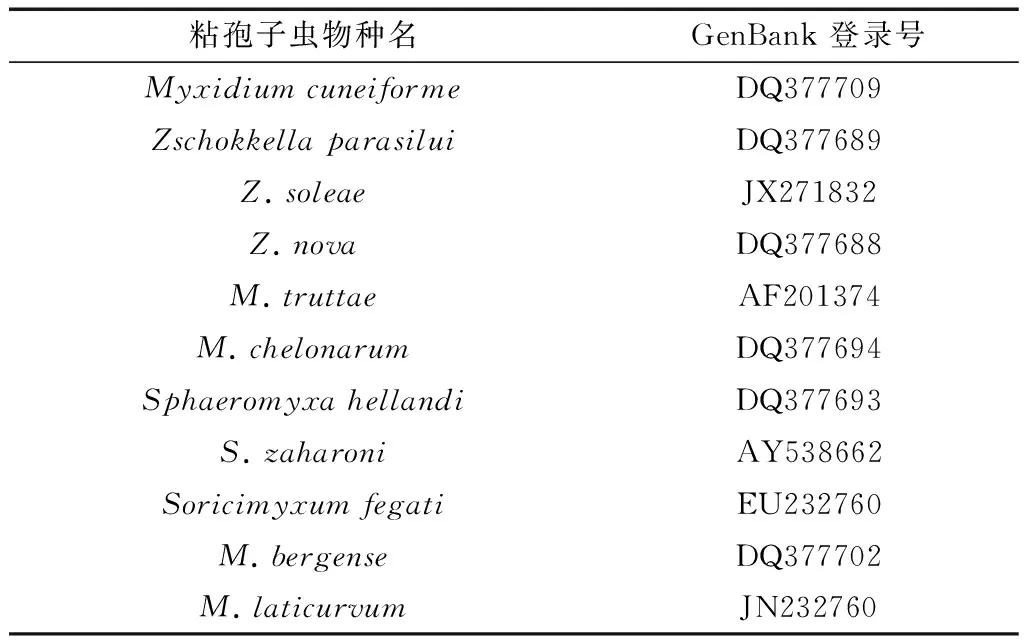
表1 粘孢子虫种GenBank登录号
对所选序列两两之间的遗传距离利用MEGA6.0(Tamuraetal.,2013)进行计算。所选粘孢子虫之间的相似度用GenBank的BLAST(bl2seq)工具计算获得。变异位点分析与GC含量的计算借助Bioedit和MEGA 6.0完成。
2 结果
2.1 楔形两极虫重庆种群的形态学重描述
楔形两极虫孢子壳面观长条形,中部稍凹陷或孢子一边突出,一边稍凹;壳瓣上有6~8条与缝嵴平行的条纹。缝嵴直,缝面观呈梭形。极囊2个,呈梨形,分布于孢子两极端;极丝细长且明显,盘曲5~6圈。孢子量度(n=20)为:孢子长12.5 μm±0.3 μm(12.0~13.1 μm),孢子宽5.4 μm±0.3 μm(4.8~6.1 μm),极囊长4.3 μm±0.2 μm(4.0~4.6 μm),极囊宽3.1 μm±0.2 μm(2.6~3.4 μm)(图1)。
2.2 楔形两极虫18S rDNA分子特征及其系统发生
本研究所得到的楔形两极虫18S rDNA部分序列片段长度为1 622 nt。楔形两极虫重庆种群比武汉种群GC含量略低(46.58% vs.46.97%)。楔形两极虫的18S rDNA经BLAST比对的结果显示,在可比范围内,本研究的楔形两极虫重庆种群与武汉种群(Fiala,2006)相似度高达99%。本种群与鲇楚克拉虫Zschokklellaparasiluri、新楚克拉虫Z.nova以及鲑两极虫M.truttae的相似度为91%、90%、90%。本研究对序列相似度最高的2条序列,即楔形两极虫武汉种群和重庆种群进行比对分析,结果表明武汉种群和重庆种群共有8个变异位点(图2)。
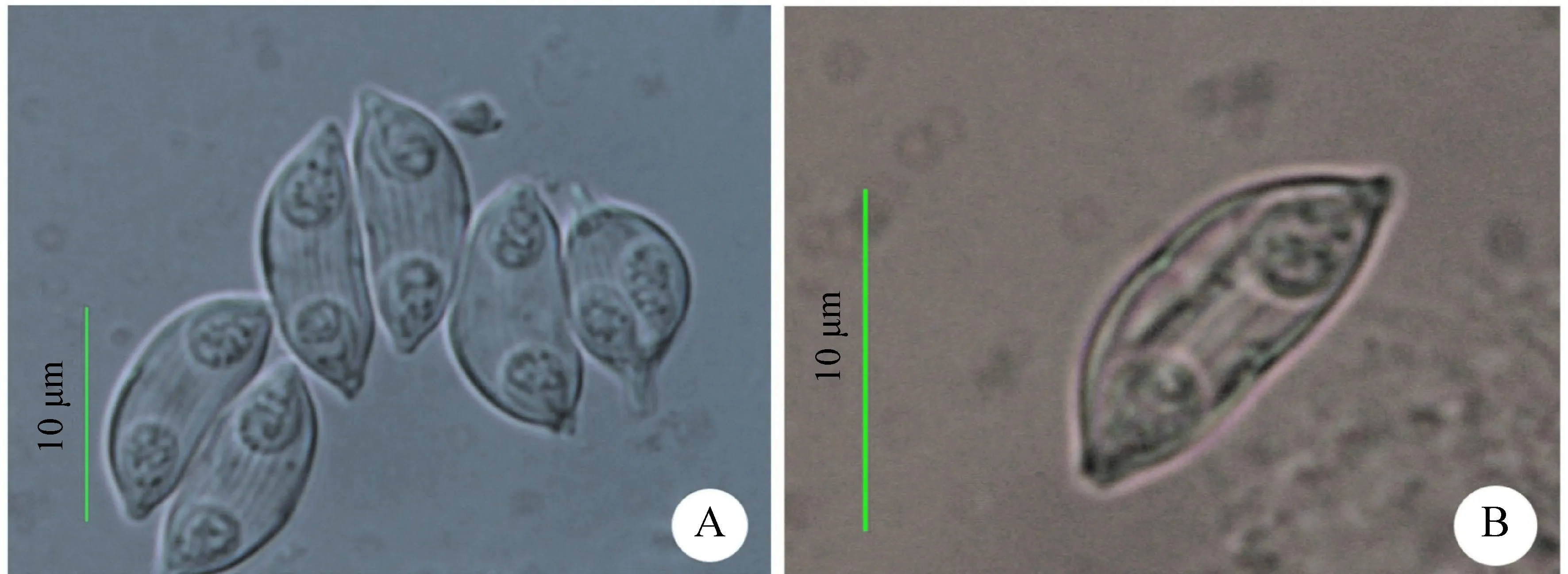
图1 楔形两极虫重庆种群孢子形态图
A.壳面观 front view, B.缝面观 lateral view.
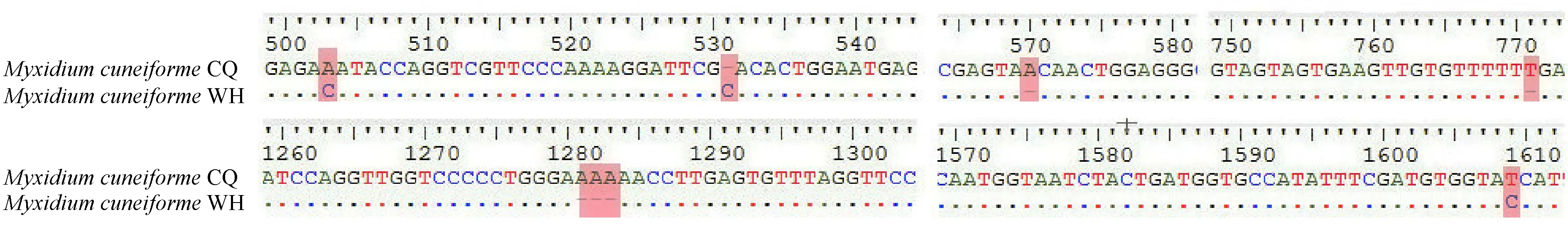
图2 楔形两极虫重庆种群与武汉种群变异位点分析
基于18S rDNA序列片段的遗传距离分析表明,本研究的楔形两极虫重庆种群与武汉种群的遗传距离为0.001,楔形两极虫重庆种群与鲑两极虫之间的遗传距离为0.046,楔形两极虫重庆种群和新楚克拉虫之间的遗传距离为0.046,鲑两极虫和新楚克拉虫之间的遗传距离为0.006(表2)。
利用ML和BI法分别构建了楔形两极虫及其相关种的18S rDNA系统树,两者呈一致的拓扑结构(图3)。粘孢子虫首先聚类为两大支系,即海水支系(图3,B支)和淡水支系(图3,A支)。海水支系由海水两极虫(M.bergense、M.laticurvum)组成,而淡水支系则由两极虫、弧形虫、楚克拉虫和肝鼩粘虫Soricimyxumfegati组成。两极虫属和楚克拉虫属均非单系发生,两属间物种相互交叉聚支(图3)。本研究得到的楔形两极虫位于淡水支系,其首先和楔形两极虫武汉种群聚在一起,且显示两者具有较高支持率(PP=1.00,BS=100)支持的同源性,它们形成的一支与鲇楚克拉虫Z.parasilui形成姐妹群关系,弧形虫支则位于淡水两极虫-楚克拉虫支系的基部。
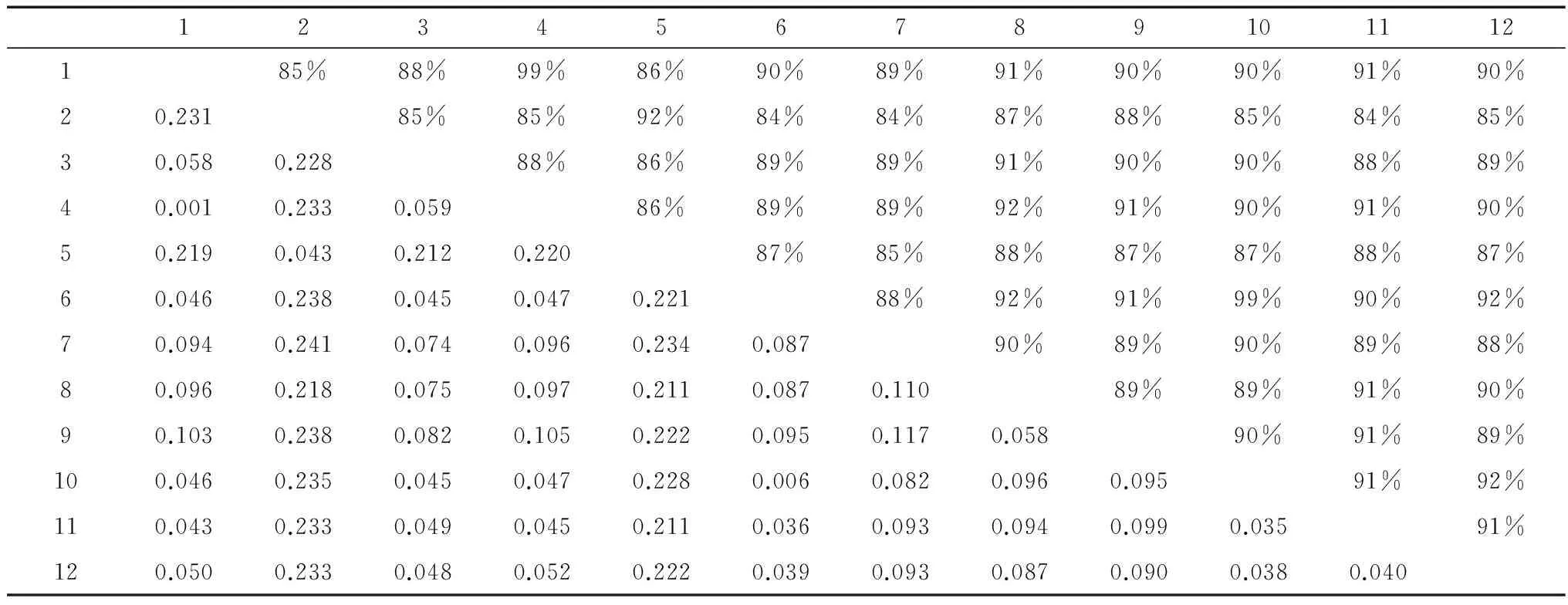
表2 12种粘孢子虫基于18S rDNA序列的相似度和遗传距离
注Notes: 1.MyxidiumcuneiformeCQ, 2.M.bergense, 3.M.chelonarum, 4.M.cuneiformeWH, 5.M.laticurvum, 6.M.truttae, 7.Soricimyxumfegati, 8.Sphaeromyxahellandi, 9.S.zaharoni, 10.Zschokkellanova, 11.Z.parasiluri, 12.Z.soleae.
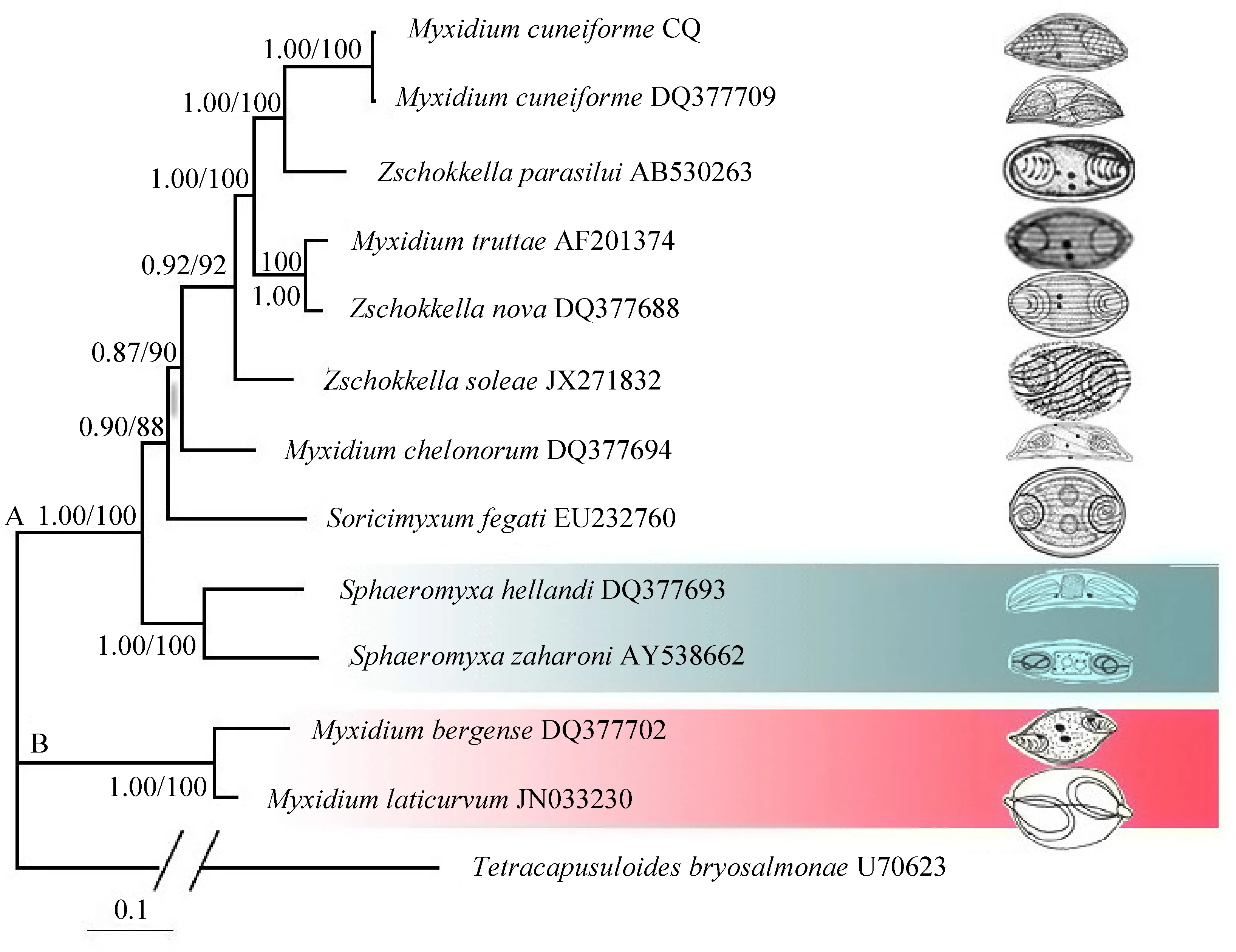
图3 利用ML/BI(最大似然法/贝叶斯法) 基于18S rDNA序列构建的系统发育树
A为淡水支, B为海水支。
A.Fresh water clade, B.Marine clade.
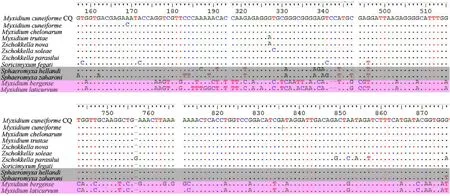
通过分析得到该12条序列共有保守区33个,较淡水种类而言,海水两极虫整体上具有更多的变异位点,弧形虫的变异位点个数介于海水两极虫和淡水种类之间,肝鼩粘虫序列保守区更相似于淡水两极虫(图4)。
3 讨论
楔形两极虫在日本从鲤胆囊中检获并首次描述(Fujita,1924),随后,在前苏联,日本和中国的辽宁、杭州西湖、四川、重庆、湖北武汉等地都有过相关报道(陈启鎏,马成伦,1998)。本研究从鲤胆囊中检获两极虫,用20个样品进行了形态学数据的测量,采用统计学方法对各种形态特征进行描述,经比较发现与楔形两极虫源报道种群(Fujita,1924)所描述的形态特征基本一致,但孢子和极囊大小与原始描述略有差异(表3),同时与《中国动物志》(陈启鎏,马成伦,1998)记载描述种群相比较,整体偏小(表3)。这可能与宿主种类和地理分布等有关。然而比较遗憾的是,除本研究外,唯一公布有18S rDNA分子数据的楔形两极虫报道却未给出其形态学数据,因此不能与该种群进行形态比较。本研究综合了该物种的形态和分子数据,补充和丰富了粘孢子虫物种基础资料。
较保守序列的变异位点的个数可以反映生物体之间的关系,变异位点越少,2种生物体之间的亲缘关系可能越近,反之亦然。序列变异位点分析结果显示,在1 622 nt长度的18S rDNA序列上,本研究所得的楔形两极虫重庆种群与武汉种群之间共有8个变异位点,其主要表现为碱基的缺失,如在531位点、570位点、771位点、1281位点、1282位点、1283位点分别缺失1个碱基。据Zhao等(2013)对粘孢子虫18S rDNA序列的分子鉴别标准,本研究所得的粘孢子虫应为楔形两极虫,这从分子水平进一步验证了从形态上对该种鉴定的准确性。
冉佼等(2014)基于18S rDNA为分子标记的遗传距离的粘孢子虫分类研究认为,种内水平的遗传距离范围为0~0.042,其中大部分物种的遗传距离集中在0~0.007范围内;种间水平的遗传距离范围为0.010~0.323,其中大多数物种的遗传距离集中在0.135 2~0.260 4范围内;属间水平的遗传距离范围为0.105~0.296,其中大多数物种的遗传距离集中在0.181 4~0.257 8范围内。本研究中,选取与楔形两极虫重庆种群相似度最高的11种粘孢子虫进行18S rDNA遗传距离计算,结果显示:本研究得到的楔形两极虫重庆种群与武汉种群之间的遗传距离为0.001,为种内遗传水平(Zhaoetal.,2013;冉佼等,2014),进一步证实了本研究所得物种为楔形两极虫。同时,序列相似度的分析得到了同样的结论。
本研究所选取的11种粘孢子虫利用BI/ML法构建的系统树一致显示,来自海水呈单系发生的弧形虫却位于淡水支(两极虫-楚克拉虫)的基部,这表明弧形虫与淡水两极虫有较近的亲缘关系。同时,保守区变异位点分析显示,弧形虫的序列差异整体上介于海水两极虫和淡水两极虫之间。弧形虫宿主大多生活于海洋性环境,其中一些有洄游习性(如Sphaeroxyumhellandi的宿主黑线鳕Melanogrammusaeglefinus),这可能对弧形虫在海-淡水中的演化有重要影响。这些表明,弧形虫在两极虫类群中地位较为特殊,其物种的形成与分化规律有待今后深入研究。18S rDNA保守区的变异位点分析(图4)和系统发育分析(图3)同时表明,陆生哺乳动物肝脏寄生的肝鼩粘虫与淡水粘孢子虫具有更近的亲缘关系,这与前人的研究结果一致(Dykováetal.,2007),这可能与其宿主鼩鼱Sorexaraneus淡水饮水环境(Michielsen,1966)有关。
目前,粘孢子虫基于分子数据的系统发生关系与依据孢子形态的分类具有很多差异(张婧等,2015a,2015b)。根据两极虫与楚克拉虫形态的相似性和差异性,前人把两者归入两极科下的2个平行属(陈启鎏,马成伦,1998;Lom & Dyková,2006)。然而,两属间诸多分类学特征却甚为模糊,如两极虫缝线多为直线形,楚克拉虫缝线弯曲成“S”形,两极虫属的极囊多为梨形,楚克拉虫属的极囊多近似圆形。但是,依据这些特征并不能解决其所有的形态分类问题,如当极囊既不是严格的梨形也不是严格的圆形时,极囊形态作为一种分类依据就显得很混乱。类似这样的鉴别性描述还有很多,如极囊开口方向,缝线形状等。但系统发育分析显示这2属的物种相互交叉聚支(图3),并不能将两者有效地分开。同时,淡水支系的两极虫与楚克拉虫在保守区的变异位点上也显示出其较近的亲缘关系(图4)。基于以上形态和分子数据的比较研究,本研究支持Diamant等(1994)将两极虫属和楚克拉虫属合并为1个属的观点。
陈启鎏, 马成伦. 1998. 中国动物志 粘体门 粘孢子纲(淡水)[M]. 北京: 科学出版社: 1-30.
鲁义善, 聂品. 2004. 淡水鱼类粘孢子虫18S rDNA分子系统学研究[J]. 水生生物学报, 28(6): 587-591.
冉佼, 杨承忠, 赵元莙. 2014. 基于遗传距离的粘孢子虫分类研究[J]. 重庆师范大学学报(自然科学版), 31(3): 31-34.
宋微波, 赵元莙, 徐奎栋, 等. 2003. 海水养殖中的危害性原生动物[M]. 北京: 科学出版社: 315-428.
张婧, 莫西, 李楠楠, 等. 2015a. 徐家汇尾孢虫HenneguyazikawiensisSikama, 1938补充描述及其分子系统学研究[J]. 内江师范学院学报, 30(4): 42-46.
张婧, 杨承忠, 赵元莙. 2015b. 碘泡科(粘体门:粘孢子纲:双壳目)动物的系统分类学研究[J]. 四川动物, 34(3): 474-480.
赵元莙, 马成伦, 宋微波. 2001. 海水养殖中原生动物病原虫的鉴定—Ⅱ 粘孢子虫原生动物的研究及鉴定方法[J]. 青岛海洋大学学报(自然科学版), 31(5): 681-688.
钟霞, 毛华明, 邓卫东. 2007. 18S rRNA/rDNA序列分析技术在瘤胃原虫分类学研究中的应用[J]. 中国畜牧兽医, 34(12): 56-58.
Barta JR, Martin DS, Libertor PA,etal. 1997. Phylogenetic relationships among eightEimeriaspecies infecting domestic fowl inferred using complete small subunit ribosomal DNA sequences[J]. The Journal of Parasitology, 83(2): 262-271.
Bartošová P, Fiala I, Hypša V. 2009. Concatenated SSU and LSU rDNA data confirm the main evolutionary trends within myxosporeans (Myxozoa: Myxosporea) and provide an effective tool for their molecular phylogenetics[J]. Molecular Phylogenetics and Evolution, 53(1): 81-93.
Canning EU, Okamura B. 2004. Biodiversity and evolution of the myxozoa[J]. Advances in Parasitology, 56: 44-131.
Diamant A, Lom J, Dyková I. 1994.Myxidiumleein. sp., a pathogenic myxosporean of cultured sea breamSparusaurata[J]. Diseases of Aquatic Organisms, 20(2): 137-141.
Dyková I, Tyml T, Fiala I,etal. 2007. New data onSoricimyxumfegati(Myxozoa) including analysis of its phylogenetic position inferred from the SSU rRNA gene sequence[J]. Folia Parasitologica, 54(4): 272-276.
Eiras JC, Saraiva A, Santos MJ,etal. 2011. Synopsis of the species ofMyxidiumBütschli, 1882 (Myxozoa: Myxosporea: Bivalvulida)[J]. Systematics Parasitology, 80: 81-116.
Fiala I. 2006. The phylogeny of Myxosporea (Myxozoa) based on small subunit ribosomal RNA gene analysis[J]. International Journal for Parasitology, 36(14): 1521-1534.
Fujita T. 1924. Studies on myxosporidian infection of the crucian carp[J]. Japanese Journal of Zoology, 1: 45-57.
Kent ML, Andree KB, Bartholomew JL,etal. 2001. Recent advances in our knowledge of the Myxozoa[J]. The Journal of General and Applied Microbiology, 48(4): 395-413.
Lom J, Dyková I. 2006. Myxozoan genera: definition and notes on taxonomy, life cycle terminology and pathogenic species[J]. Folia Parasitologica, 53: 1-36.
Michel R, Walochnik J, Aspöck H. 2003.Pseudodidymiumcryptomastigophorumgen. n., sp. n., aHyperamoebaor a slime mould? A combined study on morphology and 18S rDNA sequence data[J]. Acta Protozoologica, 42(4): 331-342.
Michielsen NC. 1966. Intraspecific and interspecific competition in the shrewsSorexaraneusL. andS.minutusL. [J]. Archives Neerlandaises de Zoologie, 17(1): 73-174.
Prunescu CC, Prunescu P, Pucek Z,etal. 2007. The first finding of myxosporean development from plasmodia to spores in terrestrial mammals:Soricimyxumfegatigen.etsp. n. (Myxozoa) fromSorexaraneus(Soricomorpha)[J]. Folia Parasitologica, 54: 159-164.
Ronquist F, Huelsenbeck JP. 2003. MrBayes 3: Bayesian phylogenetic inference under mixed models[J]. Bioinformatics, 9: 1572-1574.
Swofford DL. 2001. PAUP: phylogenetic analysis using Parsimony (and other methods) version 4[M]. Sunderland, Massachusetts: Sinauer Associates.
Tamura K, Stecher G, Peterson D,etal. 2013. MEGA6: molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution, 30: 2725-2729.
Whipps CM, Zhao YJ. 2015. Synopsis of the species of the genusSphaeromyxaThélohan, 1892 (Myxosporea: Bivalvulida: Variisporina Sphaeromyxidae[J]. Systematics Parasitology, 92(2): 81-99.
Wright ADG, Lynn DH. 1997. Phylogenetic analysis of the rumen ciliate family Ophryoscolecidae based on 18S ribosomal RNA sequences, with new sequences fromDiplodinium,Eudiplodinium, andOphryoscolex[J]. Canadian Journal of Zoology, 75(6): 963-970.
Zhao YJ, Li NN, Tang FH,etal. 2013. Remarks on the validity ofMyxobolusampullicapsulatusandMyxobolushonghuensis(Myxozoa: Myxosporea) based on SSU rDNA sequences[J]. Parasitology Research, 112(11): 3817-3823.
Redescription ofMyxidiumcuneiformeFujita, 1924 (Myxosporea: Bivalvulida) and Molecular Phylogeny with its Relative Species
LI Chao, SUO Dong, YANG Chengzhong*, ZHAO Yuanjun
(Chongqing Key Laboratory of Animal Biology, College of Life Sciences, Chongqing Normal University, Chongqing 401331, China)
The species identification betweenMyxidiumandZschokklellais difficult due to their similar morphology and vague boundaries.To clarify the taxonomic relationship of the two genera, the morphology ofMyxidiumcuneiformeFujita,1924 collected from the Fujiang River in Tongnan county, Chongqing, China was redescribed.Subsequently, molecular phylogeny was analyzed along with the relative species.The mature spore ofM.cuneiformewas elongated in valvular view with the middle part concaved slightly.The surface of each valve had 6~8 longitudinal grooves.The suture line was straight, and spore was fusiform in sutural view.The spore was 12.5 μm±0.3 μm long and 5.4 μm±0.3 μm wide (n=20), each with two polar capsules posited at the both end of the spore.The two polar capsules were pyriform with equal size of 4.3 μm±0.2 μm long and 3.1 μm±0.2 μm wide (n=20), containing polar filaments coiled 5~6 turns.Analyses of the variation of conserved regions, genetic distances, sequence similarities and molecular phylogeny based on 18S rDNA sequences indicated that,MyxidiumandZschokkellawere not monophyletic, as they clustered together with each other in the phylogenetic analysis.Therefore,MyxidiumandZschokkellahad a very close genetic relationship.The results from the morphological and molecular data supported the proposal thatMyxidiumandZschokkellashould be assigned to one single genus.
Myxidiumcuneiforme; relative species; 18S rDNA; molecular phylogeny
2015-11-06 接受日期:2016-01-15 基金项目:国家自然科学基金项目(No.31471980, No.31501845); 重庆市科委基金项目(No.cstc2014jcyjA80014); 重庆市教委科技项目(KJ1400502)
李超(1989—), 男, 硕士研究生, 研究方向为寄生虫进化生态学, E-mail:1027276898@qq.com
*通信作者Corresponding author,E-mail:drczyang@126.com
10.11984/j.issn.1000-7083.20150350
Q959.115
A
1000-7083(2016)03-0384-07

