应用吞噬性能选育矮小鸡的抗病群体
麻 慧,韩红兵,宁中华,连正兴
应用吞噬性能选育矮小鸡的抗病群体
麻 慧1,韩红兵2,宁中华2,连正兴2
(1兰州理工大学生命科学与工程学院,兰州 730050;2中国农业大学动物科技学院, 北京 100193)
【目的】单核巨噬细胞在免疫系统中发挥着重要的作用,试验研究了对单核巨噬细胞吞噬性能的选择影响矮小鸡G1代抗传染性支气管炎病毒(IBV)的能力。【方法】在矮小鸡290日龄时,检测了G0代500只个体(母鸡400只,公鸡100只)的吞噬指数(PI),并根据PI的大小分为强吞噬力组(HPIG)和弱吞噬力组(LPIG)。建立2´2交配组合:HPIG ♂´HPIG ♀(强公强母组),LPIG ♂´HPIG ♀(弱公强母组),HPIG ♂´LPIG ♀(强公弱母组),LPIG ♂´LPIG ♀(弱公弱母组)。随机选择400只1日龄G1代雏鸡(每组100只,公母各半),其中360只采用滴鼻方式人工接种含 IBV M41病毒的鸡胚尿囊液,40只作为对照,连续观察14d,记录死亡数,制作石蜡切片进行H. E.染色,并通过红细胞凝集抑制试验(HI)测定15 d时存活鸡只的抗体效价。G1代鸡20周龄时,选择母鸡12只,其中强组母鸡后代6只,弱组母鸡后代6只,以病毒模拟物Poly I:C刺激体外培养的单核巨噬细胞,采用荧光定量PCR的方法测定细胞因子及主要组织相容性复合体(MHC)mRNA的表达水平。【结果】G0代不同个体对异源红细胞的吞噬能力差异显著,通过测定G0代个体的吞噬指数,建立交配组合,孵育得到G1代鸡。对G1代鸡的IBV攻毒试验的结果为强公强母组后代的死亡率(33.3±0.05)%显著低于弱公弱母组(55.6±0.05)%,其他两个组合后代的死亡率介于上述值之间,弱公强母组为(43.3±0.05)%,强公弱母组为(47.8±0.05)%;母鸡对后代的影响大于公鸡,强母组后代的死亡率(38.3±0.04)%显著低于弱母组(51.7±0.04)%。攻毒组在接种IBV M41病毒3 d后表现出咳嗽、呼吸困难、食欲减退、精神沉郁等临床症状,对病死鸡的气管及肾脏的H.E.染色结果可见典型的病灶,气管上皮细胞坏死脱落,肾小管上皮细胞发生空泡变性等,而对照组均无临床症状及组织病变。对198只攻毒后存活个体抗体滴度的测定结果显示强组母鸡后代抗体滴度(8.45±0.07)显著高于弱组母鸡后代的抗体滴度(8.10±0.08)。利用病毒模拟物Poly I:C刺激体外培养的单核巨噬细胞2 h后,强吞噬力个体(强组母鸡后代)细胞因子IFN γ和IL-1β的表达量分别是弱吞噬力个体(弱组母鸡后代)的5.14倍(<0.05)和2.41倍(<0.05)。强吞噬力个体MHCⅠ的表达量显著高于弱吞噬力个体,而MHCⅡ的表达量差异不显著。【结论】通过测定体外培养的单核巨噬细胞的吞噬性能,按照吞噬指数的高低建立交配组合,强吞噬力母鸡后代的攻毒死亡率显著低于弱吞噬力母鸡后代,且其抗体滴度、细胞因子(IFN γ、IL-1β)和MHCⅠ的表达量显著高于弱吞噬力母鸡后代,说明强吞噬力母鸡后代具有较强的抗IBV的能力。因此单核巨噬细胞的吞噬能力可以作为培育抗IBV品系的一种指标。
单核细胞;巨噬细胞;吞噬性能;抗病性能;矮小鸡
0 引言
【研究意义】鸡传染性支气管炎是一种急性高度接触性传染病,引起鸡呼吸道、肾脏、肠道及输卵管等多个部位的感染。疫苗在鸡群的疾病抵御方面具有重要的保护作用,但IBV血清型众多,新的变异株不断出现,且不同血清型间的交叉保护性小,造成鸡群免疫失败[1]。因此,抗病品系的筛选和培养是一项重要的工作。单核巨噬细胞具有广泛的生物学效应,病原体入侵机体后,首先被单核巨噬细胞捕获,启动非特异性免疫,巨噬细胞具有趋化性及吞噬性,有效地吞噬消化外源微生物及内源性物质,活化的巨噬细胞可以产生细胞毒性物质(NO、活性氧等)破坏吞噬物,并且分泌多种细胞因子、补体、防御素等活性物质[2]。通过对单核巨噬细胞性能的筛选,选育抗传染性支气管炎病毒的品系,具有重要的意义。【前人研究进展】抗病育种的方法有多种,从最初的观察畜种、攻击畜种或后裔等直接选择法,发展到以分子标记辅助选择、转基因技术为主要内容的间接选择法,不同方法具有各自的优越性,同时也具有限制其发展的缺点[3-4]。为了获得家禽的抗病品系,ZHAO等[5-7]分别从抗体滴度、沙门氏菌的含量、生产性状等方面对群体进行了选育。LYALL等[8]制备了对病毒具有高抗性和易感性的转基因鸡的群体。但是消费者很难接受转基因的禽类产品,并且转基因鸡无法广泛应用于家禽业。以细胞学为标记的选择方法,目前已具有一些成功的例子。SWAGGERTY等[9]利用外周血嗜异白细胞培育了鸡白痢沙门氏菌的抗病品系A、D及易感B、C,其中A、B为亲本商品代肉鸡品系,C、D为F1代A、B系的正反交品系。通过对F1代抗病性能的测定发现体外异嗜细胞的功能与鸡对肠炎沙门氏菌的抗性呈正相关[10],与肠球菌及艾美尔球菌的抗性呈正相关[11-12]。通过对分子机理的研究发现,抗性品系的促炎因子和趋化因子mRNA的表达水平均高于易感品系[13]。LI等[14]研究表明单核巨噬细胞吞噬能力较高的母鸡,其子代含有较高的母源抗体,因而具有较强的抗病能力。【本研究切入点】虽然SWAGGERTY等[9]通过对家禽异嗜细胞功能的选育,建立了抗性品系和易感品系,但其并未研究这两种品系对于传染性支气管炎病毒的抗性差异。单核巨噬细胞作为固有免疫中的重要吞噬细胞,其功能的差异直接影响固有免疫的能力,LI等[14]指出高吞噬力母鸡的子代具有较高的抗病力,但并未就具体的疾病展开研究,也未研究其高抗病力的分子机制。【拟解决的关键问题】本研究旨在通过对G0代单核巨噬细胞吞噬性能的选择,研究是否可以提高G1代中高吞噬组后代对IBV病毒的抵抗力,并研究其分子机制。
1 材料与方法
试验于2010年3—11月在中国农业大学细胞与分子实验室及北京北农大种禽有限责任公司完成。
1.1 试验动物
随机选择900只农大3号节粮矮小型蛋鸡饲养于北京北农大种禽有限责任公司,鸡只按照标准条件饲养,采食饮水自由。290日龄时,测定G0代500只鸡(母鸡400只,公鸡100只)的吞噬指数(phagocytic index,PI),按照PI的强弱,分为强吞噬组(high phagocytic index groups,HPIG,其中公鸡PI ≥ 3.0,母鸡PI ≥ 2.0)和弱吞噬组(low phagocytic index groups,LPIG,其中公鸡PI=1.0,母鸡PI ≤ 1.1)。192只中等吞噬力的个体被淘汰。
试验选用2×2配种组合:HPIG ♂×HPIG ♀(强公强母组),LPIG ♂×HPIG ♀(弱公强母组),HPIG ♂×LPIG ♀(强公弱母组),LPIG ♂×LPIG ♀(弱公弱母组)。每组7只公鸡,每只公鸡配种10只母鸡。连续15 d收集种蛋后入孵。所得G1代雏鸡,每组随机选择100只(公母各半),4组共400只用于攻毒试验。其余G1代鸡饲养到20周龄时,HPIG与LPIG各选择6只健康的母鸡,用于细胞因子测定试验。
1.2 细胞分离培养
翅静脉采集0.5 mL外周血,缓慢注入加有肝素的1.5 mL无菌离心管中。利用密度梯度离心法分离外周血单个核细胞(PBMC):抗凝血与Hank’s以1﹕1的比例混合,再加入1 mL淋巴细胞分离液的液面上,500×水平离心20 min收集中间层的PBMC,加Hank’s液800×离心10 min洗涤PBMC一次。将PBMC用配好的RPMI1640培养液以1×107个/孔接种于96孔板中,在37℃,5% CO2饱和湿度培养箱中培养24 h。用移液器移走悬浮细胞,RPMI1640培养液洗涤贴壁细胞2—3次,贴壁细胞即为单核巨噬细胞,淋巴细胞和血小板不具有贴壁特性。培养48 h后,90%的贴壁细胞为单核巨噬细胞[3]。
1.3 吞噬性能测定
经过72 h培养,单核巨噬细胞的密度为2×105个/孔。取寿光鸡的红细胞作为异源红细胞,并以1×106个/孔加入培养单核巨噬细胞的96孔培养板。将培养板放入CO2培养箱,吞噬反应于6 h内发生。吞噬性能的计数方法:吞噬后细胞用PBS洗涤2次,用相差显微镜,计数300个单核巨噬细胞中吞噬红细胞的单核巨噬细胞数,及被吞噬的红细胞总数[15]。吞噬指数(PI)表示为被吞噬的红细胞数除以吞噬红细胞的单核巨噬细胞数[16]。
1.4 传染性支气管炎病毒复壮及收获
IBV M41株冻干毒购自中国兽药监察所。使用前,加2 mL无菌生理盐水入冻干毒得病毒液。选用10日龄SPF鸡胚,照蛋画出气室和胚位,在气室接近胚位处用酒精消毒,打孔器打小孔,将注射器针头从小孔处小心扎入1.5 cm深注入0.1 mL病毒液。用石蜡封口,置孵育箱中孵育,弃掉24 h内死亡鸡胚。每天照蛋1次,收集72 h内死亡鸡胚的尿囊液。离心去杂质后取上清病毒液放4℃冰箱备用。
1.5 IBV攻毒及抗体测定
随机选择400只(每组100只,公母各半)1日龄的G1代雏鸡,其中360只用于攻毒试验,40只作为对照。攻毒组采用滴鼻方式人工接种IBV M41病毒鸡胚尿囊液0.2 mL/只,含毒量为107—109EID50,对照组接种非感染尿囊液0.2 mL/只。为了避免交叉感染,攻毒组和对照组严格隔离饲养,试验时按照先对照组后攻毒组的原则进行饲养与记录,各饲养组有独立的工作服及器皿,严格避免病原菌的传播。接种后连续观察14 d,记录死亡数,剖解死亡鸡只,观察心、肝、脾、肺、肾等的病理变化,确定其死亡原因。制作切片并通过H. E. 染色观察组织的病理变化。第15天屠宰被感染的活鸡,取血清进行红细胞凝集抑制试验(HI)测定其抗体效价(log2)。
1.6 病毒模拟物Poly I:C刺激细胞
选择20周龄G1代健康母鸡12只,其中强吞噬力个体(强组母鸡后代)和弱吞噬力个体(弱组母鸡后代)各6只。提取外周血单核细胞,细胞计数后,以相同浓度接种于6孔板中。细胞纯化培养到46 h时,向培养液中加入Poly I:C(Sigma),添加浓度为1 μg·mL-1,刺激时间为0、2 h。48 h时加裂解液收集细胞,使用RNA提取试剂盒(Omega Bio-tek公司)提取RNA。纯化后的RNA分装后放入-80℃备用。
1.7 荧光定量PCR
荧光定量PCR引物设计程序为Primer Express 3.0,引物参见表1。反应程序:95℃ 10 min;95℃ 30 s,60℃ 30s,68℃ 30s,40个循环,在60℃ 30s处采集荧光信号;95℃ 30s,60℃ 30s,95℃ 30s,1个循环,在60℃ 30s处采集荧光信号。

表1 基因及引物
1.8 数据分析
利用χ2检验分析不同组间攻毒死亡率的差异,并利用GLM程序(SAS V8.2)对对数转化后的抗体滴度的差异性进行方差分析,所用模型如下:
Yij= μ + Fi+ Mj+ Fi´Mj+ eij
式中,Yij表示第ij个个体的表型性状记录值,μ为平均值,Fi为第i个母鸡吞噬能力的效应,Mj为第j个公鸡吞噬能力的效应,Fi×Mj为第i个母鸡吞噬能力与第j个公鸡吞噬能力互作对表型值的效应,eij为残差效应。差异显著水平为0.05。
攻毒死亡率表示为死亡率±标准误。标准误的计算方法依据样本百分数标准误计算公式,表示样本百分数,S为样本百分数标准误,S=,其中,=,=总样本数。
荧光定量PCR的结果分析采用2-ddCt相对定量法,计算出目标基因转录的变化倍数,β-actin作为内参基因。不同组合倍数变化的差异比较采用SAS软件的GLM程序。
2 结果
2.1 G0代吞噬性能的差异
对异源红细胞的吞噬能力有效地反映了不同个体间单核巨噬细胞的吞噬性能。通过对500只G0个体PI值的检测,筛选出了吞噬力差异显著的个体(图1)。

(a)强吞噬指数组(公鸡PI ≥ 3.0,母鸡PI ≥ 2.0)的个体;(b)弱吞噬指数组(公鸡PI = 1.0,母鸡PI ≤ 1.1)的个体
2.2 IBV攻毒死亡率
攻毒时间为14d,死亡162只,解剖全部病死鸡,均具有典型的传染性支气管炎症状。强公强母组后代的死亡率(33.3±0.05)%显著低于弱公弱母组(55.6±0.05)%,其他两个组合后代的死亡率介于强公强母组和弱公弱母组之间,弱公强母组为(43.3±0.05)%,强公弱母组为(47.8±0.05)%(图2-A)。分析公鸡和母鸡的PI对后代死亡率的影响,结果显示母鸡对后代的影响大于公鸡,强母组后代的死亡率((38.3±0.04)%)显著低于弱母组((51.7± 0.04)%),而强弱公鸡组后代的死亡率差异不显著(图2-B)。
2.3 抗体滴度
测定了198只个体血清中抗IBV的抗体滴度。强公强母组后代的抗体滴度显著高于其余3组(图3-A)。统计结果表明,公鸡对后代的影响不显著。强组母鸡后代抗体滴度(8.45±0.07)显著高于弱组母鸡后代的抗体滴度(8.10±0.08)(图3-B)。

选择400只G1代个体(公母各半)平均来自4个交配组合。然后,360只采用滴鼻方式(107-109 EID50/只)接种含有IBV的尿囊液0.2 mL,40只接种不含IBV的尿囊液0.2mL作为对照组。观察14 d。A. 4个交配组合后代的死亡率:1:HPIG ♂ ´ HPIG ♀,2:LPIG ♂ ´ HPIG ♀,3:HPIG ♂ ´ LPIG ♀,4:LPIG ♂ ´ LPIG ♀。B. 母鸡HPIG 和母鸡LPIG 后代的死亡率。HPIG =强吞噬指数组;LPIG =弱吞噬指数组。数据表示为平均数±标准误。a, b表示差异显著(P<0.05)
2.4 病死鸡临床症状及病理组织学观察
攻毒组鸡在接种IBV M41病毒后3 d出现临床症状,表现为轻度咳嗽和精神沉郁,从第4天开始,呼吸困难,张口呼吸,出现啰音,食欲减退。对照组精神和采食正常。
试验组病死鸡的器官和组织在攻毒后出现不同程度的病理组织学损伤,取病死鸡的组织样进行H.E.染色鉴定。试验组鸡攻毒后第3天起,气管黏膜层结构不完整,上皮细胞核变圆,有的胞核碎裂,部分上皮细胞坏死脱落;黏膜下层水肿,毛细血管扩张充血(图4-A)。肾间质血管扩张出血,肾小管上皮细胞发生空泡变性,部分出现颗粒变性,核浓缩,间质有淋巴细胞浸润(图4-B)。对照组组织器官均无明显病变。
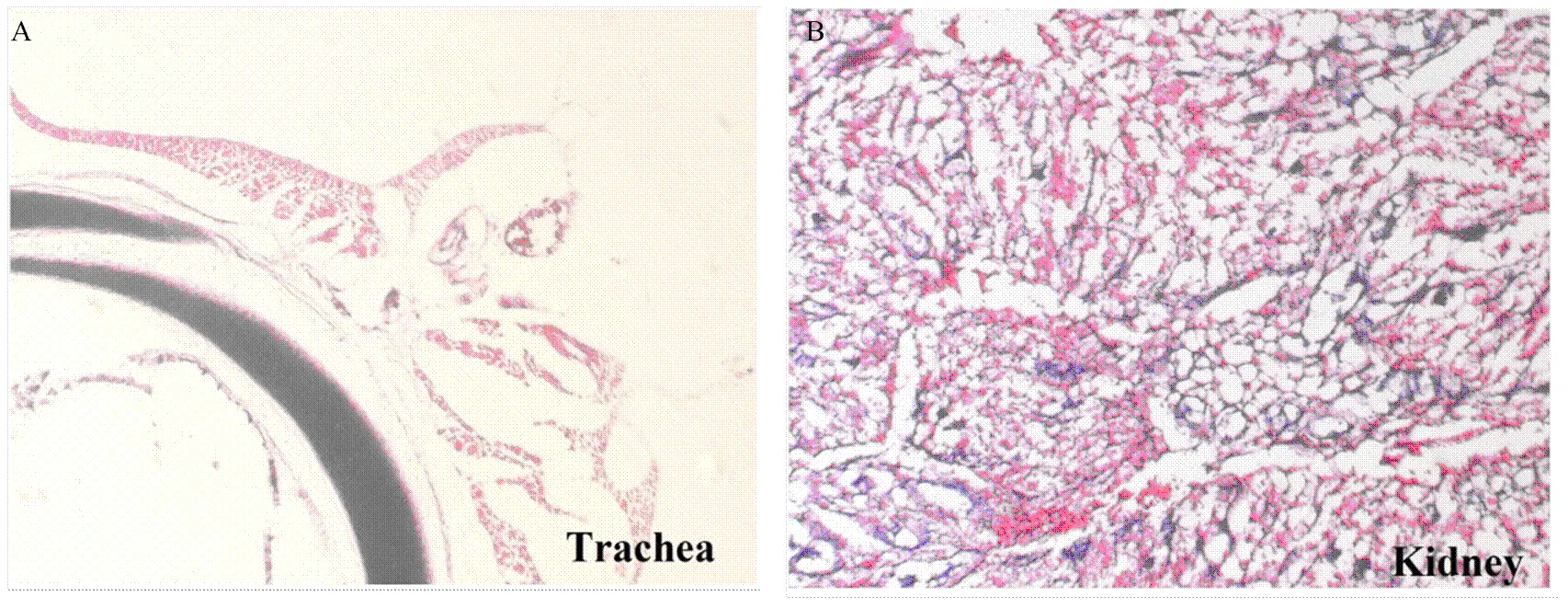
A. 气管;B. 肾脏 A. trachea; B. kidney
2.5 荧光定量PCR
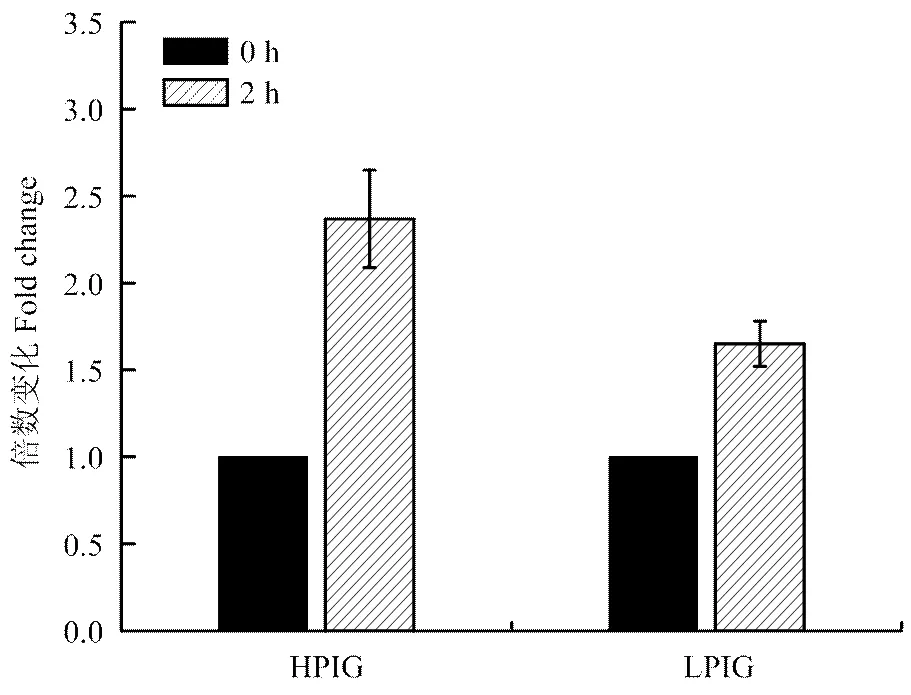
试验通过病毒模拟物Poly I:C对外周血单核巨噬细胞的刺激作用,利用相对定量的方法,比较了G1代不同吞噬力个体先天性免疫反应的差异。单核巨噬细胞是先天性免疫反应中的主要效应细胞,同时也可以有效地递呈抗原,激活获得性免疫反应。本试验测定了先天性免疫反应中重要的细胞的因子IFN γ及IL-1β的表达量,结果表明刺激2 h时,强吞噬力个体IFN γ的表达量是弱吞噬力个体的5.14倍(<0.05,图5),而强吞噬力个体IL-1β的表达量是弱吞噬力个体的2.41倍(<0.05,图6)。主要组织相容性复合体(MHC)具有介导先天性及获得性免疫反应的重要作用。强吞噬力个体MHCⅠ的表达量显著高于弱吞噬力个体(图7),而MHCⅡ的表达量差异不显著(图8)。
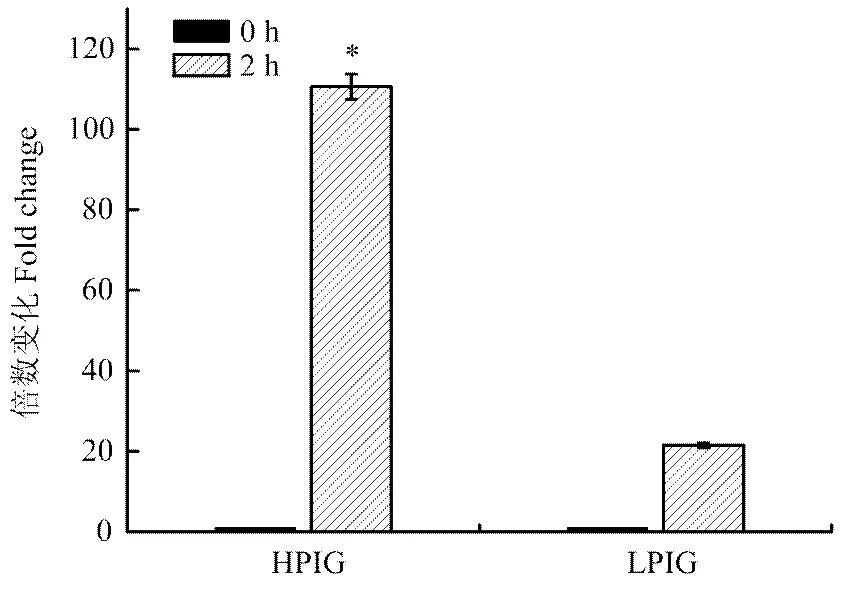
将从12只G1代个体中分离得到的单核细胞分别培养在6孔板中。46小时后,向细胞培养液中加入Poly I:C (1加入分别培养在分别刺激0小时和2小时。然后提取mRNA。应用实时定量PCR检测细胞因子的表达量。* 表示P<0.05即相同刺激时间时HPIG 和LPIG的表达量差异显著。HPIG =强吞噬指数组;LPIG =弱吞噬指数组。数据表示为平均数±标准误
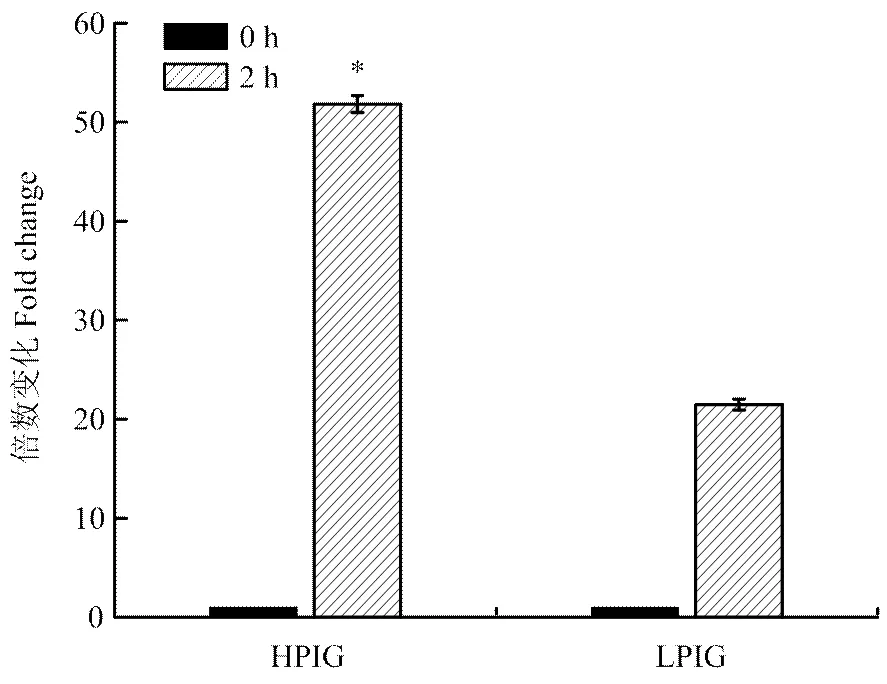
HPIG =强吞噬指数组,LPIG =弱吞噬指数组。数据表示为平均数±标准误, *表示P<0.05
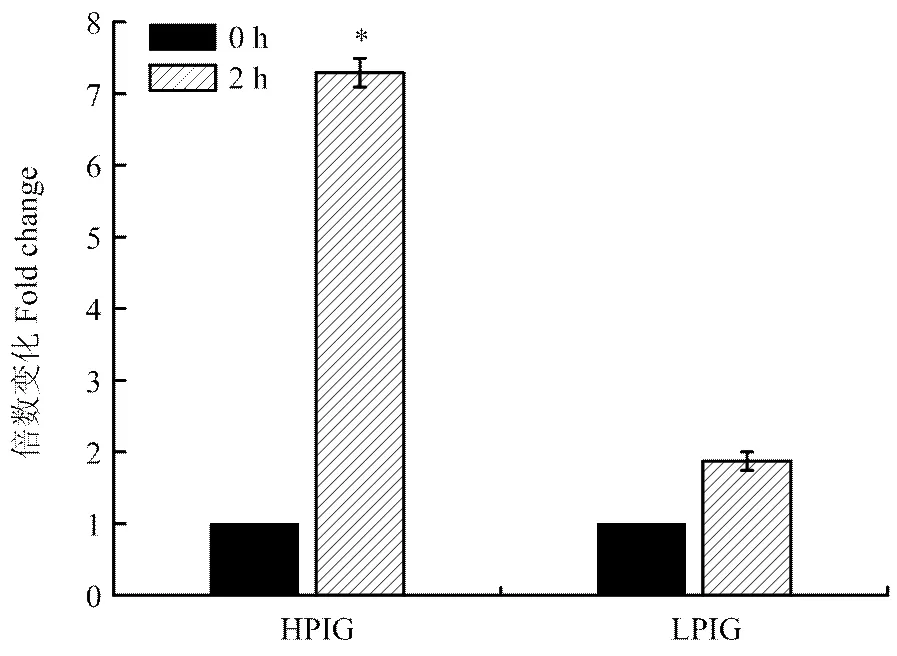
HPIG =强吞噬指数组,LPIG =弱吞噬指数组。数据表示为平均数±标准误, *表示P<0.05
HPIG =强吞噬指数组,LPIG =弱吞噬指数组。数据表示为平均数±标准误,*表示P<0.05
3 讨论
鸡传染性支气管炎是由冠状病毒引起的急性高度接触性呼吸道传染病。引起雏鸡高死亡率、生长发育受阻及母鸡成年后无法达到产蛋高峰。蛋鸡感染传支后,产蛋量急剧下降,破蛋软蛋增多,造成养殖业的巨大经济损失,因此通过抗病育种的方法选育抗传染性支气管炎品系意义重大。抗病育种常用的方法有直接选择法和间接选择法,其中间接选择法又包括免疫遗传学抗病育种、分子标记辅助选择、利用转基因技术抗病育种等。畜禽感染病原体后,激活固有免疫和适应性免疫应答,研究表明,免疫应答具有低遗传力或中等遗传力。单核巨噬细胞是固有免疫应答的主要细胞,同时是激活适应性免疫应答的重要细胞,据报道单核巨噬细胞体外的吞噬性能可以很好地反映细胞自身的免疫功能[17]及机体的抗病性能[15],检测其吞噬性能的方法有多种,利用异源红细胞作为吞噬物来测定吞噬指数是常用的一种方法[18]。本文通过体外测定单核巨噬细胞的吞噬指数,分别将公鸡和母鸡分为强组和弱组,并进行配种,获得4种交配组合的后代并测定其抗病性能。
强吞噬力母鸡后代较弱吞噬力母鸡后代对IBV的抗性强,IBV攻毒后,强吞噬力母鸡后代的死亡率低且抗体滴度高。首先,单核巨噬细胞在先天性及获得性免疫反应中都具有重要的调节作用。通过细胞表面的受体感知并吞噬入侵的微生物,并且通过分泌细胞因子来扩大信号传导及激活T淋巴细胞的反应[2]。单核巨噬细胞的强吞噬作用可以有效促进抗体的表达,进而提高机体的抗病力[19-20]。其次,LI等[14]报道,母本的吞噬能力与鸡蛋中IgY的含量呈正相关[3]。对于刚出生的雏鸡,免疫系统不成熟,极易受病菌的感染。而雏鸡通过鸡蛋获得的母源抗体具有重要的保护作用,加强雏鸡对各种病原体的免疫力[21]。母源抗体不仅起被动的保护作用,而且可以促进雏鸡自身免疫系统的发育与成熟[22]。因此,母本的吞噬能力决定了后代对疾病的抗性。
本试验利用Poly I:C这一病毒模拟物,刺激强吞噬组及弱吞噬组体外培养的单核巨噬细胞,结果表明强吞噬组IFN γ及IL-1β的表达量显著高于弱吞噬组。这一结果与前人的报道较为相同。WIGLEY等[23]体外培养了沙门氏菌抗性品系和易感品系的巨噬细胞,用沙门氏菌感染细胞后测定细胞因子,结果表明抗性品系表达大量促炎细胞因子IL-1系、IL-6、CCLi2等。同样,SWAGGERTY等[24]经体内及体外沙门氏菌感染试验表明,抗性品系促炎细胞因子的表达量均高于易感品系。
细胞因子是固有免疫应答阶段重要的免疫分子,包括促炎细胞因子和抗炎细胞因子,其中促炎细胞因子可以通过增强炎症应答来提高机体的抗感染能力[25-26]。CAUTHEN等[27]对感染禽流感病毒(AIV)的1日龄及4周龄鸡只的研究表明,IFN的表达量与AIV的毒力、传播及变异密切相关,IFN表达量高的个体其病毒滴度低,且带毒时间短。NIU等[28]研究表明,雏鸡在受到IBV感染后会产生大量的干扰素[14]。干扰素可以有效抑制IBV在肾及气管组织中的复制。IFN γ可以促进巨噬细胞表达活性氧及NO等活性物来杀伤病源[29]。同时IFN γ可以促进MHCⅡ、IL12等的表达,且促进抗体的生成[30-31]。IL-1β是一类主要的促炎细胞因子,可以促进T、B细胞活化、增殖和分化[32]。单核巨噬细胞通过调节细胞因子的分泌,抑制了IBV的复制。
MHC与动物的抗病性密切相关。报道表明鸡只对传染性支气管炎病毒的抗性与MHC的单倍型有关[33]。而MHC与单核巨噬细胞具有互相调节的作用[34]。在家禽中,不同MHC单倍型的个体其单核巨噬细胞在吞噬、胞内病毒清除及血液单核细胞趋化性等方面的功能差异显著。MHCⅠ的主要作用为递呈内源性抗原(如病毒、肿瘤等),启动Th1型淋巴细胞反应[35]。本试验中,强吞噬组MHCⅠ的表达量显著高于弱吞噬组,因此对病毒的递呈能力及获得性免疫反应的激活作用较强。
4 结论
本研究通过活体攻毒试验及体外细胞因子的表达测定,证明了强吞噬组后代抗传染性支气管炎病毒的能力显著高于弱吞噬组后代。在受到病毒感染后,强吞噬组后代可以迅速调动机体的免疫反应,体内的单核巨噬细胞释放大量的促炎细胞因子IL-1β、IFNγ等,增强先天性免疫反应对病毒的清除作用,同时组织相容性复合体Ⅰ的高表达可以提高向细胞毒性T淋巴细胞递呈抗原的效率,启动较强的获得性免疫反应。因此可以通过对单核巨噬细胞吞噬能力的选择来选育抗传染性支气管炎病毒的家禽品系。
References
[1] 陶家权, 刘乔然, 乔荣岑, 孙进忠, 张许科. 鸡传染性支气管炎的流行及防控. 中国家禽, 2009, 31(24):65-66.
TAO J Q, LIU Q R, QIAO R C, SUN J Z, ZHANG X K. Epidemiology and control of chicken infectiou bronchitis.2009, 31(24): 65-66. (in Chinese)
[2] O'MAHONY D S, PHAM U, IYER R, HAWNT R, LILES W C. Differential constitutive and cytokine-modulated expression of human toll-like receptors in primary neutrophils, monocytes, and macrophages.2008, 5(1): 1-8.
[3] METTERLEIN T, SCHUSTER F, TADDA L, HAGER M, ROEWER N, ANETSEDER M. Statins alter intracellular calcium homeostasis in malignant hyperthermia susceptible individuals., 2010, 28(6):356-360.
[4] YONASH N, BACON L D, WITTER R L, CHENG H H. High resolution mapping and identification of new quantitative trait loci (qtl) affecting susceptibility to marek’s disease.1999, 30(2):126-135.
[5] ZHAO X L, HONAKER C F, SIEGEL P B. Phenotypic responses of chickens to long-term selection for high or low antibody titers to sheep red blood cells.2012, 91:1047-1056.
[6] BEAUMONT C, CHAPUIS H, PROTAIS J, SELLIER N, MENANTEAU P, FRAVALO P, VELGE P. Resistance to Salmonella carrier state: Selection may be efficient but response depends on animal’s age.2009, 91:161-169.
[7] CHENG H W, EICHER S D, CHEN Y, SINGLETON P, MUIR W M. Effect of genetic selection for group productivity and longevity on immunological and hematological parameters of chickens.2001, 80:1079-1086.
[8] LYALL J, IRVINE R M, SHERMAN A, MCKINLEY T J, NUNEZ A, PURDIE A, OUTTRIM L, BROWN I H, ROLLESTON-SMITH G, SANG H, TILEY L. Suppression of avian influenza transmission in genetically modified chickens.2011, 331:223-226.
[9] SWAGGERTY C L, PEVZNER I Y, FERRO P J, CRIPPEN T L, KOGUT M H. Association between in vitro heterophil function and the feathering gene in commercial broiler chickens., 2003, 32(5):483-488.
[10] SWAGGERTY C L, FERRO P J, PEVZNER I Y, KOGUT M H. Heterophils are associated with resistance to systemicinfection in genetically distinct lines of chickens.2005, 43:149-154.
[11] SWAGGERTY C L, LOWRY V K, FERRO P J, PEVZNER I Y, KOGUT M H. Disparity in susceptibility to vancomycin-resistant Enterococcus organ invasion in commercial broiler chickens that differ in innate immune responsiveness.2005, 16:1-15.
[12] SWAGGERTY C L, GENOVESE K J, HE H, DUKE S E, PEVZNER I Y, KOGUT M H. Broiler breeders with an efficient innate selection for resistangce against salmonella.2011, 90: 1014-1019.
[13] SWAGGERTY C L, KAISER P, ROTHWELL L, PEVZNER I Y, KOGUT M H. Heterophil cytokine mRNA profiles from genetically distinct lines of chickens with differential heterophil-mediated innate immune responses.2006, 35:102-108.
[14] LI H, ZHANG Y, NING Z H, DENG X M, LIAN Z X, LI N. Effect of selection for phagocytosis in dwarf chickens on immune and reproductive characters.2008, 87(1):41-49.
[15] SUN S F, PAN Q Z, HUI X, ZHANG B L, WU H M, LI H, XU W, ZHANG Q, LI J Y, DENG X M, CHEN J W, LIAN Z X, LI N. Stronger in vitro phagocytosis by monocytes-macrophages is indicative of greater pathogen clearance and antibody levels2008, 87(9):1725-1733.
[16] BASSOE C F, SMITH I, SORNES S, HALSTENSEN A, LEHMANN A K. Concurrent measurement of antigen- and antibody-dependent oxidative burst and phagocytosis in monocytes and neutrophils.2000, 21(3):203-220.
[17] 萨仁娜, 佟建明, 何春年, 高微微, 张琪. 海带岩藻聚糖及其级分在氧化应激条件下对肉鸡巨噬细胞免疫功能的影响. 中国农业科学, 2008, 41(10): 3256-3263.
SA R N, TONG J M, HE C N, GAO W W, ZHANG Q. Effect of fucoidan and fraction isolated from laminaria japonica on immunity of broiler macrophages under oxidation stress condition.2008, 41(10): 3256-3263. (in Chinese)
[18] NILSSON A, OLDENBORG P A. Cd47 promotes both phosphatidylserine-independent and phosphatidylserine-dependent phagocytosis of apoptotic murine thymocytes by non-activated macrophages.2009, 387(1): 58-63.
[19] SOLANO G I, BAUTISTA E, MOLITOR T W, SEGALES J, PIJOAN C. Effect of porcine reproductive and respiratory syndrome virus infection on the clearance of haemophilus parasuis by porcine alveolar macrophages.1998, 62(4):251-256.
[20] HAMAL K R, BURGESS S C, PEVZNER I Y, ERF G F. Maternal antibody transfer from dams to their egg yolks, egg whites, and chicks in meat lines of chickens.2006, 85(8):1364-1372.
[21] GRINDSTAFF J L. Maternal antibodies reduce costs of an immune response during development.2008, 211(Pt 5):654-660.
[22] Reid J M, Arcese P, Keller L F, Hasselquist D. Long-term maternal effect on offspring immune response in song sparrows melospiza melodia.2006, 2(4):573-576.
[23] WIGLEY P, HULME S, ROTHWELL L, BUMSTEAD N, KAISER P, BARROW P. Macrophages isolated from chickens genetically resistant or susceptible to systemic salmonellosis show magnitudinal and temporal differential expression of cytokines and chemokines following salmonella enterica challenge.2006, 74(2):1425-1430.
[24] SWAGGERTY C L, PEVZNER I Y, HE H, GENOVESE K J, NISBET D J, KAISER P, KOGUT M H. Selection of broilers with improved innate immune responsiveness to reduce on-farm infection by foodborne pathogens.2009, 6(7): 777-783.
[25] 黄琴, 黄怡, 崔志文, 李雅丽, 李卫芬, 余东游. 鼠李糖乳杆菌对巨噬细胞先天性免疫应答的调节作用. 中国农业科学, 2012, 45(8): 1621-1626.
HUANG Q, HUANG Y, CUI Z W, LI Y L, LI W F, YU D Y. Modulation ofon innate immune responses in macrophages.2012, 45(8): 1621-1626. (in Chinese)
[26] 王继英, 王彦平, 郭建凤, 王怀中, 林松, 张印, 武英. 仔猪外周血中内参基因的筛选及细胞因子和受体的表达水平. 中国农业科学, 2015, 48(7): 1437-1444.
WANG J Y, WANG Y P, GUO J F, WANG H Z, LIN S, ZHANG Y, WU Y. Selection of reference genes and determination of cytokines and receptor mRNA expression in peripheral blood of piglets.2015, 48(7): 1437-1444. (in Chinese)
[27] CAUTHEN A N, SWAYNE D E, SEKELLICK M J, MARCUS P I, SUAREZ D L. Amelioration of influenza virus pathogenesis in chickens attributed to the enhanced interferon-inducing capacity of a virus with a truncated ns1 gene.2007, 81(4): 1838-1847.
[28] NIU M, HAN Y, LI W. Baculovirus up-regulates antiviral systems and induces protection against infectious bronchitis virus challenge in neonatal chicken.2008, 8(12): 1609-1615.
[29] PEI J, SEKELLICK M J, MARCUS P I, CHOI I S, COLLISSON E W. Chicken interferon type i inhibits infectious bronchitis virus replication and associated respiratory illness.2001, 21(12):1071-1077.
[30] HE H, GENOVESE K J, KOGUT M H. Modulation of chicken macrophage effector function by th1/th2 cytokines.2011, 53:363-369.
[31] FLESCH I E, HESS J H, HUANG S, AGUET M, ROTHE J, BLUETHMANN H, KAUFMANN S H. Early interleukin 12 production by macrophages in response to mycobacterial infection depends on interferon gamma and tumor necrosis factor alpha.1995, 181(5):1615-1621.
[32] FINKELMAN F, KATONA I, MOSMANN T R, COFFMAN R L. Ifn-gamma regulates the isotypes of ig secreted during in vivo humoral immune responses.1988, 140(4): 1022-1027.
[33] CHEESEMAN J H, KAISER M G, CIRACI C, KAISER P, LAMONT S J. Breed effect on early cytokine mrna expression in spleen and cecum of chickens with and without salmonella enteritidis infection.2007, 31(1): 52-60.
[34] BACON L D, HUNTER D B, ZHANG H M, BRAND K, ETCHES R. Retrospective evidence that the mhc (b haplotype) of chickens influences genetic resistance to attenuated infectious bronchitis vaccine strains in chickens.2004, 33(6):605-609.
[35] ZINKERNAGEL R. On cross-priming of mhc class i-specific ctl: Rule or exception?2002, 32(9): 2385-2392.
(责任编辑 林鉴非)
Breeding of Disease Resistant Dwarf Chickens by Phagocytic Ability
MA Hui1, HAN Hong-bing2, NING Zhong-hua2, LIAN Zheng-xing2
(1College of Life Science and Engineering, Lanzhou University of Technology, Lanzhou 730050;2College of Animal Science and Technology, China Agricultural University, Beijing 100193)
【Objective】Monocytes-macrophages play an important role in the immune system. The effect of selection for monocytes-macrophages phagocytosis on infectious bronchitis virus (IBV) resistance in generation 1 (G1) of dwarf chickens was studied. 【Method】The phagocytic index (PI) of 500 dwarf chickens (400 hens and 100 cocks) of generation 0 (G0) was tested at 290 d of age, and then the chickens were divided into high and low PI groups (HPIG and LPIG). 2´2 mating combinations were conducted: HPIG ♂´HPIG ♀, LPIG ♂´HPIG ♀, HPIG ♂´LPIG ♀, LPIG ♂´LPIG ♀. Four hundred G1 chickens (half in sex) equally from 4 mating groups were selected to IBV challenge at 1 d, 360 of which were artificially inoculated with allantoic fluid containing IBV M41 virus, while 40 as a control. Chickens were observed for 14 d and deaths were recorded. Paraffin sections were made and stained by hematoxylin-eosin (H. E.). Antibody titers of the survival chickens at 15 d were measured by the red cell agglutination inhibition test (HI). Twelve G1 chickens at 20 w equally from high and low PI groups were selected. Monocytes- macrophages were isolated and cultured, then challenged with Poly I:C. Expression of mRNA of cytokines and major histocompatibility complex (MHC) were tested by quantitative real-time PCR. 【Result】Phagocytic ability of heterologous erythrocytes were different significantly in G0. G1 chickens were incubated according to mating groups according to PI of G0. Results of challenge in G1 showed that the mortality rate (33.3±0.05)% of progeny from HPIG ♂´HPIG ♀ were significantly lower than that of progeny from LPIG ♂´LPIG ♀(55.6±0.05)%. Mortality rates of progeny from LPIG ♂´HPIG ♀ and HPIG ♂´LPIG ♀were (43.3±0.05)% and (47.8±0.05)% respectively. Effect of hens on the offspring was greater than cocks. The mortality rate of progeny from HPIG ♀ was (38.3±0.04)%, which was significantly lower than that of progeny from LPIG ♀(51.7±0.04)%. Chickens showed clinical symptoms of cough, shortness of breath, loss of appetite and depression after challenged with IBV M41 for 3 d. Typical damages on the trachea and kidney of dead and sick chickens could be seen through H. E. staining. Epithelial cells appeared necrosis and empty bubble degeneration in tracheal, respectively. The control group showed no clinical symptoms and pathological changes. The antibody titers of 198 surviving challenged individuals showed that antibody titer of progeny from HPIG ♀ (8.45±0.07) was significantly higher than that of progeny from LPIG ♀(8.10±0.08). Expressions of IFN γ and IL-1β of high phagocytic chickens (progeny of HPIG ♀) was 5.14 times (<0.05) and 2.41 times (<0.05) higher than the low phagocytic chickens (progeny of LPIG ♀). Expression of MHC Ⅰ of high phagocytic chickens was significantly higher than that of low phagocytic chickens, while expression of MHCⅡ was not significant. 【Conclusion】The experiment was performed with four mating combinations according to phagocytic index of monocytes-macrophages. Mortality rate of progeny of HPIG ♀ was significantly lower than that of progeny of LPIG ♀ after challenge, while the antibody titer and the expression of cytokines (IFN γ and IL-1β) and MHC Ⅰ were significantly higher. The results showed that the progeny of HPIG ♀ was more resistant to IBV than progeny of LPIG ♀. Therefore, the phagocytic ability of monocytes-macrophages could be an indicator for breeding IBV resistant lines.
monocyte; macrophage; phagocytosis; disease resistance; dwarf chicken
2016-01-07;接受日期:2016-10-10
国家“973”基础研究计划(2006CB102100)、国家自然科学基金(30471234)、甘肃省青年科技基金计划(1310RJYA018)
麻慧,Tel:13893208829;E-mail:caumah@163.com。通信作者连正兴,Tel:010-62732463;E-mail:lianzhx@cau.edu.cn

