黄土高原不同耕作措施下AM真菌的多样性
高 萍,闫飞扬,蒙 程,李 芳,段廷玉
(草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020)
黄土高原不同耕作措施下AM真菌的多样性
高 萍,闫飞扬,蒙 程,李 芳,段廷玉
(草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020)
本研究分析了冬、夏两季黄土高原耕作(T)、免耕(NT)、耕作+秸秆覆盖(TS)及免耕+秸秆覆盖(NTS)4种不同耕作措施下土壤中AM真菌的多样性。夏季共分离鉴定出AM真菌4属12种,其中球囊霉属(Glomus)8种,多孢囊霉属(Diversispora)1种,巨孢囊霉属(Gigaspora)2种,盾巨孢囊霉属(Scutellospora)1 种;冬季共分离鉴定出AM真菌3属11种,均属于夏季分离AM真菌;冬、夏两季,球囊霉属在各耕作措施下所占比例均为最大,且优势种均为聚丛球囊霉(G.aggregatum)、苏格兰球囊霉(G.caledonium)和极大巨孢囊霉(G.gigantea)。冬、夏两季,NT处理下土壤中AM真菌多样性最高,T处理下AM真菌多样性最低,4种耕作措施下AM真菌的群落组成丰富度表现为NT>NTS>TS>T。以上研究表明,耕作措施对AM真菌的多样性产生了显著影响。
从枝菌根真菌;多样性;耕作;免耕;秸秆覆盖;季节
从枝菌根(arbuscular mycorrhiza,AM)真菌在自然界中普遍存在,可与陆地上80%的植物形成菌根共生体[1]。AM真菌可以促进宿主植物对营养元素尤其是P的吸收,提高作物抗旱、耐寒、抗盐碱性等[2-5],亦可与根际其它微生物产生协同作用[6-7],还可改善土壤结构,促进作物的生长发育,使草地恢复生产力[8-10]。AM真菌是联结地上生态系统和地下生态系统物质传输的桥梁,可以调节植物群落的结构、植物的生物多样性以及植物生态系统的生产力[11-13]。AM真菌与植物协同进化,是目前已探明的与植物关系最为密切的土壤微生物之一[14-15]。
我国黄土高原是世界上水土流失最严重的地区之一,该地区地表裸露,土壤蒸发强烈,易形成地表径流,造成水土流失,导致土壤肥力下降,土质退化,作物减产[16-18]。免耕、秸秆覆盖等保护性耕作措施具有改善土壤结构,提高水分利用效率,增加产量,减少能量投入的优点[19]。这些措施不仅会对生态系统产生影响,而且还会影响土壤微生物的多样性,如AM真菌群落的组成[20]。研究表明,在耕作和免耕土壤中,AM真菌的丰富度和群落结构存在显著的差异[21]。群落生态学是近年来国外在生态学研究中最兴旺的一个分支学科[22],而群落和生态系统的结构和组成是生态学基础研究的前沿课题之一。目前,AM真菌的群落生态学已开始引起菌根学家的重视,关注在不同地域土壤中的AM真菌群落[23-25],而对于在不同耕作措施下AM真菌多样性报道甚少。本研究以黄土高原轮作系统下的土壤为研究对象,以确定不同耕作措施及季节对AM真菌多样性的影响,为通过农业管理措施,发挥和利用AM真菌在农业生态系统中的作用提供理论支持。
1 材料与方法
1.1 试验地概况
试验地位于兰州大学草地农业科技学院庆阳试验站(35° 39′ N,107° 51′ E),该站处于黄土高原西部,属温带大陆性季风气侯。年降水量480~660 mm,多集中在7-9月,年平均蒸发量1 504 mm。年平均气温8~10 ℃,极端最高气温39.6 ℃,极端最低气温-22.4 ℃,年日照时数为2 300~2 700 h,无霜期平均为161 d。土壤为黑垆土,机械组成中粉粒含量70%,有机质含量在1%左右,土壤全氮含量低于0.1%,pH值为8.0~8.5[19]。
1.2 试验设计
试验地建于2001年,轮作方式为玉米(Zeamays)-小麦(Triticumaestivum)-大豆(Glycinemax)。耕作措施为:1)传统耕作(T),每年在9月份冬小麦播种前或冬小麦收获后翻耕地表20 cm;2)免耕(NT),全年不耕作,仅在播种时,对土壤有较小的扰动;3)传统耕作+秸秆覆盖(TS),耕作后,收获前茬作物,将全部或部分秸秆还田;4)免耕+秸秆覆盖(NTS),免耕,将前茬作物秸秆全部或部分还田。覆盖物采用前茬作物秸秆,玉米的前茬是大豆,秸秆覆盖处理为大豆收获豆荚后秸秆立茬(全部还田),冬小麦的前茬是玉米,50%的玉米秸秆截成小段后均匀铺撒在地表,大豆前茬作物为冬小麦,冬小麦收获时留30 cm左右高茬,其它秸秆均匀铺撒在地表。每处理4个重复,小区面积为4 m×13 m,完全随机区组排列。
轮作序列为春玉米-冬小麦-夏大豆。玉米于4月上旬播种(行株距38 cm),9月中下旬收获;玉米收获后立即播种小麦(播量187 kg·hm-2,行间距15 cm),第2年6月底或7月初收获;随后立即播种大豆(行间距25 cm),10月收获。大豆收获后休闲至来年4月,至此完成一个轮作循环。为使轮作的所有作物在同一年出现,试验设2个阶段,每2年完成一个轮作循环。
1.3 田间管理
玉米和冬小麦播种前,各施300 kg·hm-2磷酸氢二铵(NH4)2HPO3(18% N,64% P)作为底肥,玉米在生长期间施30 kg·hm-2尿素(46% N)作为追肥,冬小麦拔节期施150 kg·hm-2尿素(46% N)作为追肥。大豆前茬作物为小麦,小麦收获时,覆草处理留茬30 cm左右,于同一块地中及时播种大豆,播前施63 kg·hm-2P2O5磷肥作为底肥。作物生长期间定期人工除草[26-27]。
1.4 土壤取样
第1次于2014年6月,即夏季,分别在4个处理样地上,取地表5-30 cm处的土壤(每份土样2 kg左右),每处理3个重复。采集的土样装于无菌塑料袋中,带回实验室,过2 mm筛,自然风干后存于4 ℃冰箱中,在4个月内处理完。
第2次于2014年12月,即冬季,按第1次的方法取样带回实验室,并处理。
1.5 AM真菌种类鉴定
采用湿筛倾注-蔗糖离心法[27]分离原始土样和培养物中的孢子。在体视显微镜下先观察孢子的颜色、大小、连孢菌丝的特征、孢子果形态等;然后用微吸管挑取孢子置于载玻片上,加水、乳酸、PVLG(聚乙烯醇-乳酸-甘油)和PVL(聚乙烯醇-乳酸酚)等作浮载剂,封片后在显微镜下继续观察记录孢子的颜色、连孢菌丝的特征,测定孢子的大小。压碎孢子后再观察内含物的性质、孢壁层次及各层颜色,测定各层孢壁的厚度等。鉴定中辅助使用Me1zer’s试剂[28],观察孢子的特异性反应,对有代表性或特异性的特征随时进行拍照[29-30]。
综合以上观察结果,根据Schenck 和 Péréz[31]的及国际丛枝菌根保藏中心INVAM国际网站(http://invam.caf.wvu.edu/Myc-Info/)的分类描述,并参阅有关鉴定材料和近年来发表的新种进行种属的检索和鉴定。
1.6 指标计算方法
AM真菌种丰富度(species richness)[22],一个生境中物种数目的多寡,本研究指一种宿主植物20 g根际土壤样本中的AM真菌种数。
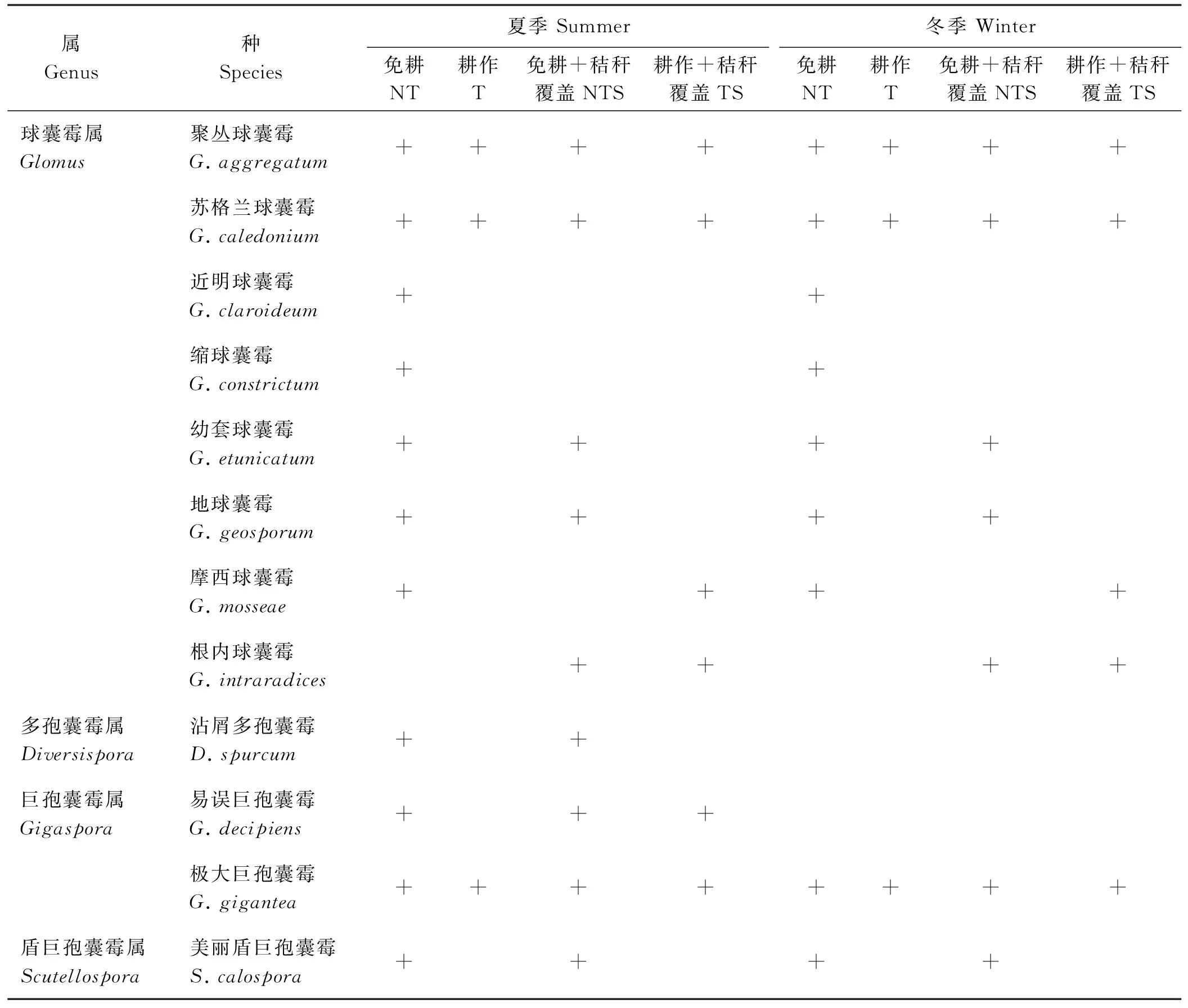
AM真菌频度(frequency,F)[22],指某物种在样本总体中的出现率,即:F=AM真菌某种出现次数/土壤总样本数×100%。以种的频度作为划分优势种的标准,F>50%为优势种,30% 1.7 数据分析 数据用SPSS (Version 17)统计软件进行方差分析,用Duncan’s新复极差法进行多重比较,检验各处理平均值之间的差异显著性。 2.1 AM真菌的种类 夏季不同耕作措施下共鉴定出AM真菌4属12种(表1)。其中,NT处理下,AM真菌多样性最高,包括球囊霉属(Glomus)、多孢囊霉属(Diversispora)、巨孢囊霉属(Gigaspora)、盾巨孢囊霉属(Scutellospora)4个属,共11个种;T处理下,AM真菌多样性最低,包括球囊霉属和巨孢囊霉属2属,共3个种;NTS处理下,鉴定出球囊霉属、多孢囊霉属、巨孢囊霉属、盾巨孢囊霉属4个AM真菌属,共9个种;TS处理下,鉴定出球囊霉属、巨孢囊霉属、盾巨孢囊霉属3个AM真菌属,共7个种。4个耕作措施下,均鉴定出了球囊霉属和巨孢囊霉属。 冬季不同耕作措施下共鉴定出AM真菌3属11种(表1)。其中,NT处理下AM真菌多样性最高;T处理下AM真菌多样性最低,包括球囊霉属、巨孢囊霉属2个属,3个种。 与夏季相比,NT处理在冬季未分离到多孢囊霉属,巨孢囊霉属在种的组成上也发生了变化,未检测到易误巨孢囊霉(G.decipiens);T处理下的AM真菌,无论是属的组成,还是种的组成,冬夏两季均无显著变化;NTS处理下,冬季未分离到多孢囊霉属和巨孢囊霉属中的易误巨孢囊霉;TS处理下,未分离到易误巨孢囊霉。 2.2 AM真菌的种丰富度 NT和NTS处理下,夏季和冬季间AM真菌种丰富度差异显著(P<0.05);T和TS处理下,AM真菌的种丰富度受季节变化影响较小(图1)。无论夏季还是冬季,NT处理下AM真菌种的丰富度最高,T处理最低,NT与NTS间均差异不显著(P>0.05),但显著高于T和TS(P<0.05)。夏、冬季,4种耕作措施下AM真菌的群落组成丰富度均表现为NT>NTS>TS>T。 2.3 AM真菌种的频度分级 冬季与夏季相比,一些种在群落组成中的分化等级发生了变化,即AM真菌群落的结构发生了改变,但变化不明显,例如,在夏季土样中,易误巨孢囊霉为优势种,沾屑多孢囊霉为常见种,在冬季土样中却未发现(表2)。 3.1 耕作措施对AM真菌多样性的影响 研究结果表明,耕作措施显著影响了AM真菌的群落结构,传统耕作较免耕会降低AM真菌的种丰度,这一结果与Jansa等[32]一致。引起这种变化的原因主要有:1)耕作破坏了AM真菌的菌丝体;2)耕作改变了土壤中的营养成分;3)影响了微生物的活动;4)杂草群落的改变[33-34]。球囊霉属和巨孢囊霉属AM真菌在耕作以及免耕土壤中均有存在,因为球囊霉属对耕作干扰的耐受力较强,且Boddington和Dodd[35]认为耕作可以促进球囊霉属菌丝体的生长。耕作破坏了其它属的AM真菌繁殖生存的根外菌丝体以及孢子体,并使其在土壤中消亡,这也为球囊霉属减小了生存竞争[33]。而巨孢囊霉属在耕作土壤中存在,也许是由于试验土壤适宜与该属共生的植物生长。耕作+秸秆覆盖土壤中相较耕作土壤中,发现了盾巨孢囊霉属AM真菌的存在,因为秸秆覆盖改变了土壤的营养结构,产生了更适宜盾巨孢囊霉属AM真菌生存的环境,或是试验地的该类型土壤之前种植过适宜盾巨孢囊霉属AM真菌产生共生体的宿主植物,孢子体又得以在适宜的土壤环境中生存以及繁殖。免耕+秸秆覆盖土壤中,AM真菌的群落组成类似于免耕土壤。不同的AM真菌会有不同的共生效力[34,36],因此AM真菌的群落结构也不尽相同[33]。 表1 夏季和冬季不同耕作措施下的AM真菌种类Table 1 AM fungi species under different tillage practices in summer and winter 注:+,发现该种;NT,免耕;T,耕作;NTS,免耕+秸秆覆盖;TS,耕作+秸秆覆盖。 Note:+, species be occurred; NT, no-tillage; T, tillage; TS, tillage+stubble return; NTS, no-tillage+stubble return. 3.2 季节对AM真菌多样性的影响 无论是夏季还是冬季,4种耕作措施下的AM真菌菌种的数量均表现为NT>NTS>TS>T,冬季土壤与夏季土壤相比,各耕作措施下AM真菌的属均未发生变化,但种的组成发生了改变。冬季的土壤中,各耕作措施下,依旧表现为球囊霉属占最大比例,这一结果也说明囊霉属适宜生存于各种生境。在免耕措施下,夏季的土壤中共检出4属11种,而冬季为3属9种,冬季土壤中未有多孢囊霉属的AM真菌存在,球囊霉属的根内球囊霉和巨孢囊霉属的易误巨孢囊霉也未检测到。这是由于冬季土壤温度低,光合时间短,用于作物光合作用的叶片数目也较少,作物以及根系生长受到抑制[37],这便使得某些对寄主营养需求大的AM真菌的生长发育也受到抑制,导致其频度降低,从而改变了AM真菌的群落结构。传统耕作下,冬夏季AM真菌的群落组成表现出类似的趋势,只鉴定出2属3种,为聚丛球囊霉、苏格兰球囊霉和极大巨孢囊霉,说明这3种AM真菌在条件较恶劣的情况下也可以生存。4种耕作措施下,冬季与夏季相比,少了多孢囊霉属中的沾屑多孢囊霉,巨孢囊霉属中的易误巨孢囊霉,说明这两种AM真菌对温度和寄主的要求比较高。从冬、夏季AM真菌频度分级中发现,易误巨孢囊霉和易误巨孢囊霉在夏季土样中为优势种,在冬季土样中却未发现,是因为在冬季,这两种菌没有适宜生存的温度,没有足够的赖以生存的光合产物,而无法在土壤中存在。 图1 夏、冬季不同耕作措施下AM真菌种丰富度Fig.1 Species richness of AM fungi under different agricultural farming practices in summer and winter 注:不同小写字母表示同一季节不同处理间差异显著(P<0.05); *表示同处理夏季和冬季间差异显著(P<0.05)。 Note:Different lower case letters in the same season indicate significant difference among different treatments at 0.05 level;*,indicate significant difference for the same treatment between summer and winter at 0.05 level. 表2 夏、冬季AM真菌的频度分级类Table 2 Frequency classification of AM fungi in summer and winter 注:A,优势种;B,常见种;C,少见种;-,没有发现该种。 Note: A, dominant species; B, common species; C, rare species; -, species not be occurred. References: [1] Smith S E,Read D J.Mycorrhizal Symbiosis.Longdon:Academic Press,2008:145-187. [2] Dehne H W.Interaction between vesicular-arbuscular mycorrhizal fungi and plant pathogens.Phytopathology,1982,72(8):1115-1119. [3] Thompson J P,Wildermuth G B.Colonization of crop and pasture species with vesicular-arbuscular mycorrhizal fungi and a negative correlation with root infection byBipolarissorokiniana.Canadian Journal of Botany,1989,67(3):687-693. [4] Fitter A H,Garbaye J.Interactions between mycorrhizal fungi and other soil organisms.Plant and Soil,1994,159(1):123-132. [5] McGonigle T P,Yano K,Shinhama T.Mycorrhizal phosphorus enhancement of plants in undisturbed soil differs from phosphorus uptake stimulation by arbuscular mycorrhizae over non-mycorrhizal controls.Biology and Fertility of Soils,2003,37(5):268-273. [6] 冯固,张福锁,李晓林,张俊伶,盖京苹.丛枝菌根真菌在农业生产中的作用与调控.土壤学报,2010,47(5):995-1004. Feng G,Zhang F S,Li X L,Zhang J L,Gai J P.Functions of arbuscular mycorrhizal fungi in agriculture and their manipulation.Acta Pedologica Sinica,2010,47(5):995-1004.(in Chinese) [7] 张峰,段廷玉,闫飞扬,李芳.丛枝菌根真菌与根际微生物的互作.草业科学,2014,31(9):1673-1685. Zhang F,Duan T Y,Yan F Y,Li F.Advances in the interactions of arbuscular mycorrhizal fungi and rhizosphere microorganisms.Pratacultural Science,2014,31(9):1673-1685.(in Chinese) [8] 王保民,任萌圃.丛枝菌根应用研究进展.湖北农业科学,2004(3):56-59. Wang B M,Ren M P.Advances in the research on the applications of arbuscular mycorrhizal fungi.Hubei Agricultural Sciences,2004(3):56-59.(in Chinese) [9] 王立,贾文奇,马放,李世阳,张淑娟.菌根技术在环境修复领域中的应用及展望.生态环境学报,2010,19(2):487-493. Wang L,Jia W Q,Ma F,Li S Y,Zhang S J.Perspective of mycorrhizal technology application for environmental remediation.Ecology and Environmental Sciences,2010,19(2):487-493.(in Chinese) [10] Zhang T,Sun Y,Shi Z Y,Feng G.Arbuscular mycorrhizal fungi can accelerate the restoration of degraded spring grassland in Central Asia.Rangeland Ecology and Management,2012,65(4):426-432. [11] van der Heijden M G A,Boller T,Wiemken A,Sanders I R.Different arbuscular mycorrhizal fungal species are potential determinants of plant community structure.Ecology,1998,79(6):2082-2091. [12] van der Heijden M G A,Klironomos J N,Ursic M,Moutoglis P,Streitwolf-Engel R,Boller T,Wiemken A,Sanders I R.Mycorrhizal fungal diversity determines plant biodiversity,ecosystem variability and productivity.Nature,1998,396:69-72. [13] Ehrenfeld J G,Ravit B,Elgersma K.Feedback in the plant-soil system.Annual Review of Environment & Resources,2005,30(1):75-115. [14] Mosse B,Hayman D S,Mikola P.Mycorrhiza in agricultural plants.In:Mikola P.(ed).Tropical Mycorrhizae Research.Oxford:Clarendon Press,1980:213-230. [15] 冀春花,张淑彬,盖京萍,白灯莎,李晓林,冯固.西北干旱区AM真菌多样性研究.生物多样性,2007,15(1):77-83. Ji C H,Zhang S B,Gai J P,Bai D S,Li X L,Feng G.Arbuscular mycorrhizal fungal diversity in arid zones in northwestern China.Biodiversity Science,2007,15(1):77-83.(in Chinese) [16] Vance C P,Graham P H,Allan D L.Biological nitrogen fixation:Phosphorus-a critical future need.Nitrogen Fixation from Molecules to Crop Productivity,2000,38:509-514. [17] 严洁,邓良基,黄剑.保护性耕作对土壤理化性质和作物产量的影响.中国农机化学报,2005(2):31-34. Yan J,Deng L J,Huang J.Effect of conservation tillage on soil physicochemical properties and crop yields.Chinese Agricultural Mechanization,2005(2):31-34.(in Chinese) [18] 郑丽娜,王先之,沈禹颖.保护性耕作对黄土高原塬区作物轮作系统磷动态的影响.草业学报,2011,20(4):19-26. Zheng L N,Wang X Z,Sheng Y Y.Dynamic of phosphorus with wheat-soybean rotation systems under conservation tillage in the western Loess Plateau.Acta Prataculturae Sinica,2011,20(4):19-26.(in Chinese) [19] 杨晶,沈禹颖,南志标,高崇岳,牛伊宁,王先之,罗彩云,李光棣.保护性耕作对黄土高原玉米-小麦-大豆轮作系统产量及表层土壤碳管理指数的影响.草业学报,2010,19(1):75-82. Yang J,Shen Y Y,Nan Z B,Gao C Y,Niu Y N,Wang X Z,Luo C Y,Li G D.Effects of conservation tillage on crop yield and carbon pool management index on top soil within a maize-wheat-soy rotation system in the Loess Plateau.Acta Prataculturae Sinica,2010,19(1):75-82.(in Chinese) [20] 闫飞扬,段廷玉,张峰.农业管理措施对 AM 真菌功能影响的研究进展.草业科学,2014,31(12):2230-2241. Yan F Y,Duan T Y,Zhang F.Effects of agricultural managements on the function of arbuscular mycorrhizal fungi.Pratacultural Science,2014,31(12):2230-2241.(in Chinese) [21] Rosendahl S,Matzen H B.Genetic structure of arbuscular mycorrhizal populations in fallow and cultivated soils.New Phytologist,2008,179(4):1154-1161. [22] 张美庆,王幼珊,刑礼军.我国东南沿海地区AM真菌群落生态分布研究.菌物系统,1998,17(3):274-277. Zhang M Q,Wang Y S,Xing L J.The ecological distribution of AM fungi community in south and east coast of China.Mycosystema,1998,17(3):274-277.(in Chinese) [23] 董全.西方生态学近况.生态学报,1996,16(3):314-324. Dong Q.Currrent state and trend of ecological studies in western countries.Acta Ecologica Sinica,1996,16(3):314-324. (in Chinese) [24] Franke-Snyder M,Douds D D,Galvez L,Phillips J G,Wagoner P,Drinkwater L,Morton J B.Diversity of communities of arbuscular mycorrhizal(AM) fungi present in conventional versus low-input agricultural sites in eastern Pennsylvania,USA.Applied Soil Ecology,2001,16(1):35-48. [25] Morton J B,Bentivenga S P,Bever J D.Discovery,measurement,and interpretation of diversity in arbuscular endomycorrhizal fungi(Glomales,Zygomycetes).Canadian Journal of Botany,1995,73(S1):25-32. [26] 罗彩云,沈禹颖,南志标,高崇岳,Chan Y,樊丽琴.水土保持耕作下陇东玉米-小麦-大豆轮作系统产量、土壤易氧化有机碳动态.水土保持学报,2005,19(4):84-88. Lou C Y,Shen Y Y,Nan Z B,Gao C Y,Chan Y,Fan L Q.Dynamics of crop yield and soil oxdizible organic carbon fraction within a maize-winter wheat-soy rotation under different tillage treatment in Longdong Loess Plateau.Journal of Soil and Wanter Conservation,2005,19(4):84-88.(in Chinese) [27] 樊丽琴,南志标,沈禹颖,高崇岳.保护性耕作对黄土高原小麦田土壤微生物量碳的影响.草原与草坪,2005(4):51-53. Fan L Q,Nan Z B,Shen Y Y,Gao C Y.Effect of conservation tillage practices on soil microbial biomass carbon in wheat fild in the Loess Plateau.Grassland and Lawn,2005(4):51-53.(in Chinese) [28] Morton J B.Taxonomy of VA mycorrhizal fungi:Classification,nomenclature,and identification.Mycotaxon,1988,32(7):267-324. [29] 弓明钦,陈应龙,仲崇禄.菌根研究及应用.北京:中国林业出版社,1997. [30] 马琨,陶媛,杜茜,王占军,蒋齐.不同土壤类型下 AM 真菌分布多样性及与土壤因子的关系.中国生态农业学报,2011,19(1):1-7. Ma K,Tao Y,Du Q,Wang Z J,Jiang Q.Arbuscular mycorrhizal fungi diversity and its relationship with soil environmental factors in different soil types.Chinese Journal of Eco-Agriculture,2011,19(1):1-7.(in Chinese) [31] Schenck N C,Péréz Y.Manual for the Identification of VA Mycorrhizal Fungi.Gainesville:Synergistic Publications,1990. [32] Jansa J,Mozafar A,Anken T,Ruh R,Sanders I,Frossard E.Diversity and structure of AMF communities as affected by tillage in a temperate soil.Mycorrhiza,2002,12(5):225-234. [33] Jansa J,Mozafar A,Kuhn G,Anken T,Ruh R,Sanders I R,Frossard E.Soil tillage affects the community structure of mycorrhizal fungi in maize roots.Ecological Applications,2003,13(4):1164-1176. [34] Smith F A,Jakobsen I,Smith S E.Spatial differences in acquisition of soil phosphate between two arbuscular mycorrhizal fungi in symbiosis withMedicagotruncatula.New Phytologist,2000,147(2):357-366. [35] Boddington C L,Dodd J C.The effect of agricultural practices on the development of indigenous arbuscular mycorrhizal fungi. I.Field studies in an Indonesian ultisol.Plant and Soil,2000,218(1):137-144. [36] Jakobsen I,Abbott L K,Robson A D.External hyphae of vesicular-arbuscular mycorrhizal fungi associated withTrifoliumsubterraneumL.1.Spread of hyphae and phosphorus inflow into roots.New Phytologist,1992,120(3):371-379. [37] Pearson J N,Smith S E,Smith F A.Effect of photon irradiance on the development and activity of VA mycorrhizal infection inAlliumporrum.Mycological research,1991,95(6):741-746. (责任编辑 苟燕妮) Diversity of arbuscular mycorrhizal fungi under different agricultural practices in Loess Plateau in China Gao Ping, Yan Fei-yang, Li Fang, Duan Ting-yu (State Key Laboratory of Grassland Agro-ecosystems, College of Pastoral Agriculture Science and Technology, Lanzhou University, Lanzhou 730020, China) Arbuscular mycorrhizal fungi (AMF) widely distributes in the cropland system, and plays an important role in soil structure maintenance and nutrition absorption. Agriculture practices such as tillage, fertilizer and crop rotation can easily affected AM fungi. In the present study, soil samples from different agricultural farming practices, including tillage (T), no-tillage (NT), tillage + stubble return (TS) and no-tillage + stubble return (NTS) in the field of the Loess Plateau were collected in summer and winter to analysis the biodiversity of AMF. The results showed that 12 AM fungal species belonging to 4 genera were isolated and identified in summer soil samples. Specifically, there were 8Glomus, 1Diversispora, 2Gigaspora, 1Scutellosporaspecies. Eleven AM fungal species belonging to 3 genera were isolated and identified in winter soil samples and all these 11 AM fungal species had been present in soil samples. Glomus was the most dominant genera across the treatments andG.aggregatum,G.caledoniumandG.giganteawere the most dominant species both in summer and winter soils of the all treatments. AM fungi diversity decreased in the following order NT>NTS>TS>T. Farming practices and season could have significant impacts on AMF diversity. Arbuscular mycorrhiza fungi; biodiversity; tillage; no-tillage; stubble return; season Duan Ting-yu E-mail:duanty@lzu.edu.cn 10.11829/j.issn.1001-0629.2015-0583 前植物生产层 2015-10-26 接受日期:2016-03-28 兰州大学中央高校基本科研业务费自由探索项目(860343);教育部博士点基金新青年教师项目(20110211120032);甘肃省自然科学基金项目(1208RJZA270)第一作者:高萍(1991-),女,甘肃武威人,在读硕士生,研究方向为植物病理学。E-mail:gaop14@lzu.edu.cn 段廷玉(1976-),男,甘肃靖远人,副教授,博士,研究方向为从枝菌根与微生物或农业措施互作。E-mail:duanty@lzu.edu.cn S432.4+4 A 1001-0629(2016)10-1917-07* 高萍,闫飞扬,蒙程,李芳,段廷玉.黄土高原不同耕作措施下AM真菌的多样性.草业科学,2016,33(10):1917-1923. Gao P,Yan F Y,Meng C,Li F,Duan T Y.Diversity of arbuscular mycorrhizal fungi under different agricultural practices in Loess Plateau in China.Pratacultural Science,2016,33(10):1917-1923.2 结果
3 讨论