胶乳增强免疫比浊法检测尿液中α1-微球蛋白的含量
蒋泽军 蒋庆姣 冼庆勇* 刘云鹏 何金洋 韦秋云
胶乳增强免疫比浊法检测尿液中α1-微球蛋白的含量
蒋泽军①蒋庆姣①冼庆勇①*刘云鹏①何金洋①韦秋云①
目的:对自主研制的尿α1-微球蛋白(α1-MG)检测试剂盒进行综合性能评价,并与进口试剂进行临床对比。方法:采用尿α1-MG检测试剂盒,对收集的101例肾病患者晨尿进行α1-MG的含量检测。将α1-MG的多克隆抗体包被在胶乳微粒上,添加相应的稳定剂得到试剂R2,采用适合的缓冲体系、增敏剂及稳定剂得到试剂R1。评价由试剂R1和试剂R2组成试剂盒的定标曲线、稳定性、干扰试验及回收率等检测性能。结果:试剂盒的测量范围在2.0~160 mg/ L,回收率为94.0%~106.0%,对不同浓度的临床样本测试20次,其变异系数(CV)<5.0%;与日本进口试剂相比较,测试临床标本101例,其相关系数r2=0.9854。结论:该试剂盒具有良好的准确性和重复性,线性范围宽,符合临床检测需要,可用于尿液中α1-MG的含量检测。
免疫;比浊;α1-微球蛋白;尿液;胶乳
[First-author’s address] Reagent R&D Center, Guilin URIT Medical Electronics co., LTD, Guilin 541004, China.
尿液检验对于泌尿系统感染性和非感染疾病的筛查、辅助诊断、病程和疗效监测,以及对其他系统疾病(如糖尿病、高血压、遗传性疾病及药物不良反应等)的筛查,疗效或并发症的监测都具有重要意义[1-4]。临床上有些药物的排泄通过肾小球滤过和近端肾小管分泌,这些药物的使用增加了肾功能下降和慢性肾脏疾病的风险,从而可能引起尿液中特种蛋白含量的增加[5-6]。
尿液蛋白的检测多采用化学比色法,随着科技的进步,蛋白种类得以分类,并具有相应的临床意义[7-9]。特种蛋白的免疫测定得到快速发展,是利用抗原-抗体的特异反应检测临床样本中微量蛋白的分析方法,而此种方法最大的特点是特异性强、灵敏度高,以及使用的简便和快速[10-11]。
尿液α1-微球蛋白(α1-microglobulin,α1-MG)的相对分子量为27000,是一种相对较小的糖蛋白,等电点(isoelectric point,PI)为4.5~5.5[12]。该蛋白产生恒定,在机体内广泛分布,易通过肾小球滤过膜,其中绝大部分被肾小管重新吸收,且不受pH值变化的影响。尿液α1-MG的升高,常提示肾小管与间质损害[13-14]。尿液α1-MG测定有利于鉴别上、下尿路感染、肾性与肾后性蛋白尿及血尿[15]。为此,本研究自主研制尿液α1-MG的检测试剂盒并对其进行综合性能评价,为临床疾病诊断提供科学依据。
1 材料与方法
1.1一般资料
选取2014年8-9月桂林医学院附属医院收治的101例肾病患者,其中男性57例,女性44例;年龄23~74岁;均为肾脏疾病或其他疾病引起的肾功能损害患者,收集患者晨尿进行α1-MG含量检测。
1.2仪器与试剂
(1)采用7180型全自动生化分析仪(日本,HITACHI);TG21KR型高速离心机(长沙东旺实验仪器有限公司);XC-CD型细胞粉碎机(宁波市先倡电子科技有限公司)。
(2)α1-MG多克隆抗体(丹麦);聚苯乙烯胶乳、磷酸缓冲盐溶液(phosphate buffer saline,PBS)、表面活性剂及稳定剂,日本进口α1-MG检测试剂盒;本研究研制的α1-MG检测试剂盒。
1.3试剂盒制备方法
将1 ml的α1-MG多克隆抗体、0.5 ml胶乳微球(固含量5%)及2%的碳化二亚胺20 μl加入到2 ml浓度为0.05 mol/L的PBS缓冲液中,放置于25 ℃环境下搅拌30 min,以15000 r/min的转速离心30 min分离后加入分散缓冲液,再加入阻断剂封闭胶乳,超声10 min后胶乳均匀悬浮,即为R2试剂;R1为试剂自配:在100 ml的浓度为0.15 mol/L的PBS缓冲体系中加入0.1 g表面活性剂、0.25 g聚乙二醇(polyethylene glycol,PEG)6000及0.08 g稳定剂等。
1.4检测方法
采用全自动生化分析仪测试试剂性能及临床样本,参数设置:R1试剂200 μl,R2试剂50 μl,样本、标准样本及水均为12 μl,检测主波长为600 nm,副波长为700 nm。
2 结果
2.1检测性能
使用自制的R1和R2试剂及外购的α1-MG校准品,用7180型日立全自动生化分析仪定标测试,定标曲线如图1所示。由曲线可见自制试剂盒在对α1-MG的检测反应良好,并呈现较好的线性关系,r2=0.998。
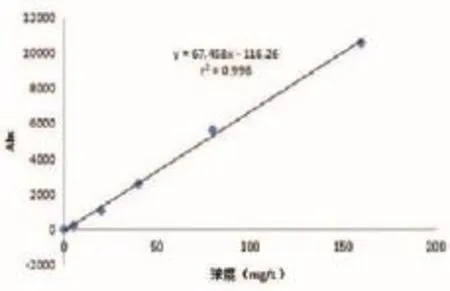
图1 α1-MG的定标曲线图
2.2稳定性分析
将自制试剂盒的R1和R2密封放置于温度为40 ℃,湿度为80%的恒温恒湿箱中,负荷7 d后测试,对比测试负荷前后试剂盒的检测性能。结果显示,负荷后试剂盒的吸光度值略有降低,但α1-MG校准品的浓度在2.0~160 mg/L的范围时,降低的吸光度值<10%,且仍呈现良好的线性关系(r2=0.998),如图2所示。
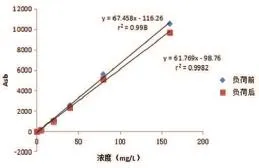
图2 α1-MG检测试剂盒负荷前后的定标曲线对比图
2.3精密度分析
分别选取3个不同水平(低值、中值、高值)的尿液样本,连续测试20次,计算测量值、标准偏差及相对标准偏差,其测试变异系数(coefficient variation,CV)值均在5%以内,见表1。
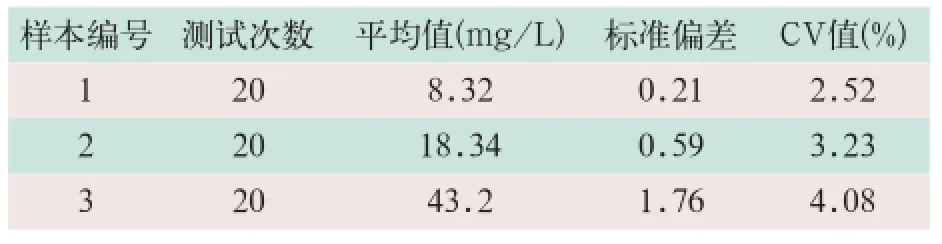
表1 精密度分析测试结果
2.4干扰测试
分别选用2个不同水平(高值、低值)的混合尿液样本,加入不同浓度的干扰物,以等体积的生理盐水作为无干扰样本,同时测定这些标本的浓度,结果以干扰程度10%作为该系统对干扰物的最高限。结果显示,在血红蛋白≤10 g/L、胆红素≤0.6 g/L、维生素C≤0.6 g/L以及肌酐≤10 g/L时,对于测定尿液中α1-MG无影响。
2.5加标回收率
将已知α1-MG浓度的混合尿液样本分成3等份,分别添加一定量的α1-MG校准品,进行测试3次,平均回收率为94.0%~106.0%,相对标准偏差<5%,符合实验要求,见表2。
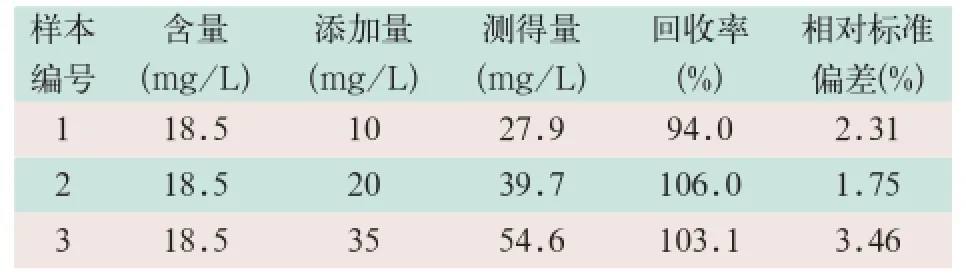
表2 加标回收率测试结果
2.6临床对比测试
对101例临床尿液样本分别使用自制α1-MG试剂与日本进口试剂进行临床对比测试,其结果显示呈现较好的相关性(r2=0.9854),如图3所示。
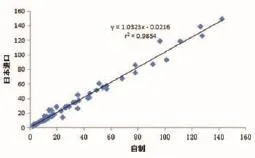
图3 自制α1-MG试剂与日本进口试剂临床测试对比图
3 讨论
尿液特种蛋白的检测被认为是反映早期肾损伤的灵敏指标,人体内α1-MG的产生恒定,尿液中α1-MG的排出量较少受肾外因素的影响,尿液α1-MG检测可为肾小管损伤诊断提供参考依据,被认为是较特异的肾功能损伤诊断试验[16-18]。因此,α1-MG检测试剂盒的综合性能在临床测试中尤为重要,本研究中尿液α1-MG检测试剂盒在2~160 mg/ L范围内,α1-MG的浓度与吸光度值呈良好的线性关系,r2=0.998。此外,试剂盒密封放置于温度为40℃,湿度为80%的恒温恒湿箱中负荷7 d,试剂盒与尿液中α1-MG的反应仍具有较高的吸光度,且呈现良好的线性关系,r2=0.9982。由此可见,本研究中的α1-MG试剂盒具备较好的稳定性。
本研究对该方法的检测试剂盒进行了加标回收率实验,在已知α1-MG浓度(18.5 mg/L)的尿液样本中添加不定量的α1-MG校准物,分别添加10 mg/L、20 mg/L及35 mg/L,重复3次测试,计算回收率及相对标准偏差,其回收率为94.0%~106.0%,相对标准偏差<5%。同时,对尿液中较常见的干扰物质进行干扰试验,包括10 g/L血红蛋白、0.6 g/L胆红素、0.6 g/ L维生素C以及10 g/L肌酐,均对本测试方法无影响。试验结果表明,本研究中的α1-MG检测试剂盒在尿液中的检测应用具有较好的可行性。
使用自制的α1-MG检测试剂盒和日本进口的α1-MG检测试剂盒分别对101例临床样本进行平行检测,其结果显示,临床样本的α1-MG含量均在试剂盒的检测范围内,两种方法的测试结果对比,呈现良好的相关性,r2=0.9854。在本研究α1-MG试剂盒精密度实验中,分别对3个不同水平的尿液样本进行重复测试20次,其标准偏差控制在0.21~1.76范围内,其CV值<5%,表明本研究的试剂盒能够满足临床测试的需要。
综上所述,本研究利用胶乳增强免疫比浊法研制了检测尿液中α1-MG的试剂盒,并对试剂盒的检测性能、精密度、稳定性、干扰试验、回收率以及临床对比等进行分析测试。结果表明,本研究研制的尿液α1-MG检测试剂盒,测试性能良好,能够满足临床检测的需要,可为肾脏疾病患者的临床诊断和治疗提供更多可靠的参考依据。
[1]彭明婷,周文宾.尿液分析规范化的相关问题[J].中华医学检验杂志,2013,36(12):1060-1063.
[2]Stubendorff B,Finke S,Walter M,et al. Urine protein profiling identified alpha-1-microglobulin and haptoglobin as biomarkers for early diagnosis of acute allograft rejection following kidney transplantation[J].European Urology Supplements,2014,13(1):e910.
[3]Perazella MA.The Urine Sediment as a Biomarker of Kidney Disease[J].Am J Kidney Dis,2015,66(5):748-755.
[4]Cağdaş A,Aydinli K,Irez T,et al.Evaluation of the fetal kidney maturation by assessment of amniotic fluid alpha-1microglobulin levels[J].Eur J Obstet Gynecol Reprod Biol,2000,90(1):55-61.
[5]Scherzer R,Estrella M,Li Y,et al.Association of tenofovir exposure with kidney disease risk in HIV infection[J].AIDS,2012,26(7):867-875.
[6]Kang J,Liu J,Ding H,et al.Urine is a better marker for early tubular dysfunction than beta2-microglobulin among tenofovir-exposed human immunodeficiency virus-infected men who have sex with men[J]. Braz J Infect Dis,2015,19(4):410-416.
[7]Chang CT,Liao HY,Huang WH,et al.Early prediction of severe acute pancreatitis by urinary β-2microglobulin/saposin B peak ratios on MALDI-TOF[J].Clin Chim Acta,2015,44(2):115-
[8]122.Delanghe SE,Speeckaert MM,Segers H,et al.Soluble transferrin receptor in urine,a new biomarker for IgA nephropathy and Henoch-Schönlein purpura nephritis[J].Clin Biochem,2013,46(7-8):591-597.
[9]Norden AG,Lapsley M,Unwin RJ.Urine retinolbinding protein 4:a functional biomarker of the proximal renal tubule[J].Adv Clin Chem,2014,63:85-122.
[10]Maddens BE,Daminet S,Demeyere K,et al. Validation of immunoassays for the candidate renal markers C-reactive protein,immunoglobuli n G,thromboxane B2 and retinol binding protein in canine urine[J].Vet Immunol Immunopath ol,2010,134(3-4):259-264.
[11]Nead KT,Zhou MJ,Caceres RD,et al.Usefulness of the Addition of Beta-2-Microglobulin,Cystatin C and C-Reactive Protein to an Established Risk Factors Model to Improve Mortality Risk Prediction in Patients Undergoing Coronary Angiography[J]. Am J Cardiol,2013,111(6):851-856.
[12]丛玉隆.现代尿液分析技术与临床[M].北京:人民军医出版社,2007:233.
[13]Nishijima T,Shimbo T,Komatsu H,et al. Urinary beta-2 microglobulin and alpha-1 microglobulin are useful screening markers for tenofovir-induced kidney tubulopathy in patients with HIV-1 infection:a diagnostic accuracy study[J].J Infect Chemother,2013,19(5):850-857.
[14]周达.尿MA、β2-MG、TRF、α1-MG测定对2型糖尿病肾功能损害的应用价值[J].国际检验医学杂志,2013,34(16):2193-2194.
[15]Liakos CI,Vyssoulis GP,Markou MI,et al.Twenty-Four-Hour Urine α1 -Microglobulin as a Marker of Hypertension-Induced Renal Impairment and Its Response on Different Blood Pressure-Lowering Drugs[J].J Clin Hypertens(Greenwi ch),2016,18(10):1000-1006.
[16]Del Palacio M,Romero S,Casado JL.Proximal tubular renal dysfunction or damage in HIV-infected patients[J].AIDS Rev,2012,14(3):179-187.
[17]Nordberg J,Allhorn M,Winqvist I,et al. Quantitative and qualitative evaluation of plasma and urine α1-microglobulin in healthy donors and patients with different haemolytic disorders and haemochromatosis[J].Clin Chim Acta.2007,386(1-2):31-37.
[18]Gudehithlu KP,Garcia-Gomez I,Vernik J,et al.In Diabetic Kidney Disease Urinary Exosomes Better Represent Kidney Specific Protein Alterations Than Whole Urine[J].Am J Nephrol,2016,42(6):418-424.
Latex particle-enhanced turbidimetric immunoassay method for the determination of α1-microglobulin in urine
JIANG Ze-jun, JIANG Qing-jiao, XIAN Qing-yong, et al// China Medical Equipment,2016,13(11):47-50.
Objective: The comprehensive performance of self-developed urine alpha 1 -microglobulin (α1-MG) testing kit was evaluated and compared with imported reagents kit for clinical samples. Methods: The method is detecting the content of trace α1-MG in urine by the test kit, which included reagents R2 and R1. The reagents R2 of the test kit contained stabilizer and latex particles, which is packaged on the polyclonal antibody of α1-MG. The main component of the reagents R1 of the test kit was suitable buffer system, sensitization agent and stabilizer. Evaluation of the detection performance of the test kit was completed, including calibration curve, stability, interference test, and recovery rate, detecting the content of urinary α1-MG in 101 patients with kidney disease. Results: The measurement range of the test kit is 2.0~160 mg/L, and the recovery is 94.0%~106.0%. Testing the different concentrations of clinical samples(n=20), the coefficient of variation is less than 5.0%. Compared with the imported reagent from Japan, the correlation coefficient of 101 clinical samples is 0.9854. Conclusion: The test kit with fine repeatability, veracity and wide measurement range can be used for clinical detection of α1-MG in urine.
Immunoassay; Turbidimetric; α1–microglobulin; Urine; Latex
蒋泽军,男,(1986- ),硕士,工程师。桂林优利特医疗电子有限公司试剂研发中心,从事尿液特种蛋白含量分析及尿质控品研究。
1672-8270(2016)11-0047-04
R446.6
A
10.3969/J.ISSN.1672-8270.2016.11.014
①桂林优利特医疗电子有限公司试剂研发中心 广西 桂林 541004
xianqingyong@uritest.com.cn
2016-05-10

