安徽白山羊GDF9基因群体遗传效应分析
汤继顺,章 薇,朱德建,惠文巧,苏世广,陈 胜
(安徽省农业科学院畜牧兽医研究所,合肥 230031)
安徽白山羊GDF9基因群体遗传效应分析
汤继顺,章 薇,朱德建,惠文巧,苏世广,陈 胜
(安徽省农业科学院畜牧兽医研究所,合肥 230031)
为验证GDF9基因是否与山羊产羔数存在关联性,采集具有1~5胎产羔记录的安徽白山羊经产母羊血样265份,提取血液总DNA;根据基因序列(GenBank:EF446168.2)和参考文献设计4对引物,利用PCR-SSCP方法检测GDF9基因2个外显子在安徽白山羊品种中是否存在遗传多态性,采用最小二乘均值法分析遗传突变位点不同基因型产羔数之间的差异。结果表明:在外显子1中存在1个SNPEF446168.2:c.1956A>C(同义突变),而在外显子2中存在2个SNPs(EF446168.2:c.3319G> A,错义突变;EF446168.2:c.4085G>A,同义突变)。群体遗传分析发现,3个SNP位点均存在3种基因型,优势基因型频率分别为AA(0.607 5)、GG(0.750 9)、GG(0.786 8)。关联性分析表明,在EF446168.2:c.1956A>C位点,3种基因型安徽白山羊产羔数LSM(最小二乘均值)无显著差异;对EF446168.2:c.3319G>A位点,AA型产羔数LSM分别比GG型个体和GA型个体LSM高0.77只和0.41只(P<0.01);对EF446168.2:c.4085G>A,AA型个体产羔数LSM分别比GG型个体和GA型个体LSM高0.43只和0.28只(P<0.01)。因此,GDF9基因与安徽白山羊产羔数密切相关,可能是影响产羔数的一个主效基因;EF446168.2:c.1956A>C、EF446168.2:c.3319G>A、EF446168.2:c.4085G>A可能作为分子标记,应用于安徽白山羊多胎性育种。
安徽白山羊;GDF9基因;产羔数;PCR-SSCP
安徽省是我国山羊主产区之一,境内山羊主要品种为黄淮山羊安徽白山羊类群,集中分布于安徽省的阜阳、亳州、滁州以及淮北、宿州等市县,具有耐粗饲,抗病力强,终年发情,繁殖力高,母性好和难产率低等优点,一般5月龄母羔就能发情配种[1]。近年来,为改善肉用性能,对安徽白山羊进行选育提高。经选育后,安徽白山羊生长性能有了很大提高,但产羔率却出现下降。采取常规的育种方法,很难较为迅速地改善该山羊群体中的繁殖性能。产羔数受基因和环境等影响,是一个遗传力很低的数量性状(遗传力仅0.1左右[2]),但经济价值十分巨大,是影响肉羊养殖效益的主要因素。随着分子育种技术和现代分子生物学方法的发展,分子标记辅助选择(MAS)为解决这一问题提供了新的方向和契机。MAS可以消除性别、年龄、环境等因素对表型选择的干扰,从而弥补常规表型选择方法的不足,但找到与这些数量性状基因座相连锁的分子遗传标记,是实现标记辅助选择的先决条件[3]。
生长分化因子9(GDF9)是转化生长因子β超家族的一个新成员,对卵巢卵泡的发育起着关键的调节作用[4]。自1993年发现GDF9基因以来,围绕其功能,国内外科研工作者开展了一系列研究工作。已发现GDF9基因在人、啮齿类、牛、绵羊及有袋类动物卵巢的卵母细胞中特异性表达,在山羊的卵母细胞和黄体中能同时表达[5-6]。目前,对绵羊GDF9基因群体遗传学研究较多,而在山羊,尤其是在安徽白山羊上的研究相对较少。因此,本研究以安徽白山羊为研究对象,采用PCR-SSCP技术检测GDF9基因在安徽白山羊群体内的遗传多态性,统计对应的产羔记录,分析不同GDF9基因型与产羔数之间的相关性,旨在寻找与产羔性状相关的遗传标记,为安徽白山羊高繁殖力选育的标记辅助选择提供科学依据。
1 材料与方法
1.1材料
1.1.1试验动物在亳州、宿州两地的安徽白山羊养殖场,共选择265只安徽白山羊经产母羊,要求母羊有1~5胎以上产羔记录。
1.1.2样品的采集每只母羊颈静脉采血5mL,ACD抗凝,低温冰盒带回实验室,-20℃冻存。
1.1.3主要试剂 血液基因组DNA提取试剂盒购自北京诺博莱德科技有限公司,2×Reaction Mix和Marker B1(600 bp)等均购自上海生工生物工程技术服务有限公司。引物合成由上海铂尚生物技术有限公司完成。
1.1.4其他试剂耗材Tris、冰乙酸、硼酸、无水乙醇、碳酸氢钠、琼脂糖、甲醛、EDTA、5×TBE缓冲液、核酸染料、聚丙烯酰胺(29∶1)、APS、TEMED、去离子甲酰胺、溴酚蓝、硝酸银和二甲苯氰FF等均购自上海生工生物工程技术服务有限公司。
1.2方法
1.2.1引物设计根据山羊GDF9基因序列(GenBank: EF446168.2)和参考文献[7]设计4对引物,引物1和2扩增第1外显子产物,引物3和4扩增第2外显子(见表1)。

表1 用于GDF9基因PCR-SSCP分析的4对引物序列
1.2.2DNA提取 根据血液基因组DNA提取试剂盒说明步骤提取DNA,其中全血剂量为600μL,提取后的基因组DNA,经微量紫外分光光度计检测OD值,均在100 ng/μL以上,能满足整个试验的要求。
1.2.3PCR扩增PCR扩增反应体系(25μL):100μmol/L上、下游引物各0.1μL,2×Reaction Mix 12.5μL,超纯水10.3μL,DNA模板2μL。4对引物的扩增程序相同,即94℃预变性3min;94℃变性30 s,退火温度退火30 s,72℃延伸30 s,共35个循环;72℃再延伸10min,4℃保存。退火温度见表1。PCR产物采用2%琼脂糖凝胶电泳检测。
1.2.4SSCP分析参照王百川等[3]方法。取PCR产物4μL和上样缓冲液[98%去离子甲酰胺、0.025%溴酚蓝、0.025%二甲苯青、10mmol/LEDTA(pH值为8.0)]6μL,98℃变性10min后立即冰浴10min,上样于预冷的12%聚丙烯酰胺凝胶上,160 V电泳10min,再将电压调到100 V电泳6~8 h,银染强碱显色,扫描仪成像保存及分析。
1.2.5测序 在经过SSCP法分析后,对不同基因型PCR产物(25μL)直接测序,序列测序由上海铂尚生物技术有限公司完成。
1.3数据处理
根据下列模型进行最小二乘均值(LSM)分析,比较安徽白山羊产羔数在GDF9不同基因型之间的差异。

其中,Yij为个体性状观察值,μ为群体平均值,Gi为基因型效应值,Pj为胎次效应,Eij为随机误差。根据以上线性模型,用SPSS 22.0 ANOVA软件对产羔数进行方差分析。
2 结果与分析
2.1GDF9基因的PCR扩增
用所设计的引物(4对)对安徽白山羊基因组进行扩增,所得PCR产物用2%琼脂糖凝胶电泳检测,DNA Marker为100~600 bp,扩增结果见图1a~d。结果表明:扩增片段与目的片段大小一致,且特异性良好,可直接进行SSCP分析。

图1 4对引物扩增产物的DNA结果分析
2.24对引物扩增PCR产物的SSCP分析
如图2显示,4对引物中除了引物1扩增片段没有多态性,其余均有多态性,引物2扩增片段出现多态,分别定义为AA型、CC型和AC型3种基因型;引物3扩增片段出现多态,可定义为GG型、AA型和GA型3种基因型;引物4扩增片段出现多态,定义为GG型、AA型和GA型3种基因型。

图2 4对引物扩增产物SSCP结果分析
2.33个位点不同基因型纯合型个体测序分析
由图3、图4和图5得知,经过SSCP分析的不同引物扩增的纯合子基因型个体,重新扩增PCR产物后进行测序分析。引物2扩增产物中,AA型与CC型相比在外显子1第183 bp处有1个A→C的单碱基突变(EF446168.2: c.1956A>C)。该SNP不改变编码的氨基酸(ABR10699.1: p.Leu61Leu),属于同义突变。
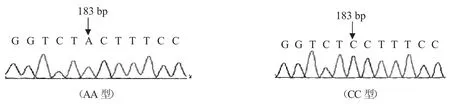
图3 安徽白山羊GDF9基因编码区第183 bp处AA和CC基因型的序列比较

图4 安徽白山羊GDF9基因编码区第3 319 bp处GG和AA基因型的序列比较

图5 安徽白山羊GDF9基因编码区第4 085 bp处GG和AA基因型的序列比较
引物3扩增产物中,GG型和AA型外显子2的第26 bp处有1个G→A的单碱基突变(EF446168.2:c.3319G>A)。该SNP可致编码的氨基酸序列改变,即由缬氨酸变为异亮氨酸(ABR10699.1:p.Val9Ile),属于错义突变。
引物4扩增产物中,EE型和FF型外显子2第792bp处有1个G→A的单碱基突变(EF446168.2:c.4085G>A)。该SNP不改变编码的氨基酸(ABR10699.1:p.Arg264Arg),属于同义突变。
2.4GDF9基因在安徽白山羊品种中的遗传多态性
不同引物扩增GDF9基因在安徽白山羊品种中的基因型频率及基因频率的分布(见表2)。由表2可知,在安徽白山羊群体中,对于EF446168.2:c.1956A>C,AA、CC和AC基因型频率分别为0.607 5、0.064 2和0.328 3,AA型为优势基因型;等位基因A和C的频率分别为0.771 7和0.228 3,A为优势等位基因。
对于EF446168.2:c.3319G>A,GG、AG和AA基因型频率分别为0.581 1、0.339 6和0.079 2,GG型为优势基因型;等位基因G和A的频率分别为0.750 9和0.249 1, G为优势等位基因。
对于EF446168.2:c.4085G>A,GG、GA和AA基因型频率分别为0.634 0、0.305 7和0.060 4,等位基因G和A的频率分别为0.786 8和0.213 2,G为优势等位基因。
2.5GDF9基因的Hardy-Weinberg平衡检测
从表2可以看出,经χ2适合性检验表明,GDF9基因中EF446168.2:c.1956A>C、EF446168.2:c.3319G>A和EF446168.2:c.4085G>A位点P值均大于0.05,达到Hardy-Weinberg平衡状态。

表2 不同引物扩增GDF9基因在安徽白山羊中的等位基因频率和基因型频率
2.6安徽白山羊GDF9基因不同基因型产羔数的最小二乘均值
由表3可见:对于EF446168.2:c.1956A>C,3种基因型母羊产羔数LSM没有明显差异。
对于EF446168.2:c.3319G>A,AA型安徽白山羊产羔数LSM比AG型的多0.41只(P<0.01),比GG型的多0.77只(P<0.01);AG型产羔数LSM比GG型多0.36只(P<0.01)。
对于EF446168.2:c.4085G>A,AA型安徽白山羊产羔数LSM比AG型的多0.28只(P<0.01),比GG型的多0.43只(P<0.01);AG型产羔数LSM和GG型之间没有显著差异。

表3 不同GDF9基因型的安徽白山羊产羔数的最小二乘均值及标准误
3 讨论
3.1安徽白山羊GDF9基因的遗传多态性
GDF9基因生理效应主要是对卵泡发育和生殖功能产生影响[8]。在研究肉羊GDF9基因多态性方面,绵羊的GDF9基因研究较多[12-13],对山羊如济宁青山羊、鲁北白山羊、沂蒙黑山羊等的研究也在逐步开展。Hanrahan等[14]研究发现,GDF9基因外显子2编码活性肽的全部序列,绵羊GDF9基因编码区有8个突变,其中G8突变(FecGH)对卵巢发育具有重要调节作用。孟丽娜等[15]研究发现,山羊GDF9基因编码区有4个突变位点,后2个突变位点会导致编码氨基酸改变。周泽晓等[16]利用AS-PCR方法分析贵州白山羊GDF9基因发现,790位点的SNP多态性与繁殖率相关,对山羊繁殖率的调节可能与绵羊相类似。本研究以安徽白山羊为研究对象,采用PCR-SSCP方法分析只发现3个突变位点,分别在1 956、3 319和4 085 bp处(GenBank:EF446168.2),其中3 319 bp处G→A突变导致编码氨基酸残基改变,由半胱氨酸残基变为酪氨酸残基,而其他2次碱基突变属于同义突变。但程萧等[17]在安徽白山羊和波尔山羊没有发现GDF9基因FecGH突变,何远清等[18]在济宁青山羊等6个山羊品种中也未检测出GDF9基因G8突变。这些可能是由于研究方法和样本数量不同而导致结论不同。对GDF9基因进行 Hardy-Weinberg平衡检测发现,除1956A>C达到Hardy-Weinberg平衡状态(P>0.05)外,3319G>A和4085G>A均未达到平衡状态(P<0.05),这可能是受到安徽白山羊选育措施的影响。
3.2GDF9基因与安徽白山羊产羔的相关性分析
王百川等[3]采用PCR-SSCP技术检测GDF9基因外显子2在济宁青山羊、崂山奶山羊和莱芜黑山羊中的单核苷酸多态性后指出,GDF9基因可能是控制济宁青山羊和莱芜黑山羊多胎性能的一个主效基因或是与之存在紧密遗传连锁的分子标记。朱广琴等[19]通过对169只黄淮山羊采用PCR-SSCP技术分析后发现,GDF9基因扩增片段均存在多态性,但只有2种基因型,产羔数最小二乘平均值在基因型之间均存在极显著差异(P<0.01)。
吴泽辉等[2]为了研究GDF9基因单核苷酸多态性对高繁殖力山羊品种(济宁青山羊)以及低繁殖力山羊品种(波尔山羊、文登奶山羊、辽宁绒山羊、北京本地山羊)繁殖力的影响,采用PCR-SSCP技术分析发现,GDF9基因可能是控制济宁青山羊多胎性能的1个主效基因或是与之存在紧密遗传连锁的分子标记。本次试验发现,4对引物中3对扩增产物有多态,在外显子1中存在1个SNPEF446168.2:c.1956A>C(同义突变),而在外显子2中存在2个SNPs(EF446168.2:c.3319G>A,错义突变;EF446168.2:c.4085G>A,同义突变)。群体遗传分析发现,3个SNP位点均存在3种基因型。关联性分析证实,在EF446168.2:c.3319G>A位点,AA型产羔数LSM较GG型个体和GA型个体分别高0.77只和0.41只(P<0.01);对 EF446168.2:c.4085G>A,AA型个体产羔数 LSM较GG、GA型个体分别高 0.43只和0.28只(P<0.01)。可以判断:EF446168.2:c.4085G>A的单碱基突变影响了GDF9基因功能表达,从而导致不同基因型母羊出现产羔数的差异。因此,可以猜测GDF9基因是影响安徽白山羊产羔数的主效基因,EF446168.2:c.4085G>A可能作为分子标记,应用于安徽白山羊多胎性育种。
[1]陈胜,汤继顺,朱德建,等.安徽省肉羊产业现状及发展趋势分析[J].当代畜牧,2013(专辑):56-61.
[2]吴泽辉,储明星,李学伟,等.山羊生长分化因子9基因外显子2的PCR-SSCP分析[J].中国农业科学,2006,39(4):802-808.
[3]王百川,张钦恺,徐君君,等.3个山羊品种基因外显子多态性检测[J].中国草食动物科学,2014,34(专辑):132-136.
[4]Tang KQ,YangW C,Zhang X X,etal.Effectsofpolymorphisms in thebovinegrowth differentiation factor9 geneon sperm quality in Holstein bulls[J].GenetMolRes,2013,12(3):2189-2195.
[5]Crawford JL,Mcnatty K P.The ratio of growth differentiation factor 9∶bonemorphogenetic protein 15mRNA expression is tightly coregulated and differsbetween speciesoverawide rangeofovulation rates[J].Mol CellEndocrinol,2012,348:339-343.
[6]HosoeM,KaneyamaK,UshizawaK,etal.Quantitativeanalysisofbone morphogenetic protein 15(BMP15)and growth differentiation factor 9(GDF9)gene expression in calfand adultbovine ovaries[J].Reprod BiolEndocrinol,2011,9:33.
[7]董传河,杜立新.山羊GDF9基因多态性与产羔数关联分析研究[J].山东农业大学学报:自然科学版,2011,42(2):227-237.
[8]陶萨茹拉,王峰,刘永斌.生长分化因子GDF9基因的研究进展[J].畜牧与饲料科学,2009,30(1):54-55.
[9]ShiF T,Cheung A P,Huang H F,etal.Growth differentiation factor 9(GDF9)suppresses follistatin and follistatin-like 3 production in human granulosa-lutein cells[J].PLoSOne,2011,6(8):e22866.
[10]Mottershead DG,Ritter L J,Gilchrist R B.Signalling pathwaysmediating specific synergistic interactions between GDF9 and BMP15[J]. MolHum Report,2012,18(3):121-128.
[11]Pramod R K,Sharma S K,Singhi A,et al.Differential ovarian morphometry and follicularexpression of BMP15,GDF9 and BMPR1B influence the prolificacy in goat[J].ReportDomestAnim,2013,48(5):803-809.
[12]Mullen M P,Hanrahan JP,Howard D J,etal.Investigation of prolific sheep from UK and Ireland for evidence on origin of themutations in BMP15(FecXG,FecXB)and GDF9(FecGH)in Belclareand Cambridge sheep[J].PLoSOne,2013,8(1):e53172.
[13]李碧侠,储明星,王金玉.生长分化因子9基因的研究进展[J].中国畜牧兽医,2012,29(6):33-36.
[14]Hanrahan JP,Gregan SM,MulsantP,etal.Mutations in thegenes for oocyte-derived growth factors GDF9 and BMP15 are associated with both increased ovulation rate and sterility in Cambridge and Belclare sheep(Ovisaries)[J].BiologyofReproduction,2004,70:900-909.
[15]孟丽娜,张英杰,刘月琴.山羊基因及其多态性分析研究进展[J].中国草食动物科学,2012,32(专辑):55-57.
[16]周泽晓,王嘉福,冉雪琴.贵州白山羊GDF9和BMP15基因多态性与产羔数的相关性研究[J].中国畜牧杂志,2012,28(21):9-11.
[17]程箫,任春环,张子军,等.安徽白山羊、波尔山羊GDF9和BMP15基因的RFLP分析[J].安徽农业大学学报,2012,39(3):352-355.
[18]何远清,储明星,王金玉,等.山羊高繁殖力候选基因GDF9 RFLP分析[J].农业生物技术学报,2006,14(1):135-136.
[19]朱广琴,王庆林,康永刚,等.GnRHR、GDF9、KISS1基因多态性与黄淮山羊产羔性状相关性的研究[J].黑龙江畜牧兽医:科技版,2013(6):58-61.
Analysison Population Genetic Effectof GDF9Gene of AnhuiW hite Goat
Tang Jishun,ZhangWei,Chen Sheng,etal
(InstituteofAnimalHusbandryand Veterinary,AnhuiAcademyofAgriculturalScience,Hefei230031,China)
To certify the possibleeffectof the GDF9 gene asamajor gene on lambing rate of Anhuiwhite goat,the blood samples were collected from 265Anhuiwhite doeswith the record of1-5 fetal littersizes.The totalDNA wasextracted from theblood,the 4 pairs of primers were designed according to the gene sequence(GenBank:EF446168.2)and reference to detect the polymorphism of two exonsmutation site in GDF9 by using PCR-SSCPmethod and analyze litter sizes of difference between different genotypes by using least squaresmeans(LSM)in Anhuiwhite goat.The results showed that there was one SNP EF446168.2:c.1956A>C(synonymousmutation)in the exonⅠ,and two SNPS(EF446168.2:c.3319G>A,missensemutation,EF446168.2:c.4085G>A,synonymousmutation)in the exonⅡ.Population genetic analysis showed thatallof the 3 SNPSsites had three kindsofgenotypesand the preponderantgenotype frequencieswere AA genotype(0.607 5),GG(0.7509),GG(0.7868)respectively.Correlation analysisshowed that the lambing number LSM of three genotypeshad no difference in the EF446168.2:c. 1956A>Csite;the lambingnumber LSM ofAA genotypeweremore than thoseofGG and GA genotypeby 0.77 and 0.41(P<0.01)in the EF446168.2:c.3319G>A site;the lambing number LSM of AA genotype weremore than those of GG and GA genotype by 0.43 and 0.28(P<0.01)in the EF446168.2: c.4085G>A site.Therefore,it couldbe concluded that the GDF9 genemightbe amajor genewhich influenced the littersize;the three SNPS sites of EF446168.2:c.1956A>C,EF446168.2:c.3319G>A and EF446168.2:c.4085G>A might be used in prolificacybreedingasamolecularmarker in Anhuiwhitegoat.
Anhuiwhitegoat;GDF9;litter size;PCR-SSCP
S827.2
A
2095-3887(2016)06-0001-06
10.3969/j.issn.2095-3887.2016.06.001
2016-09-19
安徽省农业科学院院长青年创新基金项目(15b0415)
汤继顺(1979-),男,助理研究员,主要从事肉羊繁育和疾病防治研究。
陈胜(1974-),男,副研究员,主要从事草食动物遗传育种与繁殖研究。

