基因工程T细胞的临床研究进展*
高俊芳,李 峰,王丽萍,张 毅
1)郑州大学第一附属医院肿瘤科 郑州 450052 2)郑州大学第一附属医院生物细胞治疗中心 郑州 450052 3)郑州大学生命科学学院 郑州 450001

基因工程T细胞的临床研究进展*
高俊芳1),李 峰2),王丽萍1),张 毅1,2,3)#
1)郑州大学第一附属医院肿瘤科 郑州 450052 2)郑州大学第一附属医院生物细胞治疗中心 郑州 450052 3)郑州大学生命科学学院 郑州 450001
#通信作者,男,1964年4月生,博士,教授,主任医师,研究方向:肿瘤免疫,E-mail:yizhang@zzu.edu.cn
免疫治疗;基因工程T细胞;TCR-T细胞;CAR-T细胞
尽管手术和放化疗等传统治疗手段在肿瘤治疗方面取得了很大进展,但在改善肿瘤患者预后和生存等方面仍不令人满意。近年来,肿瘤免疫治疗领域发展迅速,出现了多种效果良好的免疫治疗药物和技术[1-6]。免疫治疗已经成为肿瘤综合治疗的重要手段,甚至在不久后有可能成为肿瘤治疗的主要手段。在这些免疫治疗新技术中,基因工程T细胞的发展尤为令人瞩目[7]。多项临床研究[8-11]显示,基因工程T细胞能够有效清除机体内恶性细胞,甚至能够长期缓解病情。该文将介绍基因工程T细胞的临床研究进展,并探讨该领域在中国的发展。
1 基因工程T细胞的主要类型
目前,临床研究中最重要的基因工程T细胞是T细胞受体(T cell receptor, TCR)改造的T细胞(TCR-T细胞)和嵌合抗原受体(chimeric antigen receptor, CAR)T细胞(CAR-T细胞)。TCR-T和CAR-T细胞均通过识别肿瘤抗原来杀伤肿瘤细胞,但是二者在受体结构和抗原识别方面存在很大差异。TCR-T细胞中仅转导了TCR的α链与β链,转导的TCR依赖细胞内CD3和CD28等分子传导信号,最终激活T细胞[12]。TCR构建相对复杂,既需要考虑主要组织相容性复合体(major histocompatibility complex, MHC)类型,又需要对复杂的α链与β链亚型进行鉴定,最后才能获得特异TCR序列。而CAR中不仅含有识别肿瘤抗原的单链抗体(single chain antibody fragment, scFv)序列,更重要的是含有胞内信号转导结构[13],因此,CAR能够以非MHC依赖性的方式识别肿瘤细胞表面抗原,并直接激活T细胞。另外,CAR序列的构建相对容易,可变区仅是scFv,其他部分均是保守的已知序列。在CAR-T细胞研究方面,目前的热点主要是测试不同信号分子组合对T细胞功能的影响。由于具有结构简单、作用直接等优点,CAR-T细胞是当前的研究热点,尤其在血液肿瘤方面,CAR-T细胞临床研究的报道非常多,并且取得了令人满意的效果。与CAR-T细胞相比,TCR-T细胞在治疗靶向性以及实体瘤治疗方面具有优势。TCR-T和CAR-T细胞受体结构差异改编自文献[14],见图1;二者在抗原识别方面的差异见表1。

图1 TCR-T(左)和CAR-T(右)细胞受体结构的差异表1 TCR-T和CAR-T细胞在抗原识别方面的差异
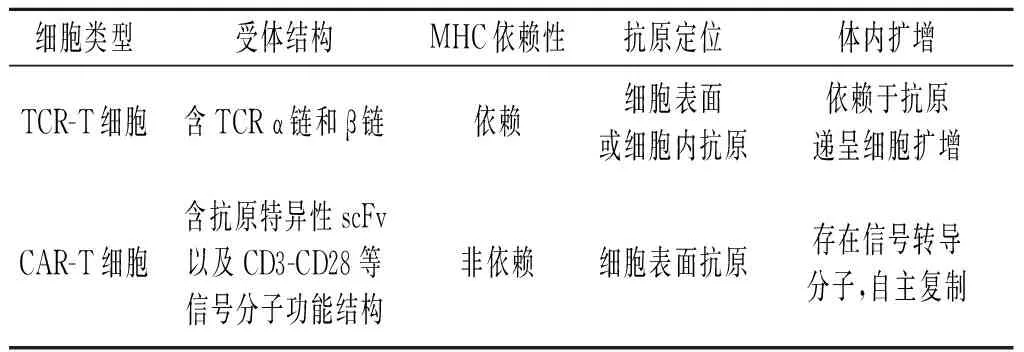
细胞类型受体结构MHC依赖性抗原定位体内扩增TCR-T细胞含TCRα链和β链依赖细胞表面或细胞内抗原依赖于抗原递呈细胞扩增CAR-T细胞含抗原特异性scFv以及CD3-CD28等信号分子功能结构非依赖细胞表面抗原存在信号转导分子,自主复制
2 TCR-T细胞的临床研究
TCR是表达于T细胞表面的异二聚体蛋白分子,能够识别和结合特异抗原肽-MHC并介导免疫应答。通过基因工程技术,将识别肿瘤特异抗原-MHC的TCR转导至体外扩增的T细胞中,就能够产生大量具有肿瘤特异杀伤能力的TCR-T细胞。目前,TCR-T细胞的临床研究主要在实体瘤治疗中开展,在血液系统恶性肿瘤治疗方面仅有少量研究报道[10,15]。其中,TCR-T细胞在多发性骨髓瘤治疗中效果显著,70%的患者(研究中共纳入20位患者)完全缓解,1位患者疾病进展,其余患者或部分缓解或疾病稳定。下面就TCR-T细胞治疗实体瘤的临床研究进展作一简单介绍。
TCR-T细胞临床研究开始的标志是2006年的两项关于治疗转移性黑色素瘤的临床研究报道。其中,Duval等[16]利用黑色素瘤分化抗原MART-1特异性TCR-T细胞治疗了15例患者,尽管仅有1例患者出现了部分缓解,但该报道证明TCR-T细胞对人体是安全的。随后,Morgan等[17]采用MART-1特异性TCR-T细胞治疗15例患者,发现体外扩增的TCR-T细胞能够在患者体内长期存活(检测时已达2个月),甚至在2例患者中高水平持续了1 a之久,并且这2例患者出现了客观缓解。此后,随着TCR-T细胞研究的深入,科学家认识到TCR亲和性与治疗效果紧密相关。当使用高亲和力TCR-T细胞时,患者缓解率大幅上升。Johnson等[18]使用MART-1高亲和力TCR-T细胞对20例转移性黑色素瘤患者进行了治疗,客观缓解率达到30%。另一个影响TCR-T细胞治疗效果的重要因素是特异性抗原在肿瘤中的表达。抗原表达越广泛,则特异性TCR-T细胞治疗效果越好。一个典型例子是癌睾抗原NY-ESO-1。NY-ESO-1在肿瘤中的表达十分普遍。Robbins等[11,19]观察了NY-ESO-1特异性TCR-T细胞治疗黑色素瘤和滑膜肉瘤的效果,结果显示55%黑色素瘤患者及61%滑膜肉瘤患者获得了临床缓解,黑色素瘤患者的3 a及5 a生存率均达到33%,滑膜肉瘤患者的3 a及5 a生存率分别达到了38%和14%。由于TCR-T细胞需要共刺激信号才能活化增殖,因此,树突状细胞(dendritic cell,DC)能够增强TCR-T细胞的治疗效果。Chodon等[20]采用DC疫苗联合MART-1特异性TCR-T细胞治疗14例转移性黑色素瘤患者,结果显示高达69%的患者明显好转。
在TCR-T细胞治疗的发展过程中,Steven Rosenberg做出了巨大贡献。Steven Rosenberg是肿瘤免疫治疗的代表人物,他的工作推动了包括肿瘤浸润淋巴细胞、TCR-T细胞和CAR-T细胞在内的过继性细胞治疗的进步。特别是在TCR-T细胞治疗领域,多数临床研究报道来自Steven Rosenberg团队。近期,Steven Rosenberg又引领了细胞治疗领域的突破,他的团队鉴定了识别肿瘤新抗原的CD4+T细胞,利用这些细胞治疗后肿瘤明显缩小[21]。这项研究突显了新抗原在肿瘤治疗中的重要性,奠定了新抗原作为基因工程T细胞治疗靶点的研究基础。更加值得注意的是,Steven Rosenberg创新了传统TCR构建方案,使利用外周血T细胞构建肿瘤抗原特异性TCR成为现实[22],这将进一步加速TCR-T细胞的研究进展。
3 CAR-T细胞的临床研究
从CAR概念的提出,至今已经20余年。CAR结构从含单一信号分子到现在含有3个甚至更多信号调控分子。对CAR结构的改造成功提高了T细胞活性与体内存活时间,为CAR-T细胞的临床应用奠定了良好基础[3,23]。目前,该领域的研究进展集中在CD19特异性CAR-T细胞治疗恶性血液病方面[8, 24-26]。CD19是一个良好的血液系统肿瘤治疗靶点,表达于几乎全部B细胞性恶性肿瘤上,但在正常细胞中,仅成熟B细胞、前体B细胞以及部分DC细胞表达CD19。更为重要的是造血干细胞不表达CD19,因而攻击CD19靶点不会影响患者的正常造血功能。
在CAR-T细胞的发展中,Carl June是一位里程碑式人物,他的系统工作为CAR-T细胞治疗突破铺平了道路。Carl June团队首先证实了利用病毒表达系统改造的CAR-T细胞在机体内能够长期存活,并且携带异源基因的T细胞对机体无害[27]。Carl June团队还观察了CD19特异性CAR-T细胞在多种血液系统肿瘤中的治疗效果。2011年,Carl June团队报道了CD19特异性CAR-T细胞治疗晚期慢性淋巴细胞白血病(chronic lymphocytic leukemia, CLL)的临床研究结果[24-25]。输入的CAR-T细胞能够在患者体内长期存活并发挥功能,通过清除外周血和骨髓中的恶性细胞,帮助重建正常免疫系统,最终带来病情的长期缓解(观察时已经达到10个月)。随后,Carl June团队又报道了CD19特异性CAR-T细胞治疗复发急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)的临床研究结果[9,26]。与CLL治疗效果类似,CAR-T细胞同样能够在ALL患者体内长效清除恶性细胞,持续缓解病情(在部分患者中观察到至少11个月的持续缓解)。更令人振奋的是,90%患者的病情在CAR-T细胞治疗后完全缓解。此外,Carl June团队还证实CAR-T细胞治疗对难治性多发性骨髓瘤同样有效[28]。除了Carl June团队的工作外,还有多项研究[29-31]结果支持CAR-T细胞治疗血液系统恶性肿瘤的有效性。Brentjens等[32]的工作也进一步证实CAR-T细胞在CLL和ALL治疗中的有效性。而Kochenderfer等[33]则发现CAR-T细胞在淋巴瘤治疗中也非常有效。除了CD19外,CD33也是血液系统肿瘤治疗的靶点[34],但相关报道较少,尚需更多研究来验证CD33特异性CAR-T细胞治疗的有效性。
与在血液系统肿瘤治疗中取得的成就相比,CAR-T细胞治疗实体瘤的临床研究结果不是十分理想。2006年,Lamers等[35]观察了靶向碳酸酐酶Ⅸ的CAR-T细胞治疗转移性肾细胞癌的效果。改造的CAR-T细胞可以在患者体内存活7周但没有明显的治疗作用。这项研究作为CAR细胞治疗实体瘤的先驱具有开拓性意义。之后的几项临床研究[36-37]也都证实CAR-T细胞能够在实体瘤患者体内生存较长时间(最长达到192周),且没有明显毒副作用,但是也未能显著缓解病情。韩为东的团队[38]观察了靶向EGFR的CAR-T细胞治疗EGFR阳性的复发或难治性非小细胞肺癌的效果,结果未出现严重毒副作用,且治疗后EGFR转阴,但临床效果并不十分明显。值得注意的是,Ahmed等[39]在难治性肉瘤患者中发现,经静脉输入的相当一部分CAR-T细胞能够到达肿瘤病灶,并在肿瘤中扩增;与此观察一致的是,肿瘤组织出现了大面积坏死,然而肿块没有明显缩小,患者没有显著临床反应。结合TCR-T细胞的临床研究经验,这个结果提示在面对异质性程度更高的实体瘤时,要采用针对不同靶点的基因工程T细胞(CAR-T细胞和TCR-T细胞)来联合治疗,同时要尽可能降低肿瘤负荷,这样才能取得好的治疗效果。
4 基因工程T细胞治疗中存在的问题
基因工程T细胞展示出强大的肿瘤清除能力,但也存在很多问题,例如,生产成本高、T细胞基因转导难和特异性细胞纯度不一致等。其中,影响治疗安全的因素主要是脱靶效应和细胞因子释放综合征(cytokine releasing syndrome,CRS)[8-9,40]。前者产生的原因是基因工程T细胞识别的抗原往往不是肿瘤细胞独有的,部分正常组织也表达这些抗原,这就导致基因工程T细胞也会攻击正常细胞。在TCR-T细胞治疗研究中,曾发现脱靶效应会带来严重肠炎和心脏毒性,并曾导致部分患者死亡[41-42]。而在CAR-T细胞治疗研究中,最典型的例子是CD19特异性T细胞攻击正常B细胞,使患者发生低丙种球蛋白血症[43]。为了解决这一问题,科学家设计了分子开关来调节基因工程T细胞活性,希望将脱靶效应的影响降至最低。另外,针对肿瘤新抗原设计基因工程T细胞可能有助于更彻底地解决脱靶问题[44]。另外一个基因工程T细胞治疗的主要副作用——CRS的产生主要是由于基因工程T细胞过于强大的肿瘤杀伤能力,使机体短时间内释放大量促炎性因子,导致患者出现发热、皮疹,器官衰竭,甚至死亡等[43,45]。但是随着对基因工程T细胞作用机制的认识加深,通过控制细胞注射数量已经能够很好地防止CRS的发生。相信随着研究的进一步深入,CRS将不再是基因工程T细胞治疗的限制因素。
5 中国科研人员的工作
近年来,中国科研人员在肿瘤免疫治疗基础研究方面也取得了许多成果[46-47]。在基因工程T细胞治疗研究领域,中国科技人员开展了广泛而深入的研究,并做出了相应贡献。在CAR-T细胞领域,解放军301医院的韩为东教授做出了代表性工作,他的团队观察了针对不同抗原(CD19、CD20和CD33)的CAR-T细胞对白血病和淋巴瘤患者的治疗效果[34,48-49],拓宽了CAR-T细胞的应用范围。更加令人欣喜的是,根据公开数据,半数以上注册的CAR-T细胞临床研究由中国科学家或公司主导,这说明中国在CAR-T细胞研究和治疗方面已经处于世界前列。在TCR-T细胞方面,目前尚未见国内的相关临床研究报道,但是根据ClinicalTrials.gov数据,中国境内已经开始了多项TCR-T细胞的临床研究。作者所在的实验室也开展了基因工程T细胞方面的工作:构建了针对血液系统肿瘤和实体瘤不同抗原的CAR-T细胞,并研究了这些细胞单独或联合治疗的效果;利用诱导型自杀基因来提高基因工程T细胞治疗的安全性,并在动物实验中取得了较佳效果;构建了病毒相关肿瘤抗原与癌睾抗原高亲和力TCR序列库,临床前研究显示这些高亲和力TCR在介导T细胞清除实体瘤时具有很好的效果,为基因工程T细胞的临床研究打下了基础。
6 展望
尽管基因工程T细胞治疗还存在种种问题,但是我们更应该注意到该类治疗的巨大潜力。据报道[50]CAR-T细胞治疗晚期或者难治性白血病的完全缓解率达到94%。这个结果非常振奋人心,也进一步证明了基因工程T细胞的巨大潜力。随着肿瘤免疫学和基因工程技术的进步,基因工程T细胞治疗将更加个体化。目前,基因工程T细胞主要针对“通用靶点”进行治疗,这就导致部分患者治疗反应不佳或者无反应。但是,如果能够根据患者的肿瘤特异新抗原设计个体化基因工程T细胞,同时与靶向肿瘤免疫微环境的免疫检查点抑制剂等相结合,将极大地提高治疗有效性和安全性。总而言之,基因工程T细胞将在肿瘤治疗中发挥越来越重要的作用,它的发展将为肿瘤患者带来更多希望。
[1]OTT PA,HODI FS,ROBERT C.CTLA-4 and PD-1/PD-L1 blockade: new immunotherapeutic modalities with durable clinical benefit in melanoma patients[J].Clin Cancer Res,2013,19(19):5300
[2]NGIOW SF,VON SCHEIDT B,AKIBA H,et al.Anti-TIM3 antibody promotes T cell IFN-γ-mediated antitumor immunity and suppresses established tumors[J].Cancer Res,2011,71(10):3540
[3]SONG DG,YE Q,CARPENITO C,et al.In vivo persistence, tumor localization, and antitumor activity of CAR-engineered T cells is enhanced by costimulatory signaling through CD137(4-1BB)[J].Cancer Res,2011,71(13):4617
[4]OREN R,HOD-MARCO M,HAUS-COHEN M,et al.Functional comparison of engineered T cells carrying a native TCR versus TCR-like antibody-based chimeric antigen receptors indicates affinity/avidity thresholds[J].J Immunol,2014,193(11):5733
[5]DUONG CP,YONG CS,KERSHAW MH,et al.Cancer immunotherapy utilizing gene-modified T cells:from the bench to the clinic[J].Mol Immunol,2015,67(2 Pt A):46
[6]ZOU W,WOLCHOK JD,CHEN L.PD-L1(B7-H1) and PD-1 pathway blockade for cancer therapy:mechanisms, response biomarkers, and combinations[J].Sci Transl Med,2016,8(328):328rv4
[7]COUZIN-FRANKEL J.Breakthrough of the year 2013:cancer immunotherapy[J].Science,2013,342(6165):1432
[8]GARFALL AL,MAUS MV,HWANG WT,et al.Chimeric antigen receptor T cells against CD19 for multiple myeloma[J].N Engl J Med,2015,373(11):1040
[9]MAUDE SL,FREY N,SHAW PA,et al.Chimeric antigen receptor T cells for sustained remissions in leukemia[J].N Engl J Med,2014,371(16):1507
[10]RAPOPORT AP,STADTMAUER EA,BINDER-SCHOLL GK,et al.NY-ESO-1-specific TCR-engineered T cells mediate sustained antigen-specific antitumor effects in myeloma[J].Nat Med,2015,21(8):914
[11]ROBBINS PF,MORGAN RA,FELDMAN SA,et al.Tumor regression in patients with metastatic synovial cell sarcoma and melanoma using genetically engineered lymphocytes reactive with NY-ESO-1[J].J Clin Oncol,2011,29(7):917
[12]ZHANG Y,LIU Y,MOXLEY KM,et al.Transduction of human T cells with a novel T-cell receptor confers anti-HCV reactivity[J].PLoS Pathog,2010,6(7):e1001018
[13]SRIVASTAVA S,RIDDELL SR.Engineering CAR-T cells:design concepts[J].Trends Immunol,2015,36(8):494
[14]HARRIS DT,KRANZ DM.Adoptive T cell therapies:a comparison of T cell receptors and chimeric antigen receptors[J].Trends Pharmacol Sci,2016,37(3):220
[15]BAR M,CHAPUIS AG,SCHMITT TM,et al.Transferred donor-derived virus specific CD8+T cells that have been transduced to express a WT1-specific T cell receptor can persist and provide anti-leukemic activity in AML patients post-transplant[J].Blood,2014,124(21):3939
[16]DUVAL L,SCHMIDT H,KALTOFT K,et al.Adoptive transfer of allogeneic cytotoxic T lymphocytes equipped with a HLA-A2 restricted MART-1 T-cell receptor: a phase Ⅰ trial in metastatic melanoma[J].Clin Cancer Res,2006,12(4):1229
[17]MORGAN RA,DUDLEY ME,WUNDERLICH JR,et al.Cancer regression in patients after transfer of genetically engineered lymphocytes[J].Science,2006,314(5796):126
[18]JOHNSON LA,MORGAN RA,DUDLEY ME,et al.Gene therapy with human and mouse T-cell receptors mediates cancer regression and targets normal tissues expressing cognate antigen[J].Blood,2009,114(3):535
[19]ROBBINS PF,KASSIM SH,TRAN TL,et al.A pilot trial using lymphocytes genetically engineered with an NY-ESO-1-reactive T-cell receptor:long-term follow-up and correlates with response[J].Clin Cancer Res,2015,21(5):1019
[20]CHODON T,COMIN-ANDUIX B,CHMIELOWSKI B,et al.Adoptive transfer of MART-1 T-cell receptor transgenic lymphocytes and dendritic cell vaccination in patients with metastatic melanoma[J].Clin Cancer Res,2014,20(9):2457
[21]TRAN E,TURCOTTE S,GROS A,et al.Cancer immunotherapy based on mutation-specific CD4+T cells in a patient with epithelial cancer[J].Science,2014,344(6184):641
[22]GROS A,PARKHURST MR,TRAN E,et al.Prospective identification of neoantigen-specific lymphocytes in the peripheral blood of melanoma patients[J].Nat Med,2016,22(4):433
[23]LIU X,RANGANATHAN R,JIANG S,et al.A chimeric switch-receptor targeting PD1 augments the efficacy of second-generation CAR T cells in advanced solid tumors[J].Cancer Res,2016,76(6):1578
[24]PORTER DL,LEVINE BL,KALOS M,et al.Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia[J].N Engl J Med,2011,365(8):725
[25]KALOS M,LEVINE BL,PORTER DL,et al.T cells with chimeric antigen receptors have potent antitumor effects and can establish memory in patients with advanced leukemia[J].Sci Transl Med,2011,3(95):95ra73
[26]GRUPP SA,KALOS M,BARRETT D,et al.Chimeric antigen receptor-modified T cells for acute lymphoid leukemia[J].N Engl J Med,2013,368(16):1509
[27]SCHOLLER J,BRADY TL,BINDER-SCHOLL G,et al.Decade-long safety and function of retroviral-modified chimeric antigen receptor T cells[J].Sci Transl Med,2012,4(132):132ra53
[28]MAUS MV,JUNE CH.CARTs on the road for myeloma[J].Clin Cancer Res, 2014,20(15):3899
[29]LEE DW,KOCHENDERFER JN,STETLER-STEVENSON M,et al.T cells expressing CD19 chimeric antigen receptors for acute lymphoblastic leukaemia in children and young adults: a phase 1 dose-escalation trial[J].Lancet,2015,385(9967):517
[30]KOCHENDERFER JN,DUDLEY ME,KASSIM SH,et al.Chemotherapy-refractory diffuse large B-cell lymphoma and indolent B-cell malignancies can be effectively treated with autologous T cells expressing an anti-CD19 chimeric antigen receptor[J].J Clin Oncol,2015,33(6):540
[31]WANG X,POPPLEWELL LL,WAGNER JR,et al.Phase 1 studies of central memory-derived CD19 CAR T-cell therapy following autologous HSCT in patients with B-cell NHL[J].Blood,2016,127(24):2980
[32]BRENTJENS RJ,RIVIERE I,PARK JH,et al.Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B-cell leukemias[J].Blood,2011,118(18):4817
[33]KOCHENDERFER JN,DUDLEY ME,FELDMAN SA,et al.B-cell depletion and remissions of malignancy along with cytokine-associated toxicity in a clinical trial of anti-CD19 chimeric-antigen-receptor-transduced T cells[J].Blood,2012,119(12):2709
[34]WANG QS,WANG Y,LV HY,et al.Treatment of CD33-directed chimeric antigen receptor-modified T cells in one patient with relapsed and refractory acute myeloid leukemia[J].Mol Ther,2015,23(1):184
[35]LAMERS CH,SLEIJFER S,VULTO AG,et al.Treatment of metastatic renal cell carcinoma with autologous T-lymphocytes genetically retargeted against carbonic anhydrase Ⅸ: first clinical experience[J].J Clin Oncol,2006,24(13):e20
[36]LOUIS CU,SAVOLDO B,DOTTI G,et al.Antitumor activity and long-term fate of chimeric antigen receptor-positive T cells in patients with neuroblastoma[J].Blood,2011,118(23):6050
[37]KATZ SC,BURGA RA,MCCORMACK E,et al.Phase Ⅰ hepatic immunotherapy for metastases study of intra-arterial chimeric antigen receptor-modified T-cell therapy for CEA+liver metastases[J].Clin Cancer Res,2015,21(14):3149
[38]FENG K,GUO Y,DAI H,et al.Chimeric antigen receptor-modified T cells for the immunotherapy of patients with EGFR-expressing advanced relapsed/refractory non-small cell lung cancer[J].Sci China Life Sci,2016,59(5):468
[39]AHMED N,BRAWLEY VS,HEGDE M,et al.Human epidermal growth factor receptor 2(HER2)-specific chimeric antigen receptor-modified T cells for the immunotherapy of HER2-positive sarcoma[J].J Clin Oncol,2015,33(15):1688
[40]MORGAN RA,CHINNASAMY N,ABATE-DAGA D,et al.Cancer regression and neurological toxicity following anti-MAGE-A3 TCR gene therapy[J].J Immunother,2013,36(2):133
[41]PARKHURST MR,YANG JC,LANGAN RC,et al.T cells targeting carcinoembryonic antigen can mediate regression of metastatic colorectal cancer but induce severe transient colitis[J].Mol Ther,2011,19(3):620
[42]LINETTE GP,STADTMAUER EA,MAUS MV,et al.Cardiovascular toxicity and titin cross-reactivity of affinity-enhanced T cells in myeloma and melanoma[J].Blood,2013,122(6):863
[43]JUNE CH,RIDDELL SR,SCHUMACHER TN.Adoptive cellular therapy: a race to the finish line[J].Sci Transl Med,2015,7(280):280ps7
[44]KLEBANOFF CA,ROSENBERG SA,RESTIFO NP.Prospects for gene-engineered T cell immunotherapy for solid cancers[J].Nat Med,2016,22(1):26
[45]BRENTJENS R,YEH R,BERNAL Y,et al.Treatment of chronic lymphocytic leukemia with genetically targeted autologous T cells:case report of an unforeseen adverse event in a phase Ⅰ clinical trial[J].Mol Ther,2010,18(4):666
[46]黄建敏,阚全程,张震,等.抗人胸腺免疫球蛋白联合干扰素γ和白介素2诱导培养细胞因子诱导的杀伤细胞的效果[J].郑州大学学报(医学版),2016,51(2):149
[47]石晓娟,乔永涛,杨黎,等.N-乙酰-D-乳糖胺、抗CD28单克隆抗体对肺癌患者来源的CIK细胞增殖及杀伤功能的影响[J].郑州大学学报(医学版),2016,51(2):176
[48]DAI H,ZHANG W,LI X,et al.Tolerance and efficacy of autologous or donor-derived T cells expressing CD19 chimeric antigen receptors in adult B-ALL with extramedullary leukemia[J].Oncoimmunology,2015,4(11):e1027469
[49]WANG Y,ZHANG WY,HAN QW,et al.Effective response and delayed toxicities of refractory advanced diffuse large B-cell lymphoma treated by CD20-directed chimeric antigen receptor-modified T cells[J].Clin Immunol,2014,155(2):160
[50]ZHANG TF,CAO L,XIE J, et al.Efficiency of CD19 chimeric antigen receptor-modified T cells for treatment of B cell malignancies in phase Ⅰ clinical trials: a meta-analysis[J].Oncotarget,2015,6(32):33961
(2016-06-08收稿 责任编辑徐春燕)
特约述评作者简介
张毅,教授、博士研究生导师、河南省特聘教授;郑州大学第一附属医院生物细胞治疗中心主任;河南省肿瘤免疫治疗工程研究中心主任、河南省肿瘤免疫和生物治疗重点实验室主任;比利时鲁汶大学肿瘤免疫学博士;国际细胞生物研究所和Ludwig癌症研究所布鲁塞尔分所博士后;美国芝加哥大学研究型助理教授、南卡医科大学助理教授和肿瘤免疫研究室主任。主持过美国癌症研究所、美国癌症协会、美国NIH、国家自然科学基金面上和国际合作项目以及卫生部重点攻关等基金项目;发表论文160余篇,其中SCI论文72篇,被引用1 500余次。中国医药质量管理学会细胞治疗质量管理和研究分会常务副主任委员、中国研究型医院生物治疗学分会副主任委员、中国医药生物技术协会精准医疗分会常委、河南省免疫学会和河南省抗癌学会生物治疗专业委员会主任委员。
10.13705/j.issn.1671-6825.2016.06.001
*国家自然科学基金项目 81171986,81271815;卫生部科研资助金 201501004

