基于阳离子型共轭聚合物和核酸适配体的高灵敏铅离子快速检测方法
刘兴奋+王亚腾+华笑笑+黄艳琴+冯晓苗+范曲立+黄维
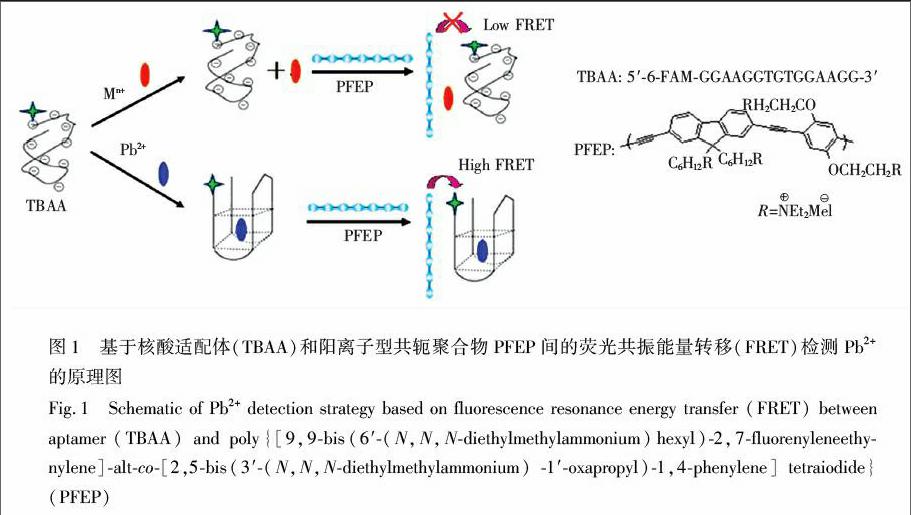


摘 要 建立了基于主链含芴的阳离子型对芳撑乙炔衍生物(poly{[9,9bis(6′(N,N,Ndiethylmethyl ammonium)hexyl)2,7fluorenyleneethynylene]altco[2,5bis(3′(N,N,Ndiethylmethylammonium)1′oxapropyl)1,4phenylene]tetraiodide}, PFEP)和核酸适配体快速检测Pb2+的新方法。使用选择性更高的核酸适配体序列,有效降低了Hg2+对Pb2+检测的干扰,提高了检测的选择性和灵敏度。用于识别Pb2+的核酸探针(TBAA)末端用荧光素标记(5′6FAMGGAAGGTGTGGAAGG3′)。当其与Pb2+发生特异性结合时,形成电荷密度高于单链DNA的G四链体结构,与PFEP之间的静电作用增强,使能量供体(聚合物)与受体(荧光素)之间的距离拉近,发生更高效的荧光共振能量转移(Fluorescence resonance energy transfer, FRET)。其它金属离子由于不能和TBAA结合,且金属离子本身对聚合物和荧光素的荧光有一定程度的猝灭,因此其FRET信号远低于空白对照。本方法快速、灵敏,几分钟内即可完成检测,常见金属离子均不干扰检测。对湖水中Pb2+的检测限为1 nmol/L,远低于饮用水国家标准中对Pb2+浓度的限量标准。本方法为水中Pb2+的检测提供了一种简便、快速、高效的新方法。
关键词 阳离子型共轭聚合物; 核酸适配体; 铅离子; 荧光共振能量转移
20160105收稿;20160419接受
本文系国家重点基础研究发展计划项目( No. 2012CB933301、2012CB723402)、国家自然科学基金项目(Nos. 21005040、51173080)、"有机与生物光电子学"教育部创新团队(No. IRT1148)、江苏高校优势学科建设工程资助项目、江苏省自然科学基金(BK20141424)、江苏省普通高校研究生科研创新计划项目(CXLX12_0792)及南京邮电大学校科研项目(NY215171)资助
Email: iamxfliu@njupt.edu.cn
1 引 言
铅离子(Pb2+)是一种常见环境污染物,具有很强的毒性,极少量的Pb2+就会对大脑和中枢神经系统造成严重的损害[1]。进入环境中的Pb2+不易降解, 很容易聚积并污染空气、水源和土壤。传统的Pb2+检测方法,如原子吸收光谱[2]、电感耦合等离子体发射光谱[3]、电化学伏安检测[4]等,具有较高的灵敏度,但存在样品预处理复杂或需要昂贵仪器等不足。因此,开发低成本、快速、灵敏的Pb2+检测新方法,实现对环境中Pb2+的快速检测和实时监测,具有重要的实际意义。
核酸适配体是一类DNA或RNA寡聚核苷酸,能特异性识别金属离子[5]、有机小分子[6]、蛋白质[7]、病毒[8]、细菌[9],甚至整个细胞[10]。与传统的识别分子(如抗体)相比,具有易合成、易标记、稳定性好的优点。文献已报道了基于核酸适配体的各种光学、电化学传感器,实现了对Pb2+ [11]、K+ [12]、腺苷三磷酸(ATP)[13]、可卡因[14]、神经毒剂[15]、生长因子[16]、凝血酶[17,18]、细菌[19]及肿瘤细胞[20]等的高灵敏检测。凝血酶的核酸适配体(TBA, 5′GGTTGGTGTGGTTGG3′)为一段富含鸟嘌呤(G)的15个碱基的序列,在凝血酶存在时可形成G四链体结构[21]。TBA也可用于Pb2+的检测[22]。然而,由于该序列含有较多胸腺嘧啶碱基(T),可与Hg2+形成THg2+T发夹结构,从而干扰对目标Pb2+的检测[23]。采用CN、SCN等掩蔽剂结合Hg2+,可以提高对Pb2+检测的选择性。但是,这些掩蔽剂具有较高毒性,很容易污染环境[23,24]。为了解决这个问题,Lu等[23]对TBA序列进行了改进,将其中的4个胸腺嘧啶(T)分别用腺嘌呤(A)代替(TBAA, 5′GGAAGGTGTGGAAGG3′)。由于A不能与Hg2+结合,因此该序列可以特异性结合Pb2+,但不能结合Hg2+,有效降低了Hg2+的干扰。
水溶性共轭聚合物为一类新型的荧光传感材料,具有良好的光捕获能力和荧光发射特性,可作为优良的能量供体,通过与能量受体之间的荧光共振能量转移(FRET),将荧光信号放大几倍至几百倍,大大提高检测的灵敏度[25],已广泛应用于生物传感[26]领域。本研究建立了基于主链含芴的阳离子型聚对芳撑乙炔衍生物与荧光素标记的核酸适配体TBAA之间FRET原理的Pb2+快速检测新方法,实现了对湖水中Pb2+的快速、灵敏、简便检测。检出限为1 nmol/L,大大低于我国《生活饮用水卫生标准》对水中Pb2+的限量要求(< 0.01 mg/L 或48 nmol/L)[27]。
2 实验部分
2.1 仪器与试剂
RF5301PC型荧光光谱仪(日本岛津公司)。荧光素标记的核酸探针TBAA由上海生工生物工程有限公司合成,序列为5′6FAMGGAAGGTGTGGAAGG3′。主链含芴的阳离子型聚对芳撑乙炔衍生物(Poly{[9,9bis(6′(N,N,Ndiethylmethylammonium)hexyl)2,7fluorenyleneethynylene]altco[2,5bis(3′(N,N,Ndiethylmethylammonium)1′oxapropyl)1,4phenylene]tetraiodide}, PFEP)为课题组自行合成[28],浓度用其单体浓度表示。NaCl, KCl, ZnCl2和PbCl2等(分析纯)购自阿拉丁试剂有限公司。缓冲溶液为20 mmol/L TrisHCl, 100 mmol/L NaCl, pH 7.4。实验用水为MilliQ(美国Millipore公司)超纯水(18.2 MΩ cm)。湖水取自江苏省南京市羊山湖,过滤离心后用于检测。
2.2 实验方法
2.2.1 可行性实验 在4 μL,100 nmol/L 的Pb2+和Hg2+溶液中,分别加入4 μL 1 μmol/L TBAA溶液和6 μL 5 μmol/L的PFEP溶液,最后加入缓冲液至总体积为400 μL,混匀后进行荧光测量。激发和发射狭缝宽度均为5 nm,响应时间2 s,电压900 V。激发波长404 nm,发射波长扫描范围410~700 nm。用相同体积的缓冲溶液作为空白样品。
2.2.2 特异性实验 分别取4 μL 1 mol/L的 Li+, Na+, K+, Ca2+, Mg2+溶液; 100 μmol/L的Ba2+, Fe2+, Co2+, Ni2+, Cu2+, Zn2+, Cd2+; 浓度为10 μmol/L的 Hg2+,以及100 nmol/L的Pb2+进行检测。配制不含Pb2+的上述离子的混合溶液,以及含有Pb2+的上述混合离子溶液,分别进行检测。实验条件与2.2.1节相同。
2.2.3 灵敏度实验 取4 μL浓度分别为0.02, 0.1, 0.5, 1.0, 2.0, 4.0, 8.0和10 μmol/L的Pb2+溶液,按照2.2.1节条件进行实验,重复测定3次。
取4 μL 浓度分别为0.02, 0.1, 0.5, 1.0 μmol/L 的Pb2+溶液,各加入4 μL 1.0 μmol/L TBAA溶液,然后加入适量湖水进行检测,其它条件与2.2.1节相同,重复测定3次。
3 结果与讨论
3.1 实验原理
TBAA探针5′端标记了荧光素(FAM),富含鸟嘌呤(G)碱基,在Pb2+存在下可形成G四链体结构。当体系中不存在Pb2+时,TBAA以柔性自由卷曲的单链形式存在。由于DNA带负电荷,共轭聚合物(PFEP)带正电荷,二者可通过静电吸引作用形成复合物,能量供体(PFFP)与受体(FAM)之间发生一定程度的荧光共振能量转移(Low FRET)。当体系中存在Pb2+时,TBAA可形成G四链体结构。这种折叠结构的G四链体比单链DNA具有更高的电荷密度[29]。因此,结合Pb2+后的G四链体与共轭聚合物之间的结合更强,FRET效率显著提高(High FRET)。通过共轭聚合物与不同构象DNA静电结合时产生的FRET信号的不同,可实现对Pb2+的特异性检测。实验原理如图1所示。
3.2 可行性研究
PFEP为一种主链含芴的阳离子型聚对芳撑乙炔衍生物。如图2所示,PFEP的吸收峰位于380 nm, 荧光发射峰位于443和465 nm;FAM的吸收峰位于488 nm,发射峰位于531 nm。因此,PFEP的荧光发射峰与FAM的吸收峰之间具有很好的光谱重叠,在合适的条件下可发生荧光共振能量转移。前期研究[17,30]表明,由于DNA与PFEP聚合物之间强烈的静电吸引作用,使荧光素和聚合物之间距离靠近,二者之间可发生高效的FRET。
以Hg2+溶液为阴性对照,对一定浓度的Pb2+溶液进行检测。与空白样品相比,含金属离子的样品中,PFEP的发射峰发生了约3 nm的蓝移。将荧光光谱图按照440 nm附近的最大荧光强度进行归一化处理,二者发生FRET的信号用531 nm和440 nm处的荧光强度比值(I531/I440)表示。如图3所示,空白样品的I531/I440为0.93;Hg2+样品为0.76,比空白样品降低18%;而Pb2+的FRET信号明显增强,I531/I440为1.46,比空白样品增加57%。从图3A可见,与空白样品相比,含有Hg2+ 和Pb2+的体系中,PFEP位于443 nm的主发射峰有一定程度的展宽,465 nm处的次发射峰明显增强,这可能是由于金属阳离子增强了DNA与聚合物之间的相互作用。此外,含有Hg2+的样品的发射光谱蓝移了3 nm,这是由于PFEP与G四链体的结合引起的。Hg2+溶液的FRET信号低于空白组的信号,这可能是由于金属离子对PFEP的荧光有一定程度的猝灭[31~33]。
3.3 特异性研究
实际样品中常含有各种离子,为了研究离子是否会影响体系的荧光,进而影响Pb2+的检测,首先分析了3组不同浓度共13种常见金属离子对PFEP和荧光素的荧光猝灭作用。第一组为Li+, Na+, K+, Ca2+和Mg2+,浓度各为10 mmol/L;第二组为Ba2+, Fe2+, Co2+, Ni2+, Cu2+, Zn2+和Cd2+,浓度各为1.0 μmol/L; 第三组为Hg2+和Pb2+,浓度为100 nmol/L。研究表明,各种金属离子本身对PFEP和荧光素的荧光都有一定程度的猝灭作用。其中,各种离子对荧光素的猝灭程度约为2%~18%,Pb2+的猝灭程度为13%。各种离子对PFEP荧光的猝灭稍强,猝灭程度为16%~38%,Pb2+的猝灭最小,为16%。这可能是对照样品的FRET信号低于空白样品的原因。
为评价方法的特异性,将上述浓度的13种金属离子,与1 nmol/L Pb2+样品的检测结果进行比较,结果如图4A所示。Pb2+的I531/I440平均值为1.66,明显高于空白样品;而其它对照离子的FRET信号(I531/I440 =0.30~0.54)均明显低于空白组(I531/I440=1.0)。一方面是由于除Pb2+以外的其它离子均不能和TBAA形成G四链体;另一方面是由于各种金属离子本身对PFEP和荧光素的荧光的猝灭作用,致使PFEP和荧光素的荧光都比无金属离子时低,因而能量转移效率也降低。对由上述离子构成的混合体系(Mix,离子种类及浓度与上述相同)及含Pb2+(1.0 nmol/L)的混合体系进行了检测,结果如图4B所示。Mix样品的FRET信号低于空白样品和含有Pb2+的样品,并且含有Pb2+的混合体系(Mix+Pb2+)产生的信号略低于相同浓度的单独的Pb2+的检测信号(降低了8.7%)。可见,虽然其它金属离子对体系的荧光有一定程度的猝灭作用,但并不影响对复杂体系中Pb2+的检测,本方法检测Pb2+具有较好的选择性。
3.4 传感器的分析性能
不同浓度Pb2+(0, 0.2, 1.0, 5.0, 10, 20, 40, 80和100 nmol/L)的荧光响应曲线如图5A和5B所示。归一化的荧光光谱图(图5A)显示,随着Pb2+浓度增加,FRET信号逐渐增强。当Pb2+浓度大于80 nmol/L时,FRET信号基本趋于稳定;在1~20 nmol/L范围内,Pb2+浓度与FRET信号具有较好的线性关系(R2=0.978),检出限为 0.2 nmol/L(3σ)。为进一步研究本方法对复杂体系中Pb2+的检测性能,以湖水(经原子吸收光谱测定,未检出Pb2+)为基质,对不同浓度Pb2+(0, 0.2, 1.0, 5.0和10 nmol/L)进行检测,如图5C和5D所示。随着Pb2+浓度增加,FRET信号呈线性增加。对湖水中Pb2+的检出限为1 nmol/L(3σ)。上述结果表明,本方法可用于实际水体系中Pb2+的定量检测。
将本研究结果与文献报道的几种基于共轭聚合物或TBA探针的荧光传感器综合性能进行了比较,如表1所示。基于Pb2+本身对共轭聚合物荧光猝灭作用的传感器,通常使用特殊结构的共轭聚合物(如含冠醚基团的聚合物)[34~37],检测Pb2+时具有高特异性,Hg2+的干扰很小,但是灵敏度普遍不高。基于富G的TBA探针的荧光传感器[5,22,38]具有较高的灵敏度,但Hg2+对检测有干扰, 本研究建立的以TBAA为识别探针,通过与共轭聚合物之间的FRET实现信号放大的光学检测方法,不仅可实现快速(几分钟)检测,而且具有很高的选择性和灵敏度。对湖水中Pb2+的检出限可达1 nmol/L,远低于饮用水国家标准[27]对Pb2+的限量水平(<0.01 mg/L或<48 nmol/L),可以满足日常检测的需要。
4 结 论
建立了基于主链含芴的阳离子型聚对芳撑乙炔衍生物PFEP和核酸适配体的Pb2+检测新方法,利用只含2个T的核酸适配体序列TBAA,有效降低了Hg2+对Pb2+检测的干扰。其它常见金属离子对检测基本无干扰。利用PFEP和荧光染料之间的荧光共振能量转移,大大提高了检测的灵敏度,对湖水中Pb2+的检出限可达1 nmol/L, 有望为各种水源中Pb2+的检测提供一种快速、简便、灵敏的新方法。
References
1 LIU ZhongHui, WANG FengShan. Journal of Environment and Health, 2007, 24(2): 122-123
刘忠慧, 王凤山. 环境与健康杂志, 2007, 24(2): 122-123
2 SONG DiShen, HE HaiYan, HE ZhiJian, CUI ShuYa, DU JunLiang. Chinese Journal of Analysis Laboratory, 2015, 34(8): 944-946
宋迪燊, 何海艳, 何志坚, 崔书亚, 杜军良. 分析试验室, 2015, 34(8): 944-946
3 WANG XiaoHui, ZHANG YuLing, LIU Na, WANG Lin. Chinese Journal of Spectroscopy Laboratory, 2008, 25(6): 1183-1187
王晓晖, 张玉玲, 刘 娜, 王 琳. 光谱实验室, 2008, 25(6): 1183-1187
4 Tang S, Tong P, Li H, Tang J, Zhang L. Biosens. Bioelectron., 2013, 42: 608-611
5 Liu C W, Huang C C, Chang H T. Anal. Chem., 2009, 81(6): 2383-2387
6 Song W, Zhang Q, Xie X, Zhang S. Biosens. Bioelectron., 2014, 61: 51-56
7 Pavlov V, Xiao Y, Shlyahovsky B, Willner I. J. Am. Chem. Soc., 2004, 126(38): 11768-11769
8 Liang H R, Hu G Q, Xue X H, Li L, Zheng X X, Gao Y W, Yang S T, Xia X Z. Virus Res., 2014, 184: 7-13
9 Kim Y S, Song M Y, Jurng J, Kim B C. Anal. Biochem., 2013, 436(1): 22-28
10 Cao H Y, Yuan A H, Shi X S, Chen W, Miao Y. Oncol. Rep., 2014, 32(5): 2054-2060
11 WEI XiaoPing, YANG Feng, DING Fan, LI JianPing. Chinese J. Anal. Chem., 2014, 42(7): 942-947
魏小平, 杨 峰, 丁 璠, 李建平. 分析化学, 2014, 42(7): 942-947
12 Nguygen B L, Jeong J E, Jung I H, Kim B, Le V S, Kim I, Kyhm K, Woo H Y. Adv. Funct. Mater., 2014, 24(12): 1748-1757
13 Song Q W, Peng M S, Wang L, He D C, Ouyang J. Biosens. Bioelectron., 2016, 77: 237-241
14 Neves Miguel A D, Blaszykowski C, Thompson M. Anal. Chem., 2016, 88(6): 3098-3106
15 LIU ZhiWei, TONG ZhaoYang, HAO LanQun, LIU Bing, MU XiHui, ZHANG JinPing, GAO Chuan. Chinese J. Anal. Chem., 2014, 42 (8): 1143-1148
刘志伟, 童朝阳, 郝兰群, 刘 冰, 穆晞惠, 张金平, 高 川. 分析化学, 2014, 42 (8): 1143-1148
16 LI Xia, TAN Hui, LI YunLei, WU ZhaoYang, SHEN GuoLi, YU RuQin. Chinese J. Anal. Chem., 2014, 42 (5): 629-635
李 霞, 谭 慧, 李云磊, 吴朝阳, 沈国励, 俞汝勤. 分析化学, 2014, 42 (5): 629-635
17 Liu X F, Shi L, Hua X X, Huang Y Q, Su S, Fan Q L, Wang L H, Huang W. ACS Appl. Mater. Inter., 2014, 6(5): 3406-3412
18 ZHANG SongBai, ZHENG LiYing, HU Xia, SHEN GuangYu, LIU XueWen, SHEN GuoLi, YU RuQin. Chinese J. Anal. Chem., 2015, 43 (11): 1688-1694
张松柏, 郑丽英, 胡 霞, 沈广宇, 刘学文, 沈国励, 俞汝勤. 分析化学, 2015, 43 (11): 1688-1694
19 Kim Y S, Chung J, Song M Y, Jurng J, Kim B C. Biosens. Bioelectron., 2014, 54: 195-198
20 Qu L, Xu J, Tan X, Liu Z, Xu L, Peng R. Acs Appl. Mater. Inter., 2014, 6(10): 7309-7315
21 Satoru N, Takahiko N, Elzbieta G, Bernard J, Shigeori T. Chembiochem, 2006, 7(11): 1730-1737
22 Zhang D, Yin L, Meng Z, Yu A, Guo L, Wang H. Anal. Chim. Acta, 2014, 812: 161-167
23 Lu Y, Li X, Wang G, Tang W. Biosens. Bioelectron., 2013, 39(1): 231-235
24 Li X, Wang G, Ding X, Chen Y, Gou Y, Lu Y. Phys. Chem. Chem. Phys., 2013, 15(31): 12800-12804
25 Duan X, Liu L, Feng F, Wang S. Accounts Chem. Res., 2010, 43(2): 260-270
26 Feng X, Liu L, Wang S, Zhu D. Chem. Soc. Rev., 2010, 39(7): 2411-2419
27 GB 57492006, Standards for drinking water quality. National Standards of the People′s Republic of China
生活饮用水卫生标准, 中华人民共和国国家标准. GB 57492006
28 Huang YQ, Fan Q L, Zhang G W, Chen Y, Lu X M, Huang W. Polymer, 2006, 47(15): 5233-5238
29 He F, Tang Y, Wang S, Li Y, Zhu D. J. Am. Chem. Soc., 2005, 127(35): 12343-12346
30 Liu X F, Ouyang L, Huang Y, Feng X, Fan Q, Huang W. Polym. Chem., 2012, 3(3): 703-709
31 Chen Y, Pu K Y, Fan Q L, Qi X Y, Huang Y Q, Lu X M, Huang W. J. Polym. Sci. Poly. Chem., 2009, 47(19): 5057-5067
32 Laurenti M, Blanco F G, LopezCabarcos E, RubioRetama J. Polym. Int., 2013, 62(5): 811-816
33 Chen Y, Fan Q L, Wang P, Zhang B, Huang Y Q, Zhang G W, Lu X M, Chan H S O, Huang W. Polymer, 2006, 47(15): 5228-5232
34 Wu Y, Tan Y, Wu J, Chen S, Chen Y Z, Zhou X, Jiang Y, Tan C. ACS Appl. Mater. Inter., 2015, 7(12): 6882-6888
35 Saha S K, Ghosh K R, Gao J, Wang Z. Macromol. Rapid Comm., 2014, 35(18): 1592-1954
36 Lee K M, Chen X, Fang W, Kim J M, Yoon J. Macromol. Rapid Comm., 2011, 32(6): 497-500
37 Yu M, He F, Tang Y, Wang S, Li Y, Zhu D. Macromol. Rapid Comm., 2007, 28(12): 1333-1338
38 Cheng S, Zheng B, Wang M Z, Ge X W, Zhao Q, Liu W, LAM M H W. Biosens. Bioelectron., 2014, 53: 479-485
Abstract A sensitive method for Pb2+ detection based on a cationic conjugated polymer and aptamer was established. By selecting a more specific aptamer probe, the interference of Pb2+ detection from Hg2+ was eliminated remarkably. The probe for Pb2+ recognition and combination is a single stranded oligonucleotide labeled with fluorescein (TBAA, 5′6FAMGGAAGGTGTGGAAGG3′). When combining with Pb2+ with high specificity, the random coiled probe changed to a Gquadruplex with higher charge density, which enhanced the electrostatic interactions between the oligonucleotide and cationic conjugated polymer, thus the two fluorophores were in more close proximity, leading to a significantly increased fluorescence resonance energy transfer (FRET) signal. However, other nontarget metal ions produced much lower FRET signals because they could not combine with the probe and thus quenched the fluorescence of the conjugated polymer and fluorescein. This method was rapid, highly specific and sensitive, and the common metal ions including Li+, Na+, K+, Ca2+, Mg2+, Ba2+, Fe2+, Co2+, Ni2+, Cu2+, Zn2+, Cd2+ and Hg2+ exhibited no influence on the detection of Pb2+ . The limit of detection for Pb2+ in lake water was estimated to be 1 nmol/L (3σ), which was far below the maximum permitted level of Pb2+ in drink water regulated by the national standard for drinking water quality. Therefore, this FRETbased method provides a new simple, rapid, and efficient method for detection of Pb2+ in various source of water.
Keywords Cationic conjugated polymer; Aptamer; Lead ion ; Fluorescence resonance energy transfer

