栀子种子萌发过程中的生理生化变化
董艳凯++朱玉野++龚雨虹++胡燕珍++罗光明
摘要:在实验室条件下,对不同萌发阶段的栀子(Gardenia jasminoides Ellis)种子进行可溶性糖、粗脂肪、淀粉、可溶性蛋白、游离氨基酸含量等生理指标的动态变化测定,以探讨栀子种子的萌发机制。结果表明,栀子种子萌发过程中粗脂肪首先被分解利用,其转化为其他营养物质;随后可溶性糖、淀粉、游离氨基酸等营养物质在相关酶的作用下逐步分解,为胚的生长提供氮源、碳源和能量;蛋白质最后被动员。试验发现种子中的氨基酸存在2个大量积累的阶段,可能是为后期的组织生长、生化反应准备基础物质。因而确定,粗脂肪的分解为栀子种子萌发的标志。
关键词:栀子(Gardenia jasminoides Ellis);种子;生理;萌发机制
中图分类号:S567.7+9.1 文献标识码:A 文章编号:0439-8114(2016)18-4726-04
DOI:10.14088/j.cnki.issn0439-8114.2016.18.025
中药栀子来源于茜草科(Rubiaceae)栀子属(Gardenia Ellis)植物栀子(Gardenia jasminoides Ellis)的干燥成熟果实,其性寒味苦,归心肺三焦经;具有泄火除烦、清热利尿、凉血解毒之功效;用于黄疸尿赤、血淋涩痛、尿血崩漏等病征[1]。栀子属植物广泛分布于热带及亚热带地区。中国主要分布在长江以南各地,主产于江西、四川、湖北、福建、湖南、广西、广东等省(自治区)。现代药理研究证明,栀子的主要活性成分为黄酮类栀子素、三萜类化合物藏红花素、藏红花酸及α-藏红花甙元、环烯醚萜甙类栀子甙、异栀子甙、去羟栀子甙、山栀子甙等[2]。现在国内外市场对于栀子的需求量很大,且不断上升,具有很好的市场前景[3],所以栀子的栽培面积在不断扩大[4]。但栽培栀子的药材品质不稳定,而且品种混杂,田间管理粗放,从而使药材的质量存在隐患。种子萌发是植物源药材生长的开始,是控制药材质量的关键环节,只有培育出良好的种苗才能获得优质的药材。栀子种子的发芽期为20 d左右,由于发芽缓慢,容易导致出苗不齐、出现缺苗现象,严重制约了栀子的生产,因此栀子优良种苗的培育问题亟待解决。试验以不同萌发阶段的栀子种子为材料,探讨了栀子种子萌发过程中可溶性糖、粗脂肪、游离氨基酸、可溶性蛋白、淀粉含量的变化,从植物生理的角度分析栀子种子对生长环境的适应性,以期为弄清栀子种子萌发的生理适应机制提供依据。
1 材料与方法
1.1 材料
1.1.1 植物材料及处理 2014年11月在江西省樟树市采集成熟的栀子种子,除去外果皮和果肉后,将种子漂洗干净,晾干后选取健康饱满的种子,放入密封袋内带回实验室。在实验室里将栀子种子于25 ℃恒温环境里浸种1 d;采用滤纸作为发芽床,30 ℃恒温无光照环境进行发芽试验。从置床开始,分别取出不同萌发阶段(干种子、吸胀、露白、伸长、变绿、长根、长叶)的适量种子样品用于各项生理指标(可溶性糖、粗脂肪、游离氨基酸、可溶性蛋白、淀粉含量)的测定。
1.1.2 试剂和仪器 试剂主要有蒽酮、抗坏血酸、苯胼戊三酮、L-亮氨酸、氢氧化钠、高氯酸、葡萄糖、无水乙醇、无水乙醚;仪器主要是BP211D电子天平(德国赛多利斯集团公司,感量0.000 1)、KQ3200超声波清洗器(昆山超声仪器厂)、YF-111B高速中药粉碎机(瑞安市永历制药机械有限公司)、GZX-9146MBE型数显鼓风干燥箱(上海博讯实业有限公司)、HH-2数显恒温水浴锅(国华电器有限公司)、UV-1800紫外可见分光光度计(日本岛津公司)、LRH-250-Z振荡培养箱(广东省医疗器械厂)以及培养皿(9 cm×3 cm)、滤纸等。
1.2 测定方法
1.2.1 可溶性糖含量测定 采用蒽酮比色法[5]来测定栀子种子的可溶性糖含量,称取新鲜种子样品0.5 g,放入研钵中,研磨匀浆,转移至50 mL烧杯中,去离子水少量多次洗涤研钵,合并洗涤液,用塑料膜封口,在沸水中提取30 min。待冷却后,将提取液转移到100 mL容量瓶中定容,用移液管吸取可溶性糖提取液1 mL放入具塞试管中,重复3次,加入5 mL 0.1%蒽酮试剂。摇匀后放入沸水中计时10 min,流动水冷却20 min。以空白为对照,用紫外可见分光光度计在620 nm波长处测其吸光度,通过葡萄糖标准曲线的回归方程(文中省略)计算糖含量,再利用公式计算样品的可溶性糖含量。
样品可溶性糖含量=C×V/(a×W×1 000)×100%,
式中,C为用葡萄糖标准曲线的回归方程所求出的糖含量(mg),a是测定时所加入的提取液体积(mL),V为提取液的总体积(mL),W是所测样品的鲜重(g)。
1.2.2 淀粉含量测定 采用高氯酸法测定栀子种子的淀粉含量,将提取可溶性糖剩余的残渣转移至50 mL烧杯中,加去离子水20 mL,沸水浴15 min之后加入9.2 mol/L高氯酸,沸水浴15 min,过滤至50 mL容量瓶中,定容,摇匀,即淀粉提取液。吸取淀粉提取液1 mL,转至具塞试管中,分别加5 mL葸酮试剂,沸水浴10 min,流动水冷却20 min,以去离子水为对照,重复3次。于620 nm波长处测其吸光度,根据葡萄糖标准曲线的回归方程计算糖含量,再利用公式计算样品的淀粉含量。
样品淀粉含量=[(C×V/A)/(W×1 000)]×100%×0.9,
式中,C为用葡萄糖标准曲线的回归方程求出的糖含量(mg),A为吸取样品液的体积(mL),V是提取液的总体积(mL),W是所测样品的鲜重(g)。
1.2.3 粗脂肪含量测定 用索氏提取法[6]测定栀子种子中粗脂肪的含量,取称过重(W1)且烘干的脱脂滤纸,再称取适量的栀子种子,严密包裹于滤纸中。包裹的样品在105 ℃烘2 h后干燥,称重(W2),烘干后的种子尽量保持在0.1 g,然后放在索氏提取器的承受瓶中,加入100 mL乙醚,置于50 ℃水浴中反复抽提8 h。待脂肪提取完后,取出滤包并在105 ℃下烘1.5 h,使乙醚完全挥发,再放入干燥器冷却,称重(W3),至恒重。该测定重复3次。利用公式计算样品的粗脂肪含量。
样品粗脂肪含量=(W2-W3)/(W2-W1)×100%。
1.2.4 可溶性蛋白含量测定 采用考马斯亮蓝法[7]测定栀子种子的可溶性蛋白含量,称取栀子种子样品0.5 g,置于研钵中,用4 mL去离子水匀浆研磨,转移到离心管中,再用适量去离子水清洗研钵,合并洗液转移至离心管,10 000 r/min离心10 min,取上清液定容至50 mL。再取1.0 mL稀释液转移至具塞试管中,加入5 mL考马斯亮蓝G-250液,充分混合,放置2 min后在595 nm处测其吸光度,通过g-球蛋白标准曲线的回归方程(文中省略)计算蛋白质含量,再利用公式计算样品的可溶性蛋白含量。
样品可溶性蛋白含量=[C×Vt/Vs×Wf×1 000]×100%,
式中,C为用g-球蛋白标准曲线的回归方程求出的蛋白质含量(mg),Vt为提取液体积(mL),Wf为样品的鲜重(g),Vs为测定时加入的提取液体积(mL)。
1.2.5 游离氨基酸含量测定 采用茚三酮比色法[8]测定栀子种子的游离氨基酸含量,精密称取栀子种子样品0.1 g于研钵中,加入5 mL 95%乙醇匀浆研磨,用适量95%乙醇少量多次洗涤研钵,合并清洗液,定容至25 mL,70 ℃保温30 min后过滤,用95%乙醇补充减少的体积。取滤液1 mL,加3 mL 0.1%茚三酮和0.1 mL 0.1%抗坏血酸,沸水浴15 min后冷却至室温,于580 nm处测其吸光度,通过g-球蛋白标准曲线的回归方程计算蛋白质含量,再利用公式计算样品的游离氨基酸含量。
样品游离氨基酸含量=[C×Vt/Vs×Wf]×100%,
式中,C为用g-球蛋白标准曲线的回归方程求出的蛋白质含量(mg),Vt为提取液总体积(mL),Wf为样品的鲜重(g),Vs为测定时加入的提取液体积(mL)。
2 结果与分析
2.1 可溶性糖含量的变化
可溶性糖是种子发芽生长的物质基础,在种子的萌发过程中,可溶性糖既可以被分解以提供能量,又可以转化为其他物质为细胞的生长提供原料;栀子种子萌发阶段可溶性糖含量的测定情况见图1。由图1可知,在栀子种子萌发过程中,可溶性糖的含量发生了明显的变化,不同萌发阶段其可溶性糖含量呈升高-降低-升高-降低-升高的变化,整体呈曲线上升趋势。具体来看,由萌发前到长叶阶段整个萌发期可溶性糖含量增加了0.308个百分点,其中以生根阶段的可溶性糖含量最低,为0.230%;在吸胀阶段含量达到最高,为1.301%,这一阶段可溶性糖的含量变化最大;之后的各阶段可溶性糖含量均低于吸胀阶段,并且在露白、变绿阶段又出现明显下滑,含量分别为0.721%、0.736%,产生的原因可能是在种子萌发的初始阶段,随着吸胀过程的进程,种子内发生了一系列复杂的生理生化变化,酶的活性增强,贮藏物质在酶的作用下被分解为简单的小分子化合物,从而使可溶性糖含量增加;而在后面的一系列萌发阶段里,可溶性糖多已被利用,用以合成或转化为其他物质,如为蛋白质合成提供碳骨架和ATP的合成提供底物,并为种子的萌发和幼苗生长提供能量,从而导致可溶性糖含量降低[7]。当种子长根后,或者进一步有侧根生成时,种子内部的物质代谢可以自给自足,因此在后面长叶阶段里,可溶性糖含量又呈现升高的趋势。
2.2 淀粉含量的变化
淀粉是种子内的大分子物质,是最重要和分布最广泛的碳水化合物与营养物质,在种子成熟后就作为营养物质而贮存于种子内;也可以在萌发过程中,通过自身的代谢、利用可溶性糖或其他营养物转化而来。种子萌发时,淀粉在淀粉酶的作用下降解为小分子量的可溶性物质,同时释放出大量的能量供胚吸收利用,所以其含量的变化是种子代谢状况的重要指标。栀子种子萌发阶段淀粉含量的测定情况见图2。由图2可知,栀子种子的淀粉含量很低,干种子仅为0.000 54%;在吸胀阶段显著增加,且淀粉含量达到最大,为0.001 35%,增加了0.000 81个百分点,此变化表明栀子种子萌发初期淀粉的代谢水平增强,可能是其他营养物质降解后转化为淀粉所致;之后的露白阶段种子里淀粉含量急剧减少,为0.000 37%;但此后淀粉代谢又增强,原贮藏的淀粉被水解为可溶性的碳水化合物供胚生长所用;随着胚芽的生长伸长,淀粉的含量缓慢回升;之后又缓慢下降,至生根阶段降至最低,为0.000 08%,说明淀粉被分解代谢后转化为小分子量简单的营养物质,并运转到生长部位,作为构成新组织的成分和产生能量的原料了。
2.3 粗脂肪含量的变化
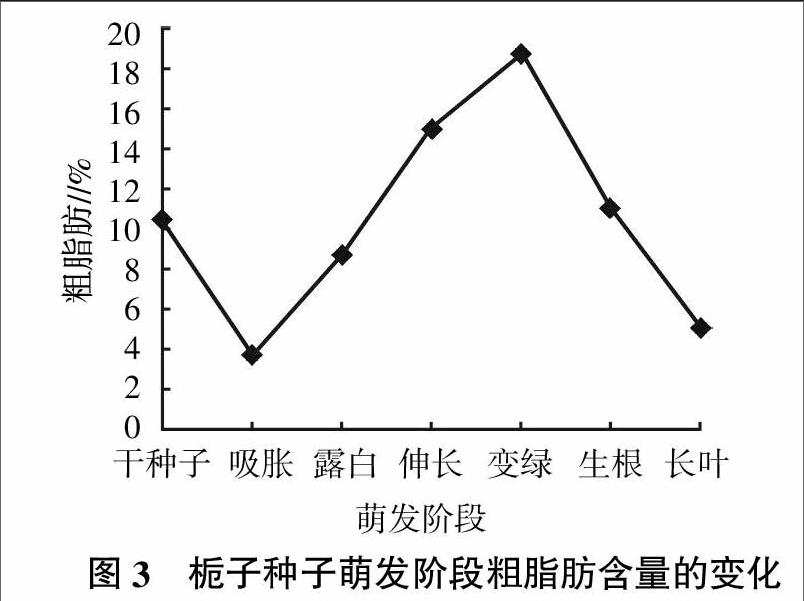
脂肪是种子主要的贮藏营养物质之一,它与糖和蛋白质共同构成细胞的组成物质;栀子种子萌发阶段粗脂肪含量的测定情况见图3。由图3可知,栀子种子内贮藏的粗脂肪含量较高,为10.54%,这应该是其种子生长所需能量的重要来源。随着种子的萌发进程,粗脂肪含量呈现降低-升高-降低的变化,在吸胀阶段粗脂肪含量大幅减少,为3.79%,可能是在脂肪酶的作用下转化成小分子量物质的缘故,从而为胚根的生长提供物质保障和能量需求;以后随着胚继续生长,粗脂肪含量呈不断升高,到达变绿阶段时含量达到最大,为18.75%,个中原因可能是可溶性糖和淀粉转化为粗脂肪造成的;再以后粗脂肪含量不断下降,至长叶阶段降至5.07%,说明随着胚芽的不断伸长,种子内部代谢活动也越加旺盛,且组织不断分化,胚需要更多的能量、营养来供其生长;贮藏的粗脂肪可被分解为脂肪酸和甘油,然后运输到生长部位,形成新的结构物质和为呼吸作用提供能量,既可通过乙醛酸循环转化为糖,又可作为呼吸基质被消耗掉,所以粗脂肪是种子萌发过程里重要的营养物质与能量来源。
2.4 可溶性蛋白含量的变化
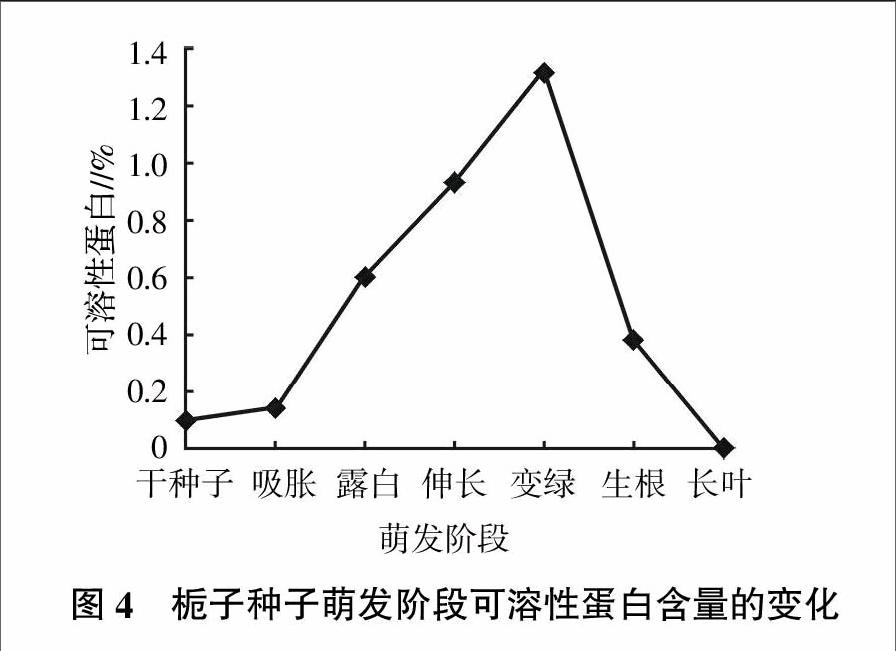
蛋白质也是种子内贮藏的重要营养物质,在种子萌发时蛋白质可水解产生氨基酸,用于新蛋白质的合成,从而为种子萌发和幼苗的生长提供氮素营养;同时可溶性蛋白含量的提高,还会增加细胞的渗透浓度和功能蛋白的数量,有助于维持细胞的正常代谢。栀子种子萌发阶段可溶性蛋白含量的测定情况见图4。由图4可知,在栀子种子萌发过程中,可溶性蛋白含量呈现升高-降低的变化,其中在干种子中的含量仅为0.098%,而在变绿阶段含量达到1.320%,升高了1.222个百分点,可能原因是胚乳的生理活动尚未加强,代谢水平弱,胚细胞伸长所需的养料和能量需求较少,贮藏蛋白开始降解,加之部分淀粉和可溶性糖转化为蛋白质,使蛋白质的含量急剧增加。此后含量迅速下降,至长叶阶段含量最低,为0.002%,比干种子含量还低了0.096个百分点。这反映出长叶阶段种子内的代谢活动较强,不断伸长的胚根和后期的组织分化、长出叶片等对可溶性蛋白的需求迅速增加,促使贮藏蛋白大量水解,而根系此时还不能从土壤中吸收新的氮元素来补充所致。
2.5 游离氨基酸含量的变化
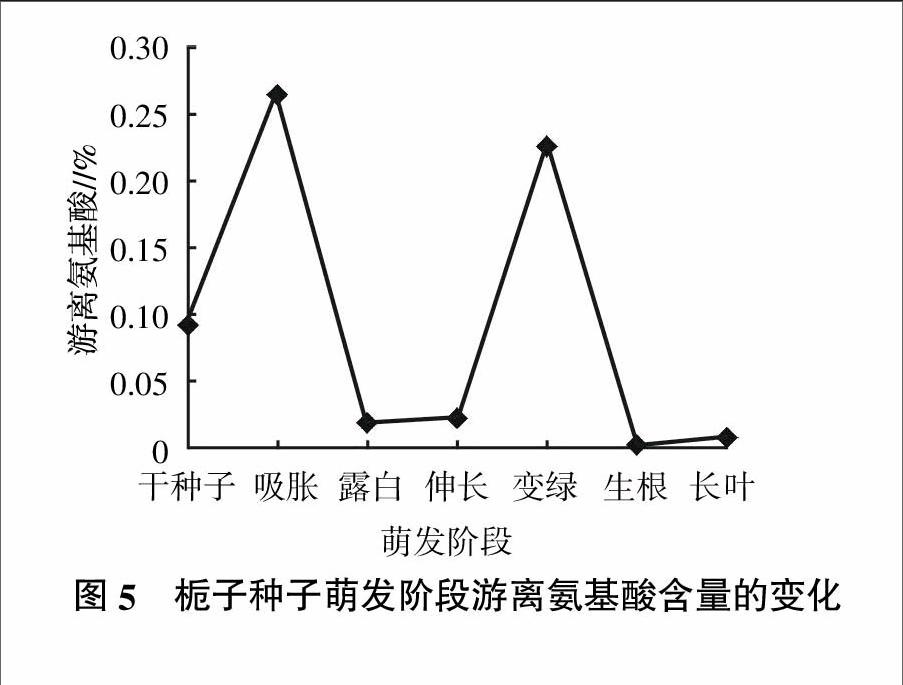
氨基酸是生物机体的众多生物活性物质之一,是构建细胞、修复组织的基础材料;氨基酸对植物的营养贡献不只是提供氮源,还对植物的生理代谢产生不可低估的影响,如氨基酸具有减轻环境重金属离子对植物的毒害作用;栀子种子萌发阶段游离氨基酸含量的测定情况见图5。由图5可知,栀子种子在不同的萌发阶段游离氨基酸的含量变化十分明显,如在干种子时含量为0.092 5%,而到了吸胀阶段则含量最高,为0.265 0%,升高了0.172 5个百分点;但到露白阶段,游离氨基酸含量又急剧下降,变为0.019 8%,而此时的可溶性蛋白含量呈明显增加的趋势,有可能是游离氨基酸被用来合成了蛋白质缘故,并且至伸长阶段仍然很低;不过到变绿阶段急剧升高,为0.226 0%,此时种子内部的淀粉和可溶性糖的含量都有所降低,极有可能是转化为游离氨基酸的缘故;到生根阶段又降到低位,并且是整个种子萌发阶段里最低的水平,游离氨基酸含量只有0.002 6%,此时种子内部物质代谢旺盛,胚根和叶片的生长都消耗了大量的氨基酸;之后至长叶阶段含量才略有上升,此时可溶性蛋白的含量不断下降,可能有部分蛋白质被水解而补充了氨基酸缘故。
3 小结与讨论
种子内的淀粉、粗脂肪、可溶性糖含量的变化反映了种子内可利用态物质和能量的供应基础水平[9],而可溶性蛋白有一部分是参与各种代谢的酶类,其含量的变化是了解植物代谢状况的一个重要指标[10]。测定植物体内游离氨基酸含量对研究植物在不同条件下及不同生长发育时期氮代谢的变化以及植物对氮素的吸收、运输、同化及营养状况等都有着重要意义。植物体内的生理指标反映了植物的生存状态,不同环境因素对这些指标有着不同的影响,通过对这些指标的探讨,可以推断体内多种生理反应的机制[11]。试验结果表明,栀子种子萌发过程中,随着种子吸水量的增加,各种酶被激活,粗脂肪首先被分解利用,转化为其他营养物质,随后可溶性糖、淀粉、游离氨基酸等营养物质在相关酶的作用下也逐步分解,为胚的生长提供氮源、碳源和能量,蛋白质最后被动员。它们在植物种子内的分布与变化反映了植物种子萌发阶段营养物质的运转情况,而且在种子萌发阶段中起着重要的调控作用[12]。其中氨基酸存在2个大量积累的阶段,可能是为后期的组织生长准备物质基础;而粗脂肪的分解可视为种子萌发的标志。
参考文献:
[1] 倪慧艳,张朝晖,傅海珍.中药栀子的研究与开发概述[J].中国中药杂志,2006,31(7):538-541.
[2] 董丽华,邹 红,朱玉野,等.不同产地栀子种子萌发特性研究[J].种子,2014,33(10):1-4.
[3] 罗光明,董艳凯,朱玉野,等.不同产地栀子种子同工酶比较[J].江苏农业科学,2015,43(8):244-247.
[4] 罗光明,董艳凯,王晓云,等.栀子种子质量标准研究[J].湖北农业科学,2014,53(19):4628-4631.
[5] 宋松泉.种子生物学研究指南[M].北京:科学出版社,2005.
[6] 李仕飞,刘世同,周建平,等.分光光度法测定植物过氧化氢酶活性的研究[J].安徽农学通报,2007,13(2):72-73.
[7] 张立军,樊金娟.植物生理学试验教程[M].北京:中国农业大学出版社,2007.
[8] 李合生.植物生理生化实验原理与技术[M].北京:高等教育出版社,2000.
[9] 林 琼,黄 华,李 辉,等.凤仙花种子萌发过程中的生理生化变化[J].贵州农业科学,2009,37(6):48-50.
[10] 彭方仁,郭 娟,徐柏森,等.木本植物营养贮藏蛋白质研究进展[J].植物学通报,2001,18(4):445-450.
[11] 吴能表,王图锦.萝卜种子萌发过程中部分生理指标的动态变化[J].西南师范大学学报(自然科学版),2006,31(6):117-120.
[12] 董晓红,万清林,徐 娜.胡萝卜种子萌发过程中生理生化变化的研究[J].生物技术,2005,15(6):55-57.

