外源NO供体SNP对冬季温室芹菜生长及硝酸盐含量的影响
冯雪++于泽娟++刘艳双++张召++张一名++孙艳香


摘要:在冬季温室条件下,分别对种子萌发期、幼苗期和快速生长期的芹菜(Apium graveolens L.)喷施0、20、50、100、200 μmol/L的外源一氧化氮(NO)供体硝普钠(SNP)溶液,测定种子萌发率、单株株高和重量、根系发育以及叶片中叶绿素、硝酸盐和亚硝酸盐含量等指标。结果表明,喷施SNP 100 μmol/L处理可促进芹菜种子萌发,加快幼苗期植株生长,提高幼苗生长量和叶片叶绿素含量;在快速生长期喷施SNP,除200 μmol/L处理显著降低了植株株高和叶绿素含量外,其他浓度处理对生长量和叶绿素含量未产生显著影响;低浓度SNP增加了芹菜的侧根数目,改变了根系结构;利用HLPC法测定芹菜叶片中硝酸盐和亚硝酸盐含量的结果显示,外源SNP不会对芹菜叶片中硝酸盐和亚硝酸盐的累积产生显著影响。NO对芹菜生长发育的影响具有阶段特异性和组织特异性,适合于在其形态建成的早期应用;NO作为一种含氮的信号分子,不会改变芹菜与硝酸盐含量相关的食用品质。
关键词:芹菜(Apium graveolens L.);一氧化氮(NO);生长量;硝酸盐;亚硝酸盐
中图分类号:S636.3+8 文献标识码:A 文章编号:0439-8114(2016)18-4717-05
DOI:10.14088/j.cnki.issn0439-8114.2016.18.023
芹菜(Apium graveolens L.)是伞形科(Umbelliferae)芹属(Apium L.)一、二年生草本植物,因其具有重要的保健作用和药理功效而在蔬菜产业中被广泛周年种植。北方冬季芹菜生产需在相对密闭的温室中完成,而温室中湿度大、温度高、光照弱、通风不良的生长条件通常会减缓芹菜的生长,影响产量和生长周期,进而降低生产效益。为此,采取有效的农艺措施提高温室栽培条件下芹菜的产量是其生产中的重要研究内容。一氧化氮(NO)是广泛存在于生物体内的一种易扩散的生物活性分子,也是一种重要的氧化还原信号分子,在植物体内调控种子的萌发、根系形态建成和花器官发生等诸多生长发育过程,同时也调节气孔运动,参与植物对多种生物胁迫和非生物胁迫的应答响应[1]。Leshem等[2]最早报道了NO可调控豌豆的生长和发育;Uchida等[3]发现用NO预处理可提高水稻幼苗在高热和高盐胁迫下的存活能力;马向丽等[4]检测到外源NO供体硝普钠(Sodium nitroprusside,简称SNP)可通过增加黑麦草体内多种过氧化物酶的含量,减缓细胞质膜相对透性的增加,从而减少低温对黑麦草的损伤,其中SNP用量在0.5 mmol/L时效果最显著;此外,Esim等[5]指出外源NO也可通过激活小麦的抗氧化系统而提高小麦的耐低温胁迫能力。在蔬菜生产中,王文等[6]利用外源NO来缓解因连作而导致的苯丙烯酸胁迫对黄瓜植株的伤害。然而,外源NO对绿色茎叶类蔬菜生长发育的影响还鲜有报道。
硝酸盐及亚硝酸盐对生态环境和人体健康的影响已引起人们的普遍关注,人体摄入的硝酸盐有81.2%来自蔬菜,绿色茎叶类蔬菜属易富集硝酸盐的作物[7],因此硝酸盐、亚硝酸盐含量的控制是蔬菜生产中的重要课题。NO作为植物体内重要的含氮类气体信号分子,除主要通过精氨酸依赖的NO合成酶(Nitric oxide synthases,NOS)途径进行合成外,亚硝酸盐依赖的硝酸还原酶(Nitrate reductase,NR)途径也是主要来源[8],由此可见,植物体中内源NO的合成与其体内硝酸盐、亚硝酸盐含量存在密切关系。外源施加NO是否会对植物体内硝酸盐、亚硝酸盐含量产生影响这在国内尚未见报道。为此,试验于温室栽培条件下,分别在芹菜种子萌发期、幼苗期和快速生长期喷施外源NO供体SNP,并测定芹菜生长发育以及收获时植株体内的硝酸盐、亚硝盐含量,以此为NO在芹菜生产中的应用提供参考。
1 材料与方法
1.1 材料
芹菜品种为西雅图(A. graveolens cv. Seattle),由天津市农业科学院蔬菜研究所提供。亚铁氰化钾、乙酸锌等常规化学试剂均为分析纯。硝酸盐氮标准溶液、亚硝酸盐氮标准溶液均为优级纯、SNP购自美国Sigma公司。
1.2 试验设计
试验于2014年冬季在天津市农业科学研究院科润蔬菜研究所温室中进行,温室温度在10~25 ℃,日照时间约8 h。试验分芹菜种子萌发期、幼苗期和快速生长期3个阶段进行。
1.2.1 种子萌发期 挑选整齐干净、均匀一致的种子,75%乙醇浸泡种子5 min,无菌水清洗,再用次氯酸钠浸泡5 min,无菌水清洗后,分别用不同浓度的SNP溶液浸泡种子12 h,各处理SNP溶液浓度分别为0(CK)、20、50、100、200 μmol/L,然后种植于泥炭盆中。每处理50粒种子、3个重复,以种子长出地面作为萌发标志,自萌发日起10 d后计算种子的发芽势,15 d后计算发芽率、发芽指数。处理15 d后,将每个处理发芽的种苗取出,去土,放入烘箱中,在70 ℃烘干5 min,取出后待凉至室温,用电子天平称量干重,计算活力指数,具体测定方法参考文献[9]。
1.2.2 幼苗期 将田间芹菜每5行(行长1 m)为一个试验小区进行种植,待芹菜幼苗生长到2片真叶后,用0、20、50、100、200 μmol/L的SNP溶液分别喷施幼苗,隔7 d再喷施1次,共喷施2次,最后1次喷施后于第八天时将芹菜幼苗小心挖出,去土留根,测量株高(茎基部到生长点)[10],用电子天平称量每行芹菜总鲜重、地上部鲜重,计算单株鲜重和平均株高。小区内各处理间随机分布。重复3次。
1.2.3 快速生长期 正常生长的芹菜在真叶5~6片、苗高15~20 cm时定植,按常规进行管理。定植30 d后,对其喷施2次SNP,2次间隔6 d,浓度同上,喷施程度以喷至叶片滴水为止。第二次喷施后20 d收获芹菜,小心去土留根,测量株高(茎基部到生长点),称量每组总鲜重及去根后地上部鲜重,计算单株鲜重及平均株高。试验设计为随机区组,5次重复,每组30~40株。
1.3 生理指标测定
采用乙醇提取法[11]测定芹菜叶片叶绿素含量,在田间摘取顶叶三轮叶片上的第一片叶,带回实验室,用分光光度计在665 nm处测叶绿素a吸光度OD665 nm,在649 nm处测叶绿素b吸光度OD649 nm,计算叶绿素总量。
采用高效液相色谱法测定芹菜叶片亚硝酸盐、硝酸盐含量,在芹菜成熟后,取顶叶三轮叶片上的第一片叶检测,具体测定方法参考余海兰等[12]所述方法,并略作修改。测定条件为Agilent ZORBAX SB-C18 Stable Bond Analytical 4.6×150 mm 5-Micron色谱柱,0.03 mol/L的KH2PO4-H3PO4缓冲液流动相,流速1 mL/min,二极管阵列检测器(Agilent G1315D),检测波长204 nm,柱温为室温。
1.4 数据处理
试验所得数据采用Microsoft Office Excel 2003软件处理,并用其制表和绘图,运用SPSS 20.0统计分析软件进行分析,采用LSD法进行多重比较。
2 结果与分析
2.1 外源NO对种子萌发的影响
发芽率反映种子发芽数量,发芽势反映种子发芽的整齐度和速度[13];活力指数既能反映发芽率、发芽速度,又能代表生长势及生长活力;而发芽指数则能反映种子的综合活力[14]。外源NO对芹菜种子萌发的影响情况见表1。由表1可知,与对照相比,SNP 100 μmol/L处理后,芹菜种子的发芽率、发芽势、发芽指数、活力指数比对照分别提高了0.75、1.02、0.92、4.06倍,说明SNP100 μmol/L处理对芹菜种子萌发具有显著的促进作用(P<0.05),而SNP 20、50 μmol/L处理后,芹菜种子活力指数分别比对照提高了2.19、1.28倍。由此可见,SNP 100 μmol/L处理过的芹菜种子最易萌发。
2.2 外源NO对芹菜生长量的影响
2.2.1 外源NO对芹菜幼苗期生长量的影响 外源NO对芹菜幼苗期生长量的影响情况分别见表2、图1。由表2、图1可知,外源NO对芹菜幼苗生长的影响表现出了不同的差异性,如喷施SNP 50 μmol/L后,芹菜幼苗株高和叶绿素含量分别比对照提高了7.52%和11.73%,差异都达到了显著水平(P<0.05),但其对鲜重2个指标无显著影响(P>0.05);喷施SNP 100 μmol/L的芹菜幼苗在株高、单株鲜重、地上部鲜重和叶绿素含量都较对照大大提高,分别提高了17.89%、27.06%、22.67%、21.60%,差异都达到了显著水平(P<0.05);而喷施SNP 200 μmol/L的处理使芹菜幼苗的单株鲜重、地上部鲜重、叶绿素含量分别降低了43.70%、43.97%、14.81%,差异都达到了显著水平(P<0.05)。这说明SNP 100 μmol/L处理能有效提高芹菜幼苗的生长指标,可促进芹菜器官的生长和叶绿素的增加,从而提高植物的光合作用效率,而200 μmol/L处理对芹菜幼苗的生长起抑制作用。
2.2.2 外源NO对芹菜快速生长期生长量的影响 外源NO对芹菜快速生长期生长量的影响情况分别见表3、图1。由表3、图1可知,在快速生长期喷施不同浓度的SNP后,芹菜的生长量又表现出不同的差异。与对照相比,喷施SNP 20~100 μmol/L浓度的处理对快速生长期芹菜的株高、单株鲜重、地上部鲜重和叶绿素含量没有显著影响(P>0.05);而200 μmol/L处理则使快速生长期芹菜的株高降低了2.60%,叶绿素含量降低了30.38%,差异都达到了显著水平(P<0.05)。这表明,喷施SNP 200 μmol/L对快速生长期芹菜的生长产生了抑制作用。但此浓度下芹菜植株的总鲜重和地上部鲜重与对照相比并未发生显著变化,说明SNP 200 μmol/L对芹菜生长的抑制可能只表现在抑制植株的纵向生长方面。
2.3 外源NO对芹菜根系发育的影响
根系是植物吸收养分的主要器官,其发育受遗传因子、非生物因素以及外部生物的影响。Eghball等[15]发现根系发育与作物氮素形态和利用效率的高低有着密切的关系;还有研究[16]表明,硝态氮使根系韧性增强,根质变硬,长度增加;氨态氮抑制侧根生成,使根系柔弱,明显变短、加粗。外源NO对芹菜根系发育的影响情况分别见表4、图1。由表4可知,在幼苗期和快速生长期分别喷施SNP后,不同浓度间对根重的影响差异都不显著(P>0.05)。但由图1-A可以看出,幼苗在喷施SNP 100 μmol/L后,与对照相比,主根长度最长,侧根数目最多;同样,由图1-B也可以看出类似现象,喷施SNP 100 μmol/L后,快速生长期的芹菜侧根数目最多,根密度最大,这都有利于芹菜增强对水分和营养的吸收能力。不过实际观察发现,低浓度SNP处理(20、50 μmol/L)增加了芹菜的侧根数目,改变了根系结构,单株根重增加也非常明显。
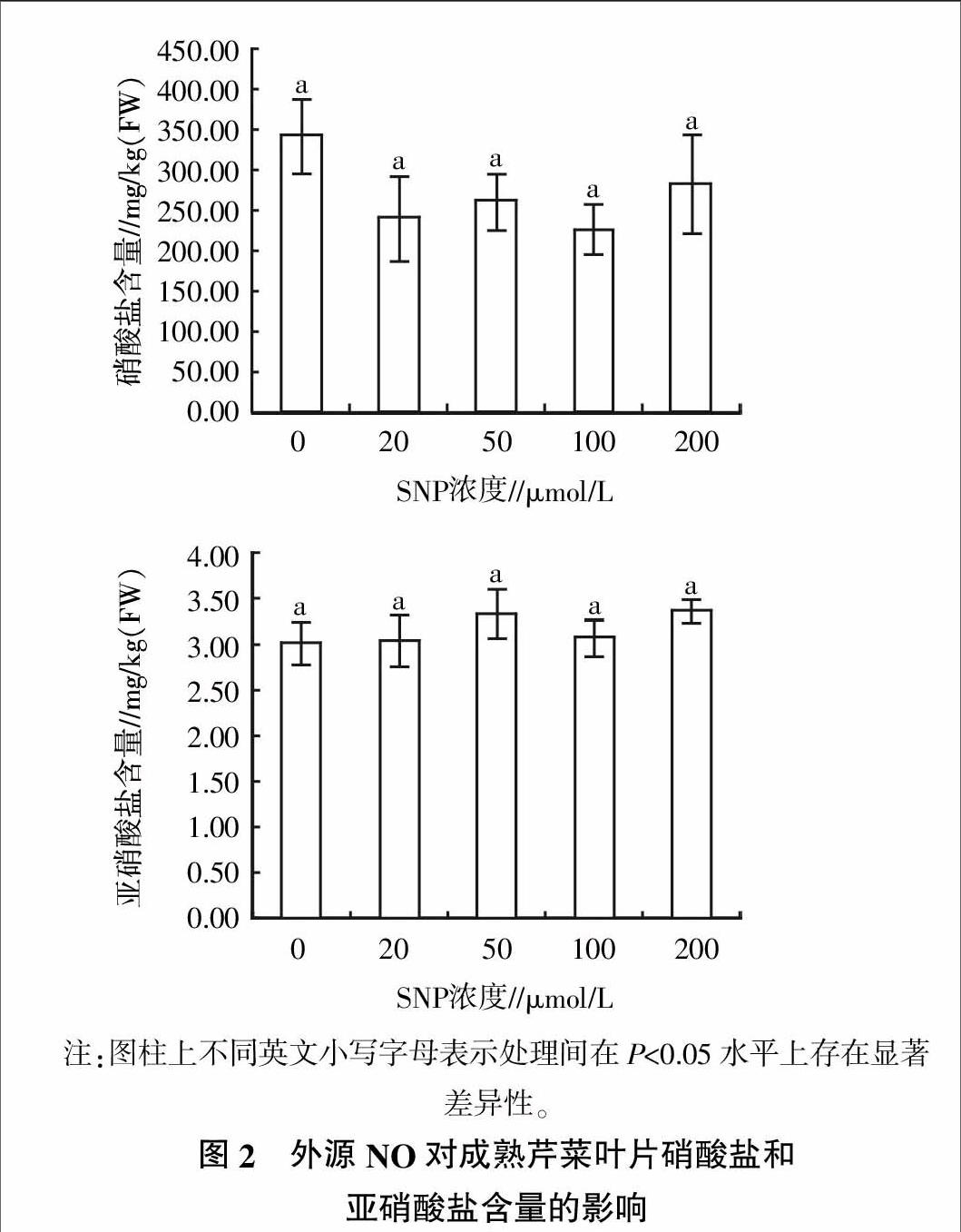
2.4 外源NO对芹菜叶片硝酸盐和亚硝酸盐含量的影响
硝酸盐和亚硝酸盐含量是食品检测的重要理化指标,外源NO对芹菜叶片硝酸盐和亚硝酸盐含量的影响情况见图2。从图2可见,喷施SNP后,收获的芹菜叶片硝酸盐和亚硝酸盐含量变化不大,各处理基本处于同一水平。其中SNP 100 μmol/L处理的芹菜叶片硝酸盐含量最低;50 μmol/L处理的亚硝酸盐含量有所增加,但各处理间的差异均未达到显著水平(P>0.05)。这表明喷施SNP后,芹菜硝酸盐和亚硝酸盐含量相对稳定,处在安全水平之内,不会影响食用品质。
3 讨论
对于绿色植物而言,光合作用非常重要,植物通过利用阳光的能量进行光合作用来获得生长发育必需的养分;而叶绿素含量则是反映光合作用的重要指标。研究表明,施加外源NO可提高NaCl胁迫下番茄幼苗叶片的叶绿素含量[17,18]。本试验通过喷施SNP提供外源NO,研究NO对芹菜生长的影响,结果表明,SNP 100 μmol/L不仅能提高芹菜叶片叶绿素含量,促进其光合作用,保证其获得充足的营养,还能增加芹菜幼苗的生长量,明显促进其株高、株重的增长。株高、株重可反映芹菜的质量和品质,是提高产量的体现。而SNP 200 μmol/L显著降低了芹菜叶绿素含量,使其株高、株重等增长降低,抑制了生长,不利于芹菜的增产。
NO作为气体信号分子,能参与植物许多生长发育过程的调控,包括促进种子萌发和侧根形成[19],有试验表明,SNP能促进绿豆侧根发生[20],显著促进番茄侧根的生长[21]。本试验结果表明,SNP具有明显的双重效应,200 μmol/L高浓度SNP具有明显抑制根生长的作用,该处理的芹菜侧根少,且根较短,扎根不深;而100 μmol/L明显促进芹菜根的生长,增加侧根的数目,有利于芹菜吸收的水分和营养向上运输,而且根明显伸长,扎根深,有利于对芹菜的支撑和固定,更多地吸收水分和营养。
NO也参与种子休眠和萌发调节,如外源NO可提高黑麦草种子的萌发率[22]。芹菜从播种到出苗时间相对较长,常因不良天气等原因造成种子出苗率偏低;因此对芹菜种子进行农艺处理以提高其发芽率和发芽势在生产中十分必要[23]。试验用NO供体SNP处理芹菜种子,通过发芽率、发芽势、发芽指数和活力指数等指标来研究NO对芹菜种子萌发的影响。结果表明,用SNP 100 μmol/L浸泡种子有利于促进芹菜种子的萌发,提高萌发率,增加种子有效利用率,降低生产成本。
人体摄入的硝酸盐80%来自于蔬菜[24],硝酸盐对人的直接毒害不大,但是蔬菜中的硝酸盐在贮藏、加工、运输、烹饪的过程中会在硝酸还原酶和微生物的作用下转变成亚硝酸盐,导致人畜患高铁血红蛋白症;而且亚硝酸盐还可在人和动物体内与摄入的次级胺等含氮物结合,转化形成公认的强致癌物亚硝胺,从而诱发消化系统癌变[25,26]。因此,蔬菜中硝酸盐、亚硝酸盐含量的调控是蔬菜生产中的重要课题。试验结果表明,外源SNP处理并未显著影响芹菜体内硝酸盐及亚硝酸盐的含量,说明NO不参与芹菜体内硝酸盐及亚硝酸盐的调控和积累,外源SNP不会对芹菜的食用品质产生显著影响,加之NO供体SNP本身具有稳定性差、见光易分解等特性,因而是一种安全型的生长调节物质,可用于绿色茎叶类蔬菜的早期生产调控。
参考文献:
[1] LE N J,CASTILLO M C,COEGO A,et al. Diverse functional interactions between nitric oxide and abscisic acid in plant development and responses to stress[J]. Journal of Experimental Botany,2014,65(4):907-921.
[2] LESHEM Y Y,HARAMATY E. Plant aging:The emission of NO and ethylene and effect of NO-releasing compounds on growth of pea(Pisum sativum) foliage[J].Journal of Plant Physiology,1996,148:258-263.
[3] UCHIDA A,JAGENDORF A T,HIBINO T,et al. Effect of hydrogen peroxide and nitric oxide on both salt and heat stress tolerance in rice[J].Plant Science,2002,16(3):515-523.
[4] 马向丽,魏小红,龙瑞军,等.外源一氧化氮提高一年生黑麦草抗冷性机制[J].生态学报,2005,25(6):1269-1274.
[5] ESIM N,ATICI O,MUTLU S. Effects of exogenous nitric oxide in wheat seedlings under chilling stress[J].Toxicol Ind Health,2014,30(3):268-274.
[6] 王 文,陈振德,罗庆熙,等.外源一氧化氮对苯丙烯酸胁迫下黄瓜幼苗生长及活性氧代谢的影响[J].中国农业科学,2010,43(17):3677-3683.
[7] 沈明珠,翟宝杰,东惠茹.蔬菜硝酸盐累积的研究[J].园艺学报,1982,9(4):41-48.
[8] YAMASAKI H,SAKIHAMA Y,TAKAHASHI S. An alternative pathway for nitric oxide production in plants:New features of an old enzyme[J].Trends in Plant Science,1999,4(4):128-129.
[9] 曹 玲,刘溪静,李楠茜,等.NaCl胁迫对芹菜种子萌发和幼苗生长的影响[J].北方园艺,2013(15):20-23.
[10] 樊怀福,郭世荣,焦彦生,等.外源一氧化氮对NaCl胁迫下黄瓜幼苗生长、活性氧代谢和光合特性的影响[J].生态学报,2007, 27(2):546-553.
[11] 王元军.黑豆芽苗菜叶绿素的提取方法[J].食品研究与开发,2010,31(2):27-29.
[12] 余海兰,方京京.高效液相色谱法测定蔬菜中硝酸盐和亚硝酸盐含量[J].湖南农业科学,2010(7):97-99.
[13] 徐 劼,胡博华,戈 涛,等.镉胁迫对生菜种子萌发及幼苗生理特性的影响[J].湖北农业科学,2014,53(20):4892-4896.
[14] 赵艳艳,胡晓辉,邹志荣,等.不同浓度5-氨基乙酰丙酸(ALA)浸种对NaCl胁迫下番茄种子发芽率及芽苗生长的影响[J].生态学报,2013,33(1):62-70.
[15] EGHBALL B,MARANVOLLE J W. Root development and nitrogen influx of genotypes grown under combined droug-ht and nitrogen stress[J].Agronomy Journal,1993,85:147-152.
[16] ZHANG H M,FORDE B G. Regulation of arabidops is root development by nitrate availability[J].Journal of Experimental Botany,2000,342:51-59.
[17] 孙德智,杨恒山,彭 靖,等.外源SA和NO对NaCl胁迫下番茄幼苗生长、光合作用及离子分布的影响[J].生态学报,2014, 34(13):3519-3528.
[18] 吴雪霞,朱月林,朱为民,等.外源一氧化氮对NaCl胁迫下番茄幼苗生长和光合作用的影响[J].西北植物学报,2006,26(6):1206-1211.
[19] 章玉平,黄碧仟.外源NO供体硝普钠浸种对3种草花种子萌发的影响[J].安徽农业科学,2008,36(20):8460-8461.
[20] 曹 冰,佘小平.一氧化氮对绿豆侧根发生的影响[J].西北农林科技大学学报(自然科学版),2009,37(12):119-122.
[21] CORREA-ARAGUNDE N,GRAZIANO M,LAMATTINA L. Nitric oxide plays a central role in determining lateral root development in tomato[J].Planta,2004,21(8):900-905.
[22] 刘建新,王 鑫,雷蕊霞.外源一氧化氮供体SNP对黑麦草种子萌发和幼苗生长的影响[J].生态学杂志,2007,26(3):393-398.
[23] BELIGNI M V,LAMATTINA L. Nitric oxide stimulates seed germination and de-etiolation,and inhibits hypocotyl elongation,three light-inducible responses in plants[J].Planta,2000, 17(2):215-221.
[24] 贾 丽,张经华,谷学新.蔬菜中硝酸盐和亚硝酸盐的分析[J].中国食物与营养,2007(7):7-9.
[25] 鲁奇林,王 娜,冯叙桥,等.大白菜贮藏过程中硝酸盐和亚硝酸盐含量变化分析[J].食品科学,2014,35(18):151-153.
[26] 王双明.贮存条件对蔬菜及其食品中硝酸盐、亚硝酸盐含量的影响[J].中国食物与营养,2004(9):35-37.

