盐及水淹对甜菜幼苗生长和生理指标的影响
时伟伟,刘冉冉,付婷婷,宋杰
(山东师范大学生命科学学院/逆境植物重点实验室,济南250014)
盐及水淹对甜菜幼苗生长和生理指标的影响
时伟伟,刘冉冉,付婷婷,宋杰*
(山东师范大学生命科学学院/逆境植物重点实验室,济南250014)
研究了1和120 mmol/L NaCl以及水淹处理对两个甜菜品种(系)Y-86-5-1(以下简称Y-86)和Y-77-6-3(以下简称Y-77)生物量、丙二醛含量、抗氧化酶的活性以及根孔隙度的影响。结果表明:盐及水淹降低地上部分和根的干重,尤其是对Y-77根的影响尤为明显;1和120 mmol/L NaCl盐度下,水淹均增加Y-86和Y-77叶片的MDA含量,尤其是Y-77;水淹处理下,盐分有降低Y-86和Y-77叶片SOD活性的趋势。1和120 mmol/L NaCl盐度下,水淹对Y-77叶片SOD活性没有显著影响,却增加Y-86叶片SOD活性。水淹处理下,盐分有增加Y-86叶片APX和CAT活性的趋势,而Y-77却相反;120 mmol/L NaCl处理下,水淹使Y-86叶片的APX和CAT活性升高,而水淹对1 mmol/L NaCl处理下的Y-86以及1和120 mmol/L NaCl盐度下的Y-77叶片APX和CAT活性均没有显著影响。水淹处理下,Y-86和Y-77根部孔隙度随盐分增加而降低,相对Y-86,盐分对Y-77根的孔隙度降低的更显著。1和120 mmol/L NaCl盐度下,水淹均不同程度地增加Y-86和Y-77根的孔隙度。两个品种相比,Y-86比Y-77对盐涝互作具有更强的适应性。
甜菜;盐涝;丙二醛;抗氧化酶;孔隙度
全世界约有8亿hm2盐渍化土壤[1]。随盐碱地面积的不断扩大,研究植物的耐盐机理,合理利用耐盐植物,成为人们关注的焦点。甜菜是一种耐盐碱、耐干旱、适应性强的耐盐植物。低盐浓度促进甜菜生长,高盐环境下甜菜生长才会受到抑制[2]。黄河三角洲由于特殊的地理位置,容易形成低湿地、季节性积水地,易造成洪涝灾害。目前有关甜菜耐盐性的筛选及抗盐机理研究,以及提高甜菜产量和含糖量的措施方面,国内外作了大量的研究[3-4]。水涝时,一些植物会在根部形成通气组织[5],便于氧气的扩散。目前,植物适应淹水环境的形态学研究仍相对较少,且仅局限于水稻、小麦等少数几种植物,对甜菜的耐涝性研究甚少。前期研究表明,出苗及小幼苗阶段盐涝互作时Y-86具有较高的出苗率,而且在苗期能较好地维持离子稳态以及叶绿素含量的相对稳定[6]。本文在前期研究的基础上,对盐及水淹处理下甜菜较大幼苗的生长、丙二醛含量、抗氧化酶的活性和根系孔隙度等进行研究,以期为深入研究甜菜的耐盐、耐涝机制,选育优良的耐盐涝甜菜品种提供依据。
1 材料与方法
1.1试验材料
甜菜品种(系)Y-86-5-1(以下简称为Y-86)和Y-77-6-3(以下简称为Y-77),均由山东大学提供,种子晾干后存于4°C冰箱。
1.2植物的培养和处理
挑选籽粒饱满的Y-86和Y-77甜菜种子,分别播种于盛有洗净河沙的塑料盆中,每个品种(系)12盆,以1/2的Hoagland每天浇灌,50d后间苗至每盆3株。用1和120 mmol/L NaCl(均以1/2的Hoagland配制)分别对幼苗进行水淹和正常沙培处理,每个处理3个重复。为了避免盐冲击,120 mmol/L NaCl处理的每天递增20 mmol/L,终浓度后处理21d,测定Y-86和Y-77的相关生理指标。
1.3测定方法
1.3.1甜菜幼苗地上部分及根干重的测定将Y-86和Y-77的地上部分与根分别收获,快速冲洗干净后用吸水纸吸干表面水分。于105℃条件下的烘箱中杀青15 min,然后在80℃条件下将其烘干,至恒重,称干重(DW)。每处理3个重复。
1.3.2丙二醛含量的测定取甜菜相同叶位的叶片,去除叶脉,称重,剪碎,放入研钵中,加入少量石英砂和1 mL 0.1%的三氯乙酸(TCA),充分研磨,将匀浆移入试管中,用1.5 mL 0.1%的三氯乙酸分别冲洗两次研钵,冲洗液都倒入试管中,再加入2.5 mL 0.5%的硫代巴比妥酸,摇匀,沸水浴10 min后,立即取出放入冷水中,冷却后,3000 r/min离心10 min,取上清液量其体积,以0.5%的硫代巴比妥酸溶液为空白对照,用分光光度计分别测量532 nm和600 nm的吸光度。计算MDA的含量:MDA含量(mmol/g FW)=△A×N/(155×W)
式中△A:A532和A600之差,N:上清液总体积,155为1 mmol反应产物(三甲川)在532 nm处的吸收系数,W:称取植物材料的鲜重(g)。
1.3.3SOD活性的测定参照李合生[7]的方法稍加修改:取新鲜甜菜叶片,去离子水洗净,称取0.5 g剪碎放入预冷的研钵,加入0.5 mL的提取液(50 mmol/L PBS,pH7.8;2 mmol/L AsA;0.1 mmol/L EDTA;1%PVP)于冰上研磨至匀浆转移至离心管,用500 μL提取液冲洗研钵2次,放入预冷4℃的离心机,12000 r/min离心15 min,上清液即为酶提液。在4 mL反应体系中,取反应介质3.9 mL(13 mmol/L蛋氨酸;77.12 μmol/L NBT;0.1 mmol/L EDTA-Na2;50 mmol/L PBS,pH7.0),80.2 μmol/L核黄素0.1 mL,酶液0.1 mL(有1支试管不加酶液,以50 mmol/L pH7.8磷酸缓冲液代替酶液作为总对照)。混匀后,从加酶液的2支试管中任取1支作为空白避光保存,其余在4000 lx光照下反应20 min。在560 nm下测定各试管OD值,结果以U/g Pro表示。计算公式:SOD活性=A×N×60/(A0×WP×T×0.1)×50%
A0:为对照在560 nm处的吸光度,A:为对照在560 nm处的吸光度与加入酶液的反应液在560 nm处的吸光度值的差,N为酶液总体积,WP:为提取酶液的植物材料中蛋白质总量,T:为光照时间,0.1:为加入酶液的体积,60:为60 min(要计算1 h的酶活力)
1.3.4APX活性的测定酶提液同SOD。取2.95 mL反应液(50 mmol/L PBS,pH7.0;50 μmol/L EDTA;250 μmol/L AsA),加入2 μL 30%H2O2和50 μL酶提液并混匀,以不加AsA的反应液作为对照,每隔1 min记录1次室温下290 nm吸光值,连续记录5次。室温下每1min氧化1 μmmol AsA的酶量作为1个酶活单位。计算公式:APX酶活性=(δA290×Vt)/(Vs×0.1×t×Pro)
Vt:提取酶液总体积(mL),Vs:测定时用的酶液总体积(mL),t:反应时间(min),Pro:叶片鲜重所含蛋白质总量。
1.3.5CAT活性的测定参照Aebi[8]的方法,稍加修改。酶提液同SOD。取2.9 mL反应液(50 mmol/L pH7.0 PBS)加入0.1mL酶液,以PBS为对照调零,25℃预热后,迅速倒入石英比色杯中,加入H2O2混匀,在240 nm下测定吸光度,每隔1 min读数1次,共测4 min,以1 min内A240减少0.1的酶量为1个酶活单位(U)计算公式:过氧化氢酶活性[U/(g·min)]=ΔA240×Vt/(0.1×Vl×t×Pro)
ΔA240:为反应时间内吸光度的变化,Vt:粗酶提取液总体积(mL),Vl:测定用粗酶提取液体积(mL),Pro:样品鲜重所含蛋白质的总量,0.1:A240每下降0.1为1个酶活单位(U),t:过氧化氢酶到最后一次读数时间(min)。
1.3.6孔隙度的测定植物根部的孔隙度测定参照通气组织被水浸满前后的浮力差进行测定。
将三蒸水抽真空12h除去三蒸水中的空气,注入25 mL已知重量的耐热比重瓶中,在室温下称其重量。剪取甜菜的根,用去离子水冲净,选择5~6 cm长的根若干,称其重量,并将根置于注满水的比重瓶中(此过程勿产生气泡),称重。随后将放入根的盛满蒸馏水的比重瓶置于真空泵中,将其抽真空直到根沉底,至没有气泡为止,再次称重。
孔隙率的计算公式:孔隙率(%)=100×(FA-FB)/(FW+TW-FB)
FA表示抽气后比重瓶、水和根样的总重量,FB表示抽气前比重瓶、水和根样的重量,FW表示比重瓶和水的总重量,TW表示根样的鲜重。
以上所得数据采用SAS统计软件进行三因素显著性分析。

图1 盐及水淹对甜菜Y-86和Y-77地上部分(A)和根(B)干重的影响
2 结果
2.1甜菜地上部分和根干重
无论水淹还是正常沙培处理,120 mmol/L NaCl均降低Y-86和Y-77地上部分和根干重,而且对两个甜菜品种影响趋势相似(图1);1和120 mmol/L NaCl处理下,水淹降低Y-86和Y-77地上部分干重的趋势相似(图1A)。1和120 mmol/L NaCl处理下,水淹均降低Y-86和Y-77根干重。与Y-86相比,在120 mmol/L NaCl处理下水淹显著降低Y-77根的干重(图1 B)。
2.2甜菜叶片丙二醛含量
无论水淹还是正常沙培,Y-86和Y-77叶片丙二醛含量均随盐浓度升高而升高(图2)。1和120 mmol/L NaCl处理下,水淹均增加Y-86和Y-77叶片丙二醛含量,尤其是Y-77。
2.3叶片抗氧化酶活性
无论正常沙培还是水淹处理下,盐分有降低Y-86和Y-77叶片SOD活性的趋势。1和120 mmol/L NaCl盐度下,水淹对Y-77叶片SOD活性没有显著影响,却显著增加Y-86叶片SOD活性。无论正常沙培还是水淹处理,盐分有增加Y-86叶片APX和CAT活性的趋势,而Y-77却相反;120 mmol/L NaCl处理下,水淹使Y-86叶片的APX和CAT活性升高,而水淹对1 mmol/L NaCl处理下的Y-86以及1和120 mmol/L NaCl盐度下的Y-77叶片APX和CAT活性均没有显著影响(图3)。
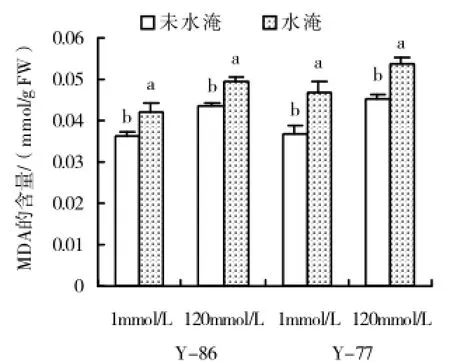
图2 盐及水淹对甜菜Y-86、Y-77叶片丙二醛含量的影响

图3 盐及水淹对甜菜Y-86、Y-77叶片SOD(A)、APX(B)和CAT(C)活性的影响
2.4根系孔隙度
无论水淹还是正常沙培,Y-86和Y-77的孔隙度随盐浓度增加而降低(图4)。在1和120 mmol/L NaCl条件下,水淹使Y-86和Y-77的孔隙度都有增大的趋势,尤其是Y-86。

图4 盐及水淹对甜菜Y-86和Y-77根部孔隙度的影响
3 讨论
尽管盐生植物能够很好地适应盐渍环境,但其耐盐能力同时受到基因型和发育阶段的影响[9]。甜菜幼苗在水淹和正常沙培处理下,Y-86和Y-77的地上和根干重均会受到高盐浓度的影响。在高盐浓度下,相对于地上部分干重,水淹使根的干重下降趋势更加明显,尤其是在高盐浓度下Y-77的根部干重。研究发现渗透胁迫下,植物地上部分生长明显降低,根受到较小程度的影响[10]。在盐及水淹的情况下,一方面盐胁迫对根部不仅会产生渗透胁迫还会产生离子胁迫,导致根部吸水困难和产生了离子毒害降低物质的积累,另一方面水淹会影响根部呼吸作用,因此盐及水淹产生了较强的双重胁迫。本试验结果表明,Y-86较Y-77具有更强的耐受盐和水淹双重胁迫的能力。
活性氧的清除系统包括酶系统和非酶系统。在植物代谢正常情况下二者是协同合作的。在逆境下植物体内的活性氧增多,植物的抗氧化酶活性迅速升高,对清除活性氧起到重要应激反应。植物在大多的环境胁迫下,抗氧化酶活性的变化多是随着胁迫强度增大而出现“先升后减”的情况。在盐及水淹时,Y-86某些抗氧化酶活性升高而Y-77的却降低。产生这种现象可能是由于Y-86通过提高抗氧化酶活性来清除在双重胁迫下产生的活性氧,减少逆境对甜菜的损伤。MDA含量是衡量膜脂过氧化的重要指标。本文研究发现,盐涝互作中,盐对甜菜MDA含量影响较显著(表1)。在1和120 mmol/L NaCl浓度下,水淹使Y-86和Y-77的MDA含量均显著增加,但相较于Y-86,Y-77受水淹的影响较大。说明在淹水胁迫下,Y-77的膜脂过氧化程度较高,而Y-86的膜质过氧化程度较低,这可能与Y-86具有较强活性氧清除能力有关,最终表现为Y-86根系生长受到的影响较小。
国内外对通气组织的研究方法主要是切片观察和测定孔隙度[11]。研究发现,盐涝互作中,盐对甜菜根系孔隙度影响较显著(表1)。在盐及水淹处理下,甜菜Y-86和Y-77孔隙度都一定程度地升高。但高盐浓度下,水淹使甜菜Y-86孔隙度显著增加,说明与Y-77相比,在双重胁迫下,Y-86产生的通气组织较多。通气组织是植物耐淹的重要指标,可以减少氧气向植物根部运输的阻力,保证根的正常代谢[12]。
综上所述,与Y-77相比,盐涝互作时Y-86具有较强的活性氧清除能力,而且具有较发达的通气组织,因而盐及水淹对其生长的影响较小。甜菜Y-86比Y-77表现为对盐涝互作具有更强的适应性。

表1 甜菜地上和地下部分干重、叶片丙二醛含量、抗氧化酶活性和根系孔隙度的三因素分析结果
[1]Munns R,Tester M.Mechanisms of salinity tolerance[J].Annual Review of Plant Biology,2008,59:651-681.
[2]Marschner H.Mineral nutrition of higher plants(Second Edition)[M].Academic,London,1995.
[3]耿贵,周建朝,陈丽,等.氯化钠胁迫下甜菜不同品种(系)种子发芽率和幼苗生长的差异[J].中国糖料,2004(2):14-18.
[4]於丽华,耿贵,崔平,等.甜菜种质资源耐盐性的初步筛选[J].中国糖料,2013(4):39-41.
[5]Voesenek LACJ,Pierik R,Millenaar FF,et al.How plants cope with complete submergence[J].New Phytologist,2006,170:213-226.
[6]付婷婷,赵维维,徐燕阁,等.盐涝互作对甜菜出苗率及幼苗的影响[J].中国糖料,2015,37(4):11-14.
[7]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006.
[8]Aebi H.Catalase in vitro[A].Methods in enzymology[C].Orlando,FL:Academic Press,1984,105:121-126.
[9]Megdiche W,Amor NB,Debez A,et al.Salt tolerance of the annual halophyte Cakile maritima as affected by the provenance and the developmental stage[J].Acta Physiologiae Plantarum,2007,29(4):375-384.
[10]Munns R.Physiological processes limiting plant growth in saline soil:some dogmas and hypotheses[J].Plant,Cell and Environment, 1993,16(1):15-24.
[11]Chen LZ,Lin P,Wang WQ.Mechanisms of mangroves waterlogging resistance[J].Acta Ecologica Sinica,2006,26(2):586-593.
[12]Fan MS,Zhang FS.Aerenchym a form at ion in plant and its physiological and ecological significance[J].Plant Physiology Communications,2002,38(6):615-618.
Interactive Effects of Salinity and Waterlogging on Growth and Physiological Index in Sugarbeet Seedlings
SHI Wei-wei,LIU Ran-ran,FU Ting-ting,SONG Jie*
(Key Laboratory of Plant Stress,College of Life Science,Shandong Normal University,Jinan 250014,China)
Effects of salinity(1 and 120 mmol/L NaCl)and waterlogging on seedling growth,MDA content, antioxidant enzyme activity and root porosity were studied in two sugarbeet cultivars(lines)Y-86-5-1(Y-86) and Y-77-6-3(Y-77).The results indicated that salinity and waterlogging decreased the shoot and root dry weight,especially for root dry weight in Y-77.Waterlogging significantly increased leaf MDA content in Y-86 and Y-77 under 1 and 120 mmol/L NaCl,especially in Y-77.Salinity tends to decrease leaf SOD activity in Y-86 and Y-77.Waterlogging had no significant effect on leaf SOD activity in Y-77,but increased the value in Y-86 under 1 and 120 mmol/L NaCl.Salinity increased the activity of leaf APX and CAT in Y-86,but the opposite trend was observed in Y-77 under waterlogging treatment.Waterlogging increased leaf APX and CAT activity in Y-86 under 120 mmol/L NaCl,but waterlogging had no significant effect on those values in Y-86 under 1 mmol/ L NaCl,and Y-77 under 1 and 120 mmol/L NaCl.The root porosity of Y-86 and Y-77 decreased with increase of salinity content under waterlogging treatment,especially in Y-77.Waterlogging increased root porosity of Y-86 and Y-77 regardless of NaCl concentration.Therefore,compared to Y-77,Y-86 is better adapted to salinity and waterlogging interaction.
sugarbeet;interaction between salinity and waterlogging;MDA;antioxidant enzymes;porosity
S566.3
A
1007-2624(2016)02-0008-04
10.13570/j.cnki.scc.2016.02.003
2015-11-07
时伟伟(1990-),女,山东省菏泽市单县人,在读硕士研究生,主要从事植物抗逆机理的研究。
宋杰,Email:songjieever@163.com

