采后柑橘与胶孢炭疽菌互作过程中果皮成分的动态变化
盖智星,贺明阳,2,3,曾小峰,黄小兰,王日葵,2,3,*,周 炼,2,3,韩 冷,2,3
(1.西南大学柑桔研究所,重庆 400712;2.中国农业科学院柑桔研究所,重庆 400712;3.国家柑桔工程技术研究中心,重庆 400712)
采后柑橘与胶孢炭疽菌互作过程中果皮成分的动态变化
盖智星1,贺明阳1,2,3,曾小峰1,黄小兰1,王日葵1,2,3,*,周 炼1,2,3,韩 冷1,2,3
(1.西南大学柑桔研究所,重庆 400712;2.中国农业科学院柑桔研究所,重庆 400712;3.国家柑桔工程技术研究中心,重庆 400712)
目的:探究柑橘胶孢炭疽菌(Colletotrichum gloeosporioides)侵染过程中柑橘果皮细胞壁降解相关酶(cell wall degrading enzymes,CWDEs)、细胞壁成分和防御相关酶活性的动态变化,为进一步研究胶孢炭疽菌致病机理提供理论参考。方法:柑橘果实接种胶孢炭疽菌后,不同培养时间取样测定,并比较分析果皮成分变化。结果:胶孢炭疽菌侵染的柑橘组织中均能产生多聚半乳糖醛酸酶(PG)、果胶甲基半乳糖醛酸酶(PMG)、纤维素酶(Cx)、β-葡萄糖苷酶(β-Glu)、角质酶,且均在侵染前期(1~3 d)达到峰值。纤维素、半纤维素、果胶等细胞壁组分含量随胶孢炭疽菌的侵染而降低,木质素含量随胶孢炭疽菌的侵染而升高。胶孢炭疽菌侵染后,柑橘组织中的过氧化物酶(POD)活性、过氧化氢酶(CAT)活性、丙二醛(MDA)含量总体呈上升趋势。结论: CWDEs和角质酶在炭疽病发病前期起到重要的致病作用,其对果皮细胞壁组分的降解加速了胶孢炭疽菌的侵入;另外胶孢炭疽菌的侵染加速了寄主细胞质膜的过氧化。
柑橘;胶孢炭疽菌;细胞壁降解酶;细胞壁成分;防御酶
柑橘是世界第一大水果,年产量高达1亿 t。我国是世界柑橘生产第一大国,2013年柑橘产量达3 276万 t。柑橘采后易受真菌侵害,造成大量腐烂[1],导致巨大经济损失。炭疽病是贮藏期柑橘重要的真菌病害之一,分布广泛。引起柑橘炭疽病的病原有两种:胶孢炭疽菌(Colletotrichum gloeosporioides)和尖孢炭疽菌(Colletotrichum acutatum),柑橘采后炭疽病主要是由胶孢炭疽菌引起[2],因此以胶孢炭疽菌为研究对象,探究其与柑橘果实互作过程中的致病机制具有重要的理论和经济价值。
目前国内对炭疽病的研究多集中于病原菌的鉴定分类[3-5]与病害防治方面[6-7],国外对炭疽病防治[8-10]及炭疽菌致病机理[11-12]的报道较多。细胞壁降解酶(cell wall degrading enzymes,CWDEs)是植物病原菌的主要致病因子之一,其在不同寄主-病原物互作中所产生的种类、时期和活性均存在差异[13]。Jorge等[14]报道尖孢镰刀菌分泌的细胞壁降解酶与枯萎病的发展呈正相关,分泌的主要细胞壁降解酶为多聚半乳糖醛酸酶(polygalacturonase,PG)和果胶裂解酶。Jat等[15]对侵染香蕉的胶孢炭疽菌细胞壁降解酶的分泌情况进行了报道,研究发现起主要作用的为多聚半乳糖醛酸反式消除酶和PG。檀根甲[16]初步明确果胶甲基半乳糖醛酸酶(polymethyl galacturonase,PMG)和纤维素酶(carboxymethyl cellulose,Cx)在炭疽菌侵染苹果过程中起关键作用。寄主抵抗致病菌侵染的过程中分泌的防御酶通过清除活性氧,从而减缓寄主细胞的过氧化。Cao Shifeng等[17]报道过氧化氢酶(catalase,CAT)与采后枇杷果实的的抗病性有重要关系。Rockenbach等[18]运用蛋白质组学的方法对苹果在胶孢炭疽菌侵染过程中的防御应答进行了研究,其中清除活性氧过程中的相关蛋白检出较多。李欣允等[19]报道炭疽菌的侵染可加速荔枝果实氧化和过氧化作用进程,从而加速衰老和劣变。鉴于细胞壁降解酶与防御酶在不同寄主-病原物互作中其产生的时期和活性均存在差异,且柑橘炭疽菌侵染柑橘果实引起的细胞壁降解酶和防御相关酶活变化还不清楚,因此本实验通过探讨柑橘与胶孢炭疽菌互作过程中细胞壁降解酶、细胞壁组分及防御酶的变化规律,明确互作过程中主要细胞壁降解酶与防御酶的时空表达,以更加全面地理解柑橘与胶孢炭疽菌的相互作用,从而为柑橘炭疽病的防控提供理论依据。
1 材料与方法
1.1 材料
供试柑橘:北碚447#锦橙,购买于重庆市北碚区;供试病原菌:柑橘胶孢炭疽菌(Colletotrichum gloeosporioides),由中国农业科学院柑桔研究所综防课题组提供。
1.2 仪器与设备
SW-CJ-1F超净工作台 江苏苏净集团;BX34光学显微镜 日本Olympus公司;RXZ-260C气候培养箱宁波东南仪器公司;LDZX-50FBS高压灭菌锅 上海申安医疗器械公司;TU-1901双管束紫外-可见分光光度计 北京普析通用仪器公司;H1850R高速冷冻离心机湖南湘仪集团。
1.3 方法
1.3.1 材料处理
选择成熟度相近、外观整齐、无机械损伤的锦橙果实,清洗后晾干备用。胶孢炭疽菌接种于马铃薯琼脂培养基,28 ℃培养10 d后将孢子刮下,制成浓度为2×106spores/mL孢子悬浮液。使用75%酒精对接种点处进行消毒,晾干。采用长度为2 mm的12号针头针刺接种点,滴加10 μL现配孢子悬浮液,对照组滴加等量无菌水。所有材料处理后放入托盘内,盘底铺浸润的脱脂棉覆上保鲜膜,摆放好后,托盘口覆上保鲜膜,并置于28 ℃相对湿度95%的培养箱。接种后分别在不同时间取接种部位组织,经液氮速冻后保存于-80 ℃冰箱备用。
1.3.2 细胞壁降解酶活性的测定
参照曹建康等[20]的方法测定。PG与PMG活性单位以每小时每克样品在37 ℃催化底物水解生成半乳糖醛酸的质量表示(mg/(h·g));Cx与β-葡萄糖苷酶(β-glucosidase,β-Glu)的酶活单位以每小时每克样品在37 ℃催化底物水解生成还原糖的质量表示。
1.3.3 角质酶活性的测定
参照孙媛[21]的方法测定。以每克鲜样每分钟产生对硝基酚的微克数定义为1 个酶活力单位U。
1.3.4 过氧化物酶(peroxidase,POD)活性的测定
采用愈创木酚法[22]。以每克样品每分钟吸光度变化(ΔA470nm)0.01为一个过氧化物酶活力单位。
1.3.5 超氧化物歧化酶(superoxide dismutase,SOD)活性的测定
采用对氮蓝四唑光还原法[22]。以每小时每克果蔬组
织的反应体系对氮蓝四唑光化还原反应的抑制为50%为一个SOD活性单位(即U/(g·h))。
1.3.6 CAT活性的测定
采用高锰酸钾滴定法[22]。CAT活性以每克果蔬组织每分钟分解H2O2的毫克数表示。
1.3.7 丙二醛(malonaldehyde,MDA)含量的测定
参照王学奎[22]的方法测定。
1.3.8 纤维素、半纤维素与木质素含量的测定
参照李春光等[23]的方法测定。
1.3.9 可溶性果胶与原果胶含量的测定
参照曹建康等[20]的方法并改进。准确称取烘干样品0.10 g进行测定,果胶含量以生成半乳糖醛酸的质量分数表示。
2 结果与分析
2.1 胶孢炭疽菌侵染对柑橘果实细胞壁降解酶的影响

图1 胶孢炭疽菌侵染后柑橘果皮组织PG(A)、PMG(B)、Cx(C)、β-Glu(D)活性的变化Fig. 1 Changes in the activities of PG (A), PMG (B), Cx (C) and β-Glu (D) in citrus tissue infected with C. gloeosporioides
从图1A可看出,胶孢炭疽菌侵染柑橘果实后1~7 d内PG活性普遍高于对照,且整体呈先升后降的趋势;在第2天被侵染的柑橘组织PG活性达到最大值,约为对照的8.65 倍。在整个培养过程中,对照组织PG活性相对稳定。被胶孢炭疽菌侵染的柑橘组织在1~4 d内PMG活性明显高于对照,且第2天达到峰值,约为对照的18.5 倍,3~7 d内侵染组织PMG活性波动较小。对照组中PMG活性在第2天出现最低突变点,表明针刺损伤对果实PMG活性的影响较大,果实通过降低分泌PMG从而减少果胶物质的水解(图1B)。
Cx与β-Glu共同作用将纤维素水解为β-葡萄糖。如图1C所示,发病组织的Cx活性普遍高于对照组,且大体呈上升趋势,在第1天达到最大值。由图1D可知,发病组织的β-Glu活性普遍高于对照组。侵染前期β-Glu活性在第2天达到峰值,3~7 d呈逐步上升趋势。2、7 d接种组织β-Glu活性分别高于对照102.74%、117.78%。β-Glu活性高峰出现时间晚于Cx,这可能是由于Cx在初期对纤维素大分子进行降解,为β-Glu提供底物[13]。
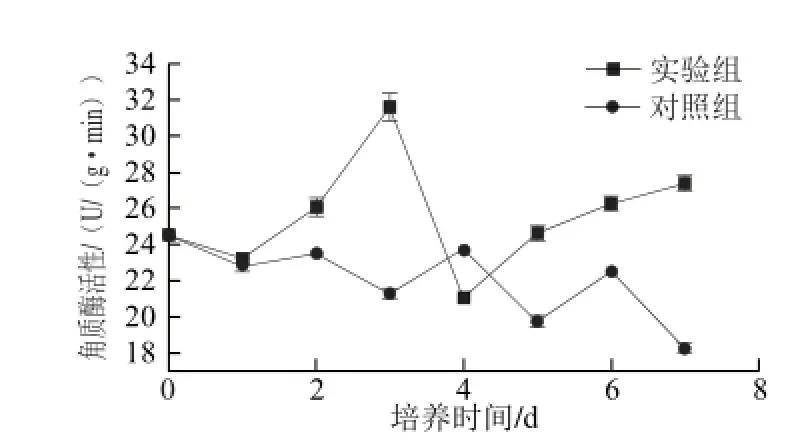
图2 胶孢炭疽菌侵染后柑橘果皮组织角质酶活性的变化Fig. 2 Changes in cutinase activities of citrus tissue infected with C. gloeosporioides
图2 表明,胶孢炭疽菌侵染过程中柑橘果皮角质酶活性整体高于对照,并在第3天达到高峰,在4~7 d呈逐步上升趋势。3、7 d接种组织角质酶活性分别高于对照48.55%、50.28%。对照组角质酶活性虽然在第4天略高于实验组,但总体呈下降趋势。实验表明角质酶的活性范围为15~35 U/(g·min),这与孙媛[21]对灰葡萄孢角质酶的报道相似。胶孢炭疽菌侵染寄主过程中,角质酶活性出现高峰较CWDEs晚,这与病原菌侵入寄主的阶段相符合。
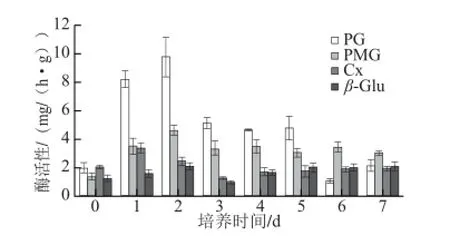
图3 胶孢炭疽菌侵染的柑橘果皮组织中细胞壁降解酶活性的比较Fig. 3 The activities of cell wall-degrading-enzymes in citrus tissue infected with C. gloeosporioides
如图3所示,柑橘果皮本身含有少量的细胞壁降解酶,其中PG与Cx含量稍高。随着接种时间的延长,柑橘果皮产生细胞壁降解酶的活性从高到低依次为PG、PMG、Cx、β-Glu,其中PG活性明显高于其余3 种酶,这与Jat等[15]研究胶孢炭疽菌对香蕉致病作用的结果一致。赵景楠等[24]研究发现草莓褐色叶斑病菌产生的CWDEs中PG活性最强,但该菌并不产生Cx。檀根甲[16]研究发现炭疽菌侵染苹果过程中,起关键作用的酶为PMG与Cx。可见不同的致病菌-寄主互作过程中起关键作用的CWDEs种类存在差异。寄主-致病菌互作过程中该4种细胞壁降解酶均呈现先上升后下降,随后又呈现上升趋势。其中Cx活性在第1天达到峰值,PG、PMG与β-Glu活性在第2天达到峰值,表明Cx对柑橘组织细胞壁的降解作用要早于其余3 种酶,然而有研究[16]发现炭疽菌与苹果互作过程中PMG活性表达在时间上早于Cx,这可能与寄主表皮成分的差异有关。
2.2 胶孢炭疽菌侵染对柑橘果皮细胞壁组分的影响
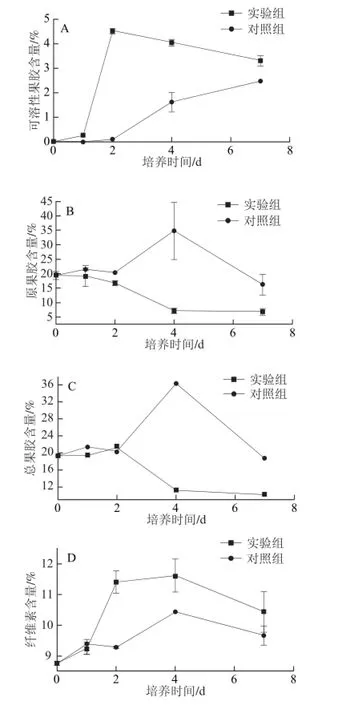
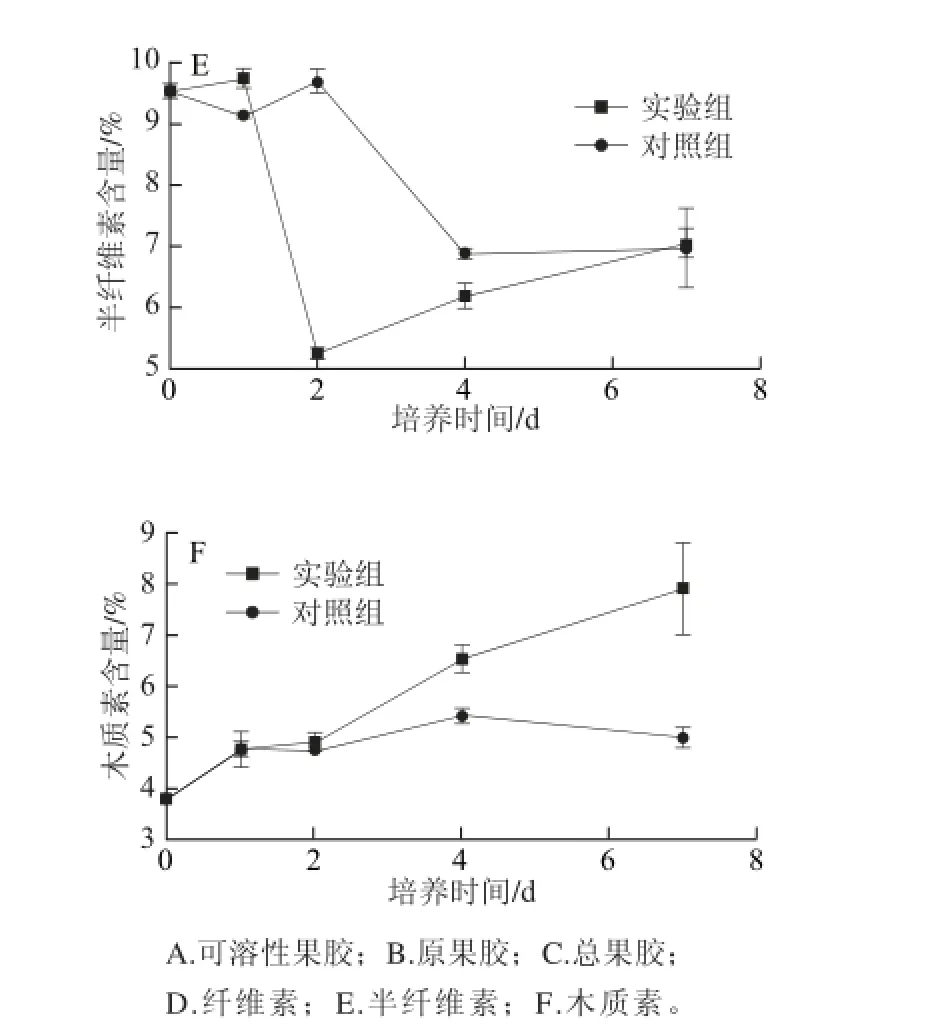
图4 胶孢炭疽菌侵染后柑橘果皮细胞壁组分的变化Fig. 4 Changes in cell wall components of citrus pericarp infected with C. gloeosporioides
如图4A所示,实验组可溶性果胶的含量呈先升高后降低的趋势,并在接种第2天达到峰值,而对照组的可溶性果胶含量呈现一直上升的趋势。胶孢炭疽菌侵染过程中,原果胶与总果胶的含量均呈下降趋势(图4B、 4C),这可能与Cx与果胶酶的共同作用相关。原果胶是果胶物质与纤维素结合后的存在状态,这种结合态在Cx与果胶酶的共同作用下分离,从而使得可溶性果胶的含量在接种1~2 d内迅速升高,而后可溶性果胶由果胶酶水解,因此总果胶的含量在第2天有小幅度升高后明显降低。对照组原果胶与总果胶的含量均呈先升高后降低的趋势,并在培养第4天达到峰值,这可能与针刺损伤引起的果实自我修复有关。
如图4D所示,实验组与对照组的纤维素含量呈先升高后降低的趋势。胶孢炭疽菌侵染柑橘果实1~2 d间,纤维素迅速合成,纤维素含量迅速增加,4~7 d纤维素逐渐被降解,含量下降。对照组纤维素含量在2~4 d有上升趋势,4~7 d呈下降趋势。胶孢炭疽菌侵染过程中半纤维素含量呈先下降后上升的趋势,并且在接种第2天迅速跌入低谷,这可能与Cx活性在第1天达到峰值有关(图4E)。
木质素是重要的植物抗病物质之一。胶孢炭疽菌侵染过程中柑橘果皮木质素含量呈上升趋势,而对照组木质素含量变化较为平稳。接菌第7天木质素含量为7.916%,为对照组的1.59 倍(图4F)。在炭疽病发病初期木质素与纤维素的合成增加,病斑硬化;随着细胞壁降解酶的作用,纤维素及果胶物质等被逐步降解,使得组织软化,病斑扩大。
2.3 胶孢炭疽菌侵染对柑橘组织膜脂过氧化的影响

图5 胶孢炭疽菌侵染后柑橘组织POD(A)、SOD(B)、CAT(C)活性与MDA含量(D)的变化Fig. 5 Changes in POD (A), SOD (B) and CAT (C) activities and MDA content (D) of citrus tissue infected with C. gloeosporioides
如图5A所示,胶孢炭疽菌侵染后柑橘组织POD活性总体呈上升趋势,在接种1~2 d上升速度最快。由图5B可知,胶孢炭疽菌侵染后柑橘组织SOD活性总体呈下降趋势,在接种第4天后迅速升高,此处SOD活性为119.221 U/(g·h)。接种第7天柑橘组织SOD活性最高,为172.528U/(g·h)。CAT属于血红蛋白酶,可以催化植物体内积累的H2O2分解,从而减少H2O2对果蔬组织的氧化伤害。图5C表明,胶孢炭疽菌侵染柑橘过程中,CAT活性整体呈上升趋势。其中1~2 d上升迅速,由0.043 mg/(g·min)上升为0.142 mg/(g·min),上升了233.33%。2~7 d发病组织CAT活性变化较为平稳。实验表明胶孢炭疽菌侵染柑橘果实过程中,果实中的防御酶活性总体呈上升趋势,且防御酶的作用时期迟于细胞壁降解酶。
MDA是质膜过氧化作用的主要产物之一,它的积累能对果蔬细胞质膜和细胞器造成一定的伤害。从图5D可知,胶孢炭疽菌侵染后柑橘组织的MDA含量在24 h内迅速下降63.06%,然后呈缓慢上升趋势。对照组中MDA含量在第2天达到峰值后降低到平稳水平,说明针刺损伤在前期也会使产生过氧化反应。MDA是判断质膜过氧化的重要指标之一,其含量在胶孢炭疽菌致病过程中大量增加,这表明胶孢炭疽菌的侵染可以引起寄主的活性氧的爆发,破坏细胞膜的完整性。
3 结 论
胶孢炭疽菌分泌的细胞壁降解酶在其致病中起到非常重要的作用,其对果皮细胞壁组分的降解加速了胶孢炭疽菌的侵入。实验结果表明:胶孢炭疽菌与柑橘互作过程中,PG活性最高,Cx活性高峰出现最早,因此PG与Cx在炭疽菌侵染柑橘过程中起关键作用,应对其作用机理进行更加深入的研究。炭疽菌侵染初期纤维素迅速合成,侵入后期在Cx作用下被逐步降解,导致病斑组织软化。木质素含量在整个互作过程中一直呈上升趋势,说明植物一直处于防御状态。另外质膜的过氧化引起的细胞膜破坏可能是引起发炭疽病的主要原因。然而,引起质膜过氧化反应的致病因子还有待深入研究。
[1] 汪晓银. 中国柑橘市场预警研究[D]. 武汉: 华中农业大学, 2013.
[2] MAISA C G, CRISTINA B, ANETE P S, et al. Recent introduction and recombination in Colletotrichum acutatum populations associated with citrus postbloom fruit drop epidemics in Sao Paulo, Brazil[J]. Phytopathology, 2014, 104(7): 769-778. DOI:10.1094/PHYTO-06-13-0165-R.
[3] 肖杰文, 刘月廉, 冉俊祥, 等. 巴西大豆中炭疽菌的分离鉴定研究[J].中国农学通报, 2011, 27(5): 333-337.
[4] 焦雁翔, 王日葵, 胡军华, 等. 重庆及周边部分地区柑橘炭疽病菌鉴定[J]. 果树学报, 2014, 31(5): 893-900.
[5] 徐成楠, 王亚南, 胡同乐, 等. 蓝莓炭疽病病原菌鉴定及致病性测定[J]. 中国农业科学, 2014, 47(20): 3992-3998. DOI:10.3864/ j.issn.0578-1752.2014.20.007.
[6] 刘浩强, 李鸿筠, 向可海, 等. 不同保鲜剂混配对锦橙采后病菌的毒性及其贮藏效果[J]. 食品科学, 2014, 35(22): 260-264. DOI:10.7506/ spkx1002-6630-201422051.
[7] 张万里, 乔润香, 尹飞, 等. 13 种植物提取物对5 种果蔬病原真菌的抑菌活性[J]. 华南农业大学学报, 2009, 30(2): 40-43.
[8] LOPES M R, KLEIN M N, FERRAZ L P, et al. Saccharomyces cerevisiae: a novel and efficient biological control agent for Colletotrichum acutatum during pre-harvest[J]. Microbiological Research, 2015, 175: 93-99. DOI:10.1016/j.micres.2015.04.003.
[9] ZHAO Yan, WANG Chen. Effect of calcium chloride in combination with salicylic acid on post-harvest freshness of apples[J]. Food Science and Biotechnology, 2015, 24(3): 1139-1146. DOI:10.1007/s10068-015-0145-5.
[10] MACHOWICZ-MATEJKO E, ZALEWSKA E D. Pharmacological substances in vitro in limiting growth and development of Fungi Colletotrichum genera[J]. Journal of Ocular Pharmacology and Therapeutics, 2015, 31(5): 303-309. DOI:10.1089/jop.2014.0128.
[11] AIELLO D, CARRIERI R, GUARNACCIA V, et al. Characterization and pathogenicity of Colletotrichum gloeosporioides and C. karstii causing preharvest disease on Citrus sinensis in Italy[J]. Journal of Phytopathology, 2015, 163(3): 168-177. DOI:10.1111/jph.12299.
[12] R AHUL P R, GANESH K V, SATHYABHAMA M, et al. Characterization and 3D structure prediction of chitinase induced in sugarcane during pathogenesis of Colletotrichum falcatum[J]. Journal of Plant Biochemistry and Biotechnology, 2015, 24(1): 1-8. DOI:10.1007/s13562-013-0226-6.
[13] 杨志敏, 毕阳, 李永才, 等. 马铃薯干腐病菌侵染过程中切片组织细胞壁降解酶的变化[J]. 中国农业科学, 2012, 45(1): 127-134. DOI:10.3864/j.issn.0578-1752.2012.01.015.
[14] JORGE I, NAVAS-CORTES J A, JIMENEZ-DIAZ R M, et al. Cell wall degrading enzymes in fusarium wilt of chickpea: correlation between pectinase and xylanase activities and disease development in plants infected with two pathogenic races of Fusarium oxysporum f. sp. ciceris[J]. Canadian Journal of Botany, 2006, 84(9): 1395-1404. DOI:10.1139/B06-103.
[15] JAT B L, SHARMA P, GOUR H N. Production of enzymes and culture filtrates by Colletotrichum gloeosporioides Penz. causing banana fruit rot[J]. Proceedings of the National Academy of Sciences, India Section B: Biological Sciences, 2013, 83(2): 177-180. DOI:10.1007/s40011-012-0125-y.
[16] 檀根甲. 采后苹果与炭疽菌的相互作用及病害控制机理研究[D]. 合肥: 安徽农业大学, 2009.
[17] CAO Shifeng, YANG Zhenfeng, CAI Yuting, et al. Antioxidant enzymes and fatty acid composition as related to disease resistance in postharvest loquat fruit[J]. Food Chemistry, 2014, 163(15): 92-96. DOI:10.1016/j.foodchem.2014.04.084.
[18] ROCKENBACH M F, BONETI J I, CANGAHUALA-INOCENTE G C, et al. Histological and proteomics analysis of apple defense responses to the development of Colletotrichum gloeosporioides on leaves[J]. Physiological and Molecular Plant Pathology, 2015, 89: 97-107. DOI:10.1016/j.pmpp.2015.01.003.
[19] 李欣允, 陈维信, 刘爱媛. 炭疽病菌侵染对荔枝果实生理生化变化的影响[J]. 亚热带植物科学, 2006, 35(1): 1-4. DOI:10.3969/ j.issn.1009-7791.2006.01.001.
[20] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007: 68-70.
[21] 孙媛. 灰葡萄孢角质酶的致病作用及角质酶突变菌株的基因分析[D].扬州: 扬州大学, 2011.
[22] 王学奎. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2006: 167-172.
[23] 李春光, 周伟铎, 田魏, 等. 甘蔗渣纤维素提取及木质素与半纤维素脱除工艺探讨[J]. 中国农学通报, 2011, 27(4): 316-320.
[24] 赵景楠, 马喆, 耿文龙, 等. 新病害草莓褐色叶斑病病原菌细胞壁降解酶研究[J]. 中国农学通报, 2014(31): 261-266.
Dynamic Changes in Chemical Components of the Pericarp of Postharvest Citrus Fruit Inoculated with Colletotrichum gloeosporioides
GE Zhixing1, HE Mingyang1,2,3, ZENG Xiaofeng1, HUANG Xiaolan1, WANG Rikui1,2,3,*, ZHOU Lian1,2,3, HAN Leng1,2,3
(1. Citrus Research Institute, Southwest University, Chongqing 400712, China; 2. Citrus Research Institute, Chinese Academy of Agricultural Sciences, Chongqing 400712, China; 3. National Citrus Engineering Research Center, Chongqing 400712, China)
Objective: To examine dynamic changes in the activities of various cell wall-degrading enzymes (CWDEs), the contents of cell wall components and the activities of defense-related enzymes in citrus pericarp tissues infected with Colletotrichum gloeosporioides, aiming to gain more knowledge on the interaction between C. gloeosporioides and citrus fruits. Methods: Chemical components of the pericarp of citrus fruit inoculated with C. gloeosporioides were detected and comparatively analyzed during different sampling periods. Results: The activities of CWDEs including polygalacturonase (PG), polymethyl-galacturonase (PMG), carboxymethyl cellulose (Cx) and β-glucosidase (β-Glu) were detected in the infected tissue. The activities of CWDEs and cutinase remained at higher levels during the early infection period (day one to three post infection). The cell wall components including cellulose, hemicellulose and pectin showed a declining trend, but lignin content showed a rising trend during the infection of C. gloeosporioides. The activities of peroxidase (POD) and catalase (CAT) and the content of malonaldehyde (MDA) showed a rising trend in the citrus pericarp tissues infected with C. gloeosporioides. Conclusion: The CWDEs and cutinase play an important pathogenic role during the early stage of anthracnose, which accelerates the infection of pathogenic fungi by degrading the cell wall components. In addition, the infection of C. gloeosporioides accelerates membrane lipid peroxidation in host cells.
citrus; Colletotrichum gloeosporioides; cell wall-degrading enzymes; cell wall components; defense-related enzymes
10.7506/spkx1002-6630-201610045
S609.3;S666.4
A
1002-6630(2016)10-0266-06
盖智星, 贺明阳, 曾小峰, 等. 采后柑橘与胶孢炭疽菌互作过程中果皮成分的动态变化[J]. 食品科学, 2016, 37(10): 266-271. DOI:10.7506/spkx1002-6630-201610045. http://www.spkx.net.cn
GE Zhixing, HE Mingyang, ZENG Xiaofeng, et al. Dynamic changes in chemical components of the pericarp of postharvest citrus fruit inoculated with Colletotrichum gloeosporioides[J]. Food Science, 2016, 37(10): 266-271. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201610045. http://www.spkx.net.cn
2015-07-02
公益性行业(农业)科研专项(201203034);中央高校基本科研业务费专项(XDJK2013C014);
重庆市应用开发计划项目(cstc2013yykfA80008);重庆市科技支撑示范工程项目(cstc2014fazktjcsf80007)
盖智星(1990—),女,硕士研究生,研究方向为农产品贮藏工程。E-mail:gezhixing@sinocitrus.com
*通信作者:王日葵(1962—),男,副研究员,研究方向为果蔬采后理论及应用技术。E-mail:ewrk@163.com

