桑白皮多糖对呼吸道合胞病毒肺炎小鼠肺组织病理和外周血T细胞亚群的影响
董德刚,刘小雪,张秀英,王艺欢
(1.大连医科大学第二附属医院,辽宁 大连 116027;2.辽宁中医药大学研究生学院,辽宁 沈阳 110847)
桑白皮多糖对呼吸道合胞病毒肺炎小鼠肺组织病理和外周血T细胞亚群的影响
董德刚1,刘小雪2,张秀英2,王艺欢2
(1.大连医科大学第二附属医院,辽宁 大连 116027;2.辽宁中医药大学研究生学院,辽宁 沈阳 110847)
目的 通过研究桑白皮多糖对呼吸道合胞病毒(RSV)肺炎BALB/c小鼠肺组织病理形态和外周血T细胞亚群的影响,探讨桑白皮多糖对BALB/c小鼠RSV肺炎的干预机制。方法 BALB/c小鼠采用随机数字表法分为正常组、模型组、高剂量组、中剂量组、低剂量组,每组10只;除正常组外,用RSV(long株)经鼻腔接种,建立小鼠RSV肺炎模型。于感染当天,高、中、低剂量组分别给予桑白皮多糖182、91、45.5 mg·kg-1·d-1灌胃,正常组与模型组给予等体积生理盐水灌胃,每天1次,于感染第7天取外周血进行T细胞亚群的检测及肺组织进行HE染色。结果 桑白皮多糖能有效地减少肺泡壁炎细胞的浸润,改善肺组织的炎症状况。高、中、低剂量组与模型组比较,高剂量组CD3+T细胞百分率为(50.35±8.97)%、CD4+T/CD8+T为(3.52±0.79),差异有统计学意义(P<0.05);中剂量组CD3+T细胞百分率为(55.05±5.94)%、 CD4+T细胞百分率为(20.39±5.56)%、CD4+T/CD8+T为(2.88±0.56),差异有统计学意义(P<0.05) ;低剂量组只有CD4+T/CD8+T为(3.49±0.45),差异有统计学意义(P<0.05)。结论 桑白皮多糖可以改善肺炎小鼠肺组织病理变化,能够调节机体细胞免疫。
桑白皮多糖;肺炎;呼吸道合胞病毒;小鼠;T细胞亚群
呼吸道合胞病毒(respiratory syncytial virus,RSV)是导致婴幼儿严重下呼吸道感染的重要的病毒病原之一[1-2]。但至今尚未有能够用于预防人RSV感染的疫苗问世[3],中药单体和复方对于呼吸道合胞病毒防治研究取得了巨大的成果[4]。桑白皮为桑科植物桑MorusalbaL.的干燥根皮,功效泻肺平喘,利水消肿,用于肺热咳喘,小便不利,面目浮肿等症。《本草纲目》中云:“桑白皮专于利小水,乃实则泻其子也,故肺中有水气及肺火有余者,宜之”。为小儿呼吸道疾病常用中药。现代药理学研究表明,桑白皮具有止咳祛痰平喘[5]、保护急性肺损伤[6]等作用,桑白皮多糖为其主要活性成分之一。本研究将通过观察桑白皮多糖对RSV肺炎小鼠肺组织病理形态和外周血T细胞亚群的影响,探讨其对RSV感染是否存在防治作用,以期为RSV感染的防治和桑白皮的开发利用提供理论依据。
1 实验材料
1.1 动物 清洁级BALB/c小鼠50只,体质量12~14 g,雌雄各半,由辽宁长生生物有限公司提供,合格证号:SCXK(辽)2010-0001。
1.2 细胞 人喉癌上皮细胞(Hep-2细胞)由辽宁中医药大学附属医院病毒实验室提供;采用含有10%高品质胎牛血清的DMEM培养液,置于37 ℃、5%CO2培养箱里培养,以EDTA-胰酶按常规方法传代培养。
1.3 病毒 呼吸道合胞病毒(RSV)(long株,购于中国预防医学科学院病毒所毒种室),保存在辽宁中医药大学附属医院病毒室液氮罐中。
1.4 药品 桑白皮总多糖购自南京泽朗医药科技有限公司,批号:ZL20140815C。
1.5 主要试剂 抗小鼠CD3 单克隆抗体(APC标记,批号:100235)、抗小鼠CD4单克隆抗体(FITC标记,批号:100509)、抗小鼠CD8单克隆抗体(PE标记,批号:100707)均为Biolegend公司产品。
1.6 主要仪器 全自动流式细胞仪(BD FAcscalibur,美国);自动组织脱水机(LEICA TP1020 ,德国);自动组织染色机(LEICA Autostainer XL ,德国);石蜡包埋机(LEICA GE1150 ,德国);切片机(LEICA RM2135 ,德国);系统生物显微镜(OLYMPUS BX50F4,日本)。
2 实验方法
2.1 RSV的扩增及组织细胞半数感染量(TCID50)的测定 将复苏成功的RSV(long)株接种处于半对数生长期的、长成单层70%以上的Hep-2细胞增值,对RSV进行培养测定,应用Reed-Muench公式计算RSV(Long株)TCID50为10-2/100 μL。
2.2 动物模型的建立、药物干预 将50只BALB/c小鼠采用随机数字表法分为正常组、模型组、高剂量组、中剂量组、低剂量组,每组10只,在清洁级实验动物房适应性饲养3 d后,除正常组外其余各组小鼠给予RSV病毒long株每只50 μL滴入鼻孔(正常组以50 μL生理盐水滴鼻) 制备模型。滴鼻2 h后开始灌胃,高剂量组予桑白皮多糖182 mg·kg-1·d-1灌胃,中剂量组予桑白皮多糖91 mg·kg-1·d-1灌胃,低剂量组予桑白皮多糖45.5 mg·kg-1·d-1灌胃,正常组与模型组予等体积生理盐水灌胃,每天1次。
2.3 取材及指标检测 于感染第7天摘眼球取血,肝素管抗凝,用于流式细胞仪检测T细胞亚群;并处死小鼠取出肺组织,用4%的中性甲醛溶液固定,4 ℃保存,用于病理学观察。
取小鼠外周新鲜全血20 μL,加抗小鼠单克隆抗体CD3+、CD4+、CD8+各3 μL混合,静置15 min,加入红细胞(RBC)裂解液300 μL,静置10 min,流式细胞仪检测各组小鼠T细胞亚群的变化。将小鼠肺组织按常规方法石蜡包埋,切片,HE染色,光学显微镜下观察肺组织切片的组织形态特征。

3 结果
3.1 桑白皮多糖对RSV肺炎小鼠肺组织病理形态学的影响 正常组小鼠支气管、肺组织结构完整,未见明显的炎性细胞浸润,肺泡壁无增厚,管腔无分泌物。模型组小鼠可见肺泡壁上皮细胞受损,肺间质可见大量淋巴细胞、浆细胞、嗜酸性细胞浸润。高剂量组、中剂量组小鼠肺泡壁轻度增厚,肺间质见少量淋巴细胞、浆细胞、嗜酸性细胞浸润,低剂量组小鼠肺泡壁中度增厚,肺间质见中量淋巴细胞、浆细胞、嗜酸性细胞浸润详见图1。
3.2 桑白皮多糖对RSV肺炎小鼠外周血T细胞亚群的影响 模型组与正常组比较,模型组CD3+T细胞百分率、 CD4+T细胞百分率、CD8+T细胞百分率、CD4+T/CD8+T差异有统计学意义(P<0.05)。高剂量组、中剂量组、低剂量组与模型组比较,高剂量组CD3+T细胞百分率、CD4+T/CD8+T差异有统计学意义(P<0.05);中剂量组CD3+T细胞百分率、 CD4+T细胞百分率、CD4+T/CD8+T差异有统计学意义(P<0.05) ;低剂量组只有CD4+T/CD8+T差异有统计学意义(P<0.05)。结果见表1,图2。

图1 桑白皮多糖对各组RSV肺炎小鼠肺组织影响的病理图
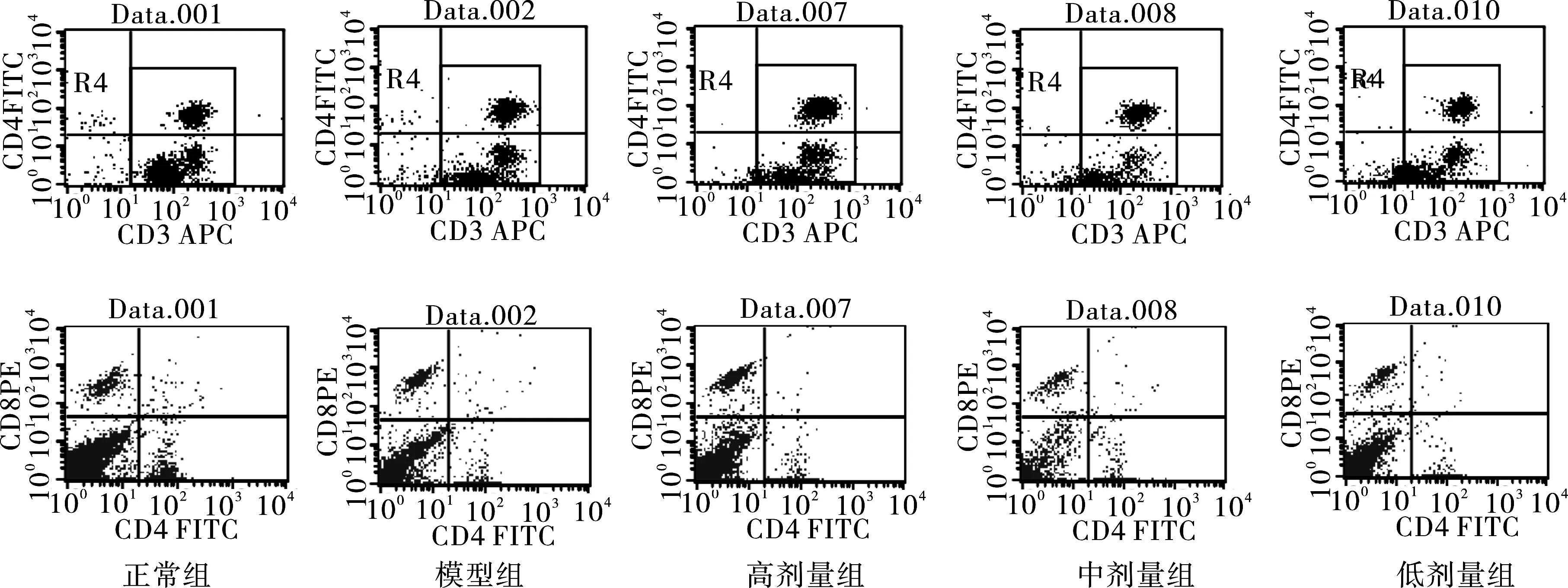
图2 各组小鼠全血的T细胞亚群流式图
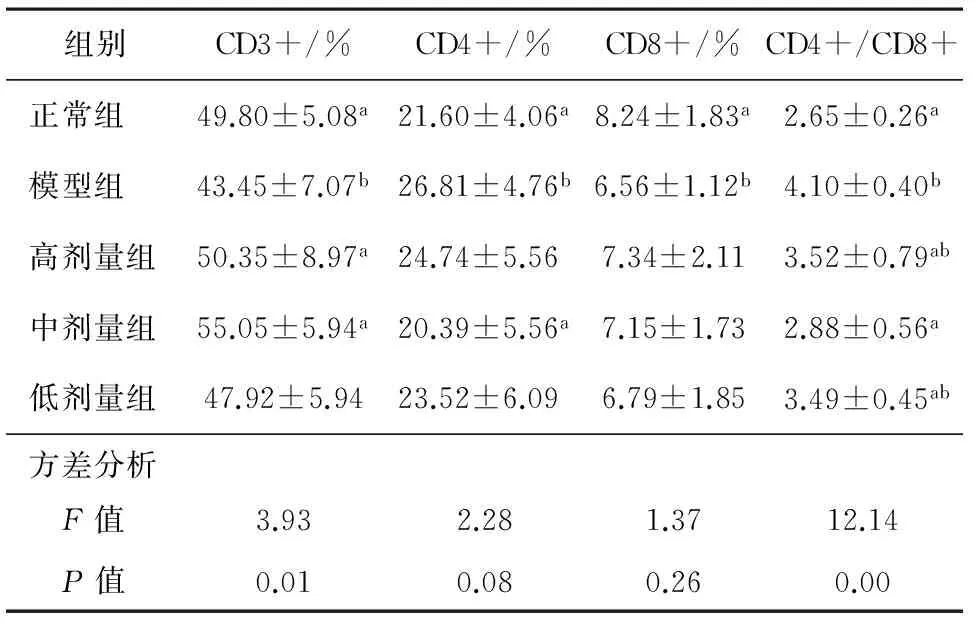
组别CD3+/%CD4+/%CD8+/%CD4+/CD8+正常组49.80±5.08a21.60±4.06a8.24±1.83a2.65±0.26a模型组43.45±7.07b26.81±4.76b6.56±1.12b4.10±0.40b高剂量组50.35±8.97a24.74±5.567.34±2.113.52±0.79ab中剂量组55.05±5.94a20.39±5.56a7.15±1.732.88±0.56a低剂量组47.92±5.9423.52±6.096.79±1.853.49±0.45ab方差分析 F值3.932.281.3712.14 P值0.010.080.260.00
注:与模型组比较aP<0.05;与正常组比较bP<0.05。
4 讨论
RSV主要是通过飞沫传播,从口鼻而入,常导致毛细支气管炎和支气管肺炎。有研究显示,小儿到了2岁,大多数都将会有RSV感染[7],婴儿期病毒感染率最高,在我国好发于冬、春季节[8-9]。中医将小儿RSV肺炎归属于“肺炎喘嗽”的范畴。小儿肺常不足,脏腑娇嫩,形气未充,腠理稀疏,卫外功能较弱,机体易被六淫邪气所伤,产生各种肺系疾病;又因小儿“阳常有余”,不论外感、内伤之邪,皆易从热化,从火化。结合临床实践经验和基础研究,针对小儿肺炎的病因病机提出了“从肺毒热论治小儿肺炎”[10]。故在小儿肺炎的治疗上应清泄肺中郁热,《本经逢原》中云:“桑根白皮,泻肺气之有余,止嗽而能利水,肺中有水气,及肺火有余者宜之”。现代文献分析发现,桑白皮在小儿肺炎风热闭肺证阶段和痰热闭肺证阶段辨证用药中单味药使用频次均较高[11],尤其在小儿肺炎中期的痰热闭肺证阶段。有文献报告[12],桑白皮多糖可通过促进淋巴细胞增殖而产生免疫调控作用。因此本实验研究了桑白皮多糖对RSV肺炎小鼠肺组织形态和T细胞亚群的影响,进一步阐释桑白皮多糖免疫调节作用。
本研究中采用RSV(long株)经鼻腔接种BALB/c小鼠,建立小鼠RSV肺炎模型。模型组与正常组比较,模型组小鼠肺组织可见肺泡壁上皮细胞受损,肺泡壁重度增厚,肺间质可见淋巴细胞、浆细胞、嗜酸性细胞等大量炎性细胞浸润;小鼠外周血中CD3+T细胞百分率、 CD4+T细胞百分率、CD8+T细胞百分率及CD4+T/CD8+T比值差异有统计学意义(P<0.05),提示RSV感染小鼠存在免疫平衡紊乱。T淋巴细胞按细胞表面抗原分为CD4+细胞和CD8+细胞等,CD4+分子多表达在T辅助细胞(Th) ,协助B细胞进行分化和产生抗体;CD8+即T抑制细胞(Ts) ,则具有杀伤和抑制作用。CD4+/CD8+比值的相对平衡对维持机体免疫稳定调控免疫应答起着重要作用,是反映人体免疫系统内环境稳定的重要标志之一[13]。
本实验中,桑白皮多糖高、中、低剂量组与模型组比较,高、中剂量组小鼠肺组织可见肺泡壁轻中度增厚,肺间质可见淋巴细胞、浆细胞、嗜酸性细胞等小量炎性细胞浸润,低剂量组小鼠肺组织可见肺泡壁中重度增厚,肺间质可见淋巴细胞、浆细胞、嗜酸性细胞等中小量炎性细胞浸润;高、中、低剂量的桑白皮多糖均可显著下调 RSV感染小鼠CD4+/CD8+比值,使其CD4+/CD8+比值趋于正常组小鼠的平衡状态,但高、中剂量的桑白皮多糖可显著上调 RSV感染小鼠CD3+T细胞百分率,中剂量的桑白皮多糖可显著下调 RSV感染小鼠CD4+T细胞百分率,这些结果表明:桑白皮多糖能够减轻RSV感染导致的机体肺组织炎症及调节T细胞亚群的平衡状态,且高、中剂量桑白皮多糖的治疗效果优于低剂量的桑白皮多糖。桑白皮多糖可能在机体免疫调节中发挥双重效应,一方面激活免疫系统增加清除病毒的能力,同时也调节免疫失衡状态来减轻肺组织的炎性损伤,使受病毒感染机体的快速康复,正气得复。今后将进一步从桑白皮多糖在免疫调节及在细胞内信号转导方面做深入研究,阐明其抗RSV的机制,为桑白皮的合理开发和利用提供更多的理论依据。
[1] Hall CB,Weinberg GA,Iwane MK,et al.The burden of respiratory syncytial virus infection in young children[J].N Engl J Med,2009,360(6):588-598.
[2] Lu G,Gonzalez R,Guo L,et al.Large-scale seroprevalence analysis of human metapneumovirus and human respiratory syncytial infections in Beijing,China[J].Virol J,2011,8(1):62.
[3] Graham BS.Biological challenges and technological opportunities for respiratory syncytial virus vaccine development[J].Immunological Reviews,2011,239(1):149-166.
[4] 朱莹莹,袁斌.中医药对小儿RSV感染的研究进展[J].浙江中医药大学学报,2014,38(2):227-229,232.
[5] 王小兰,赫金丽,张国顺,等.桑白皮水煎液及化学拆分组分止咳祛痰平喘作用研究[J].世界科学技术——中医药现代化 ,2014,16(9):1951-1956.
[6] 张天柱,姚金福,赵雷,等.桑白皮水提液对脂多糖诱导小鼠急性肺损伤的保护作用研究[J].时珍国医国药,2015,26(3):577-579.
[7] Dawson-Caswell M,Muncie HL.Respiratory syncytial virus infection in children[J].Am Fam Physician,2011,83(2):141-146.
[8] 江峤,程邦宁.2013年某院儿童急性呼吸道感染病因学特性分析[J].安徽医药,2015,19(4):725-727.
[9] 王雪峰.从肺毒热论治小儿肺炎本脏重症[J].中医杂志,2012,53(3):200-202.
[10] 张子燕,王雪峰,关艳楠,等.小儿肺炎风热闭肺证阶段辨证用药文献分析[J].中国实验方剂学杂志,2011,17(4):246-248.
[11] 关艳楠,王雪峰.肺炎喘嗽痰热闭肺证中药应用的文献分析[J].中国中西医结合儿科学,2010,17(5):396-397.
[12] Kim HM,Han SB,Lee KH,et al.Immunomodulating activity of a polysaccharide isolated from Mori Cortex Radicis[J].Arch Pharm Res,2000,23(3):240-242.
[13] 陈慰峰.医学免疫学[M].北京:人民卫生出版社,2001:179 .
Effects ofMorusalbaL.polysaccharide on lung tissue and T lymphocyte subtype in mice infected by respiratory syncytial virus
DONG Degang1,LIU Xiaoxue2,ZHANG Xiuying2,et al
(1.DalianMedicalUniversity,Dalian,Liaoning116027,China;2.LiaoningUniversityofTraditionalChineseMedicine,Shenyang,Liaoning110847,China)
Objective To investigate the effects ofMorusalbaL.polysaccharide on lung tissue and T lymphocyte subtype in BALB/c mice infected by respiratory syncytial virus.Methods Fifty young BALB/c mice were randomized into normal group,model group,high dosage group,middle dosage group and low dosage group.Except for the normal group,RSV was intranasally inoculated to mice.Aqueous solution of high,medium and low doses ofMorusalbaL.polysaccharide (182,91,45.5 mg·kg-1·d-1) were applied for the high,middle,low dosage group by gavage,and 0.9% sodium chloride solution for the normal group and model group by gavage,for a total of seven days.And then,pathological change and T lymphocyte subtype were detected.Results Morus alba L.polysaccharide could reduce the infiltration of inflammatory cells in the alveolar wall.Compared with the model group,the percentage of CD3+T(50.35±8.97)% ,CD4+T/CD8+T(3.52±0.79)in high dosage group were significantly different (P<0.05),the percentage of CD3+T(55.05±5.94)%,CD4+T(20.39±5.56)%,CD4+T/CD8+T(2.88±0.56) in middle dosage group were significantly different (P<0.05),and CD4+T/CD8+T(3.49±0.45)in low dosage group were significantly different (P<0.05).Conclusion Morus alba L.polysaccharide can improve the pathological change of lung tissue and promote cell immune adjustment in the infected mice.
MorusalbaL.polysaccharide;Pneumonia;RSV;Mice;T cell subtype
辽宁省科技厅攻关课题(2013225002)
董德刚,男,主任医师,研究方向:中医药防治病毒性疾病,E-mail:731939056@qq.com
10.3969/j.issn.1009-6469.2016.10.007
2016-04-05,
2016-06-14)

