豌豆白粉菌侵染对活性氧迸发规律和紫花苜蓿叶片结构的影响
张咏梅,马晖玲,唐云智
(1.甘肃农业大学研究测试中心,甘肃 兰州 730070;2.甘肃农业大学草业学院,甘肃 兰州 730070)
豌豆白粉菌侵染对活性氧迸发规律和紫花苜蓿叶片结构的影响
张咏梅1,2,马晖玲2,唐云智2
(1.甘肃农业大学研究测试中心,甘肃 兰州 730070;2.甘肃农业大学草业学院,甘肃 兰州 730070)
以专性寄生菌豌豆白粉菌接种紫花苜蓿,采用比色法和组织化学法对活性氧·O2-和H2O2迸发的时间、强度及作用位点进行了研究;并就侵染部位的叶片制作了石蜡切片,对叶片结构进行了观察。结果表明,接种后,抗性品种庆阳苜蓿·O2-和H2O2迸发均呈双峰形,·O2-出现在接菌后4和48 h,H2O2出现在接菌后4和24 h,且第一次高峰强度高于第二次;而感病品种德宝苜蓿·O2-含量未出现明显波动,H2O2迸发呈单峰形,仅在接菌后4 h出现一次迸发高峰。对活性氧ROS的作用位点进行研究发现,在叶片表面和内部细胞均未发现蓝色的·O2-沉积位点;而H2O2产生并积累于苜蓿上、下表皮细胞的细胞膜及受侵染处叶肉细胞的细胞质。此外,首次发现病原菌侵染后,苜蓿叶片组织结构也相应发生了改变,表皮细胞下的栅栏组织由一个长柱形细胞变为了多个卵圆形细胞,以致难以区分栅栏组织和海绵组织。本研究结果说明,不同植物种与病原菌互作中,活性氧积累的时间和强度均不相同,启动防御反应的活性氧种类亦不同;苜蓿叶肉细胞结构和形态改变可能是抵御白粉菌侵染的积极反应之一。
过氧化氢;超氧阴离子;过敏性反应;解剖结构
苜蓿(Medicagospp.)是一种产量高、品质优、耐刈割的优良豆科牧草,对于我国国民经济和畜牧业发展具有重要作用。其根系发达,具有根瘤菌更是改良土壤和水土保持的重要植物[1-2]。目前,世界上苜蓿种植面积约0.33亿hm2,其中,我国现有栽培面积约188万hm2。由于苜蓿的大面积种植,粗放型经营,为病害的猖獗创造了条件。据不完全统计,全国的苜蓿病害大约有数十种[3-4],严重影响苜蓿的产量和饲用品质(营养成分降低,有害物质增加),进而影响家畜健康,降低畜产品质量[5]。据报道苜蓿霜霉病、褐斑病等多种病害造成苜蓿减产大约在15%~70%[3],粗蛋白含量和可消化率均显著下降[6-11]。近几年来,随着我国草地畜牧业的发展和农业产业结构的调整,苜蓿种植面积进一步扩大,病害问题严重影响我国畜牧业和草产业的长足发展。
近几年来,人们致力于研究植物的抗病性及其调控机制。越来越多的证据表明以超氧阴离子(·O2-)和过氧化氢(H2O2)为主要成分的活性氧(reactive oxygen species, ROS)在植物抗病反应中起重要作用。植物与病原菌相互识别能诱导ROS在短时间内快速产生并大量累积,产生活性氧迸发[12-13]。研究表明,活性氧迸发能启动膜脂过氧化作用,促进寄主产生过敏反应(hypersensitive response,HR)[14];H2O2和·O2-等活性氧对病原菌具有直接的毒害作用。Keppler等[15]以野火病细菌接种烟草(Nicotianatabacum)悬浮细胞,悬浮细胞液产生大量活性氧,细菌数量显著下降,加入SOD酶后细菌数量又增加,并推迟了HR的出现时间;活性氧可以使植物细胞壁的强度增强,引发细胞壁结构蛋白和酚类物质的交联,还能将多聚糖连接成聚合体,加固细胞壁的结构[16];活性氧能诱导植保素的生成。已有大量报导证明植保素的合成需要活性氧,活性氧直接或间接地调节着与植保素合成相关基因的表达[17]。此外,活性氧参与系统获得抗性(system acquired resistance, SAR)的建立。水杨酸作为诱导系统获得抗性不可缺少的重要信号分子,其作用可能是通过抑制过氧化物酶的活性而引起H2O2水平的上升,由H2O2或其他活性氧作为第二信使,激活抗病途径中的防御相关基因来实现的[18]。活性氧在植物体内具有多条产生途径,其产生部位主要是存在多种氧化酶的细胞壁[19-20]、光合电子传递链的叶绿体[21]以及呼吸作用的线粒体和微粒体[21-22];相应地,植物体内也拥有多种抗氧化酶和丰富的抗氧化物质两大酶促的和非酶促的自由基清除系统。
有关活性氧在植物中的产生机制、清除系统、生理功能等方面已进行了大量的研究。在植物与病原物互作体系中,尤其对单子叶植物小麦(Triticumspp.)与条锈病互作下活性氧的迸发规律、空间分布位点,以及相应的氧清除系统进行了较深入的研究[23-25]。然而,双子叶植物苜蓿与专型寄生菌豌豆白粉菌互作中的活性氧迸发特征,尤其是白粉菌侵染后苜蓿叶片解剖结构变化的研究国内外尚无报道。
植物在与病原菌协同进化过程中,演化出的抗病方式千差万别、各有千秋。目前,饲草作物的抗性机制研究远落后于粮食作物和蔬菜作物。本研究拟以豌豆白粉菌(Erysiphepisi)接种抗/感性不同的苜蓿品种(德宝——高感品种S,庆阳苜蓿——高抗品种R),通过对H2O2、·O2-的测定和组织化学定位,研究活性氧迸发对病原菌侵染的时间和空间的响应;白粉菌侵染后,苜蓿的防御系统在解剖学方面的积极应对。掌握活性氧积累和苜蓿抗病性之间的关系,为充分利用苜蓿的自身抗病性提供理论依据。
1 材料与方法
1.1 材料的种植与取样方法
紫花苜蓿材料“德宝”(Medicagosativavar. derby)和“庆阳苜蓿” (Medicagosativavar. qingyang)种子由甘肃农业大学曹致中教授馈赠。
选取籽粒饱满的苜蓿种子于2014年7月1日播种于直径30 cm的花盆中,浇透水,并覆以PE薄膜(0.01 mm)保湿。出苗后,于黄昏时去掉薄膜。待幼苗长至3 cm高时,进行疏苗,每盆保留15株左右健壮幼苗。苜蓿豌豆白粉菌采自甘肃农业大学兰州牧草试验站,经鉴别确定无误后在甘农3号紫花苜蓿上隔离繁殖。2014年8月25日收集新鲜菌丝体和分生孢子采用涂抹法进行接种。接种后搭小拱棚并覆以PE膜保湿。
分别于接种后0、3、7、13 d取样,取苜蓿小叶置5 mL离心管中加入卡诺液固定,观察菌丝生长情况;取苜蓿小叶分别加入3-(N-吗啉)丙磺酸液(MPOS液)(含二氨基联苯胺DAB)(对照叶片先置于牛肝过氧化氢酶液中2 h,再置于 MPOS液)和4-羟乙基哌嗪乙磺酸液(HEPES液)(含氮蓝四唑NBT)(对照叶片先置于超氧化物歧化酶中30 min,再置于HEPES液)中观察H2O2和·O2-沉积位点;分别于接种后0.5、1、2、4、8、24、48、72和96 h取样,称取0.5 g样品多份用锡铂纸包好,迅速投入到液氮中,于-80 ℃贮存备用测·O2-和H2O2含量。
1.2·O2-含量的测定
参照王晨芳[24]文献,采用羟胺氧化法。0.5 g叶片加2.5 mL磷酸缓冲液(pH 7.8,0.1 mol/L)研磨匀浆,10000 r/min离心10 min 。取上清液1 mL加0. 9 mL上述磷酸缓冲液,再加0. 1 mL 10 mmol/L盐酸羟胺,25 ℃温育培养20 min。然后加入1 mL 17 mmol/L的对氨基苯磺酸和1 mL 7 mmol/L的α-萘胺,25 ℃下再温育培养20 min。反应后的显色液用同体积乙醚充分摇匀,6000 r/min离心分层,弃去乙醚相,取粉红色的水相测A530,用磷酸缓冲液代替样品做空白。用NaNO2做标准曲线,从标准曲线y=234.4x-3.3316 (R2=0.9939)上求出·O2-值,单位为μmol/L。
1.3 H2O2含量的测定
参照Patterson等[26]的方法并改进。0. 5 g叶片加少许石英砂和3 mL预冷的丙酮磨成匀浆,10000 r/min离心10 min ,保留上清液。取0.5 mL上清液加0.1 mL含20% (V/V) TiCl4的浓盐酸溶液和0. 2 mL浓氨水(17 mol/L),混合后6000 r/min离心10 min,生成的过氧化物Ti复合物用丙酮洗5次,丙酮挥发后溶于4 mL 2 mol/L的硫酸中测A410。另外以 H2O2做标准曲线,从标准曲线y=2.6583x-0.0305 (R2=0.9942)上求出H2O2值,单位为μmol/L。
1.4·O2-细胞化学定位
苜蓿小叶剪下后立即浸入0.1% 的 NBT(溶剂为50 mmol/L pH 7.2的HEPES缓冲液)(含10 mmol/L 叠氮钠)中,真空抽滤5~10 min,光照至出现特异性的蓝色斑点,叶片浸入热酒精中脱色。阴性对照叶片用NBT染色之前,先浸入1 mmol/L SOD酶中3 h,然后再浸入NBT 中染色。Motic SMZ-168体视显微镜观察并拍照。观察后的叶片制作为石蜡切片,厚度5 μm。切片无需染色,二甲苯透明后直接封片。ZEISS Imager A2显微镜观察,采用 Axio Cam MRc5 软件进行图像采集。
1.5 H2O2细胞化学定位
紫花苜蓿小叶剪下后立即浸入1% DAB (溶剂为50 mmol/L pH 7.2的MOPS缓冲液)中,真空抽滤5 min后,室温下避光温育8 h。至DAB与H2O2反应产生棕色斑点以后,将叶片浸入热酒精中使叶片脱色并使棕色斑点显现。为了核实染色沉积物的特异性,将对照叶片用DAB染色之前,先浸入25 μg/μL牛肝过氧化氢酶中2 h,然后再浸入1% DAB 中染色30 min。Motic SMZ-168体视显微镜观察并拍照。观察后的叶片制作石蜡切片,厚度5 μm。切片无需染色,二甲苯透明后直接封片。ZEISS Imager A2显微镜观察,采用 Axio Cam MRc5 软件进行图像采集。
1.6 木质素化学定位
苜蓿叶片先用一滴1 mol/L盐酸浸透,然后滴加一滴含5%~10%间苯三酚的85%酒精溶液,木质化的部位即被染为桃红色至紫红色。
1.7 数据统计与分析
采用SPSS Statistics 17.0软件单因素完全随机设计ANOVA分析所测数据,Duncan’s新复极差法进行显著性方差分析。
2 结果与分析
2.1 活性氧迸发
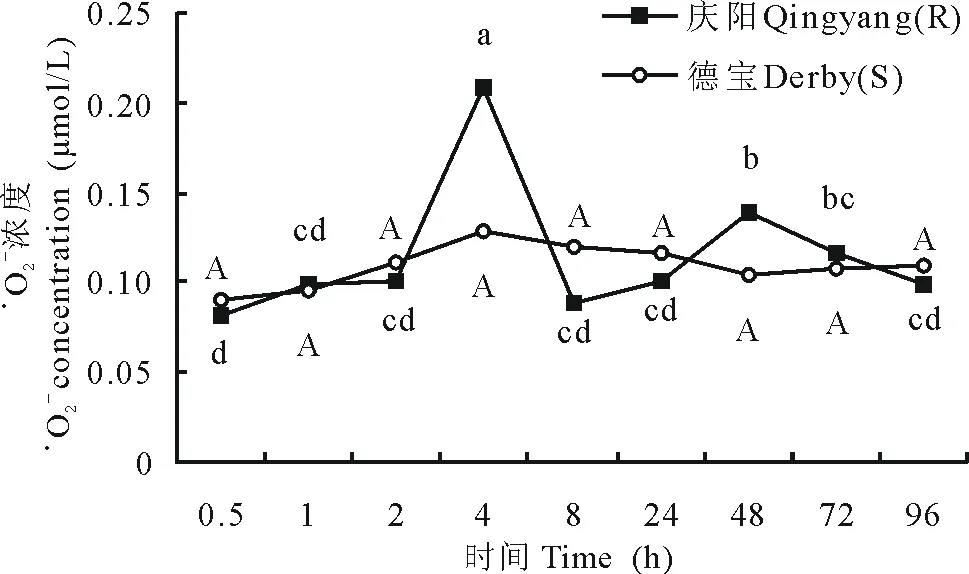
图1 接种豌豆白粉菌后,紫花苜蓿叶片·O2- 迸发趋势Fig.1 After inoculation with E. pisi, the tendency of ·O2- burst in M. sativa不同小写字母代表庆阳苜蓿间P<0.05显著水平;不同大写字母代表德宝苜蓿间P<0.05显著水平。下同。Different lowercase letters denote significant differences at P<0.05 in Qingyang alfalfa; Different capital letters denote significant differences at P<0.05 in Derby alfalfa. The same below.
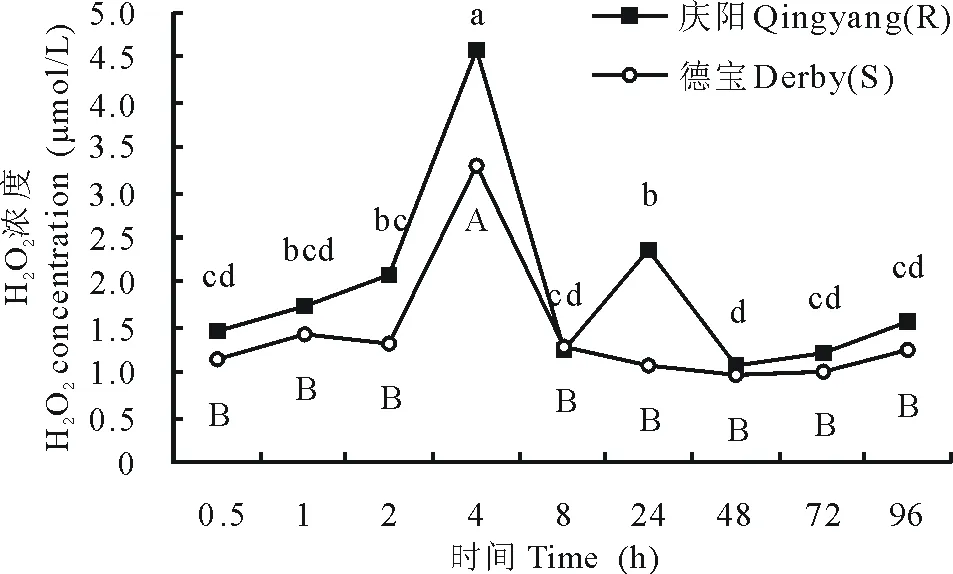
图2 接种豌豆白粉菌后,紫花苜蓿叶片H2O2迸发趋势Fig.2 After inoculation with E. pisi, the tendency of H2O2 burst in M. sativa
2.1.1 苜蓿叶片中·O2-迸发时间及强度 紫花苜蓿接种豌豆白粉菌之后,抗病性不同的苜蓿品种其·O2-迸发表现不尽相同。庆阳苜蓿叶片·O2-迸发呈双峰形,迸发高峰分别出现在接种后4和48 h,强度分别是接种前的2.55和1.71倍。德宝苜蓿·O2-浓度未出现明显波动,始终在0.1076 μmol/L左右。
2.1.2 苜蓿叶片中H2O2迸发时间及强度 接种豌豆白粉菌之后,抗病性不同的苜蓿品种叶片中产生H2O2的时间点和积累量不完全一致。庆阳苜蓿H2O2迸发呈双峰形,迸发高峰分别出现在接种后4和24 h,强度分别是接种前的3.27和1.61倍。德宝苜蓿H2O2迸发呈单峰形,迸发高峰出现在接种后4 h,且强度是接种前的2.99倍。
2.2 活性氧的定位
2.2.1 苜蓿叶片中·O2-组织化学定位 分别于接种后0、3、7、13 d取样,以NBT染色苜蓿叶片,对·O2-进行组织化学定位,观察·O2-在叶片的集聚位点。预以SOD酶清除·O2-,再以NBT染色的叶片作为对照(图3A)。由图3可以观察到:白粉菌接种苜蓿叶片后,0~13 d的叶片上未见到明显的蓝色着色点,即·O2-集聚位点(图3A~E);在接种7 d的叶片上出现大量枯黄色的HR坏死斑点(图3D);13 d的叶片上肉眼可见白粉菌菌丝体(图3E,箭头所指)覆盖在叶片表面。将观察并拍照后的苜蓿叶片制作成石蜡切片,对其组织进行更细致的观察。在目镜10倍,物镜分别为10和40倍的镜头下,叶片横切面上、下表皮细胞、海绵组织和栅栏组织细胞清晰可辨,可是仍未发现明显的·O2-的蓝色(图3G~J)着色位点。图3F相片所示叶片上的蓝色着色斑点,经分析发现是田间白虱取食伤口为NBT染色所致。

图3 接种豌豆白粉菌后,紫花苜蓿叶片·O2- 集聚位点Fig.3 After inoculation with E. pisi, the location of ·O2- accumulation in M. sativa A~E:白粉菌侵染的苜蓿叶片;F:白虱取食的苜蓿叶片;G~J:苜蓿叶片横切面(×10和×40倍,蓝色部位为·O2- 组织化学定位处)。SOD+NBT:NBT染色前先以SOD预浸泡的对照;NBT:以NBT直接染色的样品。vb: 维管束; pt: 栅栏组织; st: 海绵组织; de: 下表皮; ue: 上表皮。 A-E: Represent alfalfa leaves infected by E. pisi; F: Alfalfa leaves ingested by louselice; G-J: Section of leaf (×10 and ×40 times, blue spots were location of ·O2-). SOD+NBT: The controls soaked in SOD before dyeing with NBT; NBT: The samples dyed with NBT. vb: Vascular bundle; pt: Palisade mesophyll cell; st: Spongy mesophyll cell; de: Down-epidermis; ue: Upper-epidermis.

图4 接种豌豆白粉菌后,紫花苜蓿叶片H2O2集聚位点Fig.4 After inoculation with E. pisi, the location of H2O2 accumulation in M. sativa K1~K3,L1~L3:苜蓿叶片;K4~K5,L4~L5,M,N:苜蓿叶片横切面(×10和×40倍,棕色部位为H2O2组织化学定位处)。K1~K5:CAT预处理的对照苜蓿叶片;L1~L5:MOPS缓冲液含DAB染色的苜蓿叶片;CAT+DAB:DAB染色前先以CAT预浸泡的对照;DAB:以DAB直接染色的样品。M:DAB染色的健康苜蓿叶片;N:DAB染色的感病苜蓿叶片。K1-K3, L1-L3:Alfalfa leaves; K4-K5, L4-L5, M, N: Section of leaf (×10 and ×40 times; brown spots were location of H2O2). K1-K5:Alfalfa leaves of control pretreated with CAT; L1-L5:Alfalfa leaves soaked in MOPS buffer containing DAB.CAT+DAB: The controls soaked in CAT before dyeing with DAB; DAB: The samples dyed with DAB. M: Healthy alfalfa leaves coloring with DAB; N: Infected alfalfa leaves coloring with DAB.
2.2.2 苜蓿叶片中H2O2组织化学定位 接种豌豆白粉菌后,以DAB染色苜蓿叶片示踪H2O2集聚位点(棕色着色点)。以预先CAT酶液浸泡处理,再以DAB染色的叶片作为对照。如图4所示,接种当天,叶片叶脉清晰,叶面干净(图4K1,L1);接种3 d后,叶片侵染处出现棕色斑点,即H2O2集聚位点(图4L2),至第7天,H2O2集聚点更多、更密集(图4L3);对照第7天叶片同样观察到HR坏死斑。将叶片制作成石蜡切片后,观察发现,对照叶片无色透明,叶缘难以辨识(图4K4,K5);而DAB染色的苜蓿叶片上、下表皮细胞胞壁均呈浅棕色,叶缘清晰(图4M,N);病原菌侵染处,皮下叶肉细胞着色更深,H2O2集聚浓度更大,叶肉细胞胞膜和细胞质,甚至细胞核也染为深棕色,而相邻未受害细胞着色很浅(图4L4,L5)。说明接种豌豆白粉菌后,上下表皮细胞的细胞膜电子传递链和受害位点叶肉细胞的细胞质都是细胞中活性氧产生的重要位点。由于活性氧迸发是把双刃剑,杀死入侵病原菌的同时,也会使自身组织受害。因此,苜蓿植株仅在白粉菌侵染点大量爆发H2O2,以抵御病原菌侵染,而在未受侵部位维持较低的H2O2浓度水平。此外,图4N图片显示,菌丝侵染处,表皮下叶肉细胞变为了圆球形,栅栏组织和海绵组织细胞难以区分。
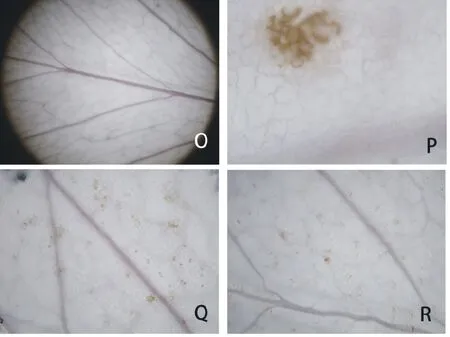
图5 接种豌豆白粉菌后,紫花苜蓿叶片HR坏死斑Fig.5 After inoculation with E. pisi, necrosis spots of HR in M. sativaO:0 d苜蓿叶片;P:过敏性反应坏死病斑;Q:庆阳苜蓿叶片坏死病斑;R:德宝苜蓿叶片坏死病斑。O: Alfalfa leaves at 0 day; P: Necrosis spots of hypersensitive reaction; Q: Necrosis spots in Qingyang alfalfa; R: Necrosis spots in Derby alfalfa.

图6 接种豌豆白粉菌后,苜蓿叶片解剖结构变化Fig.6 After inoculation with E. pisi, the changes in anatomical structure of leaf in M. sativaS:接种0 d苜蓿叶片(×10);T:接种0 d苜蓿叶脉(×10);U:接种7 d苜蓿叶片(×10); V:接种7 d苜蓿叶脉(×10)。S: Alfalfa leaves at 0 day after inoculation (×10); T: Main vein at 0 day after inoculation (×10); U: Alfalfa leaves at 7 day after inoculation (×10); V: Main vein at 7 day after inoculation (×10).
2.3 过敏性坏死
接种豌豆白粉菌后,按照一定的时间间隔取样并固定在卡诺液中。更换2~3次卡诺液,叶片组织变得洁白,经间苯三酚染色,木质化的叶脉(主脉和次脉)变成了鲜艳的桃红色至玫红色(图5O)。叶片表皮细胞呈不规则拼图样紧密相连(图5P)。HR坏死处细胞壁加厚加粗,为枯黄色,并未染为红色,说明HR坏死处细胞壁加强并不是木质化加厚(图5P)。对抗性不同的两苜蓿品种观察发现,无论抗病性大小,叶片均出现或多或少的HR坏死(图5Q,R)。
2.4 苜蓿叶片解剖结构的变化
接种豌豆白粉菌前,紫花苜蓿叶片具有典型的异面叶的结构,上、下表皮细胞之间是结构明显不同的两种叶肉细胞——长圆形的栅栏组织细胞和偏圆形的海绵组织细胞(图6S,T)。栅栏细胞1层或1~2层,排列整齐像一道篱笆位于叶片近轴面;远轴面的海绵细胞3~4层分布均匀。病原菌侵染7 d后,叶肉细胞结构发生了巨变。栅栏细胞由一个长圆形细胞变为多个偏圆形小细胞,致使两种叶肉细胞结构类似,难以区分(图6U,V)。
3 讨论
在不同病原物与寄主植物的互作反应中,活性氧的积累通常表现出不同的时间变化特征和空间分布规律。在病原菌及植物源试剂的刺激下,悬浮培养的植物细胞ROS的积累是双阶段的。快速、微弱而短暂的第一阶段积累;紧跟着是一个持续的、大量的、且更重要的第二阶段积累。第一阶段的ROS积累与任何无毒或强毒病原菌对植物的侵染相关,这可能不依赖于ROS产生酶系统;而第二阶段的ROS积累仅仅与强致病力的病原菌侵染有关,是一种依赖于增加了mRNA转录水平的诱导反应,这种mRNA编码了ROS产生酶[27-28]。然而,这些对悬浮细胞的研究结论,由于细胞间缺乏相互的联系,其ROS积累规律可能并不完全适用于植物与病原菌互作体系。
3个小麦品种在受到条锈菌侵染后发生的ROS迸发在植物抵御病菌侵染中具有关键作用,在非亲和互作中,小麦CY-23 和 CY-25 中ROS 积累出现两个峰值,分别在接种后第2天和第 5~6天[23]。在亲和互作中,小麦CY-29 只有一个峰值出现,出现时间与非亲和互作的第2个活性氧高峰期一致,且推测前期起作用的 ROS 主要是 H2O2,其作用是作为信号物质激活细胞对病菌的包括 HR 在内的防卫反应;而后期起作用的主要是·O2-,其作用是杀死病菌和细胞本身[23]。随后,对小麦成株抗条锈病研究发现,在分蘖期和孕穗期小麦-条锈菌组合中,小麦叶片于接种后24 和36 h分别形成·O2-迸发高峰,24 h和72~96 h形成 H2O2迸发高峰;·O2-和H2O2迸发高峰出现时间虽不完全一致,但是具有相似的双峰特征;而在苗期组合中,病菌的大多数侵染并没有诱导·O2-和H2O2的产生[25]。以溃疡病菌(Botryosphaeriadothidea)接种抗性水平不同的杨树(Populusspp.),两种杨树树皮中的·O2-产生速率和H2O2含量随接种时间的延长均有上升趋势,抗病杨树毛白杨(P.tomentosa)出现了较明显的“氧化爆发”,感病杨树北京杨(P.beijingensis)则不明显[29]。本研究接种豌豆白粉菌后,抗性品种庆阳苜蓿·O2-和H2O2迸发均呈双峰形,第一次高峰出现在接菌后4 h,且迸发强度高于第二次高峰;而感病品种德宝苜蓿·O2-含量未出现明显波动,H2O2迸发呈单峰形,仅在接菌后4 h出现一次迸发高峰。对于苜蓿-豌豆白粉菌互作体系研究,ROS迸发结果不完全与前人研究的植物-病原菌互作体系相同,活性氧迸发高峰出现时间早,接菌后4 h即出现第一次迸发高峰,且起主要作用的是H2O2;亦不同于前人对植物悬浮细胞-病原菌的研究结论,活性氧迸发的第一次高峰强度远高于第二次积累高峰。说明不同植物种与病原菌互作中,活性氧积累的时间和强度均不相同,启动防御反应的活性氧种类亦不同。图3 F所示叶片上的蓝色着色斑点,经分析发现是田间白虱取食伤口为NBT染色所致。说明昆虫取食处有·O2-迸发产生,具体·O2-迸发为苜蓿抵御昆虫取食诱导自身产生,还是昆虫为突破防御所释放?还待进一步分析研究。
当植物受到病原微生物侵染以后,通常在病原体入侵位点的细胞和一些邻近细胞产生一种非常迅速的自发死亡的现象,形成坏死斑,从而阻止病害的进一步发展,即过敏反应(HR)[30-32]。HR由病菌侵袭的识别引发,紧跟着出现活性氧迸发,诱导了防御相关基因的表达和过敏性细胞死亡[32]。Delledonne等[33]发现,与NO互作引起过敏性细胞死亡的信号分子是由 SOD催化·O2-产生的H2O2,而非·O2-本身。以晚疫病菌Phytophthorainfestans接种马铃薯(Solanumtuberosum),其叶片·O2-的积累水平与过敏性坏死细胞数量呈正相关[34-35]。或许不同的植物-病原物互作体系,诱发HR的ROS种类并不完全一致。本研究发现,接种豌豆白粉菌后,抗病品种(庆阳苜蓿)和感病品种(德宝苜蓿)叶片均出现了明显的HR坏死斑,结合ROS迸发规律,分析发现苜蓿HR仅与H2O2积累有关,可能是H2O2第一次迸发高峰诱发了程序性细胞死亡(PCD)相关基因的表达,从而出现了HR坏死。且在HR坏死斑处,上表皮细胞壁加强,菌丝扩展受到较明显的抑制。一般来说这种细胞壁的强化,一是由于细胞壁木质化作用[36];二是富含羟脯氨酸的糖蛋白(HRGP)等细胞壁结构蛋白和酚类物质在细胞壁上的交错网状沉积[16]。对受侵染苜蓿叶片以间苯三酚染色发现,HR坏死斑处的细胞壁不能染为红色,说明活性氧H2O2迸发可能引起了苜蓿表皮细胞的细胞壁结构蛋白发生氧化交联,从而强化了细胞壁,而非木质化加厚。 HR处,胞壁加强限制了病原菌丝向邻近细胞的扩展,同时死亡的细胞不能持续为活体营养型病原菌提供营养,从而抑制或延缓活体营养型病原体的生长和扩散。
首次发现,接种豌豆白粉菌后,紫花苜蓿叶片的栅栏组织细胞由一个长圆形细胞变为多个偏圆形小细胞,增加了进行光合作用的叶肉细胞层数,将营养物质和光合作用功能局域化,光合单位最小化,这可能是苜蓿抵御病原菌侵染的策略之一。栅栏组织细胞含有大量的叶绿体,是植物光合作用的重要场所,其体积大,在上表皮细胞下只有1层或1~2层。一旦病原菌侵染成功,损害栅栏组织细胞的光合作用功能,可能对植物造成巨大伤害。苜蓿叶片栅栏组织细胞的形态学改变可能规避这种风险,将病原菌对植物叶片光合作用的损害降低到最小,将功能发挥到最大。
[1] Chen W X. The role of legumes-root nodule bacteria nitrogen fixing system in development of west area of China. Acta Agrestia Sinica, 2004, 12(1): 12.
[2] Shi Y C. Extricate ourselves from the dilemma of desertification control and return of reclaimed farmland (to afforested area). Acta Agrestia Sinica, 2004, 12(2): 83-86.
[3] Yuan Q H. Advances in alfalfa diseases in China. Plant Protection, 2007, 33(1): 6-10.
[4] Liu R, Hou T J. A preliminary list of fungal diseases on forage legumes in northern China. Chinese Journal of Grassland, 1984, 1: 56-61.
[5] Nan Z B. Alfalfa diseases and their integrated control systems in our country. Animal Science & Veterinary Medicine, 2001, 18(4): M1-M4.
[6] Lv X L, Ai L, Yin Q S,etal. The investigation of the downy mildew of alfalfa. The Journal of Gansu Agricultural University, 1976, (3): 39-42.
[7] Nan Z B. The influence of rust disease on the nutritional ingredients ofMedicagosativa. Journal of Grassland and Forage in China, 1985, 3(2): 33-36.
[8] Geng H Z. Chinese Alfalfa[M]. Beijing: China Agriculture Press, 1995: 114-130.
[9] Hou T J, Zhou S Q. Influence of downy mildew on growth and root nodulation of seedlings of alfalfa. Grassland of China, 1997, 2: 52-54.
[10] Su S C, Wang X W, Wang C L,etal. Occurrence of common leafs pot of alfalfa in Xinjiang. Pratacultural Science, 1997, 14(5): 31-33.
[11] Yuan Q H, Li X L, Zhang W S. Studies onPseudopezizamedicaginisand its biological characteristics. Plant Protection, 2001, 27(1): 8-12.
[12] Lamb C, Dixon R A. The oxidative burst in plant disease resistance. Annual Review Plant Physiology and Plant Molecular Biology, 1997, 48: 251-275.
[13] Wojtaszek P. Oxidative burst an early plant response to pathogen infection. Biochemical Journal, 1997, 322: 681-692.
[14] Keppler L D, Baker C J.·O2-initiated lipid peroxidation in a bactia-induced hypersensitive reaction in tobacco cell suspension. Phytopathology, 1989, 79: 555.
[15] Keppler L D, Baker C J. Initiated lipid peroxidation in a bacteria induced hypersensitive reaction in tobacco suspension cells. Phytopathology, 1989, 79: 974-978.
[16] Wang L G, Li L. Role of reactive oxygen intermediates and nitric oxide in resistance to plant diseases. Chinese Bulletin of Botany, 2003, 20(3): 354-360.
[17] Guo Z J, Li D B. Active oxygen species in plant disease resistance. Acta Botanica Sinica, 2000, 42(9): 881-891.
[18] Sun D Y, Guo Y L, Ma W G. Cell Signal Transduction[M]. Beijing: Science Press, 1998: 245.
[19] Vianello A, Macri F. Generation of superoxide anion and hydrogen peroxide at the surface of plant cells. Journal of Bioenergetics and Biomembranes, 1991, 23: 409-423.
[20] Elstner E F. Mechanisms of Oxygen Activation in Different Compartments of Plant Cells[M]//Pelland E J, Steffen K L. Active Oxygen/Oxidative Stress in Plant Metabolism. Rockville: American Society of Plant Physiologists, 1991: 13-25.
[21] Apel K, Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction. Annual Review of Plant Biology, 2004, 55: 373-399.
[22] Lindqvist T, Kenne L, Lindeke B. On the chemistry of the reaction between N-acetylcysteine and 4-[(4-ethoxyphenyl)imino]-2,5-cyclohexadien-l-one, a 4-ethoxyanailine metabolite formed during peroxidase reactions. Chemical Research in Toxicology, 1991, 4: 489-496.
[23] Long S S, Cao Y L, Li Y L,etal. Metabolism of reactive oxygen species in the process of hypersensitive response of wheat to stripe rust. Journal of Northwest A & F University: Natural Sciences Edition, 2009, 37(11): 125-131.
[24] Wang C F. Studies on Histology and Cytochemistry of Oxidative Burst during Wheat-PucciniastriiformisF.SP. Tritici Interaction[D]. Yangling: Northwest A & F University, 2008.
[25] Zhang H C. Histological and Cytological Analyses of Adult Plant Resistance to Wheat Stripe Rust and Characterization of Non-host Resistances of Wheat to Uromyces Fabae[D]. Yangling: Northwest A & F University, 2012.
[26] Patterson B D, Macrae E A, Ferguson I B. Estimation of hydrogen peroxide in plant extracts using titanium (Ⅳ). Analytical Biochemistry, 1984, 139: 487-492.
[27] Miguel A T, Jonathan D G, Jones J L. Reactive oxygen species signaling in response to pathogens. Plant Physiology, 2006, 141: 373-378.
[28] Liu X M, Williams C E, Nemacheck J A,etal. Reactive oxygen species are involved in plant defense againstGallmidge. Plant Physiology, 2010, 152: 985-999.
[29] Wang Y, Liang J, Zhang X Y. Changes of active oxygen and related enzymes during the interaction of poplar and canker disease pathogen. Journal of Nanjing Forestry University: Natural Sciences Edition, 2008, 32(5): 41-46.
[30] Lam E. Controlled cell death, plant survival and development. Nature Reviews in Molecular Cell Biology, 2004, 5: 305-315.
[31] Van B F, Dat J F. Reactive oxygen species in plant cell death. Plant Physiology, 2006, 141: 384-390.
[32] Hiroshi Y, Kazuki F, Hideyuki T,etal. Polyamines as a common source of hydrogen peroxide in host- and nonhost hypersensitive response during pathogen infection. Plant Molecular Biology, 2009, 70: 103-112.
[33] Delledonne M, Zeier J. Signal interactions between nitric oxide and reactive oxygen inter mediates in the plant hypersensitive disease resistance response. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98: 13454-13459.
[34] Chai H B, Doke N. Activation of the potential of potato leaf tissue to react hypersensitive toPhytophthorainfestanscytospore germination fluid and the enhancement of this potential by calcium ions. Physiological and Molecular Plant Pathology, 1987, 30: 27.
[35] Doke N. Involvement of superoxide anion generation in the hypersensitive response of potato tuber tissue to infection with an incompatible race ofPhytophthorainfestansand to the hyphal wall component. Physiological Plant Pathology, 1983, 23: 345.
[36] Collendavelloo J, Legrand M, Fritig B. Plant disease and the regulation of enzymes involved in lignification-increased rate of de novo synthesis of the three tobacco O-Methyltransferases during the hypersensitive response to infection by tobacco mosaic virus. Plant Physiology, 1983, 73: 550-554.
[1] 陈文新. 豆科植物根瘤菌固氮体系在西部大开发中的作用. 草地学报, 2004, 12(1): 12.
[2] 石元春. 走出治沙与退耕中的误区. 草地学报, 2004, 12(2): 83-86.
[3] 袁庆华. 我国苜蓿病害研究进展. 植物保护, 2007, 33(1): 6-10.
[4] 刘若, 侯天爵. 我国北方豆科牧草真菌病害初步名录. 中国草地学报, 1984, 1: 56-61.
[5] 南志标. 我国的苜蓿病害及其综合防治体系. 动物科学与动物医学, 2001, 18(4): M1-M4.
[6] 吕新龙, 艾里, 殷启失, 等. 苜蓿霜霉病的调查研究. 甘肃农业大学学报, 1976, (3): 39-42.
[7] 南志标. 锈病对紫花苜蓿营养成分的影响. 中国草原与牧草, 1985, 3(2): 33-36.
[8] 耿华珠. 中国苜蓿[M]. 北京: 中国农业出版社, 1995: 114-130.
[9] 侯天爵, 周淑清. 霜霉病对苜蓿幼苗生长和结瘤的影响. 中国草地, 1997, 2: 52-54.
[10] 苏生昌, 王雪薇, 王纯利, 等. 苜蓿褐斑病在新疆的发生. 草业科学, 1997, 14(5): 31-33.
[11] 袁庆华, 李向林, 张文淑. 苜蓿假盘菌及其生物学特性的研究. 植物保护, 2001, 27(1): 8-12.
[16] 王利国, 李玲. 活性氧中间体和NO在植物抗病中的作用. 植物学通报, 2003, 20(3): 354-360.
[17] 郭泽建, 李德葆. 活性氧与植物抗病性. 植物学报, 2000, 42(9): 881-891.
[18] 孙大业, 郭艳林, 马文耕. 细胞信号转导[M]. 北京: 科学出版社, 1998: 245.
[23] 龙书生, 曹远林, 李亚玲, 等. 小麦抗条锈病过敏性坏死反应中的活性氧代谢. 西北农林科技大学学报: 自然科学版, 2009, 37(11): 125-131.
[24] 王晨芳. 小麦与条锈菌互作过程中活性氧迸发的组织学和细胞化学研究[D]. 杨凌: 西北农林科技大学, 2008.
[25] 张宏昌. 小麦成株抗条锈病的组织学和细胞学研究及小麦非寄主抗蚕豆锈病的机理研究[D]. 杨凌: 西北农林科技大学, 2012.
[29] 王媛, 梁军, 张星耀. 抗、感病杨树与溃疡病菌互作中活性氧及相关酶的动态. 南京林业大学学报: 自然科学版, 2008, 32(5): 41-46.
The effect ofErysiphepisiinfection on the pattern of oxidative burst and on anatomic structure of leaves inMedicagosativa
ZHANG Yong-Mei1,2, MA Hui-Ling2, TANG Yun-Zhi2
1.InstrumentalResearch&AnalysisCenter,GansuAgriculturalUniversity,Lanzhou730070,China; 2.PrataculturalCollege,GansuAgriculturalUniversity,Lanzhou730070,China
Medicagosativawas inoculated withErysiphepisi. The colorimetric method was used to study the timing and intensity of·O2-and H2O2bursts in leaves, and histochemical methods were used to study localization of·O2-and H2O2accumulation. In addition, paraffin sections were made from infected leaves to observe structural changes in those leaves. It was found that after inoculation,·O2-and H2O2bursts in Qingyang alfalfa (resistant cultivar) were observed as two peaks, appearing 4 and 48 h after inoculation for·O2-and 4 and 24 h after inoculation for H2O2, respectively, with the intensity of the first peak higher than that of the second peak. By contrast, in Debao alfalfa (susceptible cultivar), no obvious fluctuation in·O2-content appeared and only the one peak for H2O2accumulation was seen. Staining to reveal zones of localization of reactive oxygen species (ROS) showed that blue-stained·O2-deposition sites did not occur at the surface of or inside of leaves, while brown-stained H2O2deposition sites were observed in the cell wall of upper and lower epidermal cells, and the cytoplasm of infected mesophyll cells. Most importantly, we report here for the first time that the tissue structure of alfalfa leaves was changed after infection withE.pisi. Palisade cells changed from a long-cylindrical cell type to groups of several subrotund cells, so that it was difficult to distinguish the palisade tissue and spongy tissue cells. Our results show that for the different plant species and pathogen resistance combinations investigated, the timing and intensity of ROS accumulation differed, as did the identity of the chemical species generated in activating the defense reaction. The structural and morphological change of mesophyll cells may be one component of an effective response against powdery mildew infection inM.sativa.
hydrogen peroxide; superoxide anion; hypersensitive response; anatomic structure
10.11686/cyxb2016011
http://cyxb.lzu.edu.cn
2016-01-06;改回日期:2016-03-08
甘肃农业大学盛彤笙科技创新基金 (GSAU-STS-1343) 和“十二五”农村领域国家科技计划专题(2012BAD12B02-4)资助。
张咏梅(1974-),女,甘肃武威人,副研究员,博士。E-mail:zym824@sina.com
张咏梅, 马晖玲, 唐云智. 豌豆白粉菌侵染对活性氧迸发规律和紫花苜蓿叶片结构的影响. 草业学报, 2016, 25(11): 34-42.
ZHANG Yong-Mei, MA Hui-Ling, TANG Yun-Zhi. The effect ofErysiphepisiinfection on the pattern of oxidative burst and on anatomic structure of leaves inMedicagosativa. Acta Prataculturae Sinica, 2016, 25(11): 34-42.

