中枢神经系统孤立性纤维瘤的诊断和治疗*
柯代波 刘文科 惠旭辉 鞠延 张跃康 张思 张乔
(四川大学华西医院神经外科, 四川 成都 610041)
·论著·
中枢神经系统孤立性纤维瘤的诊断和治疗*
柯代波 刘文科 惠旭辉 鞠延 张跃康 张思 张乔
(四川大学华西医院神经外科, 四川 成都 610041)
目的 探讨中枢神经系统孤立性纤维瘤(cSFT)这一罕见疾病的临床特征、诊断要点及治疗原则。方法 收集2009年至2015年经病理证实cSFT的患者22例,对所有患者术前症状,影像学表现,病理学特征,治疗方案及预后等资料进行回顾性分析。结果 本组患者中男性10例,女性12例,患者年龄自23~70岁,中位年龄44岁;11例位于幕上,6位于幕下,5例位于椎管内;MRI提示19例病灶为边界清楚的实性占位,其T1WI呈等低信号,T2WI呈高低混杂信号,另外3例含囊性成分,其 T1、T2相信号明显不均;所有肿瘤平扫T2低信号区域增强效应明显;19例患者获全切,除2例老年患者失访外,均无复发,3例行次全切者均行伽马刀辅助放疗,其中两例复发。组织学检查提示肿瘤良性者18例,恶性4例。免疫组化CD34、Bcl-2、CD99、Vimentin均阳性,Des、S-100均阴性。结论 cSFT在中枢神经系统及其罕见且易复发,其影像学表现具一定特点,最终诊断仍靠病理活检及免疫组化。cSFT首选手术治疗,若能全切则总体预后较好,肿瘤未全切者术后放射治疗效果不确定,所有患者术后需密切随访。
孤立性纤维瘤; 中枢神经系统; MRI; CD34
孤立性纤维瘤(solitary fibrous tumor, SFT)为一种罕见的间充质来源的梭形细胞肿瘤,于1931年首次被Klemperer和Rabin报道发生于胸膜[1];随后,其陆续被报道发生于中纵膈、腹膜后、心包浆膜腔、内脏、皮肤软组织等全身各脏器[2-4]。自1996年Carneiro等[5]报道第一例起源于硬膜的中枢神经系统SFT(SFT of central nervous system, cSFT)后,国内外除时有关于cSFT 的小宗或个案报道[6-9]。因发病罕见及认识不足,cSFT术前往往被误诊为脑膜瘤及血管外皮细胞瘤(Hemangiopericy toma, HPC)等相应部位常见肿瘤[10-12],从而对治疗效果及预后造成一定困难。本文回顾性分析22例cSFT,并结合文献对其临床特点、影像学表现、病理特征、预后因素等进行更全面的分析和总结,以增加对该病的了解和认识。
1 资料和方法
1.1 资料及标本来源 回顾性分析2009年1月至2015年12月间出院诊断为cSFT的资料,其病理诊断依据为 2007年版WHO中枢神经系统肿瘤分类标准[11]。
1.2 仪器和方法 所有患者均行CT和(或)MRI平扫及增强扫描;CT采用Siemens Somatom Definition CT机,非离子型对比剂优维显(300 mgl/ml),剂量1.5~2.0 ml/kg体质量,以高压注射器经肘静脉团注,流率3.5 ml/s;管电流180 mAs,管电压120 kV,层厚5 mm, 层间距5 mm。MRI:采用Siemens Magnetom Verio System 3.0T超导MRI仪,分别用SET1WI、T2WI 、flair序列,动态增强采用扰相梯度回波快速扫描序列;采用Gd-DTP对比剂,剂量0.1 mmol/kg体质量,以高压注射器经肘静脉团注,流率2~3 ml/s。CT及MRI影像观察项目:肿块部位,大小,密度或信号,肿瘤边缘,强化情况以及邻近组织的改变。
1.3 病理学检查 肿瘤组织均经 40 g/L的甲醛固定,石蜡包埋,3~5 μm厚切片, HE染色。同时采用即用型 Envi-sion二步法,二氨基联苯胺 (DAB)显色,苏木精对比染色对 22例标本的石蜡切片行免疫组织化学染色。选用抗体如下: CD34 (Dako公司)、 vimentin(Dako公司)、 CD99 (Dako 公司)、 bcl-2(Dako公司)、 S-100(迈新公司)、EM A(Dako公司)和 Ki67 (中山公司)。阳性结果判定: 抗体阳性反应呈棕黄色, CD34和vimentin均为胞质阳性, S-100和 Ki67为核阳性, bcl-2、 CD99为膜阳性, EMA为胞质和膜阳性。
2 结果
2.1 临床特点 本组22例cSFT中男性10例,女性12例,患者首次术后年龄自23~70岁,中位年龄44岁;临床表现以头痛,视力眩晕,步态不稳,视力下降,坐骨神经痛等压迫症状为主;平均症状持续时间4.2月。良性肿瘤183例恶性肿瘤4例,术后2例患者失访。表1记录了所有患者临床治疗特点。
2.2 影像学特征 MRI结果提示,11例位于幕上(鞍区3例,额叶3例,顶叶3例,枕叶1例,颞叶1例); 6位于幕下(桥小脑角区3例,天幕来源2例,颈静脉孔1例);5例位于椎管内(颈椎1例,胸椎2例 腰椎1例) ;肿瘤大小28~60 mm,中位直径 37 mm。

表1 22例中枢神经系统孤立性纤维瘤的临床特点
4例患者行CT扫描,其中3例呈不均匀或稍高密度,1例因瘤内囊性变呈部分低密度,瘤内均无钙化影;邻近颅骨未见明显增厚或侵蚀(见图1)。
MRI检查者22例:5例椎管内及1例颈静脉孔区肿瘤呈哑铃形且与硬膜无明显相关;其余肿瘤均以硬膜为基底,其中12例呈圆形或类圆形,4例肿瘤轮廓欠规则或呈分叶状。3例因瘤内囊性变平扫T1、T2相信号高低不等,增强后囊性部分无强化(见图1);9例T1相呈等信号为主的等低混杂信号,T2相呈高低混杂信号,增强效应明显但欠均匀(见图1);4例表现为明显分离的的高、低信号(阴阳征),其中T2低信号区域强化明显(见图2);6例哑铃型肿瘤T1相以等信号为主,T2相呈等高信号,增强效应均匀明显。平扫见明显血管流空效应者16例,瘤周水肿4例,仅2例出现明显“脑膜尾征”(图2)。
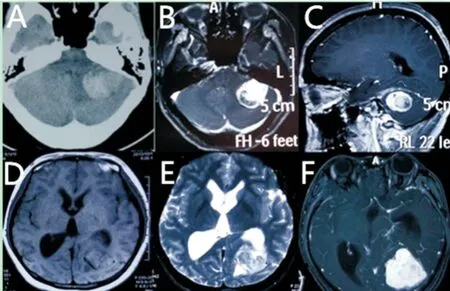
图1 中枢神经系统孤立性纤维瘤的影像学表现
Figure 1 Radiological appearance of SFTs of central nervous system
注:A.CT提示病灶呈片状低密度影;瘤周轻度水肿(箭头);B-C.增强MRI提示瘤内明显低密度影(箭头); D.T1等低混杂信号,瘤内可见明显血管流空效应(箭头);E-F.T2高低信号影,增强后T2低信号区强化明显(箭头)
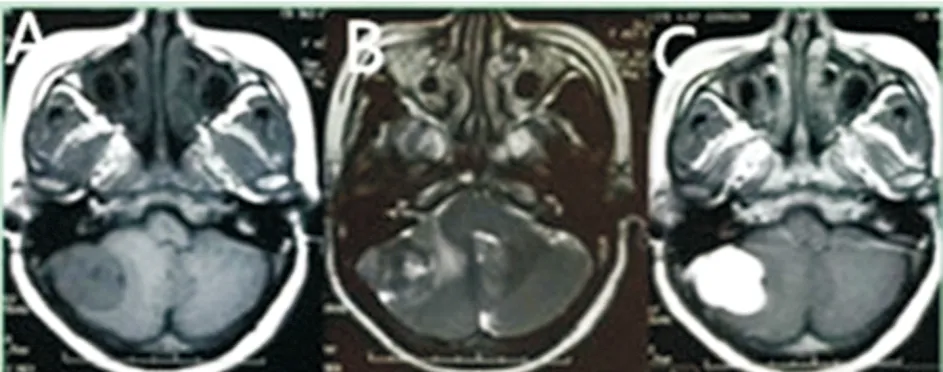
图2 中枢神经系统孤立性纤维瘤的影像学表现
Figure 2 Radiological appearance of SFTs of central nervous system
注:A.T1相呈等低混杂信号,瘤内可见血管流空效应;B-C.T2相可明显低信号区(B箭头),与周围高信号肿瘤成分形成“阴阳征”,增强后可见肿瘤均匀强化(C 箭头)。
2.3 术中所见cSFT情况 所有肿瘤包膜完整,与周围正常组织边界清楚;大部分肿瘤质地较韧,切面灰黄;少部分淡红,质地稍软,血供丰富。3例伴明显瘤内出血或囊性变,后经病理证实均为恶性;2例天幕下肿瘤与邻近静脉窦紧密粘连,1例CPA区肿瘤与将面神经严重挤压并包裹,为避免大量出血及保护神经功能该3例患者仅行次全切;2例天幕复发肿瘤的第2次手术中,其邻近的横窦已完全闭合,周围代偿引流静脉已充分形成,故第二次将邻近硬膜在内的肿瘤成分完全切除。
2.4 组织学特点 本组良性病18例中肿瘤细胞呈卵圆,短至长梭形,胞质稀少,排列成束状或编织状,在镜下构成细胞致密区和稀疏区。细胞致密区可见大量形态整齐,染色明显的梭形细胞,稀疏区则主要由丰富的胶原束和少量染色稍淡的肿瘤细胞组成,以所谓“无固定结构”的方式生长排列;在肿瘤间质内可见壁厚、扩张的“鹿角状血管”(图3)。4例恶性患者除上述典型表现外还可见部分区域坏死、出血,细胞核大小及染色深浅不一,有丝分裂明显增加(4次>10HP)见图4。此外在2例复发病例中第二次组织学表现较第一次无明显改变。
2.5 免疫组化结果 本组病例中22例患者一共行24次开颅手术治疗,表2记录了所有病理标本的免疫组化结果:CD34阳性率100%(24/24),其中20例肿瘤细胞胞质弥漫阳性,4例为灶性; Bcl-2阳性率100%(24/24),其中18例弥漫阳性,6例为灶性;CD99及 Vimentin阳性率100%(24/24)(图3);S-100, EMA均为阴性。Ki-67 2例7%,2例15%,其他均小于1%,见表2。

图3 良性中枢神经系统孤立性纤维瘤的组织学表现和免疫组化特征
Figure 3 Histologic appearances and immunohischemical features of benign SFTs
注:A.镜下见肿瘤细胞胞核呈规则的梭状,胞质稀少,排列成束状或编织状,细胞间可见丰富的胶原纤维及厚壁扩张的分支样血管(×400);B.CD34强阳性;C.bcl-2弥散强阳性;D.CD99中度阳性;E.Vimentin中度阳性;F. Ki-67<1%(×200)。

图4 恶性中枢神经系统孤立性纤维瘤的组织学表现和免疫组化特征
Figure 4 Histologic appearances and immunohischemical features of malignant SFTs
注:A.镜下见肿瘤细胞稀疏淡染,胞核大小不一,瘤内大面坏死及出血(×40);B.核分裂象明显增多(×40); C.CD34中度染色(×200);D.Ki-67约15%(×200)。

表2 22例患者24次病理组织及免疫组化分析结果
注:免疫组化强度分级:无(0),弱(+),中度(++),强(+++)。
3 讨论
中枢神经系统孤立性纤维瘤(cSFT)于1996年首次被Carneiro报道[7]。cSFT常见于多见于中老年人,偶发于儿童[12]甚至是婴幼儿[13];无明显性别差异,绝大部分cSFT为轴外肿瘤且以硬脑膜为基底[8-9,14],偶可见脑内及脑室内[15-16]等SFT的报告,其分别被认为发生于脑内血管外结缔组织[17-18]及脉络丛间充质内CD34阳性的纤维母细胞[19];大部分SFT为良性病变,文献报道颅内外SFT恶变率均为10%~20%[18];术后局部复发往往与手术切除不全相关[9]。极少数情况下还可出现术前多发转移[20]、术后脑脊液播散或颅外转移[21-24],因此,cSFT术后须密切随访。
据Clarencon等[26]报道,颅内外SFT CT表现相仿,平扫均可见明显异质性改变的等或高密度影,增强扫描后病灶强化明显;和脑膜瘤引起的局部骨质增厚不同,SFT可引起邻近骨质破坏且瘤内钙化极其少见;本组4例患者CT结果和上述特点基本一致。cSFT的MRI表现指出大部分cSFT于T1相呈等低信号,T2相为不均质高低信号,且T2像低信号区增强效应明显[31]。此外,对比脑膜瘤而言,cSFT T2相较易出现血管流空效应,而增强后脑膜尾征却极其少见。cSFT的特征性表现为 “阴阳征”,即肿瘤在T2相呈两个明显不同的高低信号区域,增强后低信号区域强化更明显;后经病理证实,T2像低信号区域细胞稀疏、富含胶原纤维束;而MRI T2像高信号区细胞致密,强化效应相对微弱[26-27]。正是这种细胞堆积和纤维致密相互隔离的现象导致了“阴阳征”的形成[26]。在本组病例中,16例患者T2相可见明显血管流空效应,所有患者T2低信号区域强化明显;4例可见 “阴阳征”,仅两例可见“脑膜尾征”。这些特点均可不同程度支持cSFT的诊断。
2007年WHO将cSFT归类为不同于脑膜瘤和HPC的中枢神经系统原发肿瘤[11];其在显微镜下特点与颅外SFT基本相同。肿瘤细胞外形梭状,胞质稀疏,胞核椭圆或纺锤样,染色明显。大体观可表现为不规则的漩涡,席纹或者鱼纹样图案,其间间隔着丰富但呈“不规律”分布的胶原条索及丰富的供血血管[9,27]。漩涡状排列的肿瘤细胞和蛛网膜颗粒的组成成分沙砾体极其相似,此时和脑膜瘤的鉴别诊断比较困难[10]。与HPC一样,典型的cSFT常含有厚壁、扩张且分支明显的鹿角形血管,此特点不利于两者间的鉴别诊断;然而,HPC肿瘤细胞散在分布、形圆或椭圆、核大深染,且几乎每个独立的细胞都被丰富的网状胶原所包绕[8,27],而不存在典型的细胞分区现象。尽管如此,cSFT的最终诊断还需依赖免疫组化检查。和大多数胸膜及其它脏器恶性SFT一样,恶性cSFT(McSFT)的组织学特征常包括:富细胞现象、核异变、坏死及细胞增殖活性增加(有丝分裂>5/10HP)[18,28];此外,也有建议将脑实质浸润纳入McSFT 的报道[29]。本组病例中,除1例McSFT未出现瘤内坏死外,4例McSFT均可见明显富细胞现象、核异变及有丝分裂活动增多(>4次/10HP),故均诊断为McSFT。
关于cSFT的组织学来源目前还有争论,其一开始被认为起源于硬膜相关、CD34染色阳性的纤维母细胞或树突状细胞,2000年WHO将其定义为脑膜间充质起源肿瘤;但这种观点并不能很好解释少数大脑深部SFT的现象,对此有人认为这类肿瘤来自脑血管间充质成分[18];SFT的免疫组化常表现为CD34(+),bcl-2(+), CD99(+),Vimentin(+),而S-100,EMA常为阴性[9,27]。对绝大部分良性SFT来说其CD34、Bcl-2均弥散阳性,而CD99及Vimentin也仅有少部分染色弱阳性或阴性;上述特点对cSFT的诊断和鉴别诊断至关重要。脑膜瘤(CD34-/Bcl-2-/S-100+/EMA+)及神经鞘瘤(Vimentin+/AMA +/CD34- / S100-)与SFT的鉴别诊断较容易;HPC的临床特点及组织学表现有时难以和SFT区别开[28],但因其局部复发(87%)及远处转移的概率(50%)[35]远大于SFT而使两者的鉴别相当重要。虽然高达40%HPC CD34染色也呈阳性,但其弥散程度及染色强度均不及SFT,而是表现为局灶性或弱阳性[8,27],在本组病例中CD34阳性率100%,其中20例弥漫强阳性,仅4例恶性变者染色中度; 此外Bcl-2、CD99、Vimentin染色弥散阳性也具一定代表性,但其与HPC的鉴别意义却不及CD34。
作为一种增殖相关性抗原,Ki-67染色结果对肿瘤具有重要的预后意义。在cSFT中据报道大部分恶性或非典型者Ki-67>5%,还有记载说有的术后复发且多发转移患者仅仅存在增殖指数大于5%而不存在其它恶性组织学特点[21];本组病例中4例恶性肿瘤全部Ki-67>5%,而良性肿瘤均<1%。因此,我们认为Ki-67>5%对SFT来说是一个不良预后的指标。
由于绝大部分cSFT包膜完整,生长缓慢,外科切除成为治疗该病的首选方案;据文献报道影响cSFT预后最重要的因素为切除范围而非病理类型[9]。说明术后复发主要由手术切除不全引起。辅助放疗(伽马刀或外照射)常用于切除不全者或恶性肿瘤,但其治疗效果却尚不统一[31-32]。
4 结论
cSFT为中枢神经系统罕见肿瘤,其影像学及细胞学表现具备一定特征;免疫组化对其诊断及鉴别诊断至关重要;大部分SFT表现为良性生物学行为,手术切除范围为最重要预后相关因素;术后放疗对次全切及或恶性变者疗效尚不确定;术后需密切随访。
[1]Klemperer P, Coleman B R. Primary neoplasms of the pleura. A report of five cases[J]. Am J Ind Med, 1992,22(1):1-31.
[2]Vallat-Decouvelaere AV, Dry SM, Fletcher CD. Atypical and malignant solitary fibrous tumors in extrathoracic locations: evidence of their comparability to intra-thoracic tumors[J]. Am J Surg Pathol, 1998,22(12):1501-1511.
[3]Brunnemann RB, Ro JY, Ordonez NG,etal. Extrapleural solitary fibrous tumor: a clinicopathologic study of 24 cases[J]. Mod Pathol, 1999,12(11):1034-1042.
[4]Insabato L, Siano M, Somma A,etal. Extrapleural solitary fibrous tumor: a clinicopathologic study of 19 cases[J]. Int J Surg Pathol, 2009,17(3):250-254.
[5]Carneiro SS, Scheithauer BW, Nascimento AG,etal. Solitary fibrous tumor of the meninges: a lesion distinct from fibrous meningioma. A clinicopathologic and immunohistochemical study[J]. Am J Clin Pathol, 1996,106(2):217-224.
[6]Brunori A, Cerasoli S, Donati R,etal. Solitary fibrous tumor of the meninges: two new cases and review of the literature[J]. Surg Neurol, 1999,51(6):636-640.
[7]Kurtkaya O, Elmaci I, Sav A,etal. Spinal solitary fibrous tumor: seventh reported case and review of the literature[J]. Spinal Cord, 2001,39(1):57-60.
[8]Tihan T, Viglione M, Rosenblum MK,etal. Solitary fibrous tumors in the central nervous system. A clinicopathologic review of 18 cases and comparison to meningeal hemangiopericytomas[J]. Arch Pathol Lab Med, 2003,127(4):432-439.
[9]Metellus P, Bouvier C, Guyotat J,etal. Solitary fibrous tumors of the central nervous system: clinicopathological and therapeutic considerations of 18 cases[J]. Neurosurgery, 2007,60(4):715-722, 722.
[10] Suzuki SO, Fukui M, Nishio S,etal. Clinicopathological features of solitary fibrous tumor of the meninges: An immunohistochemical reappraisal of cases previously diagnosed to be fibrous meningioma or hemangiopericytoma[J]. Pathol Int, 2000,50(10):808-817.
[11] Louis DN, Ohgaki H, Wiestler OD,etal. The 2007 WHO classification of tumours of the central nervous system[J]. Acta Neuropathol, 2007,114(2):97-109.
[12] de Ribaupierre S, Meagher-Villemure K, Agazzi S,etal. Meningeal solitary fibrous tumour in a child[J]. Childs Nerv Syst, 2006,22(6):619-622.
[13] Maran-Gonzalez A, Laquerriere A, Bigi N,etal. Posterior fossa solitary fibrous tumour: report of a fetal case and review of the literature[J]. J Neurooncol, 2011,101(2):297-300.
[14] Caroli E, Salvati M, Orlando ER,etal. Solitary fibrous tumors of the meninges: report of four cases and literature review[J]. Neurosurg Rev, 2004,27(4):246-251.
[15] Clarencon F, Bonneville F, Sichez JP,etal.[Atypical location of a solitary fibrous tumor in the fourth ventricle][J]. J Neuroradiol, 2006,33(4):279-280.
[16] Kocak A, Cayli SR, Sarac K,etal. Intraventricular solitary fibrous tumor: an unusual tumor with radiological, ultrastructural, and immunohistochemical evaluation: case report[J]. Neurosurgery, 2004,54(1):213-216, 216-217.
[17] Waldron JS, Tihan T, Parsa A T. Solitary fibrous tumor arising from Cranial Nerve VI in the prepontine cistern: case report and review of a tumor subpopulation mimicking schwannoma[J]. Neurosurgery, 2006,59(4):E939-E940, E940.
[18] Kim KA, Gonzalez I, Mccomb JG,etal. Unusual presentations of cerebral solitary fibrous tumors: report of four cases[J]. Neurosurgery, 2004,54(4):1004-1009.
[19] Vassal F, Manet R, Forest F,etal. Solitary fibrous tumors of the central nervous system: report of five cases with unusual clinicopathological and outcome patterns[J]. Acta Neurochir (Wien), 2011,153(2):377-384.
[20] Suhr M, Gottschalk J, Kreusch T. Metastatic malignant solitary fibrous tumour to the infra-temporal fossa[J]. Int J Oral Maxillofac Surg, 2003,32(6):659-661.
[21] Miyashita K, Hayashi Y, Fujisawa H,etal. Recurrent intracranial solitary fibrous tumor with cerebrospinal fluid dissemination. Case report[J]. J Neurosurg, 2004,101(6):1045-1048.
[22] Ng HK, Choi PC, Wong CW,etal. Metastatic solitary fibrous tumor of the meninges. Case report[J]. J Neurosurg, 2000,93(3):490-493.
[23] Hashimoto K, Miyamoto K, Hosoe H,etal. Solitary fibrous tumor in the cervical spine with destructive vertebral involvement: a case report and review of the literature[J]. Arch Orthop Trauma Surg, 2008,128(10):1111-1116.
[24] Munoz E, Prat A, Adamo B,etal. A rare case of malignant solitary fibrous tumor of the spinal cord[J]. Spine (Phila Pa 1976), 2008,33(12):E397-E399.
[25] Surendrababu NR, Chacko G, Daniel RT,etal. Solitary fibrous tumor of the lateral ventricle: CT appearances and pathologic correlation with follow-up[J]. AJNR Am J Neuroradiol, 2006,27(10):2135-2136.
[26] Clarencon F, Bonneville F, Rousseau A,etal. Intracranial solitary fibrous tumor: imaging findings[J]. Eur J Radiol, 2011,80(2):387-394.
[27] Mekni A, Kourda J, Hammouda KB,etal. Solitary fibrous tumour of the central nervous system: pathological study of eight cases and review of the literature[J]. Pathology, 2009,41(7):649-654.
[28] Pakasa NM, Pasquier B, Chambonniere ML,etal. Atypical presentations of solitary fibrous tumors of the central nervous system: an analysis of unusual clinicopathological and outcome patterns in three new cases with a review of the literature[J]. Virchows Arch, 2005,447(1):81-86.
[29] Castilla EA, Prayson RA, Stevens GH,etal. Brain-invasive solitary fibrous tumor of the meninges: report of a case[J]. Int J Surg Pathol, 2002,10(3):217-221.
[30] Bisceglia M, Dimitri L, Giannatempo G,etal. Solitary fibrous tumor of the central nervous system: report of an additional 5 cases with comprehensive literature review[J]. Int J Surg Pathol, 2011,19(4):476-486.
[31] Macfarlane RG, Galloway M, Plowman PN,etal. A highly vascular intracranial solitary fibrous tumor treated with radiotherapy and toremifene: case report[J]. Neurosurgery, 2005,56(6):E1378, E1378.
[32] Moritani S, Ichihara S, Hasegawa M,etal. Dedifferentiation and progression of an intracranial solitary fibrous tumor: autopsy case of a Japanese woman with a history of radiation therapy of the head during infancy[J]. Pathol Int, 2011,61(3):143-149.
Diagnosis and treatment of solitary fibrous tumor of the central nervous system
KE Daibo, LIU Wenke, HUI Xuhui,et al
(DepartmentofNeurosurgery,WestChinaHospital,SichuanUniversity,Chengdu610041,China)
Objective To study the clinical characteristics, diagnostic findings and therapeutic management of solitary fibrous tumor of the central nerous system (cSFT).Methods Between 2009 and 2015, 22 patients harboring cSFTs were treated at our institution. We retrospectively reviewed clinical presentation, imaging characteristics, pathological features, treatment strategies and prognosis with associated clinical records. Results The 22 patients included 10 men and 12 women with a median age of 44 years. The locations were 11 cases (50%) at supratentorial, 6 cases (27%) at posterior fossa and 5 cases (23%) at spinal. 19 lesions were found as solitary and well-defined mass and were heterogeneous with areas of hypo to isointensity on T1WI and hypo to hyperintensity on T2WI. The other 3 were cystic and showed mixed signal intensity on T1 and T2-weighted imaging. All of the areas showed hypointensive signal on T2WI revealed marked enhancement. Gross total resections (GTR) and subtotal resections (STR) followed by gama knife radiosurgeries (GKRS) were achieved in 19 and 3 cases, respectively. No tumor recurrence occurred in these GTRs,excluding 2 elder cases out of follow-ups. 2 STR recurred. Pathologically, 18 and 4 cases were classified as benign and malignant, respectively. CD34, CD99 and vimentin were 100% positive, but EMA and S-100 100% negative. Conclusion cSFT is a rare mesenchymal tumor with a propensity to recur. It has some characteristics on imaging findings, while the final diagnosis depends mainly on histopathology and immunohistochemistry. Surgical resection is the preferred treatment strategy for cSFT and it should has a good prognosis when GTRs were performed. The curative effect of GKRS is not definitive. Regular follow-ups are mandatory for all cSFT.
Solitary fibrous tumor; Central nervous system; MRI; CD34
国家自然科学基金资助(81372690)
惠旭辉 E-mail:huixuhui@126.com
R 739.41
A
10.3969/j.issn.1672-3511.2016.11.013
2016-02-26;编辑: 张文秀)

