2013-2016年河南省小麦茎基腐病的发生危害情况及特点
徐 飞, 宋玉立*, 周益林, 张 昊, 王俊美, 李亚红, 韩自行
(1. 河南省农业科学院植物保护研究所,农业部华北南部作物有害生物综合治理重点实验室, 郑州 450002;2. 中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室, 北京 100193)
2013-2016年河南省小麦茎基腐病的发生危害情况及特点
徐 飞1, 宋玉立1*, 周益林2, 张 昊2, 王俊美1, 李亚红1, 韩自行1
(1. 河南省农业科学院植物保护研究所,农业部华北南部作物有害生物综合治理重点实验室, 郑州 450002;2. 中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室, 北京 100193)
2013-2016年连续4年对河南省不同类型麦田小麦茎基腐病发生和危害情况等进行了调查。结果表明,小麦茎基腐病在河南省已经广泛分布,每年均都有不同程度发生,其中2013年病田率为45.8%,病田白穗率为0.4%~11%;2014年病田率为12.6%,病田白穗率为0.1%~3.7%;2015年病田率为32.5%,病田白穗率为0.1%~16.1%;2016年发生最重,病田率为65.1%,病田白穗率为0.1%~31.5%。调查还发现,河南省小麦茎基腐病发生的特点是北部和西部发生较重;小麦-玉米连作田发生较重,而小麦-水稻连作田块发生较轻;干旱的田块发生危害重。病害产量损失的初步测定结果表明,感病最严重的分蘖病茎高度减少55.8%,且不能结实;能结实病茎较健茎高度减少14.0%~18.0%,穗粒数减少22.7%~54.5%,穗粒重减少33.3%~90.5%,千粒重减少3.2%~73.2%;当病田白穗率为22%时,有效穗数减少33.3%,产量损失达51.6%。本文还针对目前国内对小麦茎基腐病研究薄弱的问题,提出了今后需要加强的研究工作。
小麦茎基腐病; 河南省; 发生特点; 损失评估
自2012年由假禾谷镰孢引起的小麦茎基腐病在河南省报道以来[1],小麦茎基腐病在河南省不断蔓延,每年均有不同程度的发生,但不同年份的发生情况和年份间差异未见报道。据报道,引起小麦茎基腐病的病原菌主要有假禾谷镰孢(Fusariumpseudograminearum)、禾谷镰孢(F.graminearum)、亚洲镰孢(F.asiaticum)、黄色镰孢(F.culmorum),次要病原菌有燕麦镰孢(F.avenaceum)、锐顶镰孢(F.acuminatum)、F.crookwellense、早熟禾镰孢(F.poae)、尖镰孢(F.oxysporum)、木贼镰孢(F.equiseti)[2-7]。我国小麦茎基腐病主要病原菌为假禾谷镰孢、禾谷镰孢和亚洲镰孢,次要病原菌为锐顶镰孢和燕麦镰孢[8-10]。尖镰孢和木贼镰孢一般被认为是腐生菌,但室内苗期接种小麦仍能致病[6,11]。小麦茎基腐病常与根腐离蠕孢(Bipolarissorokiniana)引起的小麦普通根腐病在同一块田中混合发生,也能在同一株上混合发生[11-12]。各种镰孢菌致病菌存活在植物病残体中,其中黄色镰孢还能以厚垣孢子在土壤中长期存活[13]。病残体中镰孢菌菌丝在土壤表面萌发侵染小麦植株分蘖茎和主茎,然后随着小麦生长扩展至小麦茎基部。澳大利亚研究者发现,田间谷物上假禾谷镰孢形成子囊壳比较少见,而禾谷镰孢形成子囊壳比较常见[14-15],但我国小麦茎基腐病的发生特点和田间病茎上子囊壳鲜见报道。
陈厚德等[16]对江苏省小麦茎基腐病发生和危害情况进行调查,发现其引起的产量损失在0.19%~8.5%之间。而作者在河南省小麦田调查发现,河南省小麦茎基腐病重病田块的产量损失可能更高。为全面了解小麦茎基腐病在河南省的发生危害情况和特点,作者于2013-2016年对河南省小麦茎基腐病的分布、田间有性时期子囊壳形成以及危害情况进行田间调查,旨在为小麦茎基腐病的预测预报和综合防控提供科学依据。
1 材料与方法
1.1 2013-2016年河南省小麦茎基腐病发生情况调查
于2013-2016年在小麦灌浆期(5月5日至5月20日)对河南省小麦茎基腐病发生情况进行调查,根据地势和种植情况确定调查田块,每田块面积为2 000~6 667 m2;调查方法采用5点取样,每点1~2 m2,记录每点白穗率,另外记录田块地理信息和耕作制度等信息。由于有多种病原可引起小麦灌浆期白穗,因此需通过田间拔病株鉴定,确认为小麦茎基腐病引起的白穗,再进行白穗率的调查记载,并计算田块白穗率、各地区白穗率以及各地区病田率。

1.2 田间小麦茎基腐病病茎基部有性时期子囊壳的鉴定
由于调查病害和采集样本过程中发现部分田块病株茎基部产生黑色或者褐色子囊壳,因此采集茎基部有子囊壳的样本并标记田块地理信息。从每个田块的样本中挑取15个子囊壳在显微镜下测量其大小,然后压碎子囊壳,测量子囊和子囊孢子大小,测量后用无菌水将子囊孢子冲洗下来,收集在EP管中,取100~150 μL涂在含有150 μg/mL硫酸链霉素和75 μg/mL青霉素钠盐的PDA平板(直径9 cm)上,每个样本涂2个平板,每个平板挑取单孢菌落3~5个继代培养,因此每个样本有6~10个单子囊孢子后代。将每个单子囊孢子后代分别培养,收集菌丝并提取DNA,然后利用假禾谷镰孢的特异性引物Fp1-1/Fp1-2[17]和禾谷镰孢特异性引物Fg16F/Fg16R鉴定[18]和EF-1α序列测定。
1.3 小麦茎基腐病田间危害产量损失测定
于2016年小麦灌浆中期,在河南省焦作市温县黄庄镇西虢村自然发病田块(北纬34.980 3°,东经112.959 4°,海拔112.8 m,小麦品种为‘百农207’)中选取有白穗的0.667 m2样方3个,用红色绳子系住并记录样方的白穗率,对照为无白穗健康样方。于小麦成熟期将选好的样方中小麦植株全部拔出,每个样方中的小麦茎剥开叶鞘分级,并记录各级别茎数和总茎数。小麦茎基腐病的病情分级方法为:0级,无病茎;1级,茎基部变色至第1节;2级,茎基部变色至第2节;3级,茎基部变色至第3节;4级,茎基部变色至第3节以上或植株死亡;5级,植株严重矮化,死亡未抽穗。选取各级别典型发病主茎30茎,每10茎为1组,每个级别病茎3组,测量株高并计算每茎平均株高,株高为分蘖节到穗顶的距离,分别脱粒并称重,计算每穗平均穗粒数和穗粒重。将每个样方各级别的小麦茎分别脱粒并称重。另外取各级别麦粒1 000粒3份分别称重,计算各级别千粒重。
2 结果与分析
2.1 河南省小麦茎基腐病发生情况
2013年调查的48块小麦田中,病田率为45.8%。河南省北部和西部、河南省南部和河南全省由茎基腐病引起的白穗率分别为1.8%、2.1%和1.9%。2014年调查的87块田中,病田率为12.6%,河南省北部和西部、河南省南部和河南全省由茎基腐病引起的白穗率分别为0.8%、0.3%和0.6%。2015年调查的40块田中,病田率为32.5%,河南省北部和西部、河南省南部和河南省的茎基腐病引起的白穗率分别为2.8%、0.0%和2.5%;2016年调查的63块田中,病田率为65.1%,河南省北部和西部、河南省南部和河南全省的茎基腐病引起的白穗率分别为15.3%、0.7%和11.7%。从2013-2016年调查来看,小麦茎基腐病在河南省已经广泛分布。虽然2013-2015年小麦茎基腐病发生范围较广,但是茎基腐病引起的白穗率较低,2016年小麦茎基腐病在河南省广泛流行并且白穗率高,特别是在河南省北部和西部。
河南省小麦茎基腐病主要发生在小麦-玉米连作田块(79/199),且干旱的田块发生危害重,而小麦-水稻田块发生较少(4/31),其他耕作制度的为4/8(图1,表1)。
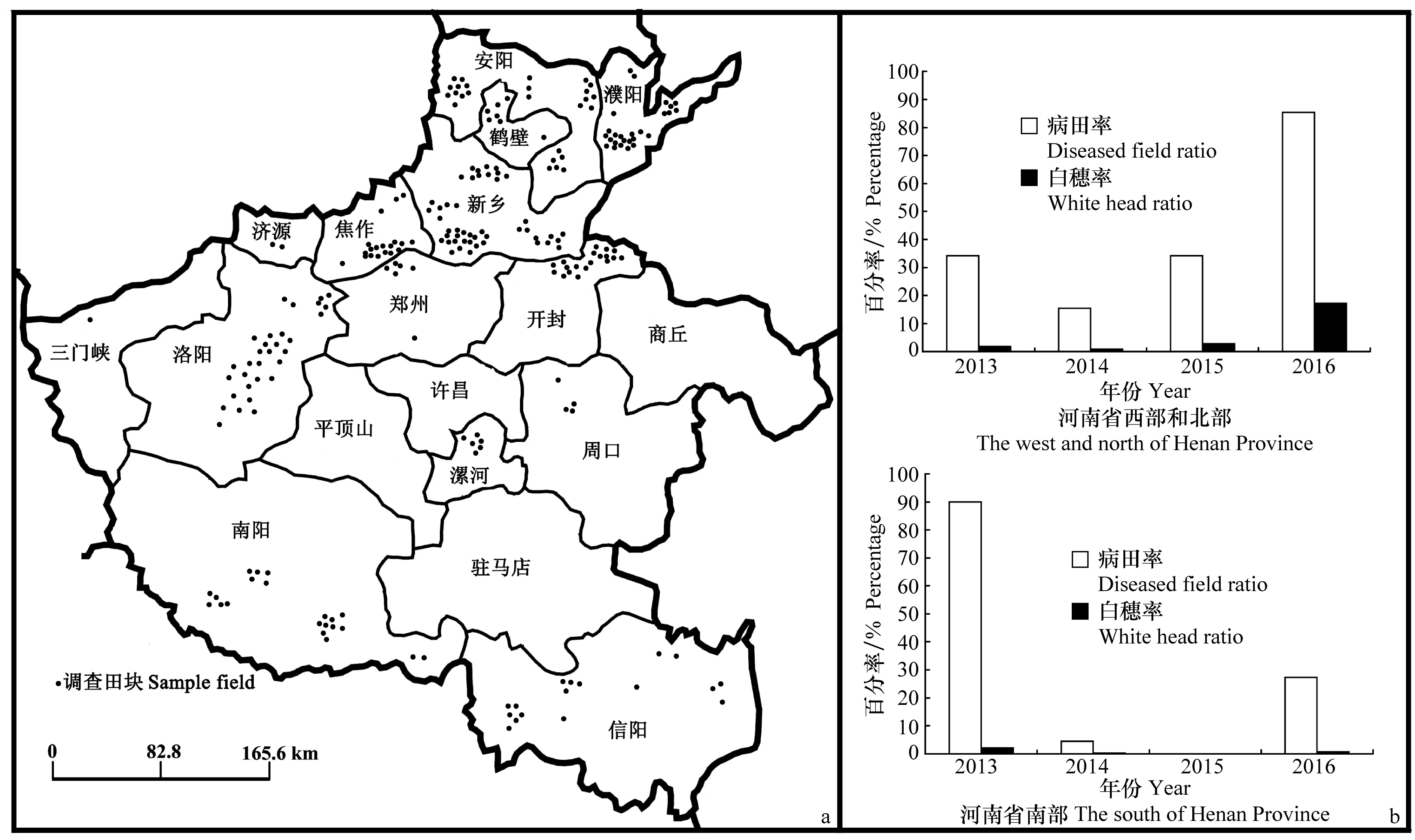
图1 2013-2016年河南省小麦茎基腐病采样点(a)及河南省西部和北部、南部病田率和白穗率示意图(b)Fig.1 Collection sites of diseased wheat plants with Fusarium root and crown rot in Henan Province in 2013-2016 (a) and ratio of diseased fields and white heads (b)
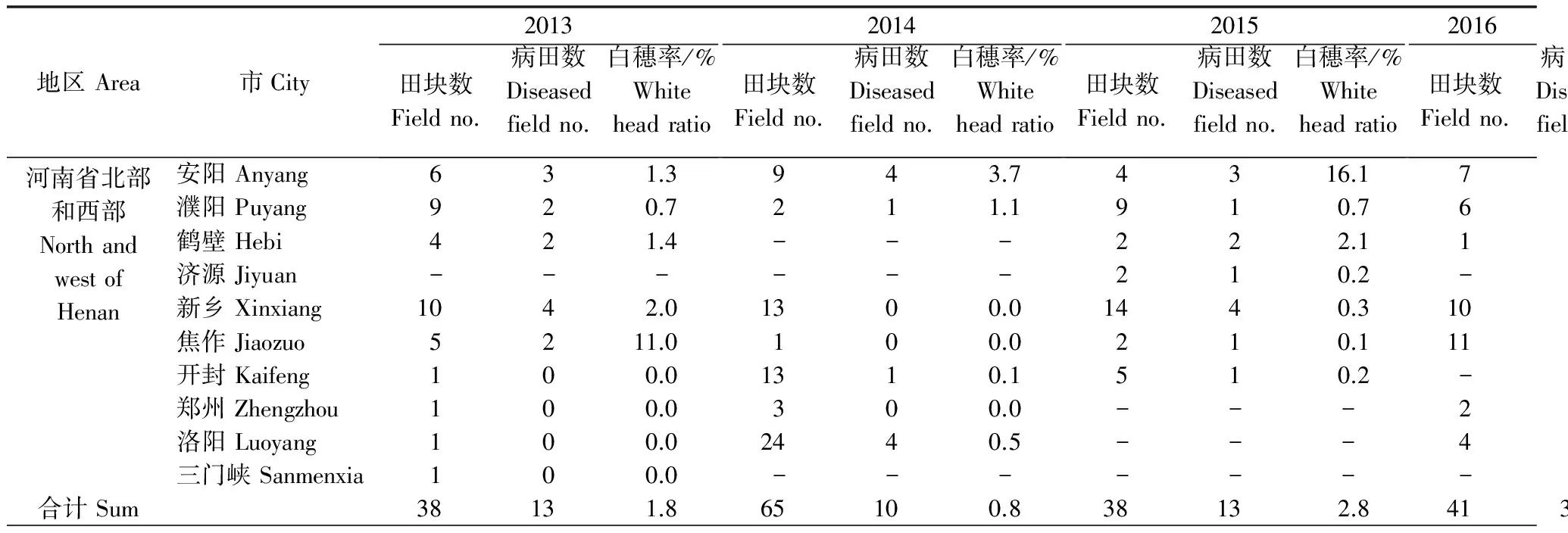
地区Area市City2013田块数Fieldno.病田数Diseasedfieldno.白穗率/%Whiteheadratio2014田块数Fieldno.病田数Diseasedfieldno.白穗率/%Whiteheadratio2015田块数Fieldno.病田数Diseasedfieldno.白穗率/%Whiteheadratio2016田块数Fieldno.病田数Diseasedfieldno.白穗率/%Whiteheadratio河南省北部和西部NorthandwestofHenan安阳Anyang631.3943.74316.1766.2濮阳Puyang920.7211.1910.7655.8鹤壁Hebi421.4---222.11120.0济源Jiyuan------210.2---新乡Xinxiang1042.01300.01440.31083.9焦作Jiaozuo5211.0100.0210.111923.4开封Kaifeng100.01310.1510.2---郑州Zhengzhou100.0300.0---2216.0洛阳Luoyang100.02440.5---4431.5三门峡Sanmenxia100.0---------合计Sum38131.865100.838132.8413515.3
续表1 Table 1(Continued)
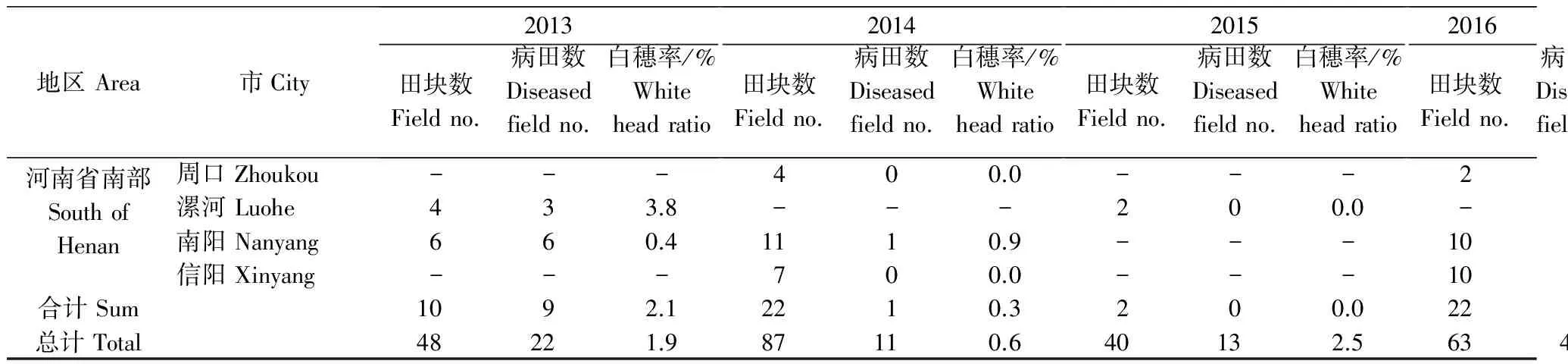
地区Area市City2013田块数Fieldno.病田数Diseasedfieldno.白穗率/%Whiteheadratio2014田块数Fieldno.病田数Diseasedfieldno.白穗率/%Whiteheadratio2015田块数Fieldno.病田数Diseasedfieldno.白穗率/%Whiteheadratio2016田块数Fieldno.病田数Diseasedfieldno.白穗率/%Whiteheadratio河南省南部SouthofHenan周口Zhoukou---400.0---200.0漯河Luohe433.8---200.0---南阳Nanyang660.41110.9---1051.9信阳Xinyang---700.0---1010.1合计Sum1092.12210.3200.02260.7总计Total48221.987110.640132.5634111.7
1) 表中“-”表示没有调查数据。
“-”in the table indicates no survey data.
2.2 小麦茎基腐病的症状
小麦茎基腐病的田间症状在小麦抽穗之后逐渐显现,根据病菌侵染早晚和发病轻重不同,表现为植株矮化、萎蔫、青枯和枯死等症状,典型症状为小麦灌浆期出现“白穗”(图2a),从病田整体来看,白穗分布较均匀,没有明显的发病中心,发病特别重时也会连片,这与小麦纹枯病田间白穗症状相似,而与全蚀病田间症状有明显区别。拔出病株观察可见在同一株不同分蘖中显现1个或者2个白穗,而且白穗的小麦茎明显矮化(图2b)。剥开病株茎基部的叶鞘,可见茎基部变成黑褐色(类似酱油的颜色)(图2c),严重时能扩展至茎部第3节(图2d),湿度较小时在节的部位产生粉红色或者白色的霉层(图2e),湿度较大时可在发病节和节间产生红色霉层(图2f),这与小麦全蚀病典型的黑脚症状、小麦纹枯病的云斑症状以及小麦普通根腐病茎基部褐变或暗色黑化有明显区别。冲洗病株根部发现小麦茎基腐病引起的根部褐变主要集中在中胚轴,如果和根腐离蠕孢混合发生根部则会变黑,典型症状为根部中胚轴变褐或变黑,但根部中胚轴中柱不变色,这与小麦全蚀病的根中柱变黑有明显区别。小麦茎基腐病常与小麦普通根腐病在同一块田中发生,甚至在小麦同一株或茎上发生,但很少与小麦纹枯病或小麦全蚀病在同一块田或小麦同一株或茎中混合发生[2];与小麦普通根腐病以及小麦全蚀病或者小麦纹枯病三者在同一块田和小麦同一株或茎混合发生的情况则更少。
2.3 田间小麦茎基部子囊壳的调查和鉴定
在河南省濮阳市范县、安阳市滑县、焦作市温县、洛阳市、南阳市进行茎基腐病病情调查时发现一些病茎茎基部有子囊壳。采集子囊壳对病菌进行了分离,分子鉴定结果表明,2016年濮阳市范县的3个田块、安阳市滑县的1个田块、焦作市温县的1个田块和南阳市的1个田块,共6个田块中采集的子囊壳为禾谷镰孢(Fusariumgraminearum)所产生;而2016年安阳市内黄县的1个田块和2014年洛阳市的1个田块的子囊壳为假禾谷镰孢(F.pseudograminearum)所产生。

图2 小麦茎基腐病田间症状Fig.2 Symptoms of Fusarium root and crown rot of wheat (FCR) caused by Fusarium pseudograminearum under field conditions
由于2014年洛阳市的样本没有测定子囊壳和子囊孢子大小,所以在表2中没有列出。禾谷镰孢在田间发病植株叶鞘上产生的子囊壳为球形或椭球形,有孔口,蓝色或黑褐色或紫色(图3a~b),大小为(100.0~294.8) μm×(100.0~263.6) μm,平均为197.3 μm×182.7 μm(图3c, 表2);子囊大小为(61.6~78.6) μm×(6.6~10.7) μm,平均大小为72.4 μm×9.0 μm;子囊孢子镰刀状,3个分隔,大小为(16.1~25.7) μm×(2.9~6.0) μm,平均大小为20.4 μm×4.2 μm(图3d, 表2)。由假禾谷镰孢引起的小麦茎基腐病在茎基部形成的子囊壳球形或椭球形,颜色为黑褐色或墨绿色或紫色,大小为(286.5~360.7) μm×(204.95~341.5) μm,平均大小为320.0 μm×281.3 μm (图3e, 表2);子囊大小为(74.2~96.7) μm×(7.1~11.8) μm,平均大小为86.2 μm×8.9 μm;子囊孢子镰刀状,3个分隔,大小为(24.1~32.4) μm×(4.1~7.1) μm,平均大小为27.1 μm×5.6 μm(表2)。假禾谷镰孢引起小麦茎基腐病在小麦节和节间产生粉红色或白色霉层比较常见(图2e~f),将霉层挑出镜检,发现霉层中有大量分生孢子,分生孢子镰刀状,大小为(29.5~49.2) μm×(3.0~4.9) μm,平均大小为40.3 μm×4.1 μm(图3f)。
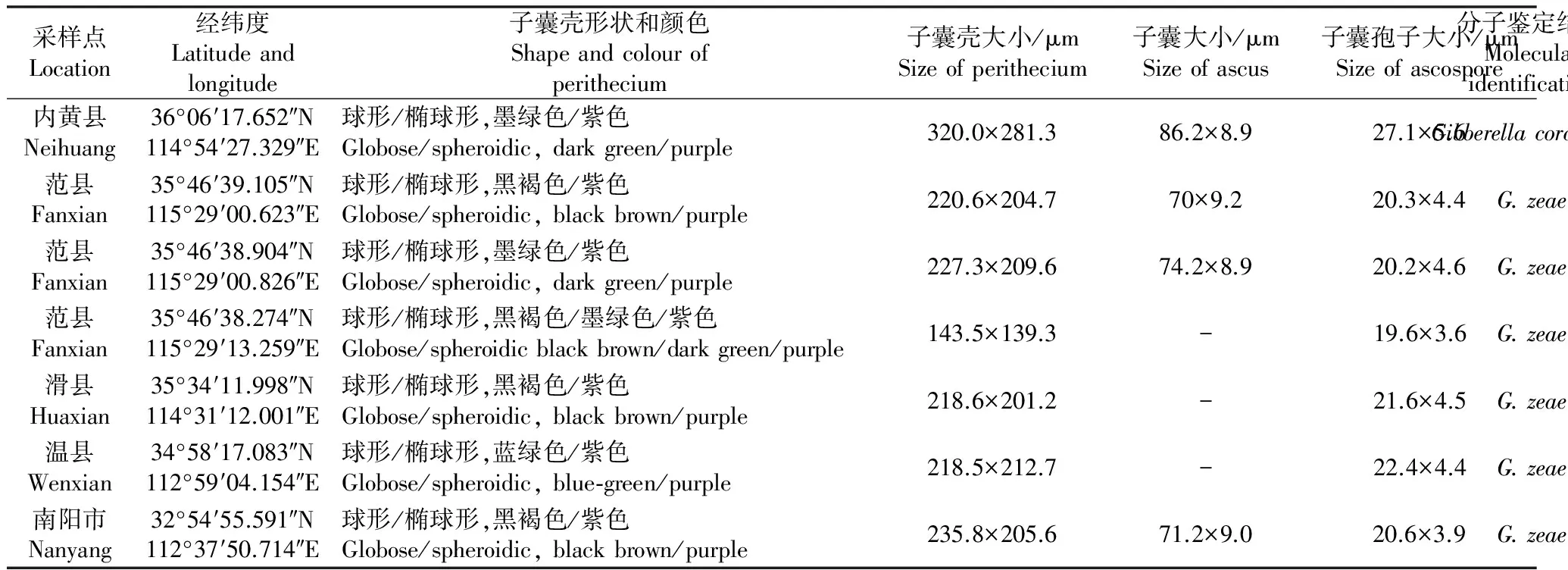
表2 田间自然状态下Gibberella zeae 和G. coronicola的子囊壳、子囊和子囊孢子形态特征1)
1) 表中子囊壳大小是15个以上的子囊壳大小的平均值;子囊大小是10个以上子囊大小的平均值;子囊孢子大小是30个子囊孢子大小的平均值。
Size of perithecium in the table is the average of more than 15 perithecia; size of ascus is the average of more than 10 asci; size of ascospore is the average of 30 ascospores.
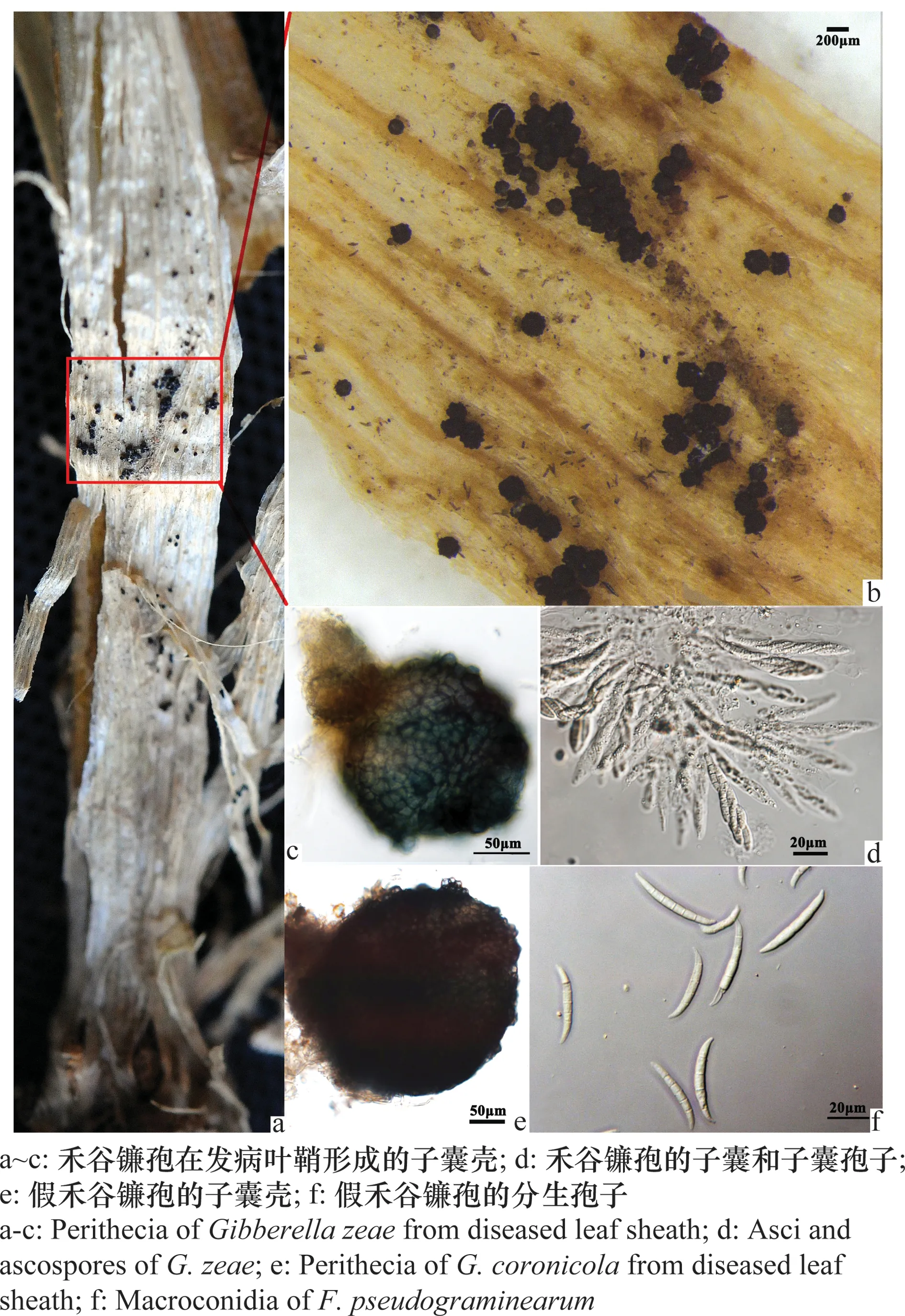
图3 禾谷镰孢和假禾谷镰孢在发病叶鞘上的病原菌形态图Fig.3 Morphology of the pathogen from diseased leaf sheath caused by Fusarium graminearum and F.pseudograminearum in field
2.4 小麦茎基腐病危害的产量损失
‘百农207’发病的产量损失结果显示,病茎较健茎的株高、穗粒数、穗粒重和千粒重显著降低。健茎株高为71.2 cm;1级至4级病茎株高为58.5~61.2 cm, 与健茎有显著性差异(P<0.05);5级病茎不结实,株高最低,为30.5 cm,显著低于其他级别病茎(P<0.05)。健茎穗粒数、穗粒重和千粒重分别为44粒、2.1 g、44 g,1级至3级病茎的穗粒数、穗粒重和千粒重分别为30~34粒、1.2~1.4 g、36.8~42.6 g,两者有显著性差异(P<0.05);4级病茎的穗粒数、穗粒重和千粒重分别为20粒、0.2 g、11.8 g,显著低于其他级别病茎的穗粒数、穗粒重和千粒重(P<0.05)(表3)。
病田样方(0.667 m2)的白穗率为13.6%~36.1%(平均白穗率为22%),病茎率为98%~100%(虽然没有表现白穗,但是茎基部已有不同程度侵染),有效穗数平均为240穗,较健康样方减少33.3%;平均产量为3 646.5 kg/hm2,较健康样方减少51.6%。
3 结论与讨论
小麦茎基腐病的研究在我国起步较晚,近年来该病有逐渐加重趋势,特别是2016年在河南省北部和西部广泛流行,并在局部造成严重危害。引起小麦茎基腐病的镰刀菌种类多,其分布和危害程度受到气候的影响较大。澳大利亚研究对维多利亚地区小麦茎基腐病发生情况进行观察发现,小麦茎基腐病发生的严重程度与生长期降雨量、年降雨量呈负相关[19-20]。河南省2013-2015年小麦茎基腐病发病较轻,而2016年则广泛流行,因此有必要继续多年调查,对各年份气候数据与病害发生情况进行分析,从而明确小麦茎基腐病发生关键因子。在调查小麦茎基腐病的过程中,也发现土壤干旱的地块容易发生该病,而且同一田块中,干旱区域较不干旱的区域发生严重。小麦返青期水浇较晚,会造成小麦茎基腐病偏重发生。因此,建议加强土壤的干旱程度、土壤含菌量与小麦茎基腐病发生程度的关系研究[21-22]。另外,已有的研究表明,致病镰刀菌种群分布也与气候条件有关。在澳大利亚假禾谷镰孢的分布不受气候条件限制,但黄色镰孢的分布受到夏季均温和年降雨量的限制;而在新西兰黄色镰孢占16%,假禾谷镰孢占1.5%,其他种类分布在杂草上[23-24]。假禾谷镰孢、禾谷镰孢、锐顶镰孢、燕麦镰孢和黄色镰孢在我国都存在,其分布规律及其原因尚不清楚。在田间小麦茎基腐病病茎上子囊壳调查过程中,共发现8块田中有子囊壳存在,其中有6块田为禾谷镰孢的子囊壳,2块田为假禾谷镰孢的子囊壳。说明我国田间小麦茎基部假禾谷镰孢形成子囊壳比较少见,而禾谷镰孢形成子囊壳比较常见。这种情况与澳大利亚研究者的结果相同[14-15]。两种镰孢子囊壳在田间出现情况不一样的主要原因可能是假禾谷镰孢属于异宗配合的真菌,而禾谷镰孢属于同宗配合的真菌。
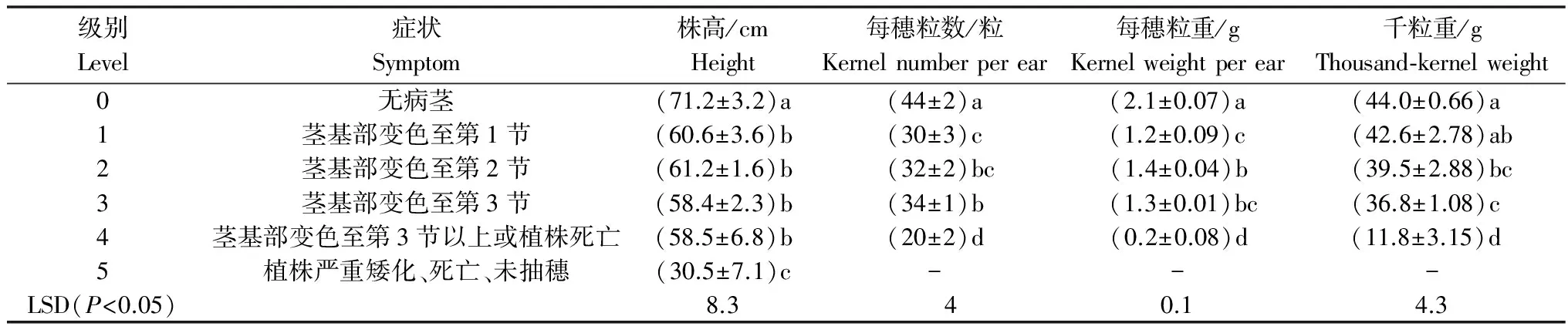
表3 小麦茎基腐不同级别病茎的产量损失1)
1) 表中数据为平均值±标准差,同列数据后不同小写字母表示有显著差异(P<0.05)。
Data in the table are mean±SD; data followed by different letters within the same column are significantly different (P<0.05) according to Fisher’s Protected Least Significant Difference Test.
小麦茎基腐病可造成严重的产量损失,陈厚德等[16]研究表明,小麦茎基腐病引起的产量损失最高可达8.5%,但是本研究中小麦茎基腐病引起的白穗率在13.6%~36.1%,产量损失可达38.0%~61.3%。产量损失差异较大的原因可能是田间的发生情况和研究方法不同造成的,也可能是引起小麦茎基腐病的病原菌种类不同。因此田间试验调查时应详细记录病害发生的白穗率、病茎率、病原菌种类和小麦品种等。
不同小麦品种对小麦茎基腐病的抗性存在差异。前人在室内和田间通过不同的接种方法对小麦茎基腐病抗性进行了研究,包括孢子液蘸根法、孢子液滴注茎基部、菌丝块接种法、麦粒培养物接种法[25-26]。杨云等[27]通过假禾谷镰孢麦粒培养物接种法对黄淮麦区主栽的小麦品种进行茎基腐病抗性鉴定,结果发现,苗期没有抗性材料,成株期鉴定为中抗的小麦品种有‘兰考198’、‘许科718’、‘泛麦8号’、‘豫保1号’、‘周麦24’、‘周麦27’、‘豫农201’、‘济麦22’、‘郑麦9023’和‘周麦26’。而张鹏等[28]通过禾谷镰刀菌孢子液滴注法对小麦种质资源进行茎基腐病抗性鉴定,发现13份中抗材料,另外还发现小麦茎基腐病和小麦赤霉病抗性间没有相关性。小麦品种资源对小麦茎基腐病抗性筛选时应该注意使用假禾谷镰孢和禾谷镰孢两种病原菌分别进行筛选,以免遗漏资源。
针对小麦茎基腐病药剂防治方面的报道较少,目前报道有通过小麦拔节期药剂喷雾可防治小麦茎基腐病。50%甲基硫菌灵WP、25%多菌灵WP和50%苯菌灵WP在茎基腐发病初期喷雾,防效均在75%以上[29]。通过筛选种子包衣剂,降低小麦茎基腐病苗期侵染,或者推后侵染时间来控制病害的发生程度和降低产量损失,在今后的工作中需要加强研究。
[1] Li Honglian, Yuan Hongxia, Fu Bo, et al. First report ofFusariumpseudograminearumcausing crown rot of wheat in Henan, China [J]. Plant Disease, 2012, 96(7): 1065.
[2] Fernandez M R, Fox S L, Hucl P, et al. Root rot severity and fungal populations in spring common, durum and spelt wheat, and kamut grown under organic management in western Canada [J]. Canadian Journal of Plant Science, 2014, 94(5): 937-946.
[3] Locke T, Moon L M, Evans J. Survey of benomyl resistance inFusariumspecies on winter wheat in England and Wales in 1986 [J]. Plant Pathology, 1987, 36(4): 589-593.
[4] Moya-Elizondo E A, Rew L J, Jacobsen B J, et al. Distribution and prevalence ofFusariumcrown rot and common root rot pathogens of wheat in Montana [J]. Plant Disease, 2011, 95(9): 1099-1108.
[5] Paulitz T C, Smiley R W, Cook R J. Insights into the prevalence and management of soilborne cereal pathogens under direct seeding in the Pacific Northwest, U.S.A [J]. Canadian Journal of Plant Pathology, 2002, 24(4): 416-428.
[6] Smiley R W, Patterson L M. Pathogenic fungi associated withFusariumfoot rot of winter wheat in the semiarid Pacific Northwest [J]. Plant Disease, 1996, 80(8): 944-949.
[7] Tunali B, Nicol J M, Hodson D, et al. Root and crown rot fungi associated with spring, facultative, and winter wheat in Turkey [J]. Plant Disease, 2008, 92(9): 1299-1306.
[8] 贺小伦, 周海峰, 袁虹霞, 等. 河南和河北冬小麦区假禾谷镰孢的遗传多样性[J]. 中国农业科学, 2016, 49(2): 272-281.
[9] 张向向,孙海燕, 李伟, 等. 我国冬小麦主产省小麦茎基腐镰孢菌的组成及其致病力[J]. 麦类作物学报, 2014, 34(2): 272-278.
[10]李伟, 陈莹, 张晓祥, 等. 小麦茎基褐腐病病原菌组成及其致病力研究[J]. 麦类作物学报, 2011, 31(1): 170-175.
[11]Fedel-Moen R, Harris J R. Stratified distribution ofFusariumandBipolarison wheat and barley with dryland root rot in South Australia [J]. Plant Pathology, 1987, 36(4): 447-454.
[12]Chakraborty S, Liu C J, Mitter V, et al. Pathogen population structure and epidemiology are keys to wheat crown rot andFusariumhead blight management [J]. Australasian Plant Pathology, 2006, 35(6): 643-655.
[13]Davis R A, Huggins D R, Cook J R, et al. Nitrogen and crop rotation effects onFusariumcrown rot in no-till spring wheat [J]. Canadian Journal of Plant Pathology, 2009, 31(4): 456-467.
[14]Summerell B A, Burgess L W, Backhouse D, et al. Natural occurrence of perithecia ofGibberellacoronicolaon wheat plants with crown rot in Australia [J]. Australasian Plant Pathology, 2001, 30(4): 353-356.
[15]Wright D G, Khangura R, Loughman R, et al. First record ofGibberellazeaeandGibberellacoronicolaon millet in Western Australia [J]. Australasian Plant Disease Notes, 2011, 7(1): 19-21.
[16]陈厚德,王彰明,袁树忠,等. 小麦茎基褐腐病的发生特点及其对产量的影响[J]. 扬州大学学报(自然科学版), 2011, 4(4): 43-46.
[17]Aoki T, O’Donnell K. Morphological and molecular characterization ofFusariumpseudograminearumsp. nov., formerly recognized as the group 1 population ofF.graminearum[J]. Mycologia, 1999, 91(4): 597-609.
[18]Nicholson P, Simpson D R, Weston G, et al. Detection and quantification ofFusariumculmorumandFusariumgraminearumin cereals using PCR assays [J]. Physiological and Molecular Plant Pathology, 1998, 53(1): 17-37.
[19]Chekali S, Gargouri S, Paulitz T, et al. Effects ofFusariumculmorumand water stress on durum wheat in Tunisia [J]. Crop Protection, 2011, 30(6): 718-725.
[20]Hollaway G J, Exell G K. Survey of wheat crops for white heads caused by crown rot in Victoria, 1997-2009 [J]. Australasian Plant Pathology, 2010, 39(4): 363-367.
[21]Poole G J, Harries M, Huberli D, et al. Predicting cereal root disease in Western Australia using soil DNA and environmental parameters [J]. Phytopathology, 2015, 105(8): 1069-1079.
[22]Williams K J, Dennis J I, Smyl C, et al. The application of species-specific assays based on the polymerase chain reaction to analyseFusariumcrown rot of durum wheat [J]. Australasian Plant Pathology, 2002, 31(2): 119-127.
[23]Backhouse D, Burgess L W. Climatic analysis of the distribution ofFusariumgraminearum,F.pseudograminearumandF.culmorumon cereals in Australia [J]. Australasian Plant Pathology, 2002, 31(4): 321-327.
[24]Bentley A R, Cromey M G, Farrokhi-Nejad R, et al.Fusariumcrown and root rot pathogens associated with wheat and grass stem bases on the South Island of New Zealand [J]. Australasian Plant Pathology, 2006, 35(5): 495-502.
[25]Erginbas-Orakci G, Poole G, Nicol J M, et al. Assessment of inoculation methods to identify resistance toFusariumcrown rot in wheat [J]. Journal of Plant Diseases and Protection, 2016, 123(1): 19-27.
[26]Mitter V, Zhang M C, Liu C J, et al. A high-throughput glasshouse bioassay to detect crown rot resistance in wheat germplasm [J]. Plant Pathology, 2006, 55(3): 433-441.
[27]杨云, 贺小伦, 胡艳峰, 等. 黄淮麦区主推小麦品种对假禾谷镰刀菌所致茎基腐病的抗性[J]. 麦类作物学报, 2015, 35(3): 339-345.
[28]张鹏, 霍燕, 周淼平, 等. 小麦禾谷镰孢菌茎基腐病抗源的筛选与评价[J]. 植物遗传资源学报, 2009, 10(3) : 431-435.
[29]王国军, 王晓娥, 孙敏, 等. 小麦茎基腐病发生趋势预报及药剂防治试验[J]. 中国农学通报, 2009, 25(20): 258-261.
(责任编辑:杨明丽)
Occurrence dynamics and characteristics of Fusarium root and crown rot of wheat in Henan Province during 2013-2016
Xu Fei1, Song Yuli1, Zhou Yilin2, Zhang Hao2, Wang Junmei1, Li Yahong1, Han Zihang1
(1. Institute of Plant Protection, Henan Academy of Agricultural Sciences; Key Laboratory of Integrated Pest Management on Crops in Southern Region of North China, Ministry of Agriculture,Zhengzhou 450002, China; 2. State Key Laboratory for Biology of Plant Diseases and Insect PestsInstitute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
The occurrence ofFusariumroot and crown rot of wheat (FCR) and its damage in different cropping systems in Henan Province were investigated during 2013-2016. The results showed that FCR has been widely distributed in Henan Province, but has a different level of disease incidence and severity each year. The diseased field ratio and white head ratio caused by FCR were 45.8% and 0.4%-11% in 2013, 12.6% and 0.1%-3.7% in 2014, 32.5% and 0.1%-16.1% in 2015, 65.1% and 0.1%-31.5% in 2016, respectively. The results also showed that FCR incidence and severity were higher in maize-wheat rotation fields than that in rice-wheat rotation fields. Drought was associated with the disease severity. The assessment of yield loss caused by FCR showed that the plant height of the worst diseased stem without spike decreased by 55.8%; the plant height, kernel number and kernel weight per ear and 1000-kernel weight of the diseased stem with spike decreased by 14.0%-18.0%, 22.7%-54.5%, 33.3%-90.5% and 3.2%-73.2%, respectively; when the white head ratio of diseased fields was 22%, the number of effective ears and yield decreased by 33.3% and 51.6%, respectively. In this study, the problems in FCR research in China were also discussed, which will provide new ideas for the future research.
Fusariumroot and crown rot of wheat; Henan Province; occurrence characteristics; loss assessment
2016-07-21
2016-10-05
科技基础性工作专项(2013FY113200);国家自然科学基金(31401791);公益性行业(农业)科研专项(201303016);河南省小麦产业技术体系(S2010-01-05)
S 435.121
A
10.3969/j.issn.0529-1542.2016.06.023
* 通信作者 E-mail: songyuli2000@126.com

