北京市及河北省小麦赤霉病菌群体遗传结构及生物学特性
董 杰, 张金良, 杨建国, 张 昊, 冯 洁
(1. 北京市植物保护站, 北京 100029; 2. 中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室, 北京 100193)
调查研究
北京市及河北省小麦赤霉病菌群体遗传结构及生物学特性
董 杰1*, 张金良1, 杨建国1, 张 昊2, 冯 洁2
(1. 北京市植物保护站, 北京 100029; 2. 中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室, 北京 100193)
本文分析了北京市与河北省小麦赤霉病菌群体遗传结构以及基础生物学特性。结果表明所有菌株均为禾谷镰刀菌(Fusariumgraminearum),属于一个大的单一群体,群体内具有较高的遗传多样性。毒素化学型测定表明,北京与河北地区小麦真菌毒素污染的主要风险为DON与15ADON毒素。表型测定显示,与F.asiaticum群体相比,F.graminearum具有较高的产孢能力,而生长速率和产毒能力较低。该群体对主要杀菌剂多菌灵、戊唑醇和氰烯菌酯均无抗药性。
小麦赤霉病; 禾谷镰刀菌; 群体遗传结构; 杀菌剂抗性
由禾谷镰刀菌复合种(Fusariumgraminearumspecies complex, FGSC)引起的小麦赤霉病是世界范围内的重要病害[1],已经被国际玉米小麦改良中心(CIMMYT)确定为限制小麦产量的一个主要因素[2]。除了引起小麦产量损失外,镰刀菌还能够产生多种真菌毒素,造成食品安全上的重大隐患。近十年来,小麦赤霉病在我国频繁暴发,特别是2012年,发病面积达1 000万hm2,约占全国小麦总面积的50%。在我国,长江中下游地区如江苏、安徽、湖北等省份是小麦赤霉病的传统流行区[3],但是由于气候变化及耕作制度改变等因素的影响,赤霉病北移十分明显。北部黄河流域省份原来只有零星发生,但近几年河北南部、河南、山东、山西、陕西南部也相继发生较为严重的小麦赤霉病。
2004年,O’Donnell等采用宗系谱法创建了禾谷镰刀菌新的分类框架,认为传统的禾谷镰刀菌是一个至少包含有9个独立种的复合种[4]。随后,又不断有新种被发现,目前禾谷镰刀菌复合种共包含15个种[5]。这一分类体系也被世界各国研究者广泛接受。Zhang等[6]对中国小麦赤霉菌的群体遗传结构进行了大范围的研究,确定中国南北方优势群体分别为F.asiaticum和F.graminearum,其中F.asiaticum具有明显的群体分化,产3ADON毒素的菌株为优势群体,正在由东向西取代NIV群体;而北方各省份的F.graminearum并没有明显的群体分化,属于一个大的随机交配群体。与之相似,近年来多个国家相继报道了赤霉菌群体在种和毒素化学型水平上的更替事件,如荷兰F.graminearum取代F.culmorum[7];加拿大3ADON型的F.graminearum取代15ADON群体[8];美国路易斯安那州NIV型F.asiaticum群体的发现[9]等。这些事件说明全球贸易快速发展以及气候、耕作制度的改变容易造成新群体的入侵和扩张,从而使病害的发生发展规律产生新的特点,毒素污染的种类与程度也会发生相应的变化。因此,对赤霉菌群体结构及基本生物学特性进行持续监测是进行有效防治的前提。中国小麦赤霉菌群体学研究多集中在长江流域,北部省份仅有少量报道。Zhang等[6]和Shen等[10]对2008-2010年中国北方部分省份的小麦赤霉菌进行鉴定,发现所有菌株均为产生15ADON毒素的F.graminearum。北美洲的研究表明,相对于15ADON,产3ADON的F.graminearum群体毒性更强,并在北美迅速扩张[8]。我国北方省份近些年赤霉菌群体组成是否发生变化,是否有高风险的3ADON群体传入尚不清楚。本文对河北省和北京市2015年小麦赤霉病菌进行了种和毒素化学型的鉴定,并测定了生长速率、产孢量、产毒量以及对主要杀菌剂的抗性水平,分析了本地区赤霉病菌群体结构,解析了其生态适应性,为制定适应本地区的小麦赤霉病的综合防控措施提供理论依据,同时可为整个食品安全生产链条中的政府决策提供参考。
1 材料与方法
1.1 菌种收集
河北省与北京市小麦赤霉病样品采集于2015年5月,具体采集地信息如表1,采用张昊等[11]报道的方法进行单孢分离。每个病穗保存一株镰刀菌,共分离镰刀菌60株。采用安徽省采集的10株F.asiaticum菌株作为生物学特性鉴定的对照。
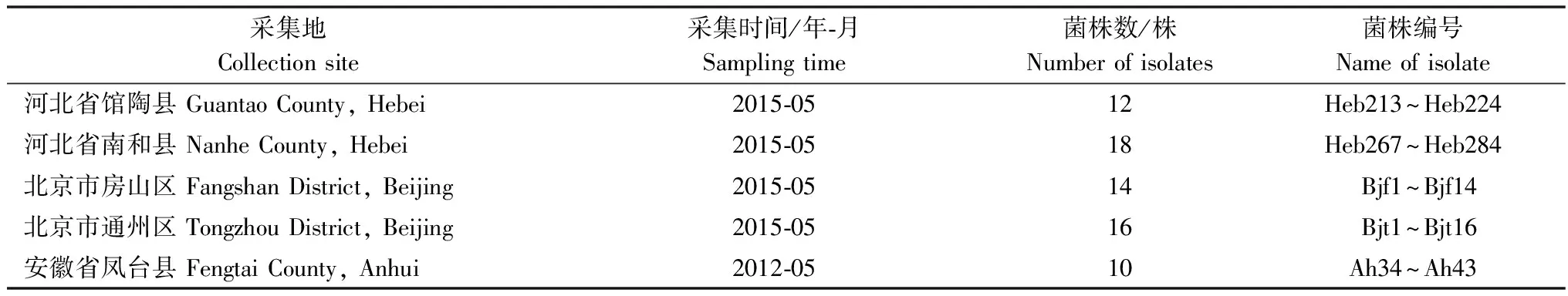
表1 菌种信息表
1.2 种的鉴定
种的鉴定采用TEF-1α基因测序鉴定法[12],扩增引物为EF1: 3′-ATGGGTAAGGA(A/G)GA CAAGAC-5′; EF2: 3′-GGA(G/A)GTACCAGT(G/C)ATCATGTT-5′,扩增产物约700 bp,由生工生物工程(上海)股份有限公司进行测序,序列提交FUSARIUM ID或GenBank数据库进行BLASTn比对,种鉴定阈值设为核苷酸一致性99%。采用MEGA 5.0软件MP法构建系统发育树进行验证。基因多样性相关参数由DnaSP软件计算。
1.3 毒素化学型的鉴定
毒素化学型采用基于毒素合成基因Tri3的引物组合进行多重PCR鉴定[8],共包含4条引物,3CON: 3′-TGGCAAAGACTGGTTCAC-5′; 3NA: 3′-GTGCACAGAATATACGAGC-5′; 3D15A: 3′-ACTGACCCAAGCTGCCATC-5′; 3D3A: 3′-CGCATTGGCTAACACATG-5′。其中NIV、15ADON和3ADON 毒素化学型的特征条带分别为840、610和243 bp。
1.4 菌丝生长速率测定
将菌株接种于PDA培养基,28℃培养3 d后,在靠近生长边缘打取6 mm菌饼,接种于新的PDA培养基中央,每个菌株3个重复,28℃避光培养,在24 h和72 h分别在菌落边缘标记4个不同的点,测量24~72 h之间的菌落生长长度,计算生长速率。
1.5 分生孢子产量测定
将一个6 mm菌饼放入盛有2 mL绿豆汤培养基的15 mL离心管,30°倾斜放入摇床,恒温28℃、220 r/min振荡培养10 d。采用DM4000B显微镜的计数模块测定分生孢子浓度,每个菌株3次重复。
1.6 毒素产量测定
各菌株毒素产量采用液相色谱-质谱联用法进行测定,色谱条件参照Suga等[13]的报道。NIV、15ADON和3ADON 毒素标准品购自Sigma。首先,将菌株接种于PDA培养基,28℃培养3 d,用6 mm打孔器在菌落生长边缘打取5个菌饼,均匀接种于大米培养基中,每个菌株3次重复,以不加病原菌的三角瓶做对照,前3天每天轻轻晃动1次,25~27℃避光培养7 d。将三角瓶放入烘箱60℃过夜烘干,放入A11研磨仪研磨30 s,取10 g放入80 mL乙腈/水(80∶20,v/v),120 r/min振荡1 h,采用Whatman No.4滤纸过滤,取2 mL滤液过Bond Elut单端孢霉烯族毒素SPE固相萃取柱,再取1 mL滤液过0.22 μm过滤器,装入Agilent 2 mL进样瓶,上机检测。
1.7 对主要杀菌剂敏感性的测定
选用3种常用杀菌剂:多菌灵(carbendazim)、戊唑醇(tebuconazole)、氰烯菌酯(phenamacril)进行药剂敏感性测定。97.5%多菌灵原药(沈阳化工股份有限公司),95.5%戊唑醇原药(中国农业大学种子病理药理实验室提供),91.2%氰烯菌酯原药(浙江大学提供)用二甲基亚砜(DMSO)配制成1×104μg/mL母液备用。分别配制含有杀菌剂浓度为0、0.025、0.05、0.1、0.2、0.4、0.8、1.6 μg/mL的PDA平板。将供试菌种在不含药PDA平板上培养3 d,在菌落边缘的同一圆周上用打孔器打取直径为5 mm的菌饼,菌丝面朝下接种于含药培养基中央,每处理3次重复,置于25℃培养箱内黑暗培养,待对照菌落接近培养皿边缘时测定各处理菌落直径,计算各杀菌剂的有效抑制中浓度EC50。
2 结果与分析
2.1 种和毒素化学型的鉴定结果
将测序结果与FUSARIUM ID和GenBank数据库进行比对分析,结果显示所有60株菌均为禾谷镰刀菌(Fusariumgraminearum)。系统发育分析也显示这60株菌与标准参照菌株F.graminearumNRRL6394(AF212456)和NRRL29169(AF212461)聚合在同一分支,而与F.asiaticum参照菌株NRRL6101(AF212450)和NRRL13818(AF212451)有明显的分化(图1)。对TEF-1α基因多样性进一步分析,各地区检测到的单倍型为4~6个,单倍型多态性(hd)和位点平均差异数量(π)分别为0.553~0.765和0.002 08~0.003 62,说明均具有较高的多态性水平。中性选择参数Tajima’sD值均不显著。具体多样性信息见表2。
毒素化学型的鉴定结果显示,所有菌株均产生610 bp的特异性条带,说明这些地区的禾谷镰刀菌的优势产毒化学型为15ADON。

图1 基于TEF-1α基因的小麦赤霉病菌系统发育分析Fig.1 Phylogenetic analysis of Fusarium strains from wheat based on TEF-1α gene

群体PopulationnShPiAhdπD河北省馆陶县Guantao,Hebei125640.7650.00362-0.927河北省南和县Nanhe,Hebei183430.5530.00208-1.129北京市房山区Fangshan,Beijing147440.6420.00222-0.071北京市通州区Tongzhou,Beijing165530.6830.00219-0.698
1)n: 群体数量;S: 多态位点数量;h: 单倍型数量;PiA:简约性信息位点数量;hd: 单倍型多态性;π: 位点平均差异数量;D:D值检验。
n: Sample size;S: Number of segregating sites;h: Number of haplotypes;PiA: Number of parsimony informative site between alleles;hd: Haplotypic diversity;π: Average number of differences per site;D: Tajima’sD.
2.2 菌丝生长速率测定结果
菌丝生长速率测定结果显示,北京市及河北省F.graminearum群体的平均生长速率为8.04~8.50 mm/d,4个群体间无明显差异(表3)。而对照组F.asiaticum群体的平均生长速率为(9.03±0.42) mm/d,生长速率明显快于F.graminearum群体(P<0.05)。
2.3 分生孢子产量测定结果
测定结果显示,北京市及河北省F.graminearum群体的平均分生孢子产量为30.45×104~35.60×104个/mL,4个群体间无明显差异(表3)。但显著高于对照组F.asiaticum群体(19.95×104个/mL,P<0.05)。
2.4 禾谷镰刀菌群体毒素产量测定结果
毒素测定结果显示,各菌株之间毒素产量差异显著,但4个F.graminearum群体间DON毒素及15ADON衍生物的产量无显著差异。对照组F.asiaticum群体DON毒素产量与F.graminearum群体间无显著差异,但3ADON毒素的量显著高于15ADON毒素(表3)。因此,F.asiaticum群体总单端孢霉烯族毒素(trichothecene)的量显著高于F.graminearum群体(P<0.05)。

表3 菌株生长速率、产孢量及毒素产量1)
1) 每列数据后不同字母表示在0.05水平有显著差异。
Values followed by different letters in the same column are significantly different atP<0.05.
2.5 禾谷镰刀菌群体对杀菌剂的敏感性
对3种主要杀菌剂抗性的测定结果显示,北京市和河北省采集的所有菌株均为敏感型菌株,没有发现抗性菌株存在。河北与北京的群体对3种杀菌剂抗性水平相似,其EC50均无显著差异。对照组F.asiaticum群体对多菌灵的EC50显著高于北京与河北F.graminearum群体(P<0.05)。而对戊唑醇与氰烯菌酯的抗性水平,F.asiaticum与F.graminearum群体间无显著差异。总体来看,氰烯菌酯的EC50范围和平均值最低,其次为戊唑醇,多菌灵最高(表4)。

表4 禾谷镰刀菌群体对多菌灵、戊唑醇与氰烯菌酯的抗性1)
1) 同行数据后不同字母表示在0.05水平差异显著。
Data followed by different letters in the same row are significantly different at 0.05 level.
3 讨论
小麦赤霉病是世界范围内的重要病害,严重威胁小麦的安全生产。目前已知至少有20余种镰刀菌可以引起小麦赤霉病,并且在各大洲表现出明显不同的区域分布特征。如:F.graminearum分布最为广泛,在各国均有分布,在北美洲、欧洲及东亚北部为优势种;F.asiaticum主要分布在亚洲,特别是东亚地区;F.boothii和F.meridionale在南美洲和亚洲的尼泊尔分布较多,而非洲的镰刀菌分布则更为复杂,种类也更多[14]。同时,近年来,随着气候及耕作制度变化,病原菌的生存环境也发生不同程度的改变。同时全球贸易一体化的发展,使病原菌随着农产品贸易在地区之间传播。这些都促使病原菌群体本身进行协同进化以适应环境,从而造成了病原菌群体结构的不断变化,如Waalwijk等发现并首先报道了在欧洲北部曾经的优势种黄色镰刀菌(F.culmorum)被禾谷镰刀菌(F.graminearum)所取代[7]。随后,多个国家发现了相同趋势[15-16]。在中国小麦赤霉病的主要流行区长江流域同样发现了3ADON型F.asiaticum群体具有取代NIV群体的趋势[6]。而在中国北方小麦产区,长期以来小麦赤霉病仅零星发生,因此对病原菌群体的系统性研究较少,特别是北京市小麦赤霉病菌群体组成未见报道。但近十年来,中国小麦赤霉病北移十分明显,在河北南部、山东、河南省份频繁发生。因此,监测北方麦区赤霉菌群体结构具有重要意义。
本研究表明,2015年收集的北京市与河北省赤霉病菌均属于产15ADON化学型毒素的F.graminearum群体,与Zhang等[6]对中国北方小麦赤霉菌是一个大的随机交配群体的推测一致。TEF-1α基因多样性分析表明,同一采样点的赤霉病菌群体内仍然存在较高的遗传多样性水平,表明群体内存在着频繁的遗传重组,这有利于赤霉菌对环境变化的快速适应以及新群体的形成。Ward等[8]发现,在加拿大3ADON型F.graminearum群体近十几年间逐渐由东向西扩张,取代原有的15ADON群体。并且表型测定显示,3ADON群体具有更强的致病力及产毒能力,因此是一个高风险群体。本研究并未在河北与北京检测到3ADON型F.graminearum菌株,说明这一群体尚未传入我国,应该加强监测,防止其传入我国北方地区,造成更大的危害。
生长速率和孢子产量是镰刀菌重要的生物学特性,对于其完成侵染十分重要。河北省和北京市各群体生长速率与分生孢子产量均无显著差异,这与种和毒素化学型的鉴定结果一致,证明其属于一个大的单一群体。对照组F.asiaticum群体的生长速率显著高于F.graminearum群体,而分生孢子产量则明显较低。这可能与两个种所处的环境不同有关,相对于长江流域的高温高湿环境,北方地区气候干燥,不利于菌丝生长,F.graminearum群体通过产生更多的孢子完成侵染。虽然一般认为赤霉病菌通过子囊孢子完成初侵染,但在许多地区,特别是北方玉米-小麦轮作区,在田间植物残体上并没有发现大规模的子囊壳存在。因此,分生孢子也可能是其重要的侵染源。DON毒素在镰刀菌侵染小麦的过程中发挥着重要作用[17]。毒素测定结果显示,不同菌株之间毒素产量有显著差异,但北京与河北各F.graminearum群体之间的毒素产量无明显差异。而对照组F.asiaticum群体虽然DON毒素产量与各群体间也无显著差异,但其3ADON产量明显较F.graminearum群体的15ADON高。镰刀菌通过将过量的DON毒素乙酰化来降低毒性,减轻对自身的危害。因此,乙酰化毒素的高产量也说明这一群体的高产毒能力。
目前,小麦赤霉病主要依靠化学防治。监测病原菌群体对主要杀菌剂的抗性水平对于指导合理用药十分重要。本研究结果表明,F.graminearum群体中未发现3种杀菌剂的抗性菌株,并且各群体之间抗性水平无显著差异,这与北方地区较少用杀菌剂进行防治有关。长江流域省份采用多菌灵防治小麦赤霉病已有30多年的历史,本研究也发现多菌灵对安徽省F.asiaticum群体的有效抑制中浓度显著高于其他群体。对3种主要杀菌剂进行对比表明,氰烯菌酯对禾谷镰刀菌的有效浓度最低,用药量最少,EC50仅为多菌灵的1/3。多菌灵的EC50最高。实际应用中,由于并没有检测到抗药群体存在,3种杀菌剂在北京市和河北省都会有较好的防效。目前多菌灵和氰烯菌酯对禾谷镰刀菌作用机制已经明确,作用位点为单一靶标,产生抗药性的风险较大。因此在实际应用中,要注意药剂轮换使用。
综上所述,本研究首次明确了北京市小麦赤霉菌的组成,发现群体内存在丰富的遗传多样性,并证实其与河北省菌株同属一个大的单一群体。毒素化学型结果表明,北京与河北地区小麦真菌毒素污染的主要风险为DON与15ADON毒素。同时,多菌灵、戊唑醇与氰烯菌酯在这一地区均具有较好防效。研究结果为制定小麦赤霉病综合防控策略、减轻毒素污染提供了重要理论依据。
[1] Nganje W E, Bangsund D A, Leistritz F L, et al. Estimating the economic impact of a crop disease: The case ofFusariumhead blight in U.S.wheat and barley [C]∥2002 NationalFusariumHead Blight Forum Proceedings, Erlanger, USA, 2002: 275-281.
[2] Stack R W.Return of an old problem:Fusariumhead blight of small grains [J/OL]. APS Feature. http:∥www.apsnet.org/publications/apsnetfeatures/Pages/headblight.aspx.
[3] Yang L J, van der Lee T, Yang X, et al.Fusariumpopulations on Chinese barley show a dramatic gradient in mycotoxin profiles [J]. Phytopathology, 2008, 98(6): 719-727.
[4] O’Donnell K, Ward T J, Geiser D M, et al. Genealogical concordance between the mating type locus and seven other nuclear genes supports formal recognition of nine phylogenetically distinct species within theFusariumgraminearumclade [J]. Fungal Genetics and Biology, 2004, 41(6): 600-623.
[5] Sarver B A, Ward T J, Gale L R, et al. NovelFusariumhead blight pathogens from Nepal and Louisiana revealed by multilocus genealogical concordance [J]. Fungal Genetics and Biology, 2011, 48(12): 1096-1107.
[6] Zhang Hao, van der Lee T, Waalwijk C, et al. Population analysis of theFusariumgraminearumspecies complex from wheat in China show a shift to more aggressive isolates [J]. PLoS ONE, 2012, 7(2): e31722.
[7] Waalwijk C, Kastelein P, de Vries I, et al. Major changes inFusariumspp. in wheat in the Netherlands [J]. European Journal of Plant Pathology, 2003, 109(7): 743-754.
[8] Ward T J, Clear R M, Rooney A P, et al. An adaptive evolutionary shift inFusariumhead blight pathogen populations is driving the rapid spread of more toxigenicFusariumgraminearumin North America [J]. Fungal Genetics and Biology, 2008, 45(4): 473-484.
[9] Gale L R, Harrison S A, Ward T J, et al. Nivalenol-type populations ofFusariumgraminearumandF.asiaticumare prevalent on wheat in southern Louisiana [J]. Phytopathology, 2011, 101(1): 124-134.
[10]Shen Chengmei, Hu Yingchun, Sun Haiyan, et al. Geographic distribution of trichothecene chemotypes of theFusariumgraminearumspecies complex in major winter wheat production areas of China [J]. Plant Disease, 2012, 96(8): 1172-1178.
[11]张昊, 张争, 许景升, 等. 一种简单快速的赤霉病菌单孢分离方法 — 平板稀释画线分离法[J]. 植物保护, 2008, 34(6): 134-136.
[12]Geiser D M, Jimenez-Gasco M M, Kang S, et al. FUSARIUM-ID v. 1.0: A DNA sequence database for identifyingFusarium[J]. European Journal of Plant Pathology, 2004, 110(5): 473-479.
[13]Suga H, Karugia G W, Ward T, et al. Molecular characterization of theFusariumgraminearumspecies complex in Japan [J]. Phytopathology, 2008, 98(2): 159-166.
[14]van der Lee T, Zhang Hao, van Diepeningen A, et al. Biogeography ofFusariumgraminearumspecies complex and chemotypes: a review [J]. Food Additives & Contaminants. Part A, Chemistry, Analysis, Control, Exposure & Risk Assessment, 2015, 32(4): 453-460.
[15]Nielsen L K, Jensen J D, Nielsen G C, et al.Fusariumhead blight of cereals in Denmark: species complex and related mycotoxins [J]. Phytopathology, 2011, 101(8): 960-969.
[16]Beyer M, Pogoda F, Pallez M, et al. Evidence for a reversible drought induced shift in the species composition of mycotoxin producingFusariumhead blight pathogens isolated from symptomatic wheat heads [J]. International Journal of Food Microbiology, 2014, 182: 51-56.
[17]Maier F J, Miedaner T, Hadeler B, et al. Involvement of trichothecenes in fusarioses of wheat, barley and maize evaluated by gene disruption of the trichodiene synthase (Tri5) gene in three field isolates of different chemotype and virulence [J]. Molecular Plant Pathology, 2006, 7(6): 449-461.
(责任编辑:杨明丽)
Population genetic structure and biological characteristics of Fusariumgraminearumon wheat in Beijing and Hebei
Dong Jie1, Zhang Jinliang1, Yang Jianguo1, Zhang Hao2, Feng Jie2
(1.Beijing Plant Protection Station, Beijing 100029, China; 2. State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
In this study, the genetic diversity and several phenotypes of the pathogens ofFusariumhead blight on wheat in Beijing and Hebei were analyzed. All isolates wereFusariumgraminearum, belonging to one random mating population. High level of genetic diversity within population was observed. The determination of trichothecene chemotype showed that DON and 15ADON were the main threats to wheat production in this area. Comparing toF.asiaticum,F.graminearumpopulation revealed higher conidial production, lower growth rate and trichothecene production. No resistant isolates to carbendazim, tebuconazole and phenamacril were identified.
Fusariumhead blight;Fusariumgraminearum; population genetic structure; fungicide resistance
Investigations
2015-11-16
2015-12-14
2015年北京市创新团队粮经作物团队岗位专家项目;国家国际科技合作专项(2013DFG31930); 国家自然科学基金(31201477)
S 435.121
A
10.3969/j.issn.0529-1542.2016.06.021
* 通信作者 E-mail:dongjiefine@126.com

