辣椒黄脉病毒RT-LAMP快速检测方法的建立
汤亚飞, 何自福*, 佘小漫, 蓝国兵
(1. 广东省农业科学院植物保护研究所, 广州 510640; 2. 广东省植物保护新技术重点实验室, 广州 510640)
实验方法与技术
辣椒黄脉病毒RT-LAMP快速检测方法的建立
汤亚飞1,2, 何自福1,2*, 佘小漫1, 蓝国兵1
(1. 广东省农业科学院植物保护研究所, 广州 510640; 2. 广东省植物保护新技术重点实验室, 广州 510640)
辣椒黄脉病毒(Pepperveinyellowsvirus,PeVYV)是影响世界辣椒生产的重要病毒,也是广东省辣椒上主要病原病毒之一。本研究根据PeVYV基因组P3蛋白基因序列设计了2对引物,建立了该病毒的反转录-环介导等温扩增(reverse transcription loop mediated isothermal amplification,RT-LAMP)检测方法。该方法70 min便可完成对PeVYV的检测,无需特殊的设备,灵敏度比普通RT-PCR高10倍,对田间疑似病样的检出结果与RT-PCR的结果一致。本研究建立的PeVYV RT-LAMP检测方法具有快速、灵敏和操作简便等优点,适合于对PeVYV病样快速、准确检测与鉴定。
辣椒黄脉病毒; RT-LAMP; 快速检测
辣椒黄脉病毒(Pepperveinyellowsvirus,PeVYV)属黄症病毒科(Luteoviridae)马铃薯卷叶病毒属(Polerovirus)成员,由蚜虫以持久方式传播,也可以嫁接传播[1]。该病毒在日本[1-2]、西班牙[3]、突尼斯、土耳其[4]、印度、印度尼西亚、菲律宾、泰国[5]、苏丹[6]和美国[7]等国家均有分布。我国的台湾[5]、湖南[8]和山东[9]等省也先后报道了该病毒。辣椒感染黄脉病毒后主要表现为叶脉黄化、叶片卷曲、节间缩短等,其产量和品质受到严重影响。
建立快速、灵敏和特异的检测鉴定方法是植物病毒病诊断、防治和预测预报的前提与基础。目前,PeVYV的检测主要采用反转录聚合酶链式反应(reverse transcription-polymerase chain reaction, RT-PCR)[6,9]。相对于血清学检测方法,该方法较快速(6 h左右)、灵敏和特异,但需要高精度的PCR仪及较复杂的方法来检测扩增产物,使其在日常诊断中受到限制。日本学者Notomi等开发了一种新型的核酸扩增方法——环介导等温扩增(loop mediated isothermal amplification,LAMP)技术[10]。该技术采用4条特异引物识别靶序列上6个特异区域,利用DNA 链置换聚合酶(BstDNA polymerase)在恒温条件下对靶基因扩增。RT-LAMP 方法是在LAMP 方法的基础上添加了反转录酶(AMV),使反转录和扩增在同一温度下进行。相对RT-PCR来说,该技术更加简便、快速(70 min左右)、特异。该技术已被应用于番茄[11-12]、柑橘[13-14]、香蕉[15]、水稻[16-17]、小麦[18]、马铃薯[19-21]、草莓[22]、兰花[23]等多种作物的病毒病检测。本文以PeVYV的P3蛋白基因序列为靶标基因,设计了4 条特异性引物,建立了该病毒的RT-LAMP快速检测方法。
1 材料与方法
1.1 材料
感染PeVYV的辣椒病样:采自广东茂名市辣椒产区,经RT-PCR检测验证,置于-80℃保存;健康辣椒材料:本实验室在防虫温室中培育的健康辣椒叶片;待检材料:采自广东省各辣椒产区疑似辣椒病叶。
Loopamp RNA 扩增反应试剂盒、Loopamp FD 荧光检测试剂购自日本Eiken Chemical 公司;RNA提取试剂盒购自北京全式金生物技术有限公司;一步法RT-PCR试剂盒购自宝生物工程(大连)有限公司;LA-320C 实时浊度仪由日本Eiken Chemical 公司提供。
1.2 方法
1.2.1 引物设计
依据GenBank中已登录的PeVYV基因组(GenBank序列登录号:AB594828.1、KP326573.1)的P3蛋白基因序列,应用LAMP 引物设计软件Primer Explorer V.4 (http:∥primerexplorer.jp/elamp4.0.0/index.html)设计外侧引物对F3和B3以及内侧引物对FIP和BIP,将引物在NCBI数据库中Primer-BLAST模块下进行比对验证,最终选出用于RT-LAMP的引物组合(表1)。应用PCR引物设计网站(http:∥primer3.ut.ee/),设计目的片段为562 bp的特异引物对P-F/P-R(表1)用于PeVYV的RT-PCR检测。所有引物由上海生工生物工程技术服务有限公司合成。
1.2.2 总RNA的提取
取辣椒病叶100 mg,应用RNA提取试剂盒抽提其总 RNA,根据试剂盒说明书的步骤进行操作,最终RNA沉淀溶解于40 μL DEPC处理的ddH2O中。
1.2.3 RT-LAMP反应体系及最佳反应温度
按照Loopamp RNA 扩增试剂盒的说明配制RT-LAMP反应体系,即:2×反应缓冲液12.5 μL,酶溶液1.0 μL,40 pmol/μL引物FIP 1.0 μL,40 pmol/μL引物BIP 1.0 μL,10 pmol/μL引物F3 0.5 μL,10 pmol/μL引物B3 0.5 μL,荧光目视检测试剂1.0 μL,RNA模板1.0 μL,去离子水6.5 μL,反应总体系为25 μL。反应温度分别设为59℃、61℃、63℃ 和65℃,反应时间为60 min,之后加热至80℃ 5 min使酶失活。扩增反应在实时浊度仪上进行,根据60 min 内出现扩增曲线的最短时间确定最佳反应温度。反应结束后,根据反应液颜色进行判断,若显绿色,则为阳性反应;若显橙色,则判断为阴性反应。进一步通过电泳加以验证,取2 μL扩增产物,在质量分数为1.5%的琼脂糖凝胶上100~125 V恒压电泳30 min,然后在紫外检测仪下观察。

表1 RT-LAMP 和RT-PCR检测PeVYV 的引物
1.2.4 RT-PCR
RT-PCR反应参照一步法RT-PCR试剂盒说明操作,即:PrimeScript 1 Step Enzyme Mix 2.0 μL,2×1 Step Buffer(Dye Plus)25.0 μL,10 μmol/L 引物P-F 2.0 μL,10 μmol/L 引物P-R 2.0 μL,RNA模板1.0 μL,去离子水18 μL,总体系为50 μL。反应条件为:50℃反转录30 min;94℃预变性4 min,94℃变性30 min、52℃退火30 s、72℃延伸1 min,35个循环,72℃最终延伸10 min,取 8 μL扩增产物在质量分数为1.5%的琼脂糖凝胶上100~125 V恒压电泳30 min,在紫外检测仪下观察并记录结果。
1.2.5 灵敏度试验
将所提取的辣椒病叶片组织的总RNA按10-1~10-8进行浓度梯度稀释,以不同浓度的RNA作模板,分别进行RT-LAMP和普通RT-PCR检测,比较两者的检测灵敏度。
1.2.6 PeVYV田间疑似病样RT-LAMP检测
从广东省各辣椒产区采集疑似感染PeVYV的辣椒病样6份,提取总RNA,分别用1.2.3的RT-LAMP方法检测,并用RT-PCR 方法加以验证。
2 结果与分析
2.1 RT-LAMP最佳反应温度
以感染PeVYV辣椒病叶组织的总RNA为模板,进行RT-LAMP反应,实时浊度仪输出的扩增时间曲线(图1)表明:在59、61、63 和65℃的反应温度下,RT-LAMP反应分别在约42、34、29 和27 min 时扩增曲线开始上升。反应结束后,肉眼观察到各温度处理反应液均呈绿色,而空白对照呈橙色(图2)。根据现场检测时间尽可能短的要求,确定65℃为最佳反应温度。

图1 RT-LAMP各反应温度下的扩增曲线Fig.1 Amplification curve of RT-LAMP assay at different temperatures

图2 RT-LAMP各温度处理的反应液颜色变化Fig.2 Color change of RT-LAMP products at different temperatures
2.2 灵敏度检测结果
将感染PeVYV的辣椒病叶片组织总RNA进行10倍系列稀释作为模板,分别进行RT-LAMP反应和RT-PCR反应。应用RT-LAMP方法,在模板稀释倍数为10-4时,反应液呈明显绿色(阳性反应),电泳时扩增的目的条带清晰;当模板稀释倍数为10-5时,反应液也呈现绿色,电泳时仍可见扩增的条带;但模板稀释倍数为10-6时,反应液呈现橙色,电泳无目的条带(阴性反应)(图3~4)。应用RT-PCR方法,在模板稀释倍数为10-4时,电泳时扩增的目的条带已经非常弱;当模板稀释倍数为10-5时,RT-PCR已不能扩增出目的条带(图5)。因此,检测PeVYV,RT-LAMP方法比RT-PCR方法灵敏度高10倍。
2.3 疑似病样的RT-LAMP检测结果
对来自广东省不同辣椒产区的6份疑似感染PeVYV病样,采用RT-LAMP方法进行检测,结果显示(图6),疑似病样1号、2号、3号、5号为阳性,4号和6号为阴性。进一步应用RT-PCR加以验证,其检测结果(图7)与RT-LAMP结果一致,两者的符合率为100%。这表明所建立的PeVYV RT-LAMP 检测方法能够实现田间病样的快速、准确检测与诊断。
3 讨论
本研究建立的PeVYV RT-LAMP 检测方法快速、简便、灵敏和特异。应用该方法可在70 min内完成对PeVYV的检测,而常规的RT-PCR检测则需要6 h左右,大幅度缩短了检测时间。整个扩增过程可在恒温水浴锅或烘箱中进行,反应结果可以通过肉眼直接观察扩增反应产物的颜色变化进行判定,检测方法简便,克服了RT-PCR检测方法在实际应用中的局限与不足。在灵敏度方面,RT-LAMP的检测灵敏度比RT-PCR高10倍。另外,由于RT-LAMP所利用的引物需要识别靶序列上6个特异性区域,而常规的RT-PCR方法引物只识别靶序列上2个特异性区域,因此RT-LAMP具有更高的特异性。
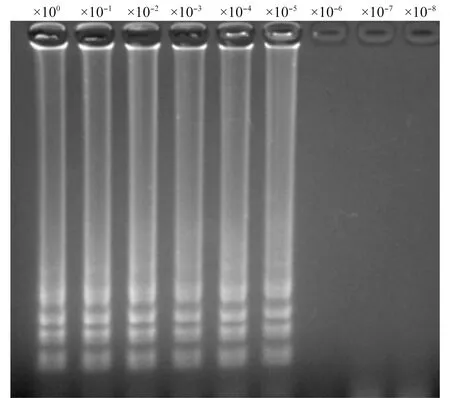
图4 RT-LAMP灵敏度试验电泳结果Fig.4 Electrophoresis result of sensitivity assay of RT-LAMP detection

图5 RT-PCR灵敏度试验电泳结果Fig.5 Electrophoresis result of sensitivity assay of RT-PCR detection

图6 田间辣椒病样的RT-LAMP检测结果Fig.6 Detection results of pepper samples from fields by RT-LAMP
由于RT-LAMP技术灵敏度高、产物扩增量大,微量的污染(如空气中的阳性气溶胶微粒)都有可能导致假阳性,因此操作过程中一定要保证试验环境、器具以及试剂等免受RNA或扩增产物的污染,检测的各个环节要严格分区进行;同时操作过程尽量减少开盖操作次数等。本研究所建立的PeVYV RT-LAMP 检测方法将所有的反应成分及荧光目视检测试剂一次性加入到反应管中进行反应,中间不再开盖,待反应结束后直接观察反应液的颜色来判断结果,大幅度降低了假阳性产生的可能性。

图7 田间辣椒病样的RT-PCR检测Fig.7 Detection results of pepper samples from fields by RT-PCR
PeVYV是辣椒上重要病毒之一。自1995年Yonaha等在日本首次报道发现PeVYV以来[1],近几年,亚洲、非洲、欧洲、美洲的多个国家陆续报道发生该病毒。2013年我国台湾首次报道发现该病毒[5],随后在山东和湖南等省份也检测到该病毒[8-9]。本团队对广东省辣椒病毒病发生情况进行了调查,发现疑似辣椒黄脉病毒病,应用小RNA测序技术及RT-LAMP方法对其病毒种类进行鉴定与检测,发现PeVYV在广东省主要辣椒产区均有分布,疑似病样的检测阳性率为38.3%,且常与甜椒脉斑驳病毒(Pepperveinalmottlevirus,PVMV)、辣椒叶脉斑驳病毒(Chilliveinalmottlevirus,ChiVMV)、黄瓜花叶病毒(Cucumbermosaicvirus,CMV)等病毒复合侵染或混合发生,说明PeVYV是引起广东辣椒病毒病的主要病原病毒之一。需要进一步弄清其分布、发生规律及辣椒品种的抗性水平,为预防与控制该病毒病的发生提供科学依据。
[1] Yonaha T, Toyosato T, Kawano S, et al.Pepperveinyellowsvirus, a novel luteovirus from bell pepper plants in Japan [J]. Annals of the Phytopathological Society of Japan, 1995, 61(3): 178-184.
[2] Murakami R, Nakashima N, Hinomoto N, et al. The genome sequence ofPepperveinyellowsvirus(familyLuteoviridae, genusPolerovirus)[J]. Archives of Virology, 2011, 156(5): 921-923.
[3] Villanueva F, Castillo P, Font M I, et al. First report ofPepperveinyellowsvirusinfecting sweet pepper in Spain[J]. Plant Disease, 2013, 97(9): 1261-1262.
[4] Buzkan N, Arpaci B B, Simon V, et al. High prevalence of poleroviruses in field-grown pepper in Turkey and Tunisia [J]. Archives of Virology, 2013, 158(4): 881-885.
[5] Knierim D, Tsai W S, Kenyon L.Analysis of sequences from field samples reveals the presence of the recently describedPepperveinyellowsvirus(genusPolerovirus) in six additional countries [J]. Archives of Virology, 2013, 158(6): 1337-1341.
[6] Alfaro-Fernández A, ElShafie E E, Ali M A, et al. First report ofPepperveinyellowsvirusinfecting hot pepper in Sudan[J]. Plant Disease, 2014, 98(10): 1446.
[7] Alabi O J, Rwahnih M Al, Jifon J L, et al. First report ofPepperveinyellowsvirusinfecting pepper (Capsicumspp.) in the United States [J]. Plant Disease, 2015, 99(11): 1656.
[8] Zhang S B, Zhao Z B, Zhang D Y, et al. First report ofPepperveinyellowsvirusinfecting red pepper in mainland China[J]. Plant Disease, 2015, 99(8): 1190.
[9] Tan W P, Dong Y Z, Sun X H, et al. The first identification ofPepperveinyellowsvirusin Shandong Province, China [J].Plant Disease, 2015, 99(9): 1288.
[10]Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA [J]. Nucleic Acids Research, 2000, 28(12): e63.
[11]Zhao Liming, Li Gang, Gao Ying, et al. Reverse transcription loop-mediated isothermal amplification assay for detectingTomatochlorosisvirus[J]. Journal of Virological Methods, 2015, 213: 93-97.
[12]Fukuta S, Ohishi K, Yoshida K, et al. Development of immunocapture reverse transcription loop-mediated isothermal amplification for the detection ofTomatospottedwiltvirusfrom chrysanthemum [J]. Journal of Virological Methods, 2004, 121(1): 49-55.
[13]刘科宏, 陈洪明, 周彦, 等. 柑橘黄化脉明病毒RT-LAMP检测方法的建立[J]. 园艺学报, 2015, 42(5): 997-1002.
[14]王永江, 周彦, 李中安, 等. 柑橘衰退病毒RT-LAMP快速检测方法的建立[J]. 中国农业科学, 2013, 46(3): 517-524.
[15]Peng Jun, Shi Minjing, Xia Zihao, et al. Detection ofCucumbermosaicvirusisolates from banana by one-step reverse transcription loop-mediated isothermal amplification [J]. Archives of Virology, 2012, 157(11): 2213-2217.
[16]周彤, 杜琳琳, 范永坚, 等. 水稻黑条矮缩病毒RT-LAMP快速检测方法的建立[J]. 中国农业科学, 2012, 45(7): 1285-1292.
[17]Le D T, Netsu O, Uehara-Ichiki T, et al. Molecular detection of nine rice viruses by a reverse-transcription loop-mediated isothermal amplification assay[J]. Journal of Virological Methods, 2010, 170: 90-93.
[18]Zhao Kun, Liu Yan, Wang Xifeng. Reverse transcription loop-mediated isothermal amplification of DNA for detection ofBarleyyellowdwarfvirusesin China [J]. Journal of Virological Methods, 2010, 169(1): 211-214.
[19]刘洪义, 辛言言, 刘忠梅, 等. 马铃薯A病毒RT-LAMP检测方法的建立[J]. 中国农学通报, 2015, 31(11): 143-147.
[20]Nie Xianzhou. Reverse transcription loop-mediated isothermal amplification of DNA for detection ofPotatovirusY[J]. Plant Disease, 2005, 89(6): 605-610.
[21]Tsutsumi N, Yanagisawa H, Fujiwara Y, et al. Detection ofPotatospindletuberviroidby reverse transcription loop-mediated isothermal amplification[J]. Research Bulletin of the Plant Protection Service, Japan, 2010, 46: 61-67.
[22]陈柳, 尚巧霞, 陈笑瑜, 等. 草莓轻型黄边病毒RT-LAMP检测方法的建立[J]. 中国农业科学, 2015, 48(3): 613-620.
[23]Lee M S, Yang M J, Hseu Y C, et al. One-step reverse transcription loop-mediated isothermal amplification assay for rapid detection ofCymbidiummosaicvirus[J]. Journal of Virological Methods, 2011, 173(1): 43-48.
(责任编辑:杨明丽)
Development of RT-LAMP for rapid detection of Pepper vein yellows virus
Tang Yafei1,2, He Zifu1,2, She Xiaoman1, Lan Guobing1
(1. Plant Protection Research Institute, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China;2. Guangdong Provincial Key Laboratory of High Technology for Plant Protection, Guangzhou 510640, China)
Pepperveinyellowsvirus(PeVYV) is an important virus of pepper worldwide. It is also one of the main pathogenic viruses infecting pepper in Guangdong Province. By using primer explorer software, two pairs of primers were designed according to the P3 gene sequence of PeVYV.The reverse transcription loop-mediated isothermal amplification (RT-LAMP) detection method of PeVYV was developed. The PeVYV detection could be finished within 70 min by using this method and needs no special equipment. Its sensitivity was 10 times higher than that of ordinary RT-PCR.The detection result of suspected samples collected from fields by the method was consistent with that by RT-PCR.The advantages of RT-LAMP detection method for PeVYV were rapid, sensitive and simple. Hence,the method is suitable for rapid and accurate detection and identification of PeVYV.
Pepperveinyellowsvirus; RT-LAMP; rapid detection
Experimental Method & Technology
2015-12-16
2016-02-04
公益性行业(农业)科研专项(201303028); 广东省科技计划项目(2013B020309003; 2014B070706017)
S 436.418
A
10.3969/j.issn.0529-1542.2016.06.017
* 通信作者 E-mail: hezf@gdppri.com

