草珊瑚的无菌播种和丛生芽诱导研究
, , , (湖州师范学院生命科学学院, 浙江 湖州 313000)
草珊瑚的无菌播种和丛生芽诱导研究
朱淑颖,杨帆,姜叶琴,张海洋
(湖州师范学院生命科学学院, 浙江 湖州 313000)
以去除果肉的草珊瑚种子为试验材料,采用无菌播种方式培育出种子苗,并以此为组织培养的外植体来源,诱导出丛生芽,为离体再生体系的建立奠定基础。结果表明:种子的最佳消毒方法为先用75%酒精消毒30 s,无菌水冲洗3~4次,再用0.1%升汞消毒3 min,无菌水冲洗3~4次;最佳播种培养基为1/4 MS+NAA 0.05 mg/L,温度25 ℃,每天光照12 h,种子发芽率可达68.89%;切取种子苗的顶芽接种于MS+6-BA 4.0 mg/L培养基上可诱导出丛生芽,且丛生芽易于增殖和生根。
草珊瑚; 无菌播种; 丛生芽; 组织培养
草珊瑚(Sarcandraglabra(Thunb.) Nakai),别名九节茶、肿节风、接骨莲、竹节草等,为金粟兰科草珊瑚属多年生常绿半灌木[1]。全株药用,具清热解毒、活血止痛、通经接骨及抗肿瘤等功效,是一种应用广泛、疗效确切的优良中药材[2]。随着草珊瑚在医药、日用品、保健品等领域的应用不断拓宽,生产需求量不断增加,无限制地采挖使资源蕴藏量锐减[3],因此进行大规模人工种植已成必然,其中种苗繁育是技术关键。传统繁殖方法如扦插、分株和播种繁殖存在繁殖速度慢、增殖率低等问题,无法满足生产需求,而组培快繁是有效解决途径。有关研究已有少量报道[4-6],但都以成年植株的茎段、叶片等为外植体,诱导丛生芽较难,特别是培养物内生菌污染严重,常在继代数次后仍有细菌状污染陆续出现,故本试验通过种子培育无菌苗以建立无菌培养体系。
本研究首次对草珊瑚无菌播种的种子消毒方法、培养基成分及适宜的温度和光照条件等进行了较为系统的研究,获得无菌种子苗,并以此作为外植体诱导出丛生芽,为草珊瑚离体再生体系的建立奠定基础,对实现草珊瑚种苗的规模化繁育具有重要的理论和现实意义。
1 材料与方法
1.1 试验材料
成熟草珊瑚果实,采自本课题组种植于湖州市东林镇农业合作中心的天宇山毛竹林下的3年生植株,于2014年11—12月采集。试验时选取籽粒饱满、质地均匀的果实,自来水浸泡5~6 h后搓洗,去除外面的果肉,分离出种子,于通风阴凉处沥干备用。
表1 不同消毒方法对草珊瑚种子污染率及发芽率的影响
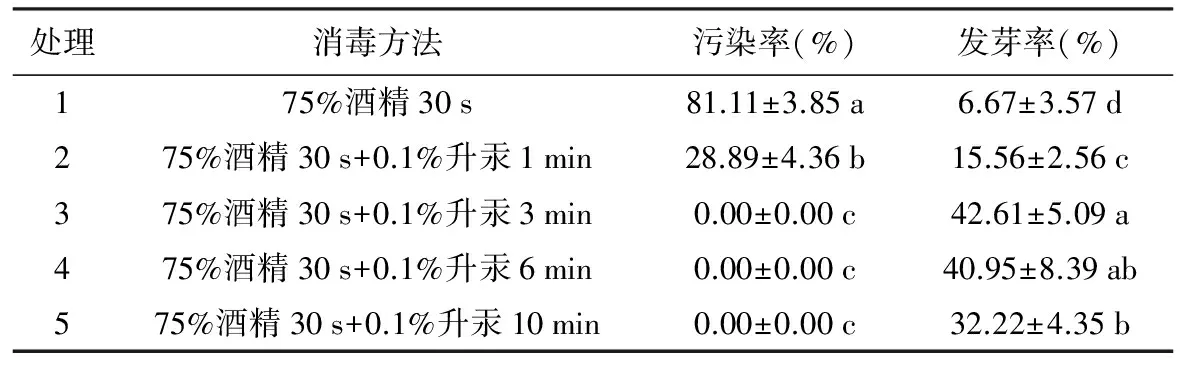
处理消毒方法污染率(%)发芽率(%)175%酒精30s81.11±3.85a6.67±3.57d275%酒精30s+0.1%升汞1min28.89±4.36b15.56±2.56c375%酒精30s+0.1%升汞3min0.00±0.00c42.61±5.09a475%酒精30s+0.1%升汞6min0.00±0.00c40.95±8.39ab575%酒精30s+0.1%升汞10min0.00±0.00c32.22±4.35b
注:①表中数据为3次重复平均值±标准差;②同列数据后不同字母表示在p=0.05水平上差异显著。下同。
1.2 试验方法
1.2.1 无菌播种前的消毒处理
在超净工作台上,将洗净沥干的种子先用75%酒精浸泡30 s,无菌水冲洗3~4次,再用0.1%升汞分别浸泡0 min(处理1)、1 min(处理2)、3 min(处理3)、6 min(处理4)、10 min(处理5),浸泡过程中不停振荡液体,再用无菌水冲洗3~4次。消毒后的种子分别接种到1/2 MS培养基(大量元素和微量元素浓度减半)中。每个处理接种30粒种子,试验重复3次,下同。接种后每隔5 d观察1次种子萌动情况及幼苗生长状况,及时去除污染的材料,至60 d时统计结果。
污染率(%)=污染种子数/接种种子总数×100%;
发芽率(%)=萌芽种子数/接种种子总数×100%。
1.2.2 无菌播种培养基的选择
在找到草珊瑚种子最佳消毒方法的基础上,进一步筛选适宜的播种培养基。以MS、1/2 MS、1/4 MS(大量元素和微量元素浓度减为MS培养基的1/4)为基本培养基,分别添加不同浓度NAA,设4个水平:0,0.05,0.1,0.2 mg/L,共12个处理。培养至60 d时统计结果,其中完全愈伤化且未见芽点的种子不计入发芽率。
1.2.3 无菌播种的适宜温度和光照条件的选择
在采用上述试验筛选出的最佳消毒方法和播种培养基的前提下,分别考察温度和光照条件对草珊瑚种子萌发的影响。
1) 种子接入培养瓶后分别置于15,20,25,30 ℃和35 ℃下培养,每天光照12 h,观察不同温度下的种子萌发情况。
2) 在25 ℃条件下,种子分别采用全黑暗、每天光照12 h和每天光照24 h(持续性光照)3种处理方法进行培养,观察不同光照条件下的种子萌发情况。
以上试验均采用1 500~2 000 lx光照度,培养基为1/4 MS+NAA 0.05 mg/L。
1.2.4 丛生芽的诱导培养
由种子培育出无菌苗后,分别切取顶芽、胚轴、子叶和胚根,进行丛生芽诱导试验,接种到下列培养基中: 1) MS+6-BA 2.0 mg/L; 2) MS+6-BA 4.0 mg/L; 3) MS+6-BA 8.0 mg/L; 4) MS+6-BA 4.0 mg/L+NAA 0.2 mg/L;5) MS+6-BA 8.0 mg/L+NAA 0.5 mg/L。以不添加植物生长物质的MS空白培养基为对照。每个处理接种20个外植体,试验重复3次。观察并统计各培养基中外植体诱导分化出芽的情况。
1.2.5 培养条件
试验所用培养基附加30 g/L蔗糖,7.0 g/L琼脂,pH值5.7~5.9,121 ℃高压灭菌15 min。培养温度(25±1)℃,光照度1 500~2 000 lx,每天光照12 h。有特殊说明的除外。
1.3 统计分析
试验数据用SPSS 19.0软件进行统计分析,并用其中的Duncan’s法作显著性差异分析。
2 结果与分析
2.1 消毒方法对草珊瑚种子萌发的影响
草珊瑚果实为核果,种子外有果肉,笔者在先期实验中比较了去果肉和不去果肉2种材料的接种后污染率,发现不去果肉的种子不管采用何种消毒方法,均在接种后20 d全部被污染,因此试验以去除果肉的种子为材料。以不同消毒方法处理后接种,从第5天开始陆续出现污染,至20 d时达到高峰,污染的种子均不能萌发,未污染的种子在第35天左右开始先后萌发,至60 d时统计并分析,结果见表1。
单独使用75%酒精做消毒处理30 s,污染率很高,结合使用0.1%升汞消毒处理,可显著降低污染率,处理时间3 min以上,污染率为0,除菌效果佳;从种子发芽率来看,随着升汞处理时间的延长,发芽率先升后降,在处理时间为3 min时达到最高,为42.61%,处理时间再延长发芽率降低,可能是由于长时间浸泡升汞透过种皮渗入内部对种子产生了毒害作用。因此,草珊瑚种子最佳的消毒方法为:先用75%酒精消毒30 s,无菌水冲洗3~4次,再用0.1%升汞消毒3 min,无菌水冲洗3~4次。以下试验均采用此方法。
2.2 培养基成分对草珊瑚种子萌发及幼苗生长的影响
由表2可知,培养基中的无机盐浓度(MS、1/2 MS、1/4 MS)和植物生长物质NAA对草珊瑚种子萌发均有显著影响。在MS、1/2 MS、1/4 MS培养基上种子发芽率分别为0.00%、46.67%和68.89%,随着无机盐离子浓度的降低,种子发芽率明显呈上升趋势,差异显著,可见低浓度无机盐更有利于种子萌发。其中本试验最高发芽率68.89%在1/4 MS+NAA 0.05 mg/L培养基上实现,苗生长正常,为最佳无菌播种培养基。
表2 不同培养基对草珊瑚种子萌发及幼苗生长的影响
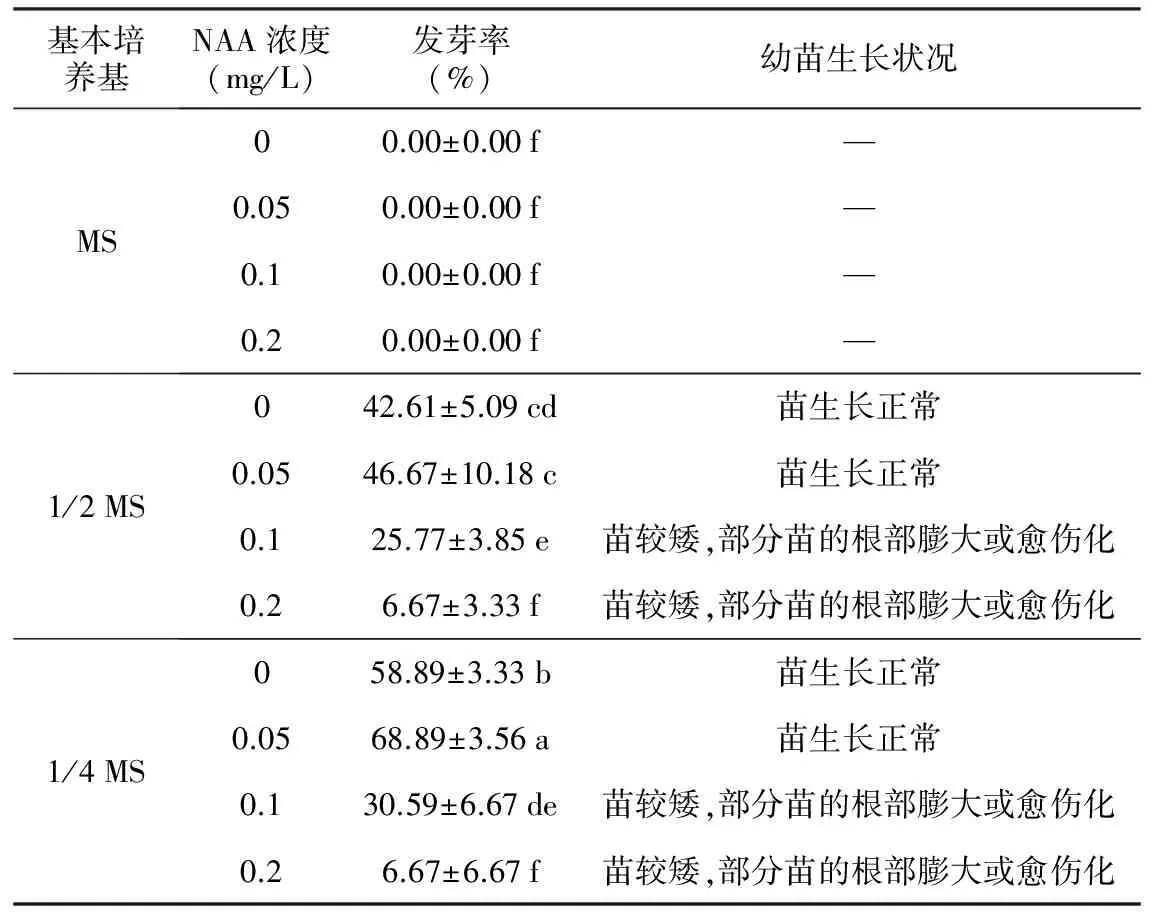
基本培养基NAA浓度(mg/L)发芽率(%)幼苗生长状况MS00.00±0.00f—0.050.00±0.00f—0.10.00±0.00f—0.20.00±0.00f—1/2MS042.61±5.09cd苗生长正常0.0546.67±10.18c苗生长正常0.125.77±3.85e苗较矮,部分苗的根部膨大或愈伤化0.26.67±3.33f苗较矮,部分苗的根部膨大或愈伤化1/4MS058.89±3.33b苗生长正常0.0568.89±3.56a苗生长正常0.130.59±6.67de苗较矮,部分苗的根部膨大或愈伤化0.26.67±6.67f苗较矮,部分苗的根部膨大或愈伤化
在高浓度的无机盐水平(MS)下,无论是否添加NAA,草珊瑚种子的发芽率均为0。而在低浓度的无机盐水平(1/2 MS和1/4 MS)下,草珊瑚种子的发芽率总体明显升高;添加NAA,相同基础培养基上的种子发芽率随NAA浓度(0,0.05,0.1,0.2 mg/L)先升后降,趋势明显,且较高NAA浓度(0.1~0.2 mg/L)下幼苗生长异常,苗较矮且根部膨大甚至愈伤化,说明NAA对种子萌发作用强烈,低浓度促进,浓度略高则出现抑制。
2.3 温度和光照对草珊瑚种子萌发及幼苗生长的影响
由表3可知,15 ℃时,草珊瑚种子发芽率为0,随着温度的增加,发芽率表现出先升后降的趋势,并且25 ℃条件下发芽率达到最高,且方差分析表明差异极显著。由此可见,温度对种子萌发的影响显著,过高或过低均不利于萌发,以25 ℃为宜。
表3 不同温度对草珊瑚种子萌发及幼苗生长的影响(每天光照12 h)

温度(℃)发芽率(%)幼苗生长状况150.00±0.00dD-2031.11±4.41cC苗生长正常2568.89±3.56aA苗生长正常3055.56±6.67bB苗生长正常3528.89±7.70cC苗较矮,叶片颜色偏淡,部分苗会烂根
注:培养基为1/4 MS+NAA 0.05 mg/L;种子消毒方法为75%酒精30 s+0.1%升汞3 min。下同。
由表4可知,在25 ℃条件下,3种光照条件(全黑暗、每天12 h光照和每天12 h光照)对发芽率无明显影响,但幼苗形态有差别,有光照时苗形态正常,而黑暗条件下苗出现黄化现象。为保证幼苗正常生长并考虑到试验操作的简便性,草珊瑚种子苗萌发可采用组织培养通用光照条件,即每天光照12 h,光照度1 500~2 000 lx。
表4 不同光照条件对草珊瑚种子萌发及幼苗生长的影响(25 ℃)

光照条件 发芽率(%) 幼苗生长状况全黑暗66.67±13.88a苗出现黄化现象,茎叶黄,顶端呈钩状弯曲每天光照12h68.89±3.56a苗生长正常每天光照24h65.56±6.94a苗生长正常
2.4 外植体类型和培养基成分对丛生芽诱导的影响
草珊瑚种子萌发获得无菌苗(见图1)后,切取顶芽、胚轴、子叶和胚根作为外植体,分别接种到6种不同培养基中。在培养全过程中,胚轴、子叶和胚根未见丛生芽产生。而部分顶芽在培养15 d后,开始出现萌动,25 d左右时,有侧芽开始长出。培养至50 d时形成丛生芽(见图2),不同培养基上的诱导情况见表5。不添加植物生长物质的MS空白培养基(对照)的丛生芽诱导率为0,而添加6-BA和NAA可显著提高诱导率,其中MS+6-BA 4.0 mg/L和MS+6-BA 4.0 mg/L+NAA 0.2 mg/L的诱导率均为100%,MS+6-BA 8.0 mg/L最低,只有25.00%,大部分顶芽褐化死亡,说明此时6-BA浓度已过高。此外,就丛生芽生长状况而言,诱导率均为100%的2种培养基,MS+6-BA 4.0 mg/L培养基的丛生芽萌动早,数量多,是较好的芽诱导培养基。

图1 草珊瑚种子萌发后形成的无菌苗
表5 不同培养基对无菌苗顶芽的丛生芽诱导率

处理 培养基(mg/L)开始萌动天数(d)丛生芽诱导率(%) 丛生芽生长状况ckMS-0.00±0.00e顶芽伸长,不形成丛生芽1MS+6⁃BA2.015~1673.33±6.68b丛生芽较少,生长良好2MS+6⁃BA4.015~16100.00±0.00a丛生芽多,健壮,生长良好3MS+6⁃BA8.019~2025.00±3.33d大量顶芽褐化死亡,丛生芽瘦弱4MS+6⁃BA4.0+NAA0.218~19100.00±0.00a丛生芽较多,健壮,生长良好5MS+6⁃BA8.0+NAA0.518~1941.67±6.68c部分顶芽褐化死亡,丛生芽瘦弱

图2 以草珊瑚无菌苗顶芽为外植体诱导出的丛生芽

图3 生根培养后得到的草珊瑚完整植株
诱导出丛生芽后,初步进行了芽增殖和生根培养,所得结果与笔者以前的研究基本一致[5],芽体在MS+6-BA 4.0 mg/L+NAA 0.2 mg/L培养基上增殖良好,增殖系数在4.0以上,切成单芽后易于生根,在1/2 MS+IBA 0.2 mg/L培养基上生根率达100%,成功获得完整植株(见图3)。
3 讨论与结论
以草珊瑚成年植株的茎段、叶片、顶芽等为外植体进行组织培养,消毒较困难,常有内生菌污染存在,不易建立无菌培养材料,因此选用草珊瑚种子通过无菌播种的方法获得无菌活体。种子无菌播种除易消毒彻底外,还有其自身的优势,一是可实现全年全天候播种,二是消毒效果不受季节和天气的影响[7]。本研究表明,通过无菌播种获得种子苗并以此为外植体来源建立草珊瑚离体再生体系是可行的。
3.1 草珊瑚种子无菌播种前的消毒
对种子进行有效的消毒是建立无菌体系的先决条件,也是无菌播种工作的一个重要环节。种子表面灭菌的关键是选择合适的消毒剂和消毒时间。因为消毒剂不仅杀灭微生物,也对种子产生一定的伤害[8]。常用的消毒剂有酒精、升汞、次氯酸钙、次氯酸钠、溴水、过氧化氢、硝酸银、抗生素等,一般而言升汞的杀菌能力最强[9-10],但对植物材料的伤害也最大,因此使用时须严格控制时间(升汞常用浓度0.1%)。本试验采用75%酒精和0.1%升汞联合使用的方法,证实升汞的作用非常明显,消毒处理时间太短(<3 min),消毒不彻底,污染率偏高,消毒时间太长(>3 min),对种子造成了伤害,发芽率降低,因此升汞处理以3 min为佳。
3.2 无机盐浓度和NAA对种子萌发的影响
许多研究表明,培养基中的无机盐浓度对种子萌发具有重要意义,MS培养基无机盐浓度过大,会影响种子的萌发[11],适当降低无机盐含量可提高发芽率。本试验表明,在不同无机盐含量的培养基中,草珊瑚种子发芽率由高到低依次为1/4 MS>1/2 MS>MS,与红三叶(TrifoliumpratenseL.)[12]及板蓝根(RadixIsatidis)[11]的无菌播种结果相同。
植物生长物质在无菌播种中的应用非常普遍,如6-BA、NAA、2,4-D、GA3等,但不同基因型、不同外植体来源和植物生长物质的配比对植物无菌苗的诱导差异很大[13]。NAA作为一种常用且价格低廉的生长素,具有促进生根、种子萌发、茎伸长、细胞分裂等作用[14],本试验选用NAA对种子萌发进行作用,结果表明,草珊瑚种子对NAA敏感,低浓度可促进种子萌发,浓度略高则出现抑制,幼苗亦出现异常,以0.05 mg/L较为适宜。其他植物生长物质的作用可作进一步研究。
3.3 温度和光照条件对种子萌发的影响
在本试验中,温度对草珊瑚种子萌发的影响非常显著,随着温度的升高,发芽率呈现明显的先升后降趋势,温度过高或过低都不利于萌发,以25 ℃最为合适,这也正是自然条件下种子最佳萌发季节是春夏交替季节的主要原因所在。
光照对植物种子萌发的影响较为复杂,植物种类不同效果不同,促进、抑制或无影响均有。在本试验中,每日光照时间对种子的发芽率无明显影响,这与赵冰[15]的研究结果相同。
3.4 丛生芽诱导
种子萌发获得无菌苗,解决了外植体来源的问题,而丛生芽诱导是植株离体再生并实现快速繁殖的关键环节,是一个植物基因型、外植体类型、培养基成分及培养条件等诸多因素间相互作用的复杂过程,其中植物生长物质是调控植物器官产生的主导因素[16]。本试验采用最常用的6-BA和NAA,设计5种浓度配比,成功诱导出丛生芽,最佳培养基为MS+6-BA 4.0 mg/L,外植体类型为无菌种子苗的顶芽,诱导率100%。顶芽相较于其他外植体类型更易获得丛生芽,可能是因为顶芽本身具有茎尖生长点的缘故。
本研究首次对草珊瑚无菌播种进行了较为系统的研究,确立了最佳消毒方法、培养基成分及适宜的温度和光照条件,成功制备出无菌种子苗,并以其顶芽为外植体诱导出丛生芽,从而为草珊瑚的组培快繁提供了一条新途径,为大量繁殖种苗提供了技术保障。
[1]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1982:79-80.
[2]陆颂规.肿节风的研究进展[J].中药材,2001,24(8):606-608.
[3]黄宝优,蓝祖栽,姚绍嫦,等.广西肿节风种质资源调查及质量评价[J].广东农业科学,2014(1):33-36.
[4]黎颖菁,蓝祖栽,凌征柱.草珊瑚的组织培养及植株再生研究[J].食品与药品,2008,10(1):32-34.
[5]Shuying Zhu,Tao Liu,Zhongming Fang,et al.Micropropagation and pharmacological analysis of a medicinal herb Sarcandra glabra [J].Medicinal and Aromatic Plant Science and Biotechnology,2011,5(1):16-19.
[6]蓝祖栽,黎颖菁,凌征柱,等.不同碳源对草珊瑚丛生芽诱导增殖的影响[J].现代中药研究与实践,2009,23(3):6-7.
[7]张日清,刘海龙,汪灵丹,等.榉树无菌播种技术[J].经济林研究,2013,31(1):139-142.
[8]解继红,于靖怡,陈景芋,等.鹅观草属种子消毒及无菌播种的研究[J].种子,2009,28(3):25-27.
[9]周峰,唐宁,陈全战,等.不同消毒剂对毕氏海莲子种子萌发和幼苗生长的影响[J].种子,2009,28(2):31-33.
[10]鲁黎明,安影.不同消毒剂对烟草种子消毒效果及萌发的影响[J].种子,2012,31(4):93-95.
[11]洪森荣,黄贞.板蓝根种子无菌体系建立的初步研究[J].广东农业科学,2010(9):87-88.
[12]高雪芹,王俊杰,云锦凤,等.红三叶新品系无菌苗培养体系优化[J].草地学报,2010,18(6):880-883.
[13]张春梅,陈杰昌,张喜军.培养基中不同碳源、激素对披针叶黄华种子无菌苗生长的影响[J].陕西林业科技,2013,(1):10-14,24.
[14]潘瑞炽,王小菁,李娘辉.植物生理学[M].北京:高等教育出版社,2008:176.
[15]赵冰.光照时间和赤霉素浓度对太白杜鹃种子萌发的影响[J].北方园艺,2014(2):60-63.
[16]刘振祥.植物组织培养技术[M].北京:化学工业出版社,2011:86-89.
Study on Aseptic Seeding and Multiple Shoot Induction ofSarcandraglabra
ZHUShuying,YANGFan,JIANGYeqin,ZHANGHaiyang
(College of Life Science, Huzhou University,Huzhou Zhejiang 313000,China)
In order to establish the in vitro regeneration system ofSarcandraglabra,multiple shoots were induced from seed seedlings which were cultured by aseptic seeding method with the seeds without flesh as tested materials.The results showed that the optimal sterilization protocol was as follows:firstly the seeds were sterilized by immersion in 75% ethanol for 30 s,then they were rinsed with sterile distilled water;finally the seeds were immersed in 0.1% HgCl2for 3 min rinsed with sterile water again before transferred onto media.The highest germination rate of seeds can reach 68.89%,which was observed on the media of 1/4 MS+NAA 0.05 mg/L under the culture condition of 25 ℃ and 12 hours illumination every day.Then the tips of seed seedlings were used as explants for the inducing of multiple shoots which were easy for proliferation and rooting.
Sarcandraglabra(Thunb.) Nakai; aseptic seeding; multiple shoot; tissue culture
2016-03-22
浙江省教育科研计划项目(编号:Y 201430579)。
朱淑颖(1980—),女,浙江湖州人;硕士,讲师,主要从事植物遗传育种研究;E-mail:zhushuy@126.com。
张海洋(1954—),男,学士,教授,主要从事植物学教学和研究工作;E-mail:haiyangzh@hutc.zj.cn。
10.16590/j.cnki.1001-4705.2016.08.032
S 567.9
A
1001-4705(2016)08-0032-05

