表面修饰磁性Fe3O4粒子及其在生物医学应用中的新进展*
李 莉,莫尊理,郭瑞斌,刘焕东,祁 磊,武琦钧
(西北师范大学 化学化工学院,生态环境相关高分子材料省部共建教育部重点实验室,甘肃省高分子材料重点实验室,兰州 730070)
表面修饰磁性Fe3O4粒子及其在生物医学应用中的新进展*
李 莉,莫尊理,郭瑞斌,刘焕东,祁 磊,武琦钧
(西北师范大学 化学化工学院,生态环境相关高分子材料省部共建教育部重点实验室,甘肃省高分子材料重点实验室,兰州 730070)
磁性材料具有独特的结构和优异的性能已被广泛的应用于生物医学领域,通过表面修饰磁性材料可使生物材料表面有更好的生物相容性。综述了磁性材料在磁共振成像、生物分离、靶向药物载体、磁流体致热治疗等方面的研究进展和应用前景。
磁性材料;表面修饰;生物医学
0 引 言
近年来,磁性材料因具有独特的结构和优异的性能在磁共振成像[1]、生物分离[2]、靶向药物载体[3]和磁流体致热治疗[4]等各个领域都有着广泛的应用前景。但是,磁性纳米材料具有较高的表面能,在溶液相中有强烈的聚集倾向,使得磁性纳米材料在应用方面受到了很大的限制,特别是生物和医药等领域。要使磁性纳米材料具有好的稳定性、生物相容性和生物可降解性[5],必须通过表面修饰,降低磁性纳米材料的表面能,获得可溶性或可分散性好的磁性纳米材料。经过处理后形成的磁性复合材料具有磁性,表面活性基团,能进一步与药物、抗体、蛋白质、酶、细胞及DNA等多种分子偶联,利用外部磁场靶向器官、组织或肿瘤。
磁性纳米材料的种类很多,常见的有金属合金(Fe、Co、Ni)、氧化铁(γ-Fe2O3、Fe3O4)、铁氧体(CoFe2O4)、氮化铁(Fe4N)和二氧化铬(CrO2)等[6],其中以氧化铁(γ-Fe2O3、Fe3O4)磁性材料应用最为广泛[7]。制备方法主要包括共沉淀法[8]、高温分解法[9]、溶胶-凝胶法[10]、微乳液法[11]、水热法[12]等,制备的关键是对晶体成核过程和晶体生长过程的控制,包括对磁性粒子的尺度、粒径分布、形貌、表面性质及带隙等进行调控,使所有的晶核在短时间内同时形成,在晶体生长的过程中不再有成核过程[13],即磁性纳米颗粒的控制合成过程,这是表面修饰的前提和基础。本文综述了磁性四氧化三铁纳米粒子表面修饰的方法及其在生物医学方面的研究进展和应用前景。
1 Fe3O4纳米颗粒的表面修饰
Fe3O4纳米颗粒粒径较小,比表面积很大,表面活性极高,颗粒间容易发生团聚和氧化,在实际应用中阻碍了其优越性的发挥。为了克服纳米颗粒自身的缺陷,对其进行表面修饰[14],可以保护其结构和成分的稳定性扩大应用范围。如磁性纳米颗粒在生物医学上的应用,可以增加其亲水性和生物相容性,方便其在生物医学领域的应用。常用的修饰方式有无机小分子修饰和有机物修饰。
1.1 无机小分子修饰
Fe3O4纳米颗粒表面包覆无机小分子是近年来纳米磁性材料领域新兴的研究方向。与高分子包覆的Fe3O4纳米颗粒相比,无机小分子包覆的粒径要小,分布更均匀。在细胞分离及生物传感检测等方面都有着潜在的应用价值。
1.1.1 无机金属修饰
Au、Ag等贵金属常用来修饰Fe3O4纳米颗粒。Wang[15]等室温下在水溶液中将Au和Ag沉积到Fe3O4的表面,成功合成了带有核壳结构的Fe3O4/Au和Fe3O4/Au/Ag纳米颗粒(如图1所示)。
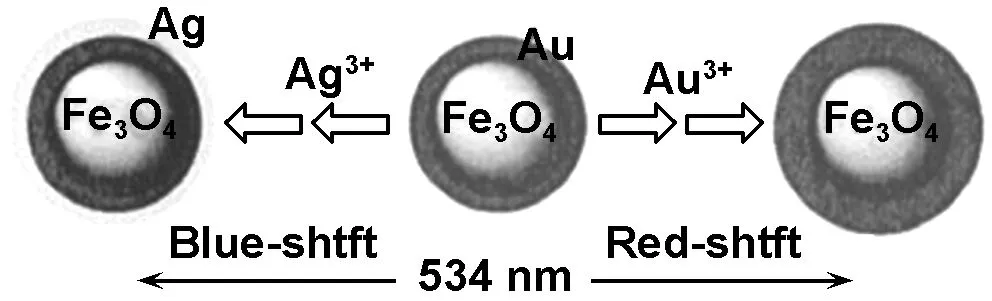
图1 Fe3O4/Au和Fe3O4/Au/Ag的形成及光学性能可控原理图
Fig 1 Schematic illustration of the formation of Fe3O4/Au and Fe3O4/Au/Ag and the control on the plasmonic properties
控制壳层厚度可调节核壳结构颗粒的光学性能,发生红移(560 nm)或蓝移(501 nm)。简单地合成了磁性和光学性能可调的复合颗粒,具有贵金属包覆壳层的磁性复合粒子起到保护Fe核的作用,并提供了进一步有机功能化的表面。
Li[16]等合成出具有高品质,单分散性,尺寸可控的Fe3O4、Ag和Fe3O4/Ag异质二聚体纳米粒子,用十二烷醇代替1,2-二羟基十六烷,通过调节配体的比例控制晶核尺寸。以乙酰丙酮银作为先驱体制备Ag纳米粒子,用不同尺寸的Fe3O4纳米粒子作为晶种,合成具有超顺磁性的Fe3O4/Ag异质二聚体纳米粒子,研究表明包覆在Fe3O4纳米粒子上Ag层的厚度取决于Fe3O4晶种的大小。另外,Fe3O4/Ag异质二聚体纳米粒子经过生物相容性的羧酸基团表面改性后成为水溶性的,在生物医学领域有着潜在的应用价值。
1.1.2 SiO2修饰
SiO2是用于Fe3O4纳米颗粒进行表面修饰的理想材料,具有良好的亲水性和生物相容性、无毒且能对被封装的Fe3O4提供极好的保护,用来改善磁性纳米粒子的稳定性,赋予其生物相容性,减少毒性。SiO2表面存在丰富的硅羟基,可与NH2-等多种功能基团发生反应,进一步与抗体或其它生物分子进行偶联,实现特异性。
Stober法和微乳液法是常用的合成SiO2修饰磁性纳米颗粒的方法。Ullah 等[17]采用Stober法对超顺磁性Fe3O4纳米颗粒进行SiO2包覆(如图2所示)。磁性硅球最终产物的粒径通过改变Fe3O4纳米颗粒的浓度和醇的种类进行控制,结果表明,在较低的Fe3O4纳米颗粒的浓度和较高分子量的醇中合成的磁性硅球的粒径较大。

图2 Stober法合成SiO2包覆的Fe3O4纳米颗粒的磁性硅球的过程示意图
Fig 2 Stober method of synthesis of Fe3O4nanoparticles of SiO2coating magnetic silicon ball process diagram
Abbas等[18]采用油包水微乳液体系合成了磁性纳米硅球。通过改变水/油比例来调节纳米硅球的粒径,SiO2的层厚可通过改变TEOS的量进行调节。Zhao等[19]以乳液液滴为微反应器,用一步合成法合成了粒径均一的磁性纳米硅球,该法可不经尺寸筛选就能得到不同粒径的单分散磁性纳米硅球,可应用于生物医学领域。
1.2 有机物修饰
1.2.1 有机小分子修饰
羧基、磺酸基团等小分子功能基团,可对磁性纳米颗粒进行表面修饰。为得到分散性好的疏水性磁性纳米颗粒,常用的有机小分子修饰剂有乙醇、羧酸、硫醇和硅烷等[20]。而要得到分散性好的亲水性磁性纳米颗粒,常用的有机小分子修饰剂有油酸钠、十二烷基胺和γ-环糊精等[20]。
疏水性磁性纳米颗粒有两种方法可以转化为亲水性纳米颗粒:其一,通过稳定剂与改性剂之间的相互作用,如sun等[21]采用了油酸与γ-环糊精的主客体相互作用,将疏水性磁性纳米颗粒转换成了亲水性的磁性纳米颗粒;其二,通过配体交换反应形成。如AIwaki等[22]在高沸点有机溶剂中通过热分解Fe(acac)3,获得尺寸精确的单分散纳米粒子,利用DMSA作为配体交换剂形成水溶液中分散的胶体。通过这种方法得到的DMSA修饰的纳米晶体在水和PBS缓冲溶液中相当稳定,不会发生团聚。这种纳米粒子被进一步制备成高性能的抗体探针,通过磁共振成像用于诊断乳腺癌细胞。
1.2.2 高分子聚合物修饰
高分子聚合物修饰Fe3O4纳米颗粒有两种方法,原位修饰和合成后表面修饰。原位修饰是在磁性纳米颗粒合成过程中将高分子聚合物修饰到其表面;合成后表面修饰是将磁性纳米颗粒先合成,再把高分子聚合物“嫁接”到其表面。聚合物分子中含有羧基,硫酸和磷酸等功能基团,将这些基团修饰到磁性纳米颗粒的表面,凭借静电排斥力或空间位阻保持其稳定性。用来修饰磁性纳米颗粒的高分子聚合物有:葡聚糖(Dextran)、聚乙烯醇(PVA)、聚乙烯吡咯烷酮(PVP)、聚乙二醇(PEG)、聚丙烯酸(PAA)及其它聚合物等[23]。
Vittorio等[24]用葡聚糖和Cy5.5荧光染料对Fe3O4纳米颗粒进行修饰,合成了用于细胞标记的磁性纳米颗粒,用于胰腺小岛标记,利用磁共振成像技术可监控胰腺小岛在体内的迁移情况。Gyergyek等[25]用后处理修饰方法合成PMMA修饰的磁性纳米颗粒,用共沉淀法合成磁性纳米颗粒,在正癸烷溶液中加入PMMA发生原位聚合,得到PMMA修饰的超顺磁性纳米颗粒。
2 Fe3O4纳米颗粒生物应用
2.1 磁共振成像
磁共振成像(MRI)是一项新崛起的医学诊断技术,空间分辨率高的人体内部器官影像对医学诊断和治疗具有重要意义[26]。与其它成像技术相比,MRI成像具有无损伤、空间分辨率高和三维可视等优点,可以有效检测局部组织坏死、局部缺血和各种恶性病变(如肿瘤),还能进行早期诊断、对器官移植进行全程检测,用于跟踪研究药物与组织相互作用的代谢过程,现在已成为最重要的临床诊断工具。但MRI成像技术的灵敏度低,为了克服这一不足,临床上使用MRI造影剂增强信号对比度,提高诊断的敏感性、特异性和软组织图像的分辨率[27]。
目前,用超顺磁性铁氧化物纳米粒子制备的MRI造影剂,进入人体后能被活体组织有效吸收,对比不同组织部位响应信号的差异,能准确定位活体病灶部位。Goldshaid 等[28]利用超顺磁氧化铁粒子的长期血液循环,用磁性Fe3O4纳米粒子-赫赛汀探针进行了人体内乳腺瘤检测。Anbarasu等[29]用单克隆抗体标记的PEG包覆的Fe3O4纳米粒子对植入小鼠体内的人体结肠癌进行了检测。而探索合成多功能成像造影剂是纳米粒子生物医学应用的一个重要研究,通过不同功能纳米粒子复合来实现,如,通过磁性四氧化三铁纳米粒子与荧光量子点的复合实现磁共振成像与荧光成像双功能。
2.2 生物分离
随着纳米技术的发展,磁性纳米颗粒的粒径控制在几纳米到几十纳米范围内。要想实现生物分离,用具有生物相容性的功能分子修饰超顺磁纳米颗粒,如聚合物(Dextran、PEG等)、磷脂、脂质体等。这些功能分子修饰剂可以稳定Fe3O4纳米颗粒,与待分离的生物分子或生物个体通过吸附或键合方式结合,到达磁性纳米颗粒表面,通过外加磁场快速将这些生物分子或生物个体进行磁性分离[2]。与传统分离方法(如离心法、沉淀法等)相比,磁生物分离具有简便、快速、高效、成本低廉等优点。
磁生物分离材料通常有超顺磁性,在外加磁场下纳米材料被磁化而富集,磁场一旦移除,它们又分散在溶液中,具有可回收性。目前,这种方法已被用于细胞、蛋白质和核酸(DNA, RNA)等多种生物样品的分离。Wang等[30]将多巴胺偶联到磁性纳米颗粒表面,通过酰胺键固定氨基三乙酸,并螯合Ni2+,改性后的磁性纳米颗粒能够高效分离细胞裂解液中的蛋白质。手性化合物的分离一直是个难题。近期Ghosh等[31]报道了用磁性纳米颗粒分离手性化合物的方法。将羧甲基-β-环糊精修饰到Fe3O4上,根据氨基酸上的氨基与环糊精上的伯醇羟基易形成氢键的特点,利用右旋/左旋芳香族氨基酸上的氨基进入与环糊精中产生的空间位阻效应的不同,有效分离了手性芳香族氨基酸,其中,左旋-色氨酸的分离率能够达到94%,为手性化合物分离提供了新的有效途径。
2.3 靶向药物载体
大部分传统药物并不具备靶向性,缺乏对肿瘤部位的定位,进入人体就随血液循环分布于各个脏器。对药物选择性差,需要大剂量才能达到预期治疗效果,在杀死肿瘤细胞的同时也攻击正常细胞,对人体产生较大的毒副作用。为了降低用药量减小毒副作用,又能提高病变部位的药物浓度,使药物具有靶向性,研究人员发明了靶向药物载体[3]。
磁性靶向药物以具有生物相容性的磁性纳米颗粒为载体,将特定药物固定在载体中形成相对稳定的药物剂型,经静脉注射进入体内,在外磁场作用下将药物富集于病变部位用于疾病治疗[7]。现在,国内外已经有很多关于 Fe3O4磁性纳米颗粒作为药物载体的研究报道,都已取得了很大进步,为恶性肿瘤的治疗提供了基础。Wang 等[32]将难溶于水的藤黄酸搭载到Fe3O4磁性纳米颗粒上,解决了藤黄酸水溶性差的难题,进入胰腺癌细胞后引起细胞的凋亡,达到治疗胰腺癌的目的。Nowicka等[33]用C6化合物作为Fe3O4磁性纳米颗粒的交联剂连接阿霉素,进入人体膀胱癌细胞,发现复合体的作用效果比纯C6化合物效果好,表明Fe3O4磁性纳米颗粒搭载药物优于脂质体药物。
尽管磁性纳米颗粒在靶向性方面表现出其独特的优势,但仍有一些问题有待解决:
(1) 安全性。磁性物质在体内可能会造成栓塞或蓄积中毒,潜在危害尚未清楚。
(2) 靶向性。根据磁性纳米颗粒的超顺磁性,外加磁场可将纳米颗粒定位于浅表的肿瘤,对于微小病灶和深度病灶的定位难度较大。
(3)有效性。磁性纳米颗粒载药量有限,能否达到最佳治疗效果尚未可知。
2.4 磁流体致热治疗
热感应是超顺磁粒子在交变磁场下表现出性质[34]。利用肿瘤细胞和正常细胞对热敏感性不同,将磁流体注射到肿瘤组织,在外加交变磁场下产生能量均匀释放给肿瘤组织,肿瘤中的血液供给不足使得肿瘤细胞热量扩散较慢,造成局部温度升高(一般在42~46 ℃),达到杀死肿瘤细胞,这种治疗方法称为磁流体过热 (magnetic fluid hyperthermia, MFH) 。
MFH在治疗肿瘤和其它疾病方面都有着巨大的应用前景,将MFH与传统的化疗和放射线疗法相结合对脑肿瘤和前列腺癌进行多重治疗,有望取得理想的治疗效果[34]。磁感应热疗在临床实施时,需要达到杀灭肿瘤和保护正常组织的治疗目标,因此要求在术前治疗计划系统中对靶区的温度分布情况进行数值模拟,确保治疗的安全性和有效性。目前,MFH治疗肿瘤的研究和应用还面临如何使磁性纳米粒子只被肿瘤细胞吞噬,而不被其它正常细胞吞噬的难题,这是实现对肿瘤细胞均匀加热的关键因素。
3 结 语
Fe3O4磁性纳米粒子作为一种新型材料,由于其独特的性质在生物医药领域被广泛的应用,并具有巨大的应用潜力。目前,表面修饰在磁性纳米材料的制备、分散和改性等方面也受到了广泛的重视,Fe3O4表面修饰剂的种类也越来越多,得到了很大的发展。但是,Fe3O4磁性纳米粒子表面能较高易发生团聚,在水溶液中的稳定性和分散性较差,应用方面受到了极大的限制。通过对Fe3O4磁性微粒的表面进行修饰可抑制团聚以提高自身的稳定性和分散性。今后我们研究的重点是拓展表面修饰剂的应用领域,开发新型表面修饰剂研究磁性纳米粒子的包覆性修饰,改进磁性纳米粒子与生物组织间的相容性,进一步开展磁性纳米粒子作为磁共振成像、生物分离、靶向药物和磁热疗等方面的生物应用研究,为新型纳米材料的广泛应用铺平道路。
[1] Savla R, Garbuzenko O B, Chen S, et al. Tumor-targeted responsive nanoparticle-based systems for magnetic resonance imaging and therapy[J]. Pharmaceutical Research, 2014, 31(12): 3487-3502.
[2] Borlido L, Azevedo A M, Roque A C, et al. Magnetic separations in biotechnology[J]. Biotechnology Advances, 2013, 31(8): 1374-1385.
[3] Xu Huan, Cheng Liang, Wang Chao, et al. Polymer encapsulated upconversion nanoparticle/iron oxide nano- composites for multimodal imaging and magnetic targeted drug delivery[J]. Biomaterials, 2011, 32(35): 9364-9373.
[4] Kita E, Oda T, Kayano T, et al. Ferromagnetic nanoparticles for magnetic hyperthermia and thermoablation therapy[J]. Journal of Physics D: Applied Physics, 2010, 43(47): 2462-2466.
[5] Safari J, Masouleh S F, Zarnegar Z, et al. Water-dispersible Fe3O4nanoparticles stabilized with a biodegradable amphiphilic copolymer[J]. Comptes Rendus Chimie, 2014, 17(2): 151-155.
[6] Jiang Chengbao, An Shizhong. Recent progress in high temperature permanent magnetic materials[J]. Rare Metals, 2013, 32(5): 431-440.
[7] Yuan Chenyan, An Yanli, Zhang Jia, et al. Magnetic nanoparticles for targeted therapeutic gene delivery and magnetic- inducing heating on hepatoma[J]. Nanotechnology, 2014, 25(34): 345101-345112.
[9] Shete P B, Patil R M, Tiwale B M, et al. Water dispersible oleic acid-coated Fe3O4nanoparticles for biomedical applications[J]. Journal of Magnetism and Magnetic Materials, 2015, 377(1): 406-410.
[10] Zhang Y, Chai C P, Luo Y J, et al. Synthesis, structure and electromagnetic properties of mesoporous Fe3O4aerogels by sol-gel method[J]. Materials Science and Engineering: B, 2014, 188(10): 13-19.
[11] Ghaemy M, Shabzendedar S, Taghavi M, et al. Synthesis and characterization of heterocyclic function- alized polymers by click reaction: Preparation of magnetic nanocomposites and studies on their thermal, mechanical, photophysical and metal ions removal properties[J]. Chinese Journal of Polymer Science, 2015, 33(2): 301-317.
[12] Liu Xiaodi, Chen Hao, Liu Shanshan, et al. Hydrothermal synthesis of superparamagnetic Fe3O4nano- particles with ionic liquids as stabilizer[J]. Materials Research Bulletin, 2015,62: 217-221.
[13] Yang Gao, Zhang Baolin, Wang Jun, et al. Preparation of polylysine-modified superparamagnetic iron oxide nanoparticles[J]. Journal of Magnetism and Magnetic Materials, 2015, 374(15): 205-208.
[14] Yang Yong, Guo Xue, Wei Kaiwei, et al. Synthesis and drug-loading properties of folic acid-modified superparamagnetic Fe3O4hollow microsphere core/mesoporous SiO2shell composite particles[J]. Journal of Nanoparticle Research, 2014, 16(1): 956-967.
[15] Wang Jing, Song Daqian, Zhang Hua, et al. Studies of Fe3O4/Ag/Au composites for immunoassay based on surface plasmon resonance biosensor[J]. Colloids and Surfaces B: Biointerfaces, 2013, 102(2): 165-170.
[16] Li X, Si H, Niu JZ, et al. Size-controlled syntheses and hydrophilic surface modification of Fe3O4, Ag, and Fe3O4/Ag heterodimer nanocrystals[J]. Dalton Trans, 2010, 45(45): 10984-10989.
[17] Ullah R, Deb B K, Mollah M Y A. Synthesis and characterization of silica coated iron-oxide composites of different ratios[J]. International Journal of Composite Materials, 2014, 4(2): 135-145.
[18] Abbas M, Rao B P, Islam M N, et al. Highly stable-silica encapsulating magnetite nanoparticles (Fe3O4/SiO2) synthesized using single surfactantless-polyol process[J]. Ceramics International, 2014, 4(1): 1379-1385.
[19] Zhao X, Zhao H, Yuan H, et al. Multifunctional superparamagnetic Fe3O4@SiO2core/shell nanoparticles: design and application for cell imaging[J]. Journal of Biomedical Nanotechnology, 2014, 10(2): 262-270.
[20] Young D D, Connelly C M, Grohmann C, et al. Small molecule modifiers of micro RNA miR-122 function for the treatment of hepatitis C virus infection and hepatocellular carcinoma[J]. J Am Chem Soc, 2010,132(23): 7976-7981.
[21] Sun Minmin, Zhu Aimei, Zhang Qiugen, et al. A facile strategy to synthesize monodisperse super- paramagnetic OA-modified Fe3O4nanoparticles with PEG assistant[J]. Journal of Magnetism and Magnetic Materials, 2014, 369(11): 49-54.
[22] Iwaki Y, Kawasaki H, Arakawa R. Human serum albumin-modified Fe3O4magnetic nanoparticles for affinity-SALDI-MS of small-molecule drugs in biological liquids[J]. Anal Sci, 2012, 28(9): 893-900.
[23] Iqbal Z, Lai E P C, Avis T J. Development of polymer-modified magnetic nanoparticles and quantum dots for Escherichia coli binding test[J]. Microchimica Acta, 2012, 176(1-2): 193-200.
[24] Vittorio O, Voliani V, Faraci P, et al. Magnetic catechin-dextran conjugate as targeted therapeutic for Pancreatic tumour cells[J]. Journal of Drug Targeting, 2014,22(5): 408-415.
[25] Gyergyek S, Huskhic M, Makovec D, et al. Superparamagnetic nanocomposites of iron oxide in a polymethyl methacrylate matrix synthesized by in situ polymerization[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2008, 317(1-3): 49-55.
[26] Felton C, Karmakar A, et al. Magnetic nanoparticles as contrast agents in biomedical imaging: recent advances in iron- and manganese-based magnetic nanoparticles[J]. Drug Metabolism Reviews, 2014, 46(2): 142-154.
[27] Shokrollahi H, Khorramdin A, Isapour G. Magnetic resonance imaging by using nano-magnetic particles[J]. Journal of Magnetism and Magnetic Materials, 2014, 369(11): 176-183.
[28] Goldshaid L, Rubinstein E, Brandis A, et al. Novel design principles enable specific targeting of imaging and therapeutic agents to necrotic domains in breast tumors[J]. Breast Cancer Research, 2010, 12(3):R29.
[29] Anbarasu M, Anandan M, Chinnasamy E, et al. Synthesis and characterization of polyethylene glycol (PEG) coated Fe3O4nanoparticles by chemical co-precipitation method for biomedical applications[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2015,135(25): 536-539.
[30] Wang Wentao, Ji Xin, Na Hyon Bin, et al. Design of a multi-dopamine-modified polymer ligand optimally suited for interfacing magnetic nanoparticles with biological systems[J]. Langmuir, 2014, 30(21): 6197-6208.
[31] Ghosh S, Fang T H, Uddin M S, et al. Enantioselective separation of chiral aromatic amino acids with surface functionalized magnetic nanoparticles[J]. Colloids and Surfaces B: Biointerfaces, 2013,105(6): 267-277.
[32] Wang Cailian, Zhang Haijun, Chen Baoan, et al. Study of the enhanced anticancer efficacy of gambogic acid on Capan-1 pancreatic cancer cells when mediated via magnetic Fe3O4nanoparticles[J]. International Journal of Nanomedicine, 2011, 6(1): 1929-1935.
[33] Nowicka A M, Kowalczyk A, Jarzebinska A, et al. Progress in targeting tumor cells by using drug-magnetic nanoparticles conjugate[J]. Biomacromolecules, 2013, 14(3): 828-833.
[34] Silva A C, Oliveire T R, Mamani J B, et al. Application of hyperthermia induced by superparamagnetic iron oxide nanoparticles in glioma treatment[J]. Int J Nanomedicine, 2011, 6(3): 591-603.
New progress of surface modification of the magnetic Fe3O4particles in biomedicine applications
LI Li, MO Zunli, GUO Ruibin, LIU Huandong, QI Lei, WU Qijun
(Key Laboratory of Eco-Environment-Related Polymer Materials, Ministry of Education of China,Key Laboratory of Polymer Materials of Gansu Province, College of Chemistry and Chemical Engineering,Northwest Normal University, Lanzhou 730070, China)
Magnetic materials is widely used in biomedical fields due to their unique structure and excellent properties, the magnetic material can have a better bio-compatibility of biomaterials surface by surface modification. The magnetic material in biomedical applications, such as magnetic resonance imaging, biological separation, targetable drug carriers and magnetic fluid hyperthermia are reviewed in the present paper, and the development trend of magnetic materials is also forecasted.
magnetic material; surface modification; biomedicine
1001-9731(2016)04-04028-05
国家自然科学基金资助项目(51262027);甘肃省科技支撑计划资助项目(1104GKCA019);甘肃省自然科学基金资助项目(1010RJZA023)
2015-04-09
2015-12-02 通讯作者:莫尊理,E-mail: mozlnwnu2010@163.com
李 莉 (1989-),女,甘肃白银人,在读硕士,师承莫尊理教授,从事纳米功能复合材料研究。
TB383; R34
A
10.3969/j.issn.1001-9731.2016.04.006

