磁共振弥散成像对耐药与不耐药结肠癌荷瘤鼠检测的观察
谢 琦,杨逸铭,吴敏仪,张鼎旋,雷正贤,张 静,许 进,钟维德
(1.广州医科大学附属广州市第一人民医院南沙医院 广州市南沙中心医院医学影像科,广东 广州 511457;2.中山大学肿瘤防治中心病理科,广东 广州 510080;3.广州医科大学附属广州市第一人民医院,广东 广州 511100)
磁共振弥散成像对耐药与不耐药结肠癌荷瘤鼠检测的观察
谢琦1,杨逸铭1,吴敏仪1,张鼎旋1,雷正贤1,张静2,许进3,钟维德3
(1.广州医科大学附属广州市第一人民医院南沙医院 广州市南沙中心医院医学影像科,广东 广州511457;2.中山大学肿瘤防治中心病理科,广东 广州510080;3.广州医科大学附属广州市第一人民医院,广东 广州511100)
目的:探索磁共振弥散成像(MR-DWI)活体检测结肠癌耐药性的可能性。方法:对耐药组与不耐药组人类结肠癌SW480荷瘤裸鼠(各5只)的肿瘤行MR-DWI检查,随后处死荷瘤鼠、切下肿瘤检测肿瘤的PKC、P-gp、MRP1蛋白表达(Western Blot),组织切片观察(HE染色);对比分析两组荷瘤鼠肿瘤MR-DWI的ADC值及蛋白表达和组织切片改变。结果:不耐药人类结肠癌SW480组裸鼠模型肿瘤边缘及中心ADC值均较耐药人类结肠癌SW480/5-FU组裸鼠模型增高,不耐药人类结肠癌SW480组裸鼠模型肿瘤边缘ADC值与耐药人类结肠癌SW480/5-FU组裸鼠模型肿瘤边缘ADC值的差别具有统计学意义(P<0.05),肿瘤中心ADC值差别则无统计学意义(P>0.05);肿瘤的ADC值与耐药性呈负相关。耐药组PKC、P-gp、MRP1蛋白表达明显高于不耐药组,差别有统计学差异(P<0.05)。结论:MR-DWI检测的ADC值变化有可能有助于利用MR活体检测结肠癌耐药性。
结肠肿瘤;磁共振成像,弥散;动物实验
活体实时监测结肠癌耐药性对临床治疗结肠癌有重要指导意义。MR扩散加权成像(DWI)能提供与组织生物物理特性、细胞和细胞膜结构有关的信息[1],对结肠癌耐药性的活体检测可能起到一定作用。本研究对比分析耐药与不耐药结肠癌荷瘤鼠的DWI改变,探索活体监测结肠癌耐药性的可能性。
1 材料与方法
1.1耐药与不耐药结肠癌荷瘤鼠模型制作
1.1.1人类结肠癌SW480对5-FU耐药细胞细胞系SW 480/5-FU的制作
人类结肠癌SW480细胞系购自中山大学细胞库,常规细胞培养,采用5-FU持续接触、浓度递增诱导肿瘤细胞耐药,连续培养5月,至结肠癌细胞能在5-FU浓度为6μg/mL的培养液中稳定生长的人类结肠癌耐药细胞株,即SW480/5-FU。
用MTT法检测SW480和SW480/5-FU细胞对5-FU的敏感性:收集对数生长期的 SW480和SW480/5-FU细胞,接种到96孔板(100 u/孔,含细胞4×1031/孔),培养24 h,加入不同浓度的5-FU(设4复孔和阴性对照),再培养72 h,每孔加入MTT液20μL,培养4h,离心,弃上清,加入二甲亚砜100μL/孔,震荡摇匀,紫色颗粒溶解后上酶标仪测定吸光度,波长490 nm,以药物浓度为横轴,细胞存活率为纵轴,绘制浓度-效应曲线,确定半数抑制浓度(IC50),计算耐药指数(RI)=耐药细胞IC50/亲本细胞IC50。
1.1.2荷瘤鼠模型制作
参照前期研究的结肠癌荷瘤鼠模型制作方法[2-3],常规细胞培养,分别制成人类结肠癌不耐药细胞株SW480、耐药细胞株SW480/5-FU细胞的混悬液(1× 107/mL),分别注射至不同健康裸鼠胁部皮下(0.5mL/只)。待肿瘤生长到1 cm以上,在麻醉状态下取出肿瘤块,置于含庆大霉素的生理盐水中切开、分离出肿瘤非坏死部分,并切成1~2mm3左右碎块,再分别移植到外表健康裸鼠大腿根部皮下 (各5只),模型鼠养殖于SPF级实验室。
1.2荷瘤鼠的MR成像
在上述荷瘤鼠肿瘤长至1.5 cm以上时,采用德国Siemens公司MAGNETOM Verio-3.0T超导型磁共振成像系统及配套腕关节专用正交线圈进行以下序列及DWI检查。
T2WI(TSE):TR/TE=4 500ms/82ms,层厚=2mm,间隔=0,FOV=128mm,NAS=4,SENSE加速因子=2,采集矩阵=128×128,重建矩阵=512×512,行轴位、冠状、矢状位成像。
DWI:采用单次激发平面回波成像序列(EPI),横轴位成像,TR=5 900ms,TE=100ms,按各向同性施加扩散敏感梯度场,b值=800mm2/s,FOV=220mm,NAS=3,层厚2mm,采集矩阵=220×220,重建矩阵= 308×308。采集的起止范围与T2WI轴位绝对一致。
采集的MR-DWI数据在西门子磁共振成像仪工作站上的专用软件拟合出ADC图,在肿瘤最大切面利用感兴趣区(ROI)自动测量并计算出ADC值,ROI在肿瘤中央及边缘各取1个ROI,ROI面积为8~75mm2(图1)。
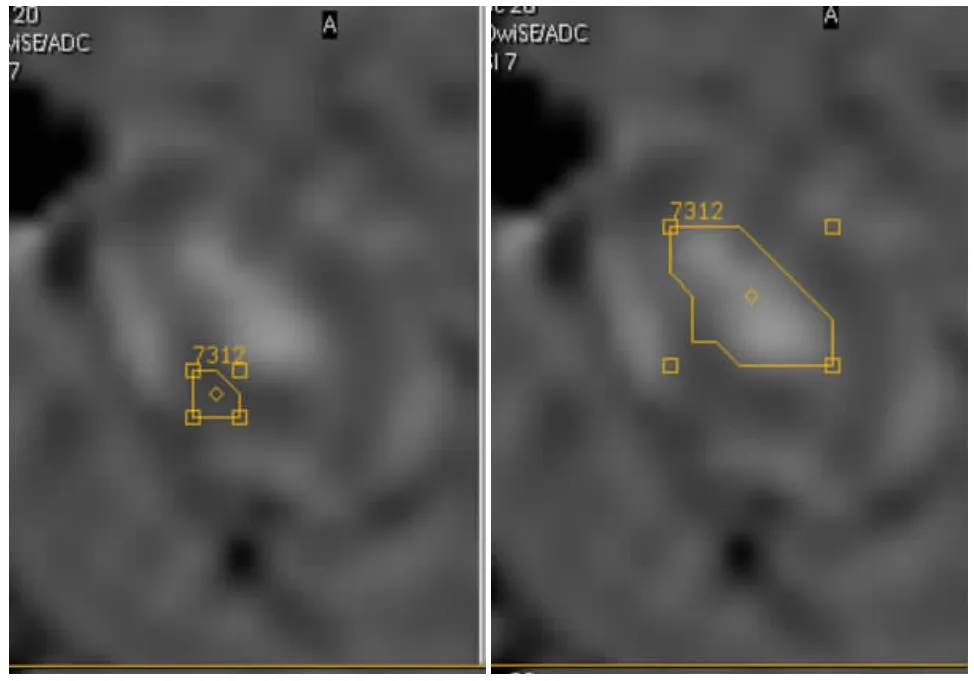
图1 荷瘤鼠结肠癌组织MR-DWI成像上ADC值测量。Figure 1.ADC values of tumor in nude mice in MR-DWI.
1.3肿瘤标本的实验研究
荷瘤鼠完成上述检查后腹腔注射常规麻醉量5倍的水合氯醛处死,完整取出肿瘤,测量肿瘤大小,将肿瘤一分为二,一半放入缓冲甲醛液固定、石腊包埋并切片(HE研究),另一半低温(-30℃以下)保存(耐药蛋白检测)。
1.3.1HE染色切片
由两位病理科医师分别按同一标准在偏光显微镜下阅片分析。
1.3.2耐药蛋白表达
Western Blot检测 PKC、MDR1、MRP1蛋白表达。从-30℃的冰冻组织样本分别提取细胞液,Bradford法蛋白定量后,用 Western blot检测。Phototope-HRP Western blot检测试剂盒购自Cell Signaling technology公司,鼠抗β-actin:BM0627购自Baster公司,鼠抗PKC、MDR1、MRP1抗体购自Bioss公司。
最终胶体的显影结果经扫描仪扫入电脑以JPGF格式保存,用Imagepro-plus 6.0版自动图像分析系统处理自动计算每组样本每个条带光密度(IOD)。
1.4统计学分析
所采集的数据采用SPSS 13.0统计学软件进行统计处理,数据用±s表示,数据符合正态分布两组之间比较用t检验,数据符合正态分布相关性分析采用Pearson相关检验,数据不符合正态分布相关性分析采用Spearman相关检验,P<0.05示差异有统计学意义。
2 结果
2.1人类结肠癌SW480/5-FU耐药细胞的制作与验证
2.1.1SW 480/5-FU与SW 480细胞形态学观察
获得能够在6μg/mL 5-FU浓度中稳定生长的人类结肠癌SW 480/5-FU细胞在37℃生长72 h,胞体明显增大,突起不明显,相邻的细胞间连接紧密,形态不规则(图2a);不耐5-FU人类结肠癌SW 480细胞,在37℃生长72 h形态,胞体增大,有显著突起伸出,相邻的结肠癌SW480细胞间可相互连接,核较大,以单核多见(图2b)。
2.1.2MTT的方法检测IC50
SW480细胞与SW480/5-FU不同药物浓度的吸光度有显著差别(图3),IC50分别为23.593μg/mL和140.642μg/mL,RI为5.93。
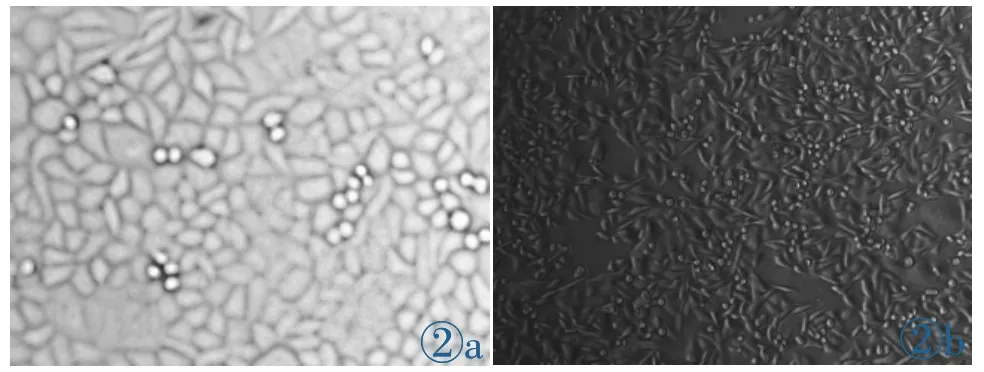
图2 SW480/5-FU细胞(2a)与人类结肠癌SW480细胞(2b)形态。Figure 2.The morphology of human colon cancer SW 480/5-FU(2a)and SW 480 cells(2b).
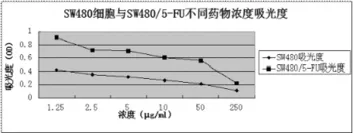
图3 SW480细胞与SW480/5-FU不同药物浓度的吸光度。Figure 3.Absorbance of SW480 and SW480/5-FU in different 5-FU concentration.
2.2MR-DWI对耐药及不耐药肿瘤的检测
不耐药组肿瘤边缘与中心ADC值均较耐药组增加,肿瘤边缘ADC值差别具有统计学意义 (P<0.05,表1),耐药与不耐药组肿瘤中心与边缘ADC定量结果见表1。
表1 耐药与不耐药组肿瘤中心与边缘ADC定量结果(±s,×10-4mm2/s)
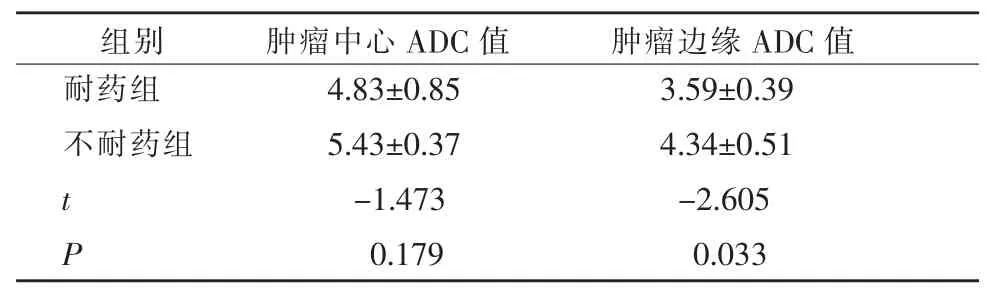
表1 耐药与不耐药组肿瘤中心与边缘ADC定量结果(±s,×10-4mm2/s)
组别 肿瘤中心A D C值 肿瘤边缘A D C值耐药组 4 . 8 3 ± 0 . 8 5 3 . 5 9 ± 0 . 3 9不耐药组 5 . 4 3 ± 0 . 3 7 4 . 3 4 ± 0 . 5 1 t -1 . 4 7 3 -2 . 6 0 5 P 0 . 1 7 9 0 . 0 3 3
2.3HE染色对耐药组与不耐药组肿瘤观察
2.3.1HE染色
偏光显微镜下观察肿瘤组织病理切片,不耐药组细胞体积较耐药组体积小,细胞之间间隙较大(图4a);耐药组细胞体积较不耐药组大,细胞之间排列较不耐药组紧密(图4b)。
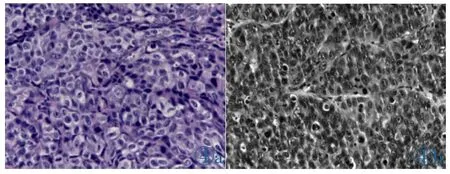
图4 不耐药组(4a)与耐药组(4b)肿瘤组织病理切片(HE染色)。Figure 4.Tumor tissue HE slices of SW480(4a)and SW480/ 5-FU(4b).
2.4耐药组与不耐药组PKC、P-gp、MRP1蛋白表达
Western Blot检测耐药组与不耐药组PKC、P-gp、MRP1表达量均较不耐药组增加(图5),两者见明显差别(表2)。

图 5 耐药组与不耐药组 PKC、P-gp、MRP1表达(Western Blot)。Figure 5. Expressions of PKC,P-gp and MRP1 in SW480 and SW480/5-FU group (Western Blot).
表2 耐药组与不耐药组耐药蛋白表达RIOD值的比较(±s)
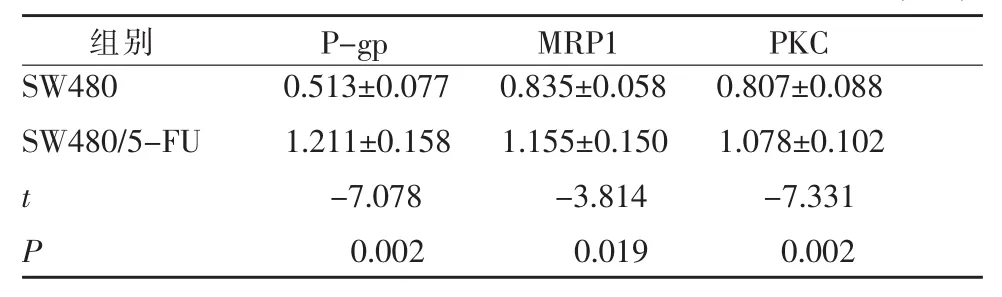
表2 耐药组与不耐药组耐药蛋白表达RIOD值的比较(±s)
组别 P -g p M R P 1 P K C S W 4 8 0 0 . 5 1 3 ± 0 . 0 7 7 0 . 8 3 5 ± 0 . 0 5 8 0 . 8 0 7 ± 0 . 0 8 8 S W 4 8 0 / 5 -F U 1 . 2 1 1 ± 0 . 1 5 8 1 . 1 5 5 ± 0 . 1 5 0 1 . 0 7 8 ± 0 . 1 0 2 t -7 . 0 7 8 -3 . 8 1 4 -7 . 3 3 1 P 0 . 0 0 2 0 . 0 1 9 0 . 0 0 2
2.5不同评价方法的相关性分析(Spearman或Pearson相关分析)
2.5.1蛋白表达与肿瘤耐药性相关性
肿瘤耐药性与肿瘤PKC、P-gp、MRP1蛋白表达光 密 度 正 相 关 性(r、P:0.870,0.001)、(r、P:0.801,0.005)、(r、P:0.870,0.001)。
2.5.2MR-DWI与肿瘤耐药性及相关蛋白表达相关性分析
ADC值与肿瘤耐药性呈负相关性(r、P:-0.731,0.016);ADC值与肿瘤 PKC、P-gp、MRP1表达光密度负相关(r、P:-0.224,0.046,r、P:-0.406,0.000,r、P:-0.326,0.004)。
3 讨论
肿瘤细胞与抗癌药物接触后,不仅能对所用药物产生耐药,对结构和功能不同的其他药物也能产生耐药性,即多药耐药(Multidrug resistance,MDR)[4-8]。
肿瘤产生耐药因素很多:如细胞的增殖状态、实体肿瘤的环境如局部血管通路及药物渗透组织能力受限、遗传及药理学因素、肿瘤的异质性等[4-8]。肿瘤耐药的机制也很复杂,但多是在不同蛋白的作用下使肿瘤细胞可存在多种耐药机制:如肿瘤细胞摄取药物的能力减低;药物活化减低;药物与DNA形成的加合物的去除增加及DNA修复能力增加;与巯基化合物(如谷胱甘肽)结合输出细胞外等[4]。目前能确定参与肿瘤耐药机制调节的蛋白有P糖蛋白(P-glycoprotein,P-gp,ABCB1)、蛋白激酶C(Protein ki-nase C,PKC)、多药耐药相关蛋白1(Multidrug resistance-associated protein,MRP1,ABCC1)。
P-gp由多药耐药基因MDR1编码,基因定位于7q2111,由1-280个氨基酸残基组成,分子量为170 kDa。MDR1参与MDR主要机制是药物的外排转运。P-gp属于转运蛋白的ATP结合盒家族(ABC,ATP-binding cassette),与带负电荷的脂性化合物的亲和性高,具有药泵作用,当肿瘤细胞膜上过度表达P-gp时,P-gp可与抗肿瘤药物结合,并通过ATP水解后释放的能量,主动将进入细胞内的药物泵出细胞外,降低细胞内药物的浓度,产生耐药[4-6]。
PKC是G蛋白偶联受体系统中的效应物,在非活性状态下是水溶性的,游离存在于胞质溶胶中,激活后成为膜结合的酶,分子量为77~83 kDa。目前,PKC家族包括至少12个亚型的表达和调控各不相同细胞类型,其中PKCα亚型与MDR密切相关,对耐药具有调节作用[7]。PKC的主要功能是参与细胞内信号转导,同时还参与调控不同的细胞功能,包括细胞粘附细胞运动,同时大量的证据表明,PKC还参与某些类型肿瘤的增殖、浸润和转移,PKC可能通过诱导MDR基因过度表达和加速P-gp磷酸化而导致MDR的形成和发展[7]。
MRP1是一种膜糖蛋白,与P-gp同属于转运蛋白的ABC家族,它们在分子结构上具有某种程度上的序列同源性,基因染色体16p13,MRP1是一个完整的膜蛋白,它有一个类似MDR一样的中心、一个N末端膜结合域和一个细胞质连接因子,MRP可转运亲水性分子甚至有机阴离子,并能和自由的谷胱甘肽(Glutathione,GSH)共同运转和GSH结合的中性药物,发挥外流泵作用[8]。
DWI可提供组织的水分子运动和微观组织成分及细胞内外的水平衡情况的信息,表观弥散系数值(ADC,反映组织弥散特征的量化值)与细胞内外成分的比例有关,并随着组织或细胞密度的增加而降低;而细胞密度可以作为肿瘤侵袭性的指征,随着细胞密度的增加,肿瘤的转移性增加;除了细胞膜,细胞骨架、有机质、基质纤维和可溶性大分子对肿瘤的弥散受限起到了作用[9]。因此,DWI提供了与组织生物物理特性、细胞和细胞膜结构有关的独特信息,如细胞的组织结构、微结构和微循环。有研究发现,结肠癌肝脏转移瘤的患者化疗前病灶ADC值高低可反应肿瘤对化疗的敏感性,对治疗无反应的病灶ADC均值明显高于对治疗有反应的病灶,治疗前ADC均值对判断转移瘤对化疗不反应的敏感性60%、特异性为100%[10]。课题组前期研究成功使用临床医用磁共振对结肠癌荷瘤鼠肿瘤进行活体MR-DWI成像[2,11]。
本研究采用5-FU持续接触、浓度递增诱导肿瘤细胞耐药,所获得的能在5-FU浓度为6μg/mL的培养液中稳定生长的人类结肠癌耐药细胞株SW480/5-FU,并建立相应的耐药结肠癌荷瘤鼠模型,与不耐药的亲代细胞的荷瘤鼠模型对比,肿瘤组织块中细胞增大,间隙缩小,肿瘤组织P-gp、PKC、MRP1的表达明显增高,说明这三种耐药蛋白是SW480对5-FU耐药形成的参与者。
对两组荷瘤鼠的活体MR监测发现,MR-DWI检测到不耐药人类结肠癌SW480组裸鼠模型肿瘤边缘及中心ADC值均较耐药人类结肠癌SW480/5-FU组裸鼠模型增高,两组肿瘤边缘ADC值差别具有统计学意义(P<0.05)。组织切片观察发现肿瘤组织周边区域SW480/5-FU细胞形态发生了改变,细胞增大,细胞间隙变窄,有可能导致细胞外的水分子扩散力减弱,使SW480/5-FU组裸鼠肿瘤边缘ADC值有意义减低。各种耐药蛋白表达增高,也改变了肿瘤细胞膜的通透性和细胞内外的渗透压,使水分子在细胞内外的扩散状况发生改变,也可能成为ADC值降低的原因之一。
本研究主要探讨功能MRI活体检测肿瘤耐药性的可能。因此,仅选取3个经典的耐药基因表达蛋白作为SW480/5-FU为耐药细胞的佐证,结肠癌SW480肿瘤活体组织对5-FU的耐药性与肿瘤组织的MR-DWI的ADC值呈负相关,耐药肿瘤组织的ADC值较不耐药组织明显降低。
总之,本研究诱导的对5-FU耐药的结肠癌的PKC、P-gp、MRP1等耐药基因蛋白较亲本不耐药结肠癌明显高表达,MR-DWI活体检测耐药肿瘤组织ADC值较不耐药的明显升高,与PKC、P-gp、MRP1等耐药基因表达呈负相关。因此,MR-DWI检测的ADC值变化有可能作为MR活体检测肿瘤耐药性的监测指标。
[1]Duygulu G,Ovali GY,Calli C,et al.Intracerebral metastasis showing restricted diffusion:correlation with histopathologic findings[J].Eur J Radiol,2010,74(1):117-120.
[2]谢琦,张鼎旋,梁碧玲,等.磁共振弥散成像活体检测rAd/p53治疗人类结肠癌荷瘤裸鼠早期疗效 [J].中国临床医学影像杂志,2012,23(3):176-180.
[3]Xie Q,Liang BL,Wu YH,et al.Synergistic anticancer effect of rAd/P53 combined with 5-fluorouracil or iodized oil in the early therapeutic response of human colon cancer in vivo[J].Gene, 2012,499(2):303-308.
[4]Wang J,Zhang J,Zhang L,et al.Expression of P-gp,MRP, LRP,GST-n and Topo IIa and intrinsic resistance in human lung cancer cell lines[J].Oncol Rep,2011,26(5):1081-1089.
[5]Zhang H,Wang J,Cai K,et al.Down regulation of gene MDR1 by shRNA to reverse multi-drug-resistance of ovarian cancer A2780 cells[J].Cancer Res Ther,2012,8(2):226-231.
[6]HuM,LiuY,DengC,et al.Enhancedinvasivenessin multidrugresistantleukemiccellsisassociatedwithover expression of P-glycoprotein and cellular inhibitor of apoptosis protein[J].2011,52(7):1302-1311.
[7]Lee SK,Shehzad A,Jung JC,et al.Protein Kinase CαProtects Against Multidrug Resistance in Human Colon Cancer Cells[J]. Mol Cells,2012,34(1):61-69.
[8]Mahjoubi F,Akbari S.Multidrug Resistance Associated Protein 1 PredictsRelapseinIranianChildhoodAcuteLymphoblastic Leukemia[J].Asian Pac J Cancer Prev,2012,13(5):2285-2289.
[9]Duygulu G,Ovali GY,Calli C,et al.Intracerebral metastasis showingrestricteddiffusion:correlationwithhistopathologic findings[J].Eur J Radiol,2010,74(1):117-120.
[10]KohDM,Scurr E,Collins D,et al.Predicting response of colorectalhepaticmetastasis:valueofpretreatmentapparent diffusion coefficients[J].AJR,2007,188(4):1001-1008.
[11]谢琦,梁碧玲,张静,等.临床医用1.5T MR成像仪对人类结肠癌裸鼠移植瘤模型的DWI研究[J].中国医学影像技术,2009,25 (z1):15-18.
Detection of the drug resistance of human colon cancer in mice with magnetic resonance diffusion-weighted imaging
XIE Qi1,YANG Yi-ming1,WU Min-yi1,ZHANG Ding-xuan1,LEI Zheng-xian1,ZHANG Jing2,XU Jin3,ZHONG Wei-de3
(1.Medical Imaging Department,Nan Sha Center Hospital,Guangzhou Municipal First People’s Hospital,Guangzhou Medical College,Guangzhou 511457,China;2.Department of Pathology,Cancer Center,Sun-yat Sen University,Guangzhou 510080, China;3.Guangzhou Municipal First People’s Hospital,Guangzhou Medical University,Guangzhou 511100,China)
Objective:To investigate the possibilities in detecting the drug resistance of human colon cancer with MR diffusion-weighted imaging(MR-DWI).Methods:SW480(drug response)and SW480/5-FU(5-FU resistance)human colon cancer-bearing nude mice(five each group)were given MR-DWI examinations.Then these mouse models were sacrificed.Their tumors were removed for PKC,P-gp,MRP1 protein expression(Western Blot),and tissue sections(HE staining)was observed. ADCs of the tumor in tumor-bearing mice of two groups were analyzed in comparison with PKC,P-gp,MRP1 protein expression and changes in tissue sections.Results:The values of apparent diffusion coefficient(ADC)detected in the center and edge of the tumor in SW480 group were higher than those in SW480/5-FU group.There was statistical difference(P<0.05)of ADC value in the edge of tumor between SW480 group and SW480/5-FU group,and there was no statistical difference(P>0.05) of ADC value in the center of tumor between two groups.ADC value of tumor was negatively correlated with drug resistance. PKC,P-gp,MRP1 protein expression of SW480/5-FU group were significantly higher than that of SW480 group(P<0.05).Conclusions:MR-DWI ADC value change has the potential to help detection of colon cancer drug resistance with MR in vivo.
Colonic neoplasms;Diffusion magnetic resonance imaging;Animal Experimentation
◁妇产影像学▷
R735.35;R445.2
A
1008-1062(2016)05-0355-04
2015-09-28
谢琦(1966-),女,四川人,主任医师。E-mail:xieqi8@yeah.net
谢琦,广州医科大学附属广州市第一人民医院南沙医院 广州市南沙中心医院医学影像科,511457。E-mail:xieqi8@yeah.net
广东省自然科学基金(2015A030313732)。

