同轴静电纺丝法制备具有核-壳纤维结构的多功能敷料
陈腊梅, 曹 婕, 叶 霖,2, 张爱英,2, 冯增国,2
(1. 北京理工大学材料学院, 北京 100081;2. 结构可控先进功能材料和绿色应用北京市重点实验室, 北京 100081)
同轴静电纺丝法制备具有核-壳纤维结构的多功能敷料
陈腊梅1, 曹 婕1, 叶 霖1,2, 张爱英1,2, 冯增国1,2
(1. 北京理工大学材料学院, 北京 100081;2. 结构可控先进功能材料和绿色应用北京市重点实验室, 北京 100081)
利用同轴静电纺丝制备了具有核壳结构纳米纤维的未交联敷料, 其中纤维内核为载有抗菌药物莫匹罗星的聚己内酯(PCL), 外壳则由载有麻醉剂利多卡因的胶原构成; 通过京尼平将胶原外壳交联后得到交联敷料. 用扫描电子显微镜(SEM)和透射电子显微镜(TEM)观察了未交联敷料的表面形貌和纤维的核壳结构. 体外药物释放实验结果表明, 在2种敷料中, 2种药物在1 h内均出现了突释现象, 而在随后的60 h中, 2种药物均能从敷料中缓慢释放出来, 说明2种敷料均具有较好的持续止痛与抗菌性能. 二辛可宁酸(Bicinchonininc acid, BCA)蛋白测试结果表明, 未交联敷料外壳上的胶原蛋白能够持续地释放出来. 体外细胞培养结果表明, 与交联敷料相比, 未交联敷料能够更好地促进成纤维细胞L929的黏附和生长, 具有更好的促进伤口愈合作用. 体外抗菌实验结果显示, 负载了莫匹罗星的2种敷料的抗菌性能均明显高于对照组, 具有良好的抗菌性能.
同轴静电纺丝; 多功能敷料; 胶原; 体外抗菌; 细胞黏附
医用敷料是重要的辅助医疗用品, 主要用于外科创伤、 烧伤和各种慢性病引起的皮肤溃烂的治疗[1]. 早期的敷料仅具有简单保护和防止感染的单一功能. 随着医疗技术的不断发展, 具有减轻患者痛苦、 可吸收渗出液和抗菌以防止感染、 减少疤痕与收缩、 促使愈合等作用[2,3]的功能性敷料应运而生, 并在临床上承担起越来越重要的作用[4].
电纺丝技术在敷料制备中具有出色的可调控性, 通过电纺丝技术制备的敷料也具有透气及比表面积大等优点, 已逐渐成为医用敷料制备的主流技术之一[5~9]. 无论是聚乳酸、 聚己内酯[6]、 聚氨酯[2]及聚乙烯醇等人工合成材料, 还是纤维素、 壳聚糖[10]、 明胶[2]、 胶原等天然材料, 都可以通过静电纺丝制成医用敷料[10~16]. 利用静电纺丝技术的可负载性, 将具有抗菌、 止痛、 促进愈合等作用的功能性物质引入到敷料纤维结构中[17~19], 可得到功能性医用敷料. Deng等[20]将抗菌药恩氟沙星负载在聚偏氟乙烯(PVDF)纤维中, 制得了对大肠杆菌和金黄色葡萄球菌具有明显抑制作用的抗菌性医用敷料. 袁晓燕等[21,22]利用同轴静电纺丝技术制备了具有核壳纤维结构的敷料, 这种敷料能够有效地促进伤口愈合, 在组织工程人工皮肤领域具有很好的应用前景.
胶原具有良好的生物相容性和促进细胞增殖的特点[23], 聚己内酯(PCL)具有良好的纺丝性能和优良的力学性能, 结合二者的特点, 本文以负载麻醉剂利多卡因的胶原为外壳, 负载抗菌药物莫匹罗星的PCL为内核, 采用同轴静电纺丝技术制备了具有核壳纤维结构的未交联敷料, 通过京尼平交联未交联敷料的胶原外壳, 得到交联敷料. 纤维的胶原外壳在敷料使用时将直接和伤口接触, 以利用其良好的生物相容性和促愈合性; 置于内核的PCL则负责提供机械强度和维持敷料使用时的形状完整性. 外壳所负载的利多卡因是临床常用的局部麻药, 吸收后可以有效抑制人体的疼痛感; 内核层载有的抗生素莫匹罗星则可以用于预防和治疗各种细菌性皮肤感染, 对伤口的感染起到良好的预防作用[24].
1 实验部分
1.1 试剂与仪器
聚己内酯(PCL, 分子量10×104)、 二氯甲烷、 乙腈(色谱级)、 磷酸二氢钠和磷酸氢二钠, 分析纯, 天津韦斯化学品有限公司; Ⅰ型胶原蛋白, Sigma Aldrich公司; 六氟异丙醇, 分析纯, 北京天宝锦华化学试剂公司; 利多卡因(纯度98%), 北京耦合科技有限公司; 莫匹罗星, 北京精华耀邦医药科技有限公司; 二辛可宁酸(Bicinchonininc acid, BCA)试剂盒, 北京索莱宝科技有限公司.
SS-2564型高压静电纺丝仪, 北京永康乐业科技发展有限公司; DZF-6020型真空干燥箱, 上海博迅实业有限公司; UV-1800型紫外分光光度计, 日本岛津公司; Tracer-100型傅里叶变换红外光谱(FTIR)仪, 日本岛津公司; S-4800型场发射扫描电子显微镜(SEM), 日本日立株式会社; JEM-2100F型透射电子显微镜(TEM),日本电子株式会社; L-20A型高效液相色谱(HPLC)仪, 日本岛津公司; DXLL-5000型万能拉力机, 上海德杰仪器设备有限公司.
1.2 敷料的制备
以六氟异丙醇为溶剂配制0.1 g/mL的Ⅰ型胶原蛋白溶液, 加入0.015 g/mL的利多卡因作为外层纺丝液; 以二氯甲烷为溶剂配制0.2 g/mL的聚己内酯(PCL)溶液, 并加入0.08 g/mL的莫匹罗星作为内层纺丝液; 将2种溶液分别加入2个注射器中, 由同轴针头连接形成同轴结构进行高压静电纺丝, 纺丝参数: 正电压17 kV, 负电压-3 kV; 内层PCL流速为3 mL/h, 外层胶原为1 mL/h; 接收距离为15 cm. 将得到的敷料于室温下真空干燥24 h, 得到未交联敷料.
将未交联敷料浸泡在0.1 g/mL的京尼平的乙醇溶液中, 交联3 h, 用乙醇洗涤敷料3次, 于室温下真空干燥24 h, 得到交联敷料.
1.3 溶胀率和拉伸强度测试
剪取3份面积约4 cm2的未交联或交联敷料并称重, 在磷酸缓冲溶液(PBS)中进行吸水实验, 在设定的时间点取出敷料, 用滤纸吸除其表面的水分后称重, 根据下式计算敷料溶胀率(SR):
SR=(me-md)/md
式中:me和md分别为敷料溶胀平衡和干燥时的质量[25].
用DXLL-5000型电子万能实验机测定2种敷料的拉伸强度和断裂伸长率. 将2种敷料分别切成工字型样条, 样条测试范围长20 mm, 拉伸速度50 mm/min; 每个样品分别平行测试3个样条取平均值.
1.4 体外药物释放和细胞黏附实验
剪取3份面积约4 cm2的未交联或交联敷料称重, 用pH=7.4的PBS缓冲液浸泡, 置于37 ℃恒温摇床中进行莫匹罗星和利多卡因的释放实验. 每份试样用3 mL PBS浸泡并定时取样, 每次取出1 mL释放液的同时补充1 mL PBS溶液, 直到取样结束. 采用HPLC测试莫匹罗星和利多卡因的含量, 用乙腈-磷酸二氢钠溶液(0.1 mol/L)作为流动相, 流速比为1∶1, 总流速0.4 mL /min, 在230 nm波长下检测莫匹罗星的含量[26]; 用乙腈-磷酸缓冲液(pH=8.0)作为流动相, 流速比1∶1, 总流速0.4 mL/min, 在254 nm波长下检测利多卡因的含量[27].
未交联敷料胶原外壳的释放采用BCA法测定. Solarbio型BCA蛋白浓度测定试剂盒内含: BCA试剂100 mL, Cu试剂3 mL, PBS稀释液30 mL及5 mg/mL的BSA(牛血清蛋白)标准液1 mL. 使用过程中将BCA试剂与Cu试剂按体积比50∶1配制成BCA工作液, 并用PBS溶液将标准BSA蛋白分别稀释至0, 0.1, 0.2, 0.3, 0.4和0.5 mg/mL, 根据BCA试剂盒操作手册建立标准曲线. 采用与莫匹罗星和利多卡因释放实验相同的实验条件得到待测胶原溶液, 利用紫外分光光度计和标准曲线标定待测液中胶原的浓度, 从而得到胶原释放曲线.
将敷料用乙醇浸泡30 min, 消毒, 制成合适的尺寸固定于24孔板底部, 将L-929细胞以1×105Cell/mL的密度接种在敷料上, 每孔1 mL细胞悬液, 1 mL Dulbecco’s Modified Eagle Medium(DMEM)培养介质, 接种后放入5%CO2(体积分数)和37 ℃的培养箱中培养, 每2 d更换一次培养介质, 培养5 d后取出并固定. 冷冻干燥后喷金, 用SEM观察细胞在材料表面的黏附生长情况.
1.5 抗菌性能测试
采用金黄色葡萄球菌(ATCC6538)以平行划线法测定2种敷料的抗菌性能. 在无菌培养皿中装入无菌琼脂, 待琼脂凝固后用一根直径4 mm的接种环蘸满稀释培养液, 在琼脂表面划5条长约60 mm, 间隔10 mm, 并且覆盖培养皿中间区域的接种线; 然后将25 mm×50 mm的未交联或交联敷料样片贴在琼脂表面, 轻压试样以保证其与琼脂表面紧密接触, 在(37±2) ℃下培养18~24 h; 观察样品边缘的抑菌区并计算其抑菌宽度, 同时观察样片底部细菌生长情况. 取样片边缘到菌种生长区域的距离作为抗菌区宽度.
2 结果与讨论
2.1 敷料的表征
图1(A)为未交联敷料的SEM照片. 可以看出, 敷料呈现良好的纳米纤维无规交叠结构, 并且具有多孔结构, 纤维直径为200~800 nm, 说明利用同轴静电纺丝制备了未交联敷料, 其中的多孔结构可以保证敷料的透气性, 也是敷料制备中必须满足的前提条件. 图1(B)为交联敷料的SEM照片. 与图1(A)相比, 交联前后敷料的形貌与纳米纤维直径均没有明显的变化, 交联后敷料仍旧保持良好的纳米纤维无规交叠结构.

Fig.1 SEM images of uncrosslinked(A) and crosslinked(B) PCL/Collagen nanofibers
图2为未交联敷料中纳米纤维的TEM照片, 可以看到明显的核壳结构, 而且大部分纤维均具有核壳结构. 图2插图给出了较大倍数下单根纤维的照片, 可以看出不同部位的核层和壳层尺寸较均匀.

Fig.2 TEM image of the core shell structure of uncrosslinked dressingInset: magnification image.
未交联敷料的拉伸强度和断裂伸长率分别为(0.83±0.05) MPa和(577±6)%; 交联敷料的拉伸强度和断裂伸长率分别为(1.27±0.18) MPa和(793±13)%. 可以看出, 经过京尼平交联后, 交联敷料的拉伸强度和断裂伸长率显著提高. 交联敷料具有更强的拉伸强度和断裂延伸率, 能够更好地在使用中保持敷料的机械强度和结构完整性.
图3给出2种敷料的溶胀率曲线. 由图3可见, 交联敷料的溶胀率明显大于未交联敷料, 交联敷料在3 h左右即达到平衡溶胀率, 未交联敷料则在12 h左右达到平衡. 在交联敷料中只发生胶原外壳的溶胀吸水过程; 但在未交联敷料中则存在胶原的吸水和未交联胶原在水中的溶解失重2个相反的过程. 由于未交联敷料中外壳胶原会因溶解而大量损失, 其平衡溶胀率远低于交联敷料. 因此, 交联敷料溶胀率的提高说明胶原外壳中发生交联. 交联之后敷料的吸水性明显增强, 当其与伤口接触时能更好地吸收渗出液从而减少患者的不适感; 未交联的敷料中溶解的胶原则可促进真皮和成纤维细胞的生长, 对伤口的愈合有很好的促进作用.
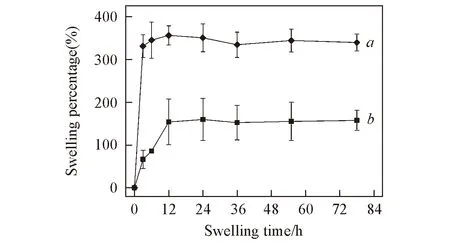
Fig.3 Swelling ratio of crosslinked(a) and uncrosslinked(b) dressing
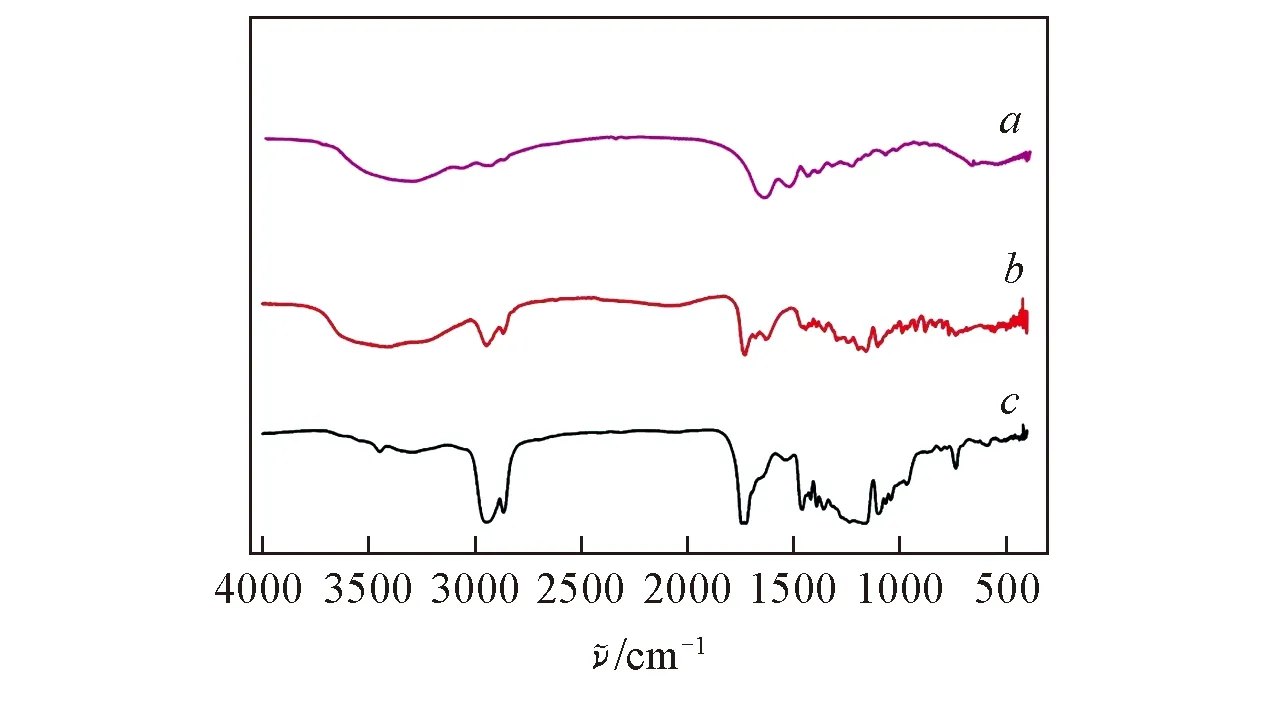
Fig.4 IR spectra of collagen(a), crosslinked(b) and uncrosslinked(c) dressings

2.2 敷料中利多卡因和莫匹罗星的体外释放行为
图5给出2种敷料的利多卡因的累积释放曲线. 由图5可见, 交联敷料在相同时间内的累积释放量均大于未交联敷料, 在1 h左右2种敷料均存在突释现象. 这可能是由附着在电纺丝纳米纤维表面的利多卡因引起的, 突释现象的存在使敷料可以在短时间内发挥止痛作用. 在1~67 h之间, 2种敷料均呈现明显的药物缓释段, 说明敷料具有长期的止痛功效. 未交联敷料在缓释段具有更多的累积释放量(其缓释段曲线更为陡峭), 这是由于利多卡因在乙醇中也具有一定的溶解性, 当使用京尼平的乙醇溶液制备交联敷料时, 纤维外壳中的利多卡因可能会迁移至纤维外壳的表面. 当体外释放实验开始时大量的利多卡因会从纤维外壳表面被突然释放出来, 这可能是在突释段交联敷料的利多卡因释放量远大于未交联敷料的原因. 由于纤维中大量的利多卡因已被释放出来, 在缓释阶段交联敷料的累积释放量反而小于未交联敷料. 图6为2种敷料中莫匹罗星的体外释放曲线. 由图6可知, 2种敷料的释放曲线也分为突释段和缓释段, 但交联敷料的累积释放量在两段中均大大低于未交联敷料. 由于莫匹罗星被负载于纤维的PCL内核中, 其释放需要通过胶原外壳. 交联后胶原外壳形成类似水凝胶的交联网络, 阻碍了药物的快速释放. 而莫匹罗星为疏水性药物, 使得其通过胶原水凝胶外壳的释放更为缓慢. 可见, 2种敷料整体上均呈很好的药物控释性能, 使得2种敷料可以在较长时间内具有一定的止痛和抗菌作用, 从而延长敷料的使用时间, 减少患者的换药次数.
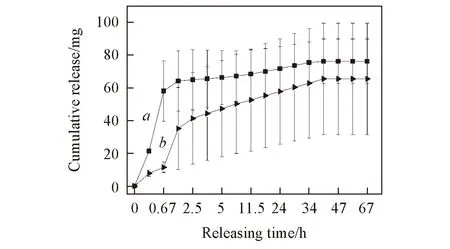
Fig.5 In vitro releasing curves of Lidocaine of crosslinked(a) and uncrosslinked(b) dressings
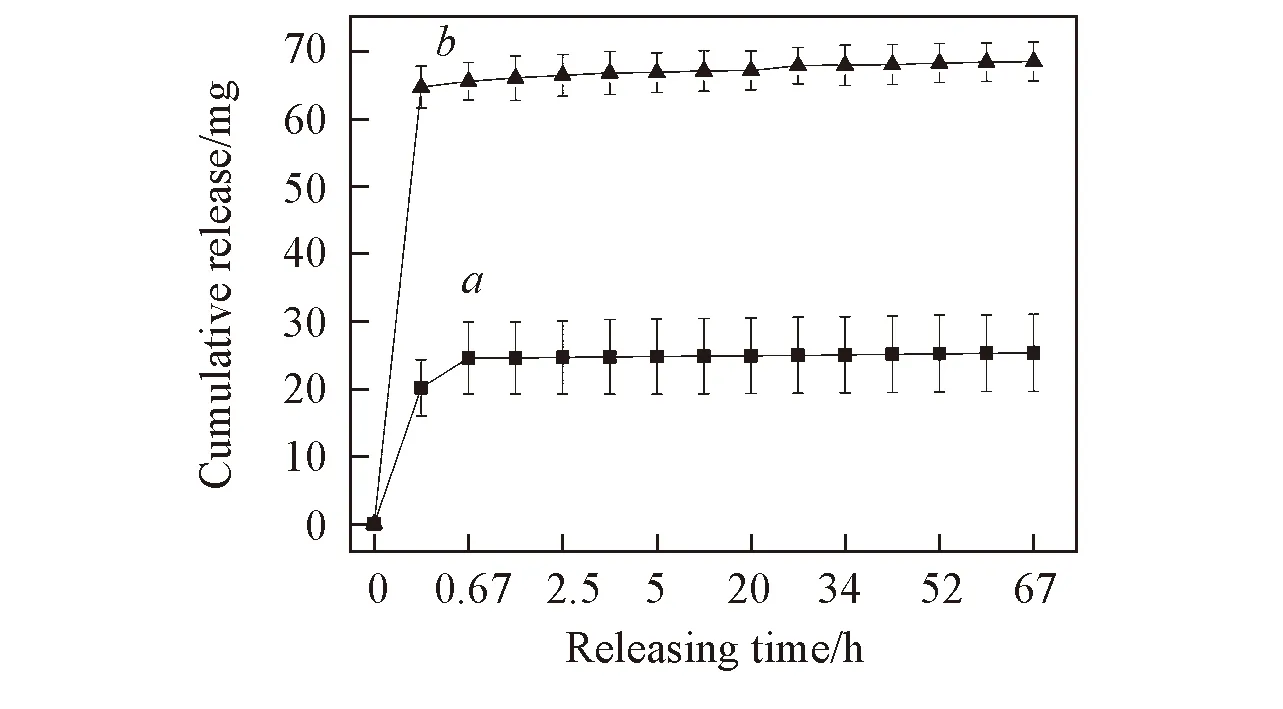
Fig.6 In vitro releasing curves of Mupirocin of crosslinked(a) and uncrosslinked(b) dressings
2.3 未交联敷料中胶原的体外释放和细胞黏附行为
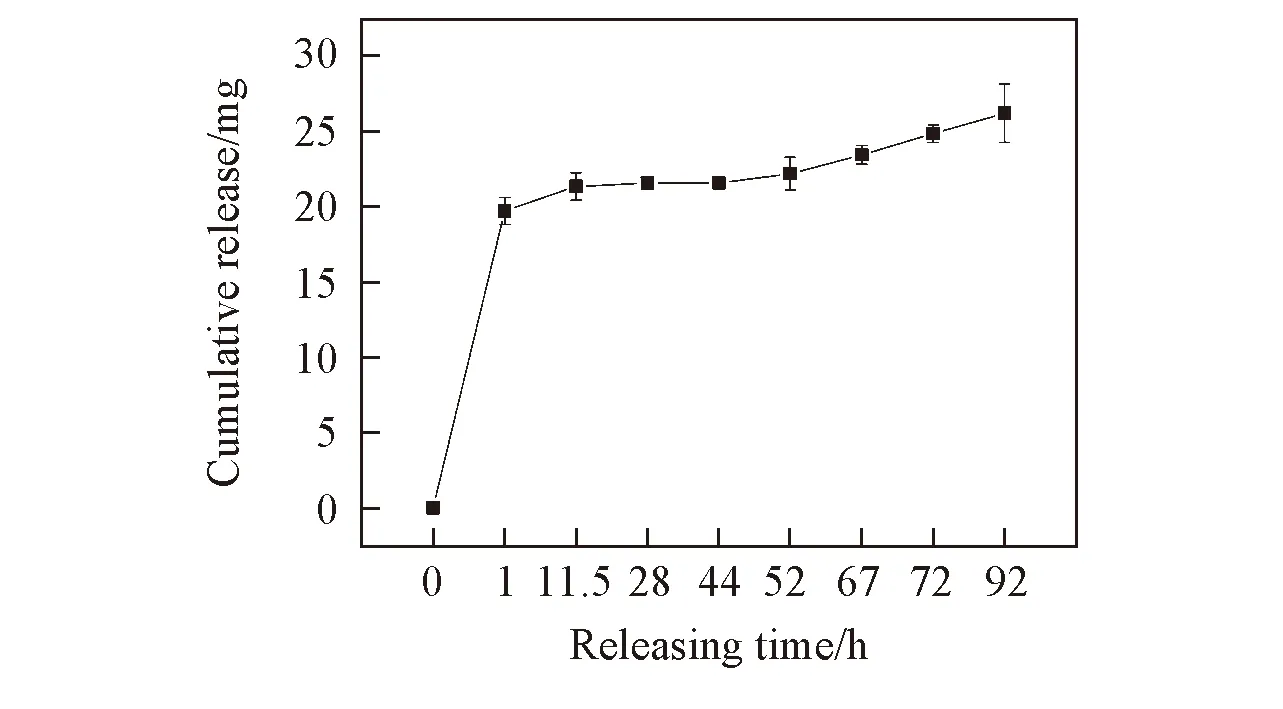
Fig.7 In vitro releasing curve of collagen of uncrosslinked dressing
图7为未交联敷料中胶原的体外释放曲线. 由图7可见, 其释放曲线也分为突释段和缓释段. 未交联敷料在释放出所负载的2种药物的同时也释放出一定量的胶原, 而胶原对成纤维细胞和真皮细胞的生长有良好的促进作用, 表明未交联敷料具有良好的促愈合作用. 而在交联敷料中, 由于交联后胶原分子从线型结构转化为网状结构, 交联后的胶原无法再从敷料中释放出来.
图8为将L929细胞在未交联和交联敷料上培养5 d后, 2种敷料表面的SEM照片. 可以看出, 2种敷料上都有细胞黏附和生长, 说明两者都具有一定的生物相容性. 但未交联敷料上具有比交联敷料更高的细胞密度, 说明未交联敷料具有更好的生物相容性. 这可能是未交联敷料能够释放出胶原蛋白, 从而更好地促进L929细胞的黏附和生长. 说明虽然2种敷料均具有一定的促愈合作用, 但其中未交联敷料具有比交联敷料更佳的促愈合作用.

Fig.8 SEM images of uncrosslinked dressing(A) and crosslinked dressing(B) cell attachment
2.4 体外抗菌性能
图9给出敷料对金黄色葡萄球菌的体外抗菌实验结果. 从图9可知, 未载药的未交联敷料的抑菌区域宽度为零, 没有任何抗菌性能; 未载药的交联敷料则有一定的抑菌功能, 其抑菌区域宽度约为9.2 mm. 载药后2种敷料具有非常明显的抑菌功能; 其中载药交联敷料的抑菌区宽度约为16.0 mm, 而载药未交联敷料的抑菌区域宽度约为15.0 mm. 说明本文制备的2种载药多功能敷料均具有很好的抑菌能力. 由于负载莫匹罗星的2种敷料具有比未负载莫匹罗星的敷料更好的抗菌能力, 说明敷料的抗菌能力来自负载的莫匹罗星. 此外, 从图9还可以看到, 京尼平交联敷料样品(载药和不载药)的抗菌区呈现深色, 这是京尼平交联后部分残留副产物渗出所导致的. 而未载药的交联敷料相比未载药的未交联敷料具有的一定的抗菌性能也可能和交联敷料中残留的副产物有关.
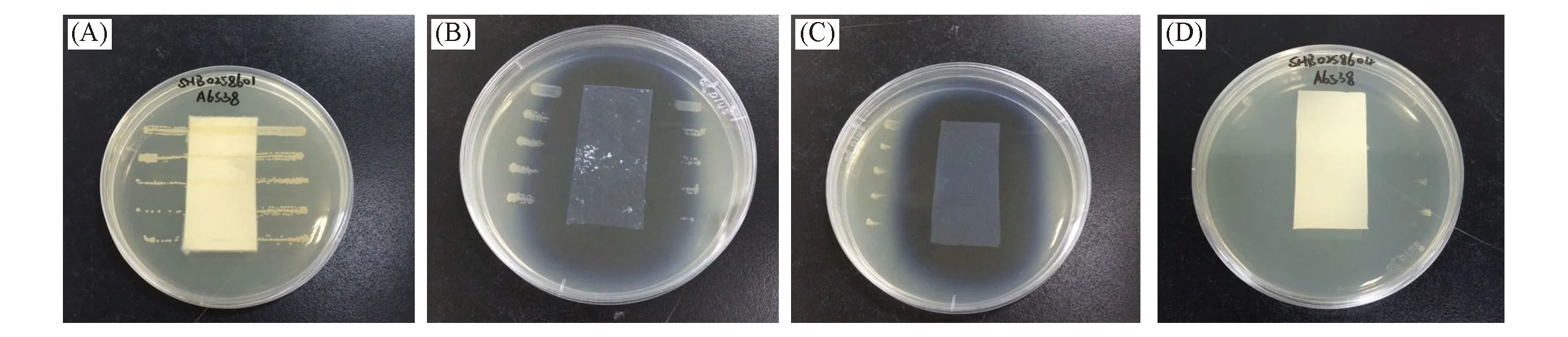
Fig.9 Antibacterium result of the wound dressings(A) Uncrosslinked dressing without drugs; (B) crossslinked dressing without drugs; (C) crosslinked dressing with drugs; (D) uncrosslinked dressing with drugs.
2.5 2种敷料的比较
具有核壳结构的未交联敷料由于构成纤维外壳的胶原具有水溶性, 因此在敷料使用过程中部分胶原外壳可能会被溶解掉. 这时由于内核中PCL的存在, 敷料仍旧可以在一定程度上保持其结构完整性并维持相当的力学性能, 而溶于水的胶原被伤口吸收后又具有很好的促愈合作用. 因此不交联外壳胶原, 直接使用未交联敷料也是一种很好的选择. 作为美国FDA所批准使用生物材料之一, PCL具有一定的生物相容性和可降解性. 当部分胶原外壳被溶解掉而使得PCL内核暴露出来与伤口相接触时, PCL的生物相容性可以确保伤口继续愈合. 而PCL的可降解性能则使得可以采用环境友好的方式对使用后敷料进行后处理.
从提高敷料的强度和维持使用中的结构完整性的角度出发, 则应进一步交联敷料中的胶原外层得到交联敷料. 京尼平是栀子苷经β-葡萄糖苷酶水解后的产物, 是一种优良的天然生物交联剂[27], 与戊二醛等传统交联剂相比, 其生物毒性非常小. 因此, 本文采用京尼平作为交联剂制备交联敷料. 与未交联敷料相比, 交联敷料具有更好的力学性能和更大的溶胀率, 因而可以有效地吸收伤口渗出液并在长期使用中维持敷料的结构完整性.
3 结 论
通过同轴电纺丝技术制备了由具有核壳结构的纳米纤维所构成的未交联敷料, 且在敷料纤维的外壳和内核之中分别负载了利多卡因和莫匹罗星, 利用京尼平的乙醇溶液交联未交联敷料后得到交联敷料. 结果表明, 未交联敷料具有更佳的促愈合性能; 而交联敷料则具有更高溶胀率和力学强度, 更适合作为湿性敷料使用并在吸收伤口渗出液, 在耐长期使用性等方面具有优势.
[1] Liu X., Lin T., Gao Y., Xu Z. G., Huang C., Yao G., Jiang L. L., Tang Y. W., Wang X. G.,JournalofBiomedicalMaterialsReseachB:AppliedBiomaterials, 2012, 100, 1556—1565
[2] Tan M., Li L. S.,ChemistryBulletin, 2000, (11), 7—12(谈敏, 李临生. 化学通报, 2000, (11), 7—12)
[3] Lalani R., Liu L. Y.,Biomacromolecules, 2012, 13, 1853—1863
[4] Morgado P. I., Aguiar-Ricardo A., Correia I. J.,JournalofMembraneScience, 2015, 490, 139—151
[5] Abrigo M., McArthur S. L., Kingshott P.,MacromolecularBioscience, 2014, 14, 772—792
[6] Agarwal S., Wendorff J. H., Greiner A.,Polymer, 2008, 49, 5603—5621
[7] Zahedi P., Rezaeiana I., Ranaei-Siadatb S. O., Jafaria S. H., Supaphol P.,Polym.Adv.Technol., 2010, 21, 77—95
[8] Liu Y., Cao P., He G., Lin Z. S., Qiu T., Li C., Cai X. D., Ao N. J.,PolymerBulletin, 2014, (6), 40—45(刘源, 曹苹, 何桂, 林钟石, 邱涛, 李淳, 蔡信东, 敖宁建. 高分子通报, 2014, (6), 40—45)
[9] Fan Y. N., Cai Z. J., Zhao K. Y.,PolymerBulletin, 2013, (11), 70—75(樊亚男, 蔡志江, 赵孔银. 高分子通报, 2013, (11), 70—75)
[10] Nina L., Afeesh R. U., Mahesh K. J., Arjun P. T., Seong Tshool H., Chan-Hee P., Cheol S. K.,ColloidsandSurfacesA:Physicochem.Eng.Aspects, 2015, 469, 194—201
[11] Tan L., Hu J. L., Zhao H. F.,MaterialsLetters, 2015, 156, 46—49
[12] Zhou Y. S., Yang D. Z., Chen X. M., Xu Q., Lu F. M., Nie J.,Biomacromolecules, 2008, 9, 349—354
[13] Tan L., Hu J. L., Huang H. H., Han J. P., Hu H. W.,InternationalJournalofBiologicalMacromolecules, 2015, (79), 469—476
[14] Tang C., Guan Y.X., Yao S. J., Zhu Z.Q.,ActaPolymericaSinica, 2014, (6), 774—781(唐川, 关怡新, 姚善泾, 朱自强. 高分子学报, 2014, (6), 774—781)
[15] Payam Z., Zeinab K., Iraj R., Seyed-Hassan J., Parvin M., Amir H. A., Mohammad A.,JournalofAppliedPolymerScience, 2012, 124, 4174—4183
[16] Chen Y., Dou G. F., Luo Y. J., Tan H. M.,PolymerBulletin, 2005, (1), 94—100(陈煜, 窦桂芳, 罗运军, 谭惠民. 高分子通报, 2005, (1), 94—100)
[17] Uyanga D., Mark K. R., Afeesh R. U., Arjun P. T., Batgerel T., Chan H. P., Cheol S. K.,InternationalJournalofBiologicalMacromolecules, 2015, (80), 1—7
[18] Tchemtchoua V. T., Atanasova G., Aqil A., Filee P., Garbacki N., Deroanne C., Noel A., Jerome C., Nusgens B.,Biomacro-molecules, 2011, 12, 3194—3204
[19] Gao Y., Truong Y. B., Zhu Y. G., Kyratzis I. L.,JournalofAppliedPolymerScience, 2014, DOI: 10.1002/app.40797
[20] He T., Wang J. N., Huang P. L., Zeng B. Z., Li H. H., Gao Q. Y., Zhang S. Y., Luo Z., Deng D. Y. B., Zhang H. W., Zhou W. Y.,ColloidsandSurfacesB:Biointerfaces, 2015, 130, 278—286
[21] Sun B., Study on Electrospun Core/shell Structured Ultrafine Fibers for Wound Dressings, Tianjin University, Tianjin, 2007(孙斌. 芯/壳结构超细纤维及其用作伤口敷料的研究, 天津: 天津大学, 2007)
[22] Wu L. L., Study on Electrospun PLGA/chitosan Composite Membranes for Artificial Skin, Tianjin University, Tianjin, 2007(邬丽丽. PLGA壳聚糖电纺复合膜用于人工皮肤的研究, 天津: 天津大学, 2007)
[23] Chen L., Study and Fabricate on a Novel Human-like Collagen(HLC)/chitosan Complex Nano Fibrous Scaffold by Electrospinning, Northwest University, Xi’an, 2010(陈岚. 新型类人胶原蛋白-壳聚糖静电纺丝纳米纤维结构组织工程支架的构建与研究, 西安: 西北大学, 2010)
[24] Thakur R. A., Florek C. A., Kohn J.,InternationalJournalofPharmaceutics, 2008, 87—93
[25] Xu X. L.,StudyonthePreparationandEnvironmentalismPactofNewWoundDressing-gelatin-basedAntibacterialNanofiberHydrogel, Donghua University, Shanghai, 2009(徐雄立. 新型医用敷料----明胶基抗菌纳米纤维水凝胶的制备及其环境影响研究, 上海: 东华大学, 2009)
[26] Fang Y., Yang Z.,ChinaPharmacy, 2013, 24(33), 3143—3144(范莹, 杨昭. 中国药房, 2013, 24(33), 3143—3144)
[27] Dong Y.,ChinaPharmaceuticals, 2010, 19(2), 36—37(董煜. 中国药业, 2010, 19(2), 36—37)
(Ed.: W, Z)
† Supported by the National Innovation Experiment Program for University Student, China(No.201410007052).
Preparation of Multi-functional Wound Dressing with Core-shell NanofibersviaCo-axial Electrospinning†
CHEN Lamei1, CAO Jie1, YE Lin1,2*, ZHANG Aiying1,2, FENG Zengguo1,2
(1.SchoolofMaterialsScienceandEngineering,BeijingInstituteofTechnology,Beijing100081,China; 2.BeijingKeyLaboratoryofConstructionTailorableAdvancedFunctionalMaterialsandGreenApplications,Beijing100081,China)
The uncrosslinked wound dressing with core-shell nanofibers was firstly fabricatedviaco-axial electrospinning. The nanofiber was composed of the polycaprolactone(PCL) core loaded with anti-bacterium drug mupirocin and collagen shell with anesthesia lidocains. The surface morphology of uncrosslinked dressing and its core-shell structured fibers were characterized by scanning electronic microscopy and transmission electronic microscopy, respectively. The crosslinked wound dressing can be further prepared by the crosslinking of collagen shell, and the successful crosslinking can be proved by the enhanced tensile strength and swelling ratio.Invitrodrug release tests implied two dressings both possessed the burst release stage and sustainable release stage for two loaded drugs, which confirmed the sustainable acesodyne and anti-bacteria effects for both dressings. The bicinchonininc acid(BCA) test results showed that the collagen in uncrosslinked dressing could also be sustainably released, whileinvitrocell attachment test depicted that uncrosslinked dressing could promote the cell attachment and growth better than crosslinked dressing. Furthermore, theinvitroanti-bacteria test showed that both dressings loaded with mupirocin had significantly better anti-bacteria ability than those without mupirocin indicating their excellent anti-bacteria ability. Two as-prepared multifunctional wound dressings possessed acesodyne and anti-bacteria effects and were able to promote the healing process so that they can reduce the pains of patients, reduce the number of dressing change, and enhance treatment effect.
Co-axial electrospinning; Multifunctional wound dressing; Collagen;Invitroanti-bacteria; Cell attachment
10.7503/cjcu20150671
2015-08-20.
日期: 2016-01-24.
国家大学生创新创业训练计划(批准号: 201410007052)资助.
O631.2
A
联系人简介: 叶 霖, 男, 博士, 讲师, 主要从事高分子材料研究. E-mail: yelin@bit.edu.cn

