开放式限制进出隔离系统(ORBAS)在生物制药中的应用及管理
沈继武 张跃鑫
(中国医学科学院北京协和医学院医学生物学研究所,云南昆明 650118)
开放式限制进出隔离系统(ORBAS)在生物制药中的应用及管理
沈继武 张跃鑫
(中国医学科学院北京协和医学院医学生物学研究所,云南昆明 650118)
结合GMP(2010版)的规范与要求,基于无菌操作风险评估与风险控制的理念,通过对ORBAS与生产工艺结合的全面剖析,着重探讨无菌操作过程中ORBAS存在的的难点与风险点,旨在为ORBAS在生物制药的应用提供更多的管理依据和指导性方法。
GMP;ORABS;生物制药
ORBAS(Open restricted access isolation system)即开放式限制进出隔离系统(下简称ORBAS)。《药品生产质量管理规范》(2010年修订)(下简称GMP)将无菌药品生产所需的洁净区分为以下4个级别:A级、B级、C级、D级。在A级对应的高风险操作区,如灌装区、放置胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域,要求应当用单向流操作台(罩)维持该区的环境状态[1]。同时在附录1:无菌药品第四章中提出:高污染风险的操作宜在隔离操作器中完成。ORBAS作为隔离操作器的一种,伴随GMP的实施与推进,被广泛引入生物制药生产线关键无菌操作的A级区域,成为一种标准配置和一种相对更高的质量标准。在无菌操作的工艺生产要求中,ORBAS彻底改变了制药工艺的传统操作模式,正发挥出前所未有的功能与作用。
ORBAS为生物制药带来了革命性的创新与改变,但问题同样是显而易见的,ORBAS在与生产工艺的结合过程中,其操作和管理对产品的质量保证与控制同样带来新的风险与挑战。如何最大限度的控制并减少污染的风险,成为最基本也是最重要的课题。
本文结合GMP(2010版)的规范与要求,基于无菌操作风险评估与风险控制的理念,通过对ORBAS与生产工艺结合的全面剖析,着重探讨无菌操作过程中ORBAS存在的的难点与风险点,旨在为ORBAS在生物制药的应用提供更多的管理依据和指导性方法。
1 ORBAS与GMP
1.1 A级区域的定义与要求
1.1.1 定义:无菌制剂高风险操作区域。
1.1.2 要求:单向流,环境状态符合A级标准:“静态”、“动态”空气悬浮粒子、微生物符合相关标准。
1.2 ORBAS安装使用位置
1.2.1 要求洁净度为A级的无菌操作的核心关键区域。
① 灌装区:包括进瓶工位,灌装工位,压塞工位,传输工位,轧盖工位[2]。
② 无菌物料脱包、传递、放置区域。如:胶塞、铝盖上料工位。
③ 无菌器具安装前脱包区域。如:灌装泵、振荡斗呼吸袋脱包。
④ 无菌装配或连接区域:药液储罐-缓冲罐-灌装泵之间通过硅胶管的安装、连接区域。
⑤ 灌装药液放置区域。如:原液配制罐放置区域。
1.2.2 物料、产品处于开口、未密封状态,需进行保护的区域。
① 轧盖前产品输送传输带。如:灌装机→冻干机、轧盖机中间传输带。
② 无菌物料进入灌装间的传输。如:预充注射
器从C级区脱包进入灌装机。
2 ORBAS关键组件、功能与作用
ORBAS由层流装置、安全联锁门、手套、在线风速仪、尘埃粒子在线监测系统、浮游菌在线监测系统等六个关键组件组成,构成一个相互配套、相互影响的有机整体。其配置、功能与作用见表1。
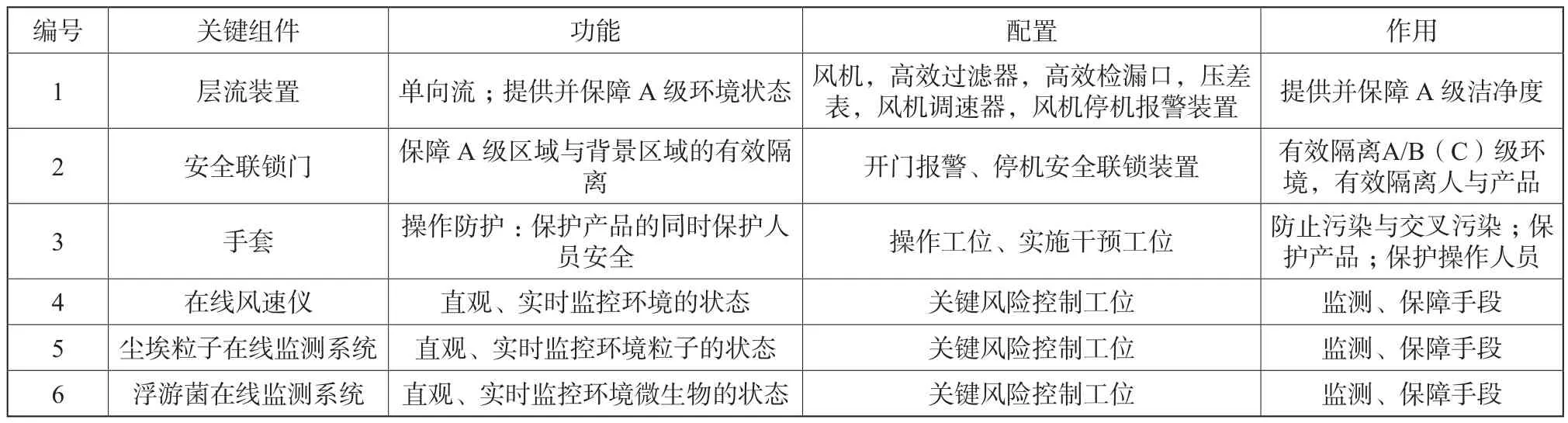
表1 ORBAS关键组件、功能与作用Tab.1 ORBAS key components, functions and effect
3 ORBAS组件关键性评估和风险评估
ORBAS风险管理包括:组件关键性评估,风险评估,失效模式与后果分析。预期达到:根据功能和组件对产品的影响,评估其GMP关键程度;识别ORBAS潜在的风险。分析并评估这些风险,确定降低风险的措施。从而降低在执行过程中这些潜在风险可能造成的危害。ORBAS组件关键性评估和风险评估见表2。
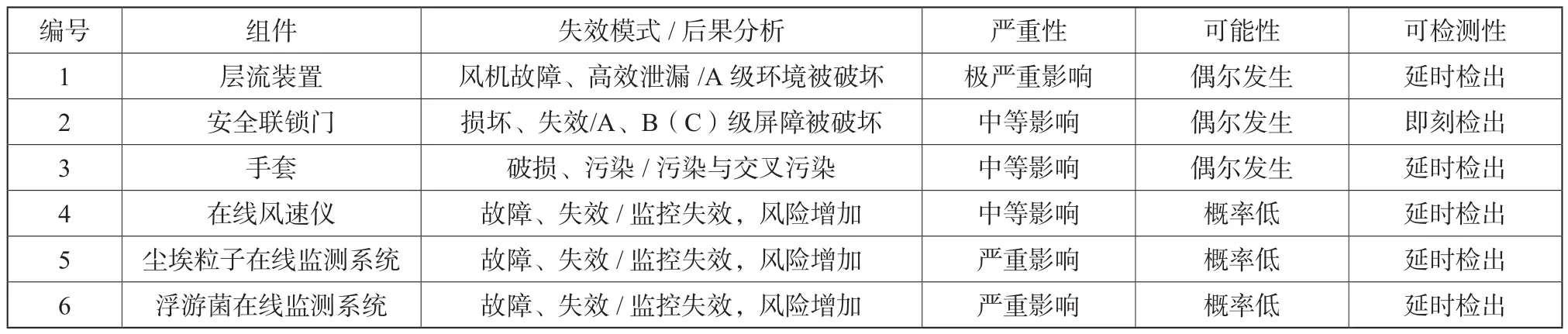
表2 ORBAS组件关键性评估与风险评估Tab.2 ORBAS critical component assessment and risk assessment
4 ORBAS关键无菌操作
4.1 人员行为规范
4.1.1 洁净区行为规范
重点规范:洁净区行为规范、更衣程序、无菌手套的外消和更换,以及无菌操作。相关操作人员经培训考核合格后允许进行相关操作。如三更衣的考核,要求在时限内完成并以视频录制的方式进行考核。
4.1.2 无菌操作,严格按SOP进行
正常操作和实施干预(如倒瓶)必须通过手套进行相关操作。生产过程中需进行维修而手套无法使用时,应严格遵守洁净区实施维修的相关要求和准则。如使用经灭菌处理的洁净区专用工具。 当设备发生短期不能修复的故障时,启动偏差程序,终止生产操作。
4.2 安全联锁门开启准则
严禁超出SOP的权限随意开关安全联锁门,需要开门时(如维修),严格按照SOP规定进行操作。严格把控:开门次数、开门时间和开门后的自净,停机后产品的处理程序。
4.3 无菌转运
所有生产物料和设备配套的工器具由低级别区域进入A级区域,必须设置必要的无菌保障措施,如:设置级别为A级的缓冲区域,如固定式层流或者是移动式层流车(可与ORBAS实现无缝对接);工器
具(如灌装泵)、物料(如胶塞、铝盖)采用两层呼吸袋包装,物料在缓冲区外消并脱去第一层包装。进入ORBAS后通过手套再次实施外消并脱去第二层包装,然后再进行相关安装和生产操作。
4.4 手套管理
定期对手套进行必要的清洁、消毒,每批生产前和生产后对手套进行检漏。检漏发现手套出现破损时及时进行更换,必要时进行追溯。有条件的的情况下,推荐使用VHP(过氧化氢)进行灭菌。
4.5 验证
ORBAS的验证可以包含在灌装机的验证中,最好与灌装机培养基模拟灌装试验同步进行,必须包含但不限于以下内容。“动态”下的最差工况、自净时间、开门次数、开门时间、尘埃粒子、沉降菌,浮游菌。“静态”下的气流模型(分为不开门和开门两种状况)、风速(对应规定的风机频率)、尘埃粒子、沉降菌、照度、噪声,高效过滤器检漏。
4.6 定期监测
定期对ORBAS所属的A级区空气悬浮粒子,沉降菌进行 “静态”检测,评判ORBAS的运行状况是否符合要求。
4.7 实时监控
生产过程中,应对风速,空气悬浮粒子、浮游菌实施实时“动态”监测。所有实时电子记录应归入生产批记录。当参数值发生偏离超出警戒限时,引起注意;超出纠偏限时,启动偏差处理程序。
4.8 维护保养
定期对压差表,风速仪进行校准。重点制定预防性维护保养制度对ORBAS进行维护保养,确保ORBAS正常、长期、稳定运行。
5 讨论
因ORBAS所在的区域为生物制药的核心关键区域,任何微小的差错或者偏差都可能导致风险的无限放大,并最终导致污染事件的发生。所以无菌保证、无菌操作的风险控制和预防性措施是ORBAS实施管理的重点。保证、控制、措施、方法及相关的关键无菌操作都应经过验证并在SMP、SOP中详细要求并规定。管理的另一个关键点是将所有工艺、操作环节形成一个完整和整体的质量体系。
6 结束语
综上所述,ORBAS是提供和保障A级区域静态、动态洁净度的优选解决方案。是实现药品生产无菌保证强有力的措施和手段。是GMP发展历程中更高标准与要求的体现。基于A级区域的重要性和特殊性,无菌保证与无菌操作直接关系产品质量,以及人员的安全。所以在ORBAS的管理中,必须从风险管理的角度规范人员行为规范,安全联锁门开启准则,无菌转运,手套管理,验证,定期监测,实时监控和维护保养。必须通过风险的查找、分析、控制、保证,建立系统全面的质量管理 ,最终实现最大程度减少污染的风险。从而真正推动并促进生产工艺的进步,全面提升生物制药的无菌保证的能力与水平。
[1]国家卫生部.药品生产质量管理规范(2010年修订)[S].
[2]陈允裔. 隔离技术在无菌原料药生产过程中的应用[J].江苏:机电信息,2013,2:26-28.
[3]史云.新版GMP规范下隔离操作技术在分装操作中的应用探讨[J]. 上海:医药工程设计,2013, 34(2):25-28.
Application and Management of Open Restricted Access Isolation System in Pharmaceutical Industry
Shen Jiwu, Zhang Yuexin
(Medical and Biological Research Institute, Chinese Academy of Medical Sciences and Peking Union Medical College, Kunming 650118)
Combined with the specification and requirements in GMP (Edition 2010), and based on the rationale of risk control and assessment for aseptic operation, in this article, through the analysis of the combination of open restricted access isolation system (ORBAS) with productive process, the difficult and risk aspects existed in aseptic operation were discussed. It is hopeful to provide more management basis and guidance in the application of ORBAS in biopharmaceutical industry.
GMP; ORBAS; biopharmaceutical production
R 951
A
2095-817X(2016)05-0021-003
2016-05-18
沈继武(1975—),男,工程师,从事生物制药设备管理工作。

