化学实验探究题常见题型分类解析
安徽省灵璧中学 汤 伟
化学实验探究题常见题型分类解析
安徽省灵璧中学 汤 伟
化学实验探究题能够较好地考查同学们综合应用知识的能力。如何解答此类问题?下面笔者对化学实验探究题型做出分析,供参考。
一、对已知物质性质的探究
该类试题注重考查考生能否将所学知识融会贯通,灵活应用所学知识。解答该类试题的关键是要熟记所学物质的相关性质及实验现象。
例1 某班同学用实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁粉,其目的是______________________________________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_____________________。
(3)乙组同学认为甲组的实验不够严谨。该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红。煤油的作用是________________。
(4)丙组同学取10 mL 0.1 mol·L-1KI溶液,与6 mL 0.1 mol·L-1FeCl3溶液混合。分别取2 mL混合溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层呈紫色;
②第二只试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是____________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有____________(填离子符号),由此可以证明该氧化还原反应为____________。
解析 (1)Fe2+具有较强的还原性,能被空气中的O2氧化,所以在配制的FeCl2溶液中加入少量铁粉,目的是防止Fe2+被空气中的O2氧化。
(2)Cl2可将Fe2+氧化成Fe3+,自身得电子生成Cl-,反应的离子方程式为2Fe2++Cl2=2Fe3++ 2Cl-。
(3)实验时必须防止空气中的O2将Fe2+氧化,所以煤油的作用是隔绝空气。
(4)根据Fe2+的检验方法,向溶液中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀,则溶液中一定含有Fe2+,即实验②检验的离子是Fe2+;碘易溶于CCl4,在CCl4中呈紫色,Fe3+遇KSCN溶液显血红色,实验①和③说明Fe3+与I-间的反应为可逆反应。
答案 (1)防止Fe2+被氧化 (2)2Fe2++Cl2=2Fe3++2Cl-(3)隔绝空气(排除氧气对实验的影响) (4)Fe2+Fe3+可逆反应
二、对未知产物的探究
根据化学反应原理猜测可能生成哪些物质,对这些物质逐一进行检验来确定究竟生成了哪些物质。正确解答此类试题的关键:把握反应原理,根据现象和原理进行合理猜测。
例2 氮的氧化物(NOx)是大气污染物,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。如下图所示,某同学在实验室中对NH3与NO2的反应进行了探究:将NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下进行实验。


操作步骤 实验现象 解释原因打开K1,推动注射器活塞,使X中的气体缓慢进入Y管中①Y管中___________②反应的化学方程式___________将注射器活塞退回原处并固定,待装置恢复到室温Y管中有少量水珠 生成的气态水凝集打开K2③__________④__________
三、对变化规律的探究
对物质性质规律的探究是中学化学实验的一个重要内容。中学化学教材中学习了众多的变化规律,如同周期、同主族元素性质的递变规律,物质的氧化还原反应规律,物质的酸(碱)性强弱规律等,这些规律都是通过实验探究和相关理论结合得出的,现在它们仍然是命题的经典情境。解答该类问题的关键点是注意控制变量法的应用,即在其他条件相同的前提下,研究一个条件的变化对对象的影响规律。注意:选择数据要有效,且变量统一,否则无法做出正确判断。
例3 以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
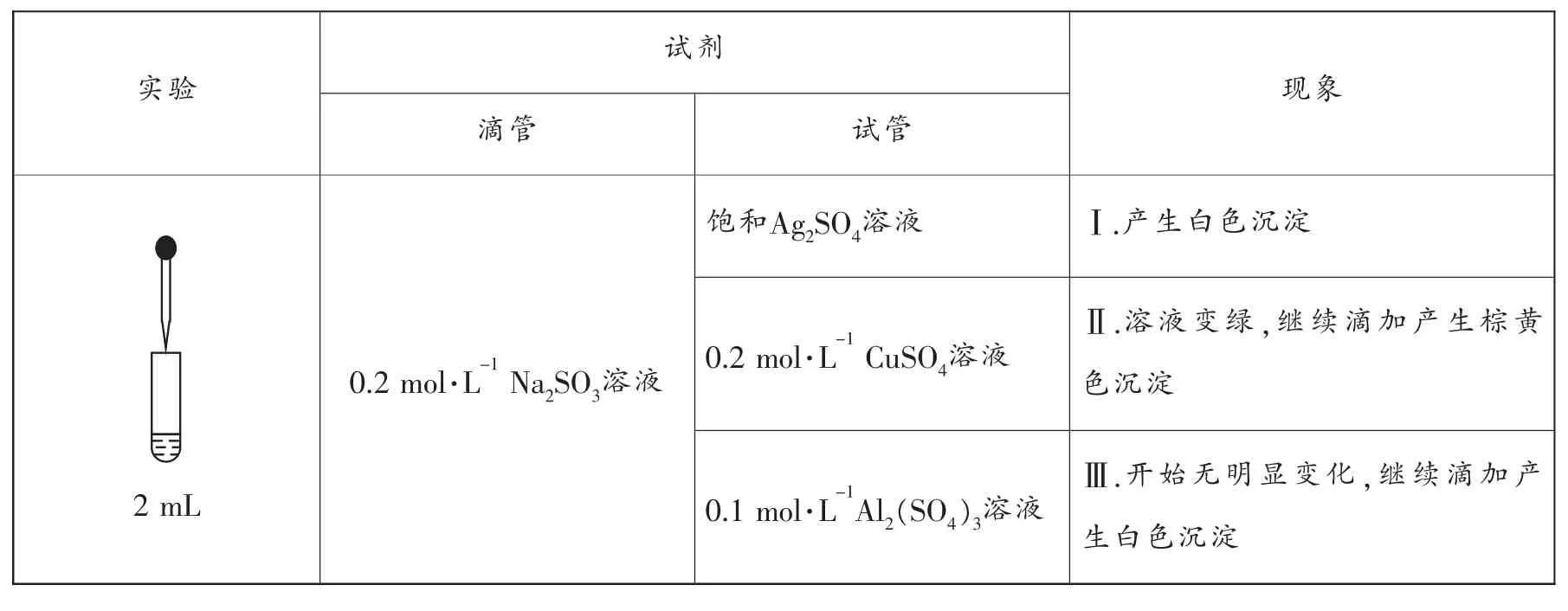
实验试剂现象滴管 试管饱和Ag2SO4溶液 Ⅰ.产生白色沉淀2 mL 0.2 mol·L-1Na2SO3溶液0.2 mol·L-1CuSO4溶液0.1 mol·L-1Al2(SO4)3溶液Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀Ⅲ.开始无明显变化,继续滴加产生白色沉淀
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:____________。
①用稀硫酸证实沉淀中含有Cu+的实验现象是____________。
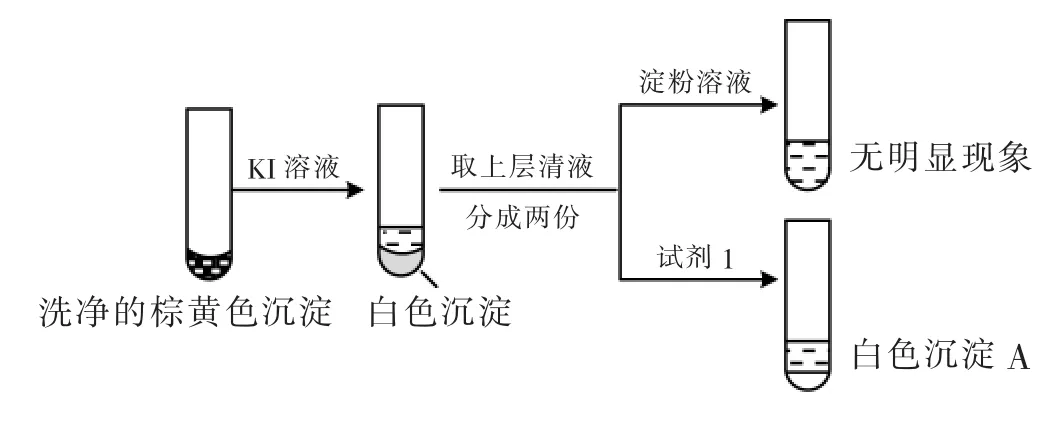
a.白色沉淀A是BaSO4,试剂1是___________。
(3)已知:Al2(SO3)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和____________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:ⅰ.被Al(OH)3所吸附;ⅱ.存在于铝的碱式盐中。对假设ⅱ设计了对比实验,证实了假设ⅱ成立。
a.将对比实验方案补充完整。
步骤一:

步骤二:________________(按上图形式呈现)。
b.假设ⅱ成立的实验证据是________________。
(4)根据实验,亚硫酸盐的性质有____________。盐溶液间反应的多样性与___________有关。
解析 (1)易知现象Ⅰ中的白色沉淀是Ag2SO3,可以得出离子方程式为。(2)根据Cu+的相关性质,可以得出加入稀硫酸后会有红色固体铜析出;确认白色沉淀为BaSO4,一般选取盐酸酸化的BaCl2检验,即试剂1是盐酸酸化的BaCl2溶液;证实沉淀中含有Cu2+和的理由是棕黄色沉淀与KI溶液反应生成白色沉淀(CuI),证明含有Cu2+,白色沉淀A为 BaSO4,证明含有。(3)①根据题意可知实验Ⅲ的白色沉淀中无,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色,则可推测沉淀中含有亚硫酸根和氢氧化铝。铝的碱式盐与氢氧化钠反应消耗的氢氧化钠的量大于氢氧化铝,所以反应应该设计一个定量对比试验,根据白色固体消耗氢氧化钠的量不同来证实假设ⅱ成立,即实验方案设计步骤二为
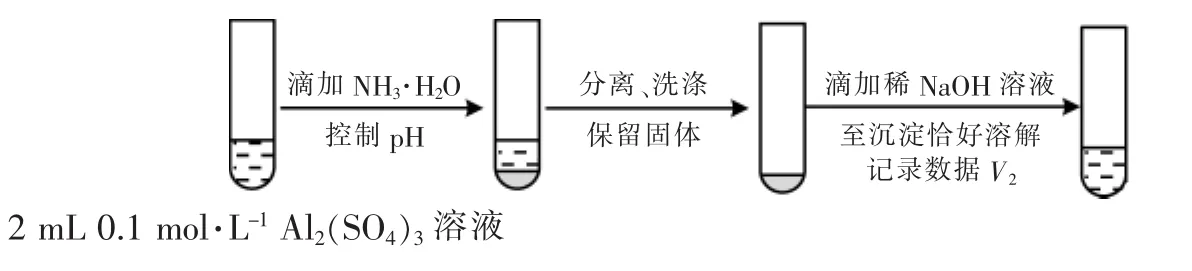
若V1明显大于V2,可说明沉淀中亚硫酸根存在于碱式盐中。
(4)根据实验,白色沉淀能使酸性KMnO4溶液褪色,说明亚硫酸盐具有还原性,另外亚硫酸根水解可使水溶液呈碱性。盐溶液间反应的多样性与盐的性质、溶液的酸碱性有关。
(3)①Al3+、OH-
②a.见解析 b.V1明显大于V2。
(4)溶解性、还原性、在水溶液中呈碱性 两种盐溶液中阴、阳离子的性质和反应条件
四、对实验方案设计与评价的探究
实验探究中还常常遇到一些实验方案的选取或设计类型的问题,如何正确评价一个实验方案的优缺点?我们要能够从多个角度分析,解题的关键点是实验设计要科学、简约、环保等。
例4 某废催化剂含58.2%的SiO2、21.0%的ZnO、4.5%的ZnS和12.8%的CuS。某同学用15.0 g该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下:

回答下列问题:
(1)在下列装置中,第一次浸出必须用______________,第二次浸出应选用____________。(填标号)

(2)第二次浸出时,向盛有滤渣1的反应器中加入稀硫酸,后滴入过氧化氢溶液。若顺序相反,会造成________________。滤渣2的主要成分是________________。
解析 (1)根据题意,第一次浸出时会因为ZnS与硫酸反应产生有毒H2S气体,该气体需要进行尾气的处理,所以选D装置;第二次反应为CuS+H2O2+H2SO4=CuSO4+S+2H2O,不会产生有毒气体,可以选取装置A。(2)第二次浸出时,向盛有滤渣1的反应器中先加入稀硫酸,后滴入过氧化氢溶液,若顺序相反,显然会造成H2O2与固体颗粒接触分解。滤渣2的主要成分为SiO2(还有少量的S)。
答案 (1)D A (2)H2O2与固体颗粒接触分解 SiO2

