用于检测细胞内谷胱甘肽的比率型荧光探针
杨润洁, 唐 尧, 朱维平
(华东理工大学药学院, 上海市化学生物学重点实验室, 上海 200237)
用于检测细胞内谷胱甘肽的比率型荧光探针
杨润洁, 唐 尧, 朱维平
(华东理工大学药学院, 上海市化学生物学重点实验室, 上海 200237)
设计合成了1种用于检测生物巯基的比率型荧光探针(4), 并考察了其对谷胱甘肽的识别作用. 在4-羟乙基哌嗪乙磺酸(HEPES)缓冲液中, 探针4可与谷胱甘肽快速反应, 溶液颜色由淡黄色变为粉红色, 从而实现“裸眼”检测, 且在608 nm处的荧光信号增强. 在1.6×10-5~2×10-4mol/L范围内, 探针4能够定量检测谷胱甘肽, 检出限为8.9×10-7mol/L. 此外, 探针4还可用于MCF-7细胞中谷胱甘肽的成像.
荧光探针; 谷胱甘肽; 细胞成像
谷胱甘肽、 半胱氨酸和高半胱氨酸都属于内源性生物巯基, 能够维持细胞内的氧化还原平衡[1,2]. 其中, 谷胱甘肽是细胞内含量最丰富(0.5~10 mmol/L) 的一类巯基化合物, 它是由谷氨酸、 甘氨酸以及半胱氨酸组成的三肽[3], 对过氧化氢等氧自由基、 汞和铅等重金属有解毒作用[4]. 细胞内的半胱氨酸浓度为50~200 μmol/L, 浓度远低于谷胱甘肽[5,6]. 细胞内的高半胱氨酸含量约为5~15 μmol/L, 它是半胱甘酸的前体, 经过甲硫氨酸和丝氨酸合成胱硫醚中间体, 进而转变成半胱氨酸[7]. 研究[8,9]表明, 多种疾病都与细胞内谷胱甘肽含量的异常相关, 如癌症、 心血管疾病和艾滋病等. 因此, 定量检测细胞内谷胱甘肽对疾病的诊断及治疗具有重要的意义. 与其它方法相比, 荧光分析法具有操作简便、 灵敏度高及能够可视化观察等优点, 能将微观上分子识别过程转化为宏观上荧光信号的变化, 从而实现对靶标的检测[10]. 近年来, 已有大量用于检测生物巯基的荧光探针被研究报道[11~14].
本文以2,4-二硝基苯磺酸酯(DNBS)为受体, 三氰基二氢呋喃(DCDHF) 为荧光团[15,16], 合成了1种新型的可用于检测细胞内含量最多的生物巯基谷胱甘肽的荧光探针(4). 其中, 2,4-二硝基苯磺酸酯是经典的受体, 它能够快速识别生物硫醇. 近年来, 大量文献[17~19]报道了以DNBS为受体的生物巯基探针. 与这些探针相比, 探针4具有合成简便、 能够实现裸眼检测的优点, 并且能够对细胞内的谷胱甘肽进行检测. 由于探针4受体部分的硝基具有吸电子作用, 致使磺酸酯基的硫原子带部分正电荷, 在亲核试剂的进攻下磺酸酯键更容易断裂. 因此, 当谷胱甘肽中的巯基亲核进攻硫原子时, 经分子内重排、 硫氧键断裂, 生成游离的酚羟基, 使荧光团供电子端电子云密度增加, 整个荧光分子推拉电子体系增强, 进而导致荧光增强(图S1, 见本文支持信息). 探针4的结构经元素分析、 质谱和核磁共振谱确认. 利用该探针在MCF-7人乳腺癌细胞中实现了对细胞内谷胱甘肽的成像.
1 实验部分
1.1 试剂与仪器
所用试剂均为分析纯; 乙腈和四氢呋喃经过重蒸处理; 氨基酸购自上海Sigma-Aldrich贸易有限公司; 200~300目硅胶购自青岛海洋化工厂产品.
WRS-1B型熔点仪(上海仪电科学仪器股份有限公司); Vario EL型元素分析仪(德国Elementar公司); Avance 400 MHz型核磁共振仪[四甲基硅烷(TMS) 为内标, Bruker公司]; 5989A型质谱仪(HP公司); Cary 100型紫外-可见光谱仪(Varian公司); Cary Eclipse荧光光谱仪(Varian公司); Leica SP8型激光共聚焦显微镜(德国Leica公司); Hera cell CO2细胞培养箱(Thermo Scientific公司); Multiskan Spectrum酶标仪(Thermo Scientific 公司).
1.2 实验过程
1.2.1 探针4的合成 目标化合物(探针4)的合成路线和结构如Scheme 1所示.

Scheme 1 Synthetic routes of probe 4
参照文献[20]方法, 由3-羟基-3-甲基-2-丁酮与丙二睛合成中间体2, 得到淡黄色晶体, 产率79%, m. p. 199.0~200.3 ℃(文献值[21]: 202~203 ℃). 向50 mL反应瓶中加入50 mg(0.25 mmol) 化合物2、 20 mL无水乙腈和100 μL哌啶, 待原料完全溶解后, 加入33 mg(0.27 mmol) 对羟基苯甲醛, 加热回流3 h, 用薄层色谱(TLC) 跟踪至反应结束. 减压蒸馏除去溶剂, 残余物用硅胶柱层析纯化[V(DCM)∶V(MeOH) = 50∶1], 得到45 mg化合物3.
目标化合物(探针4)的合成: 向25 mL反应瓶中加入20 mg(0.070mmol) 化合物3、 10 mL无水四氢呋喃和100 μL吡啶, 将混合溶液在冰浴下冷却至0 ℃, 搅拌10 min后, 加入27 mg(0.100 mmol) 2,4-二硝基苯磺酰氯的四氢呋喃(0.5 mL) 溶液, 在冰浴下反应30 min后逐渐升温到室温, 继续反应3 h. 用TLC跟踪至反应结束. 减压蒸馏除去溶剂, 残余物用硅胶柱层析纯化[V(DCM)∶V(PE)=12∶1], 得到25 mg淡黄色粉末4.
1.2.2 化合物的表征 化合物3和4的理化性质和高分辨质谱数据列于表1. 核磁共振数据列于表2.

Table 1 Appearance, melting points, yields, HRMS and elemental analysis data of compounds 3 and 4

Table 2 1H NMR and 13C NMR data of compounds 3 and 4
1.2.3 光谱分析 室温下, 用DMSO配制浓度为1×10-3mol/L的探针4标准储备液. 测试时, 用pH=7.4的4-羟乙基哌嗪乙磺酸(HEPES)缓冲液(0.1 mol/L)稀释至所需浓度, 控制DMSO的含量为1%. 探针4的浓度为10 μmol/L, 定量加入谷胱甘肽及其它氨基酸, 分别测定紫外-可见吸收光谱及荧光光谱.
1.2.4 细胞培养及染色 采用RPMI-1640培养基培养MCF-7细胞; 细胞染色后用激光共聚焦显微镜进行成像.
2 结果与讨论
2.1 探针4与谷胱甘肽反应前后的光谱变化
研究了探针4与谷胱甘肽反应前后紫外-可见光谱及荧光光谱的变化情况. 如图1所示, 探针4的最大吸收波长位于394 nm处, 与谷胱甘肽反应后, 最大吸收红移并且出现2个吸收峰, 这是由于荧光团3在pH=7.4时存在羟基和氧负离子形式(见化合物3的pH滴定曲线, 图S2, 见本文支持信息). 探针4反应前后最大吸收波长红移达到170 nm, 溶液由淡黄色变为粉红色[图1(A)插图], 可对谷胱甘肽进行“裸眼”检测. 由荧光光谱图[图1(B)]可见, 探针4与谷胱甘肽反应后, 608 nm处的荧光显著增强, 最大增强倍数达7倍.

Fig.1 UV-Vis absorption(A) and fluorescence spectra(B) of probe 4(10 μmol/L) before(a) and after(b) reaction with glutathione(200 μmol/L) in HEPES buffer(0.1 mol/L, pH=7.4, 1% DMSO)Inset of (A): color changes of solution before(a) and after(b) reaction.
2.2 探针4与不同浓度谷胱甘肽反应的紫外-可见光谱响应
由于探针4与谷胱甘肽反应后紫外吸收发生红移, 溶液颜色发生变化, 因此可以通过紫外-可见吸收光谱的变化定量检测谷胱甘肽. 如图2所示, 随着谷胱甘肽浓度的升高, 568 nm处的紫外吸收逐渐增强, 而394 nm处的紫外吸收逐渐下降, 探针溶液颜色最终由淡黄色变为粉红色. 在谷胱甘肽浓度为1.6×10-5~2×10-4mol/L范围内, 568和394 nm处吸收强度的比值与浓度呈现良好的线性关系, 计算得到探针4检出限为8.9×10-7mol/L[22].
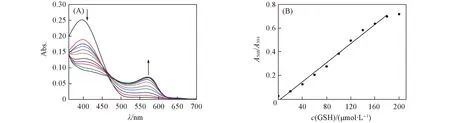
Fig.2 UV-Vis absorption spectra of probe 4(10 μmol/L) with different concentrations of GSH(A) and the linear relationship of A568/A394 vs. the concentrations of GSH over 0—200 μmol/L(B)c(GSH)/(μmol·L-1): 0, 20, 40, 60, 80, 100, 120, 140, 160, 180, 200.
2.3 探针4与谷胱甘肽反应的时间动力学曲线
图3示出了探针4与谷胱甘肽反应过程中紫外-可见吸收及荧光光谱的变化. 可见, 向探针4的HEPES缓冲液中加入200 μmol/L的谷胱甘肽后, 在0~15 min内, 探针4在394 nm处的紫外吸收强度逐渐下降, 在568 nm处的紫外吸收强度逐渐上升, 并且在455 nm处出现等吸收点, 15 min之后基本达到平衡. 由图3(B)可见, 探针4与谷胱甘肽反应过程中, 608 nm处的荧光逐渐增强, 15 min后荧光基本保持恒定.
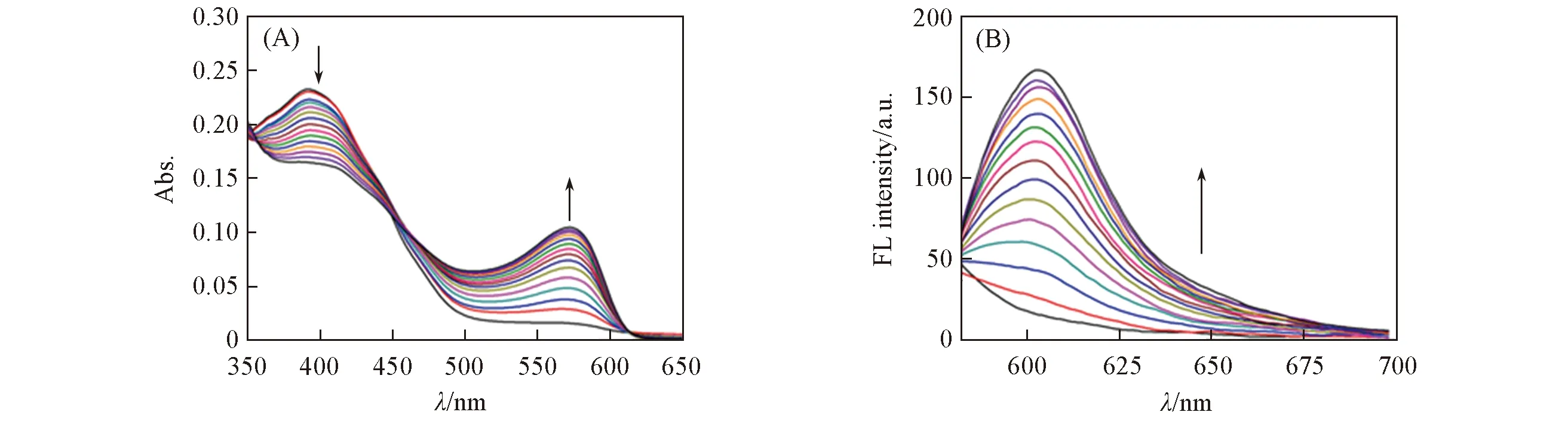
Fig.3 UV-Vis absorption(A) and fluorescence spectra(B) changes of probe 4(10 μmol/L) toglutathione(200 μmol/L) in 15 min
2.4 探针4的选择性
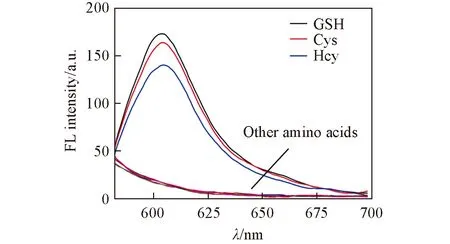
Fig.4 Fluorescence emission changes of probe 4(10 μmol/L) in HEPES upon addition of different amino acids(200 μmol/L)
图4示出了探针4对不同氨基酸的荧光响应. 除了谷胱甘肽之外, 探针4对半胱氨酸和高半胱氨酸均有类似的响应, 对其它氨基酸如组氨酸、 丝氨酸、 蛋氨酸、 谷氨酸和苏氨酸等则没有响应. 但是, 由于细胞内谷胱甘肽含量为0.5~10 mmol/L, 半胱氨酸的含量在50~200 μmol/L, 高半胱氨酸的含量为5~15 μmol/L, 浓度相差较大[5,6]. 因此, 该探针能够应用于细胞内谷胱甘肽的成像.
2.5 探针4的细胞成像
采用共聚焦显微镜考察了探针4对活细胞内谷胱甘肽的检测性能. 如图5所示, 向MCF-7细胞内加入50 μmol/L探针并培养30 min后, MCF-7细胞内出现了明亮的红色荧光[图5(D)], 而未经探针4处理的细胞内则无任何荧光信号[图5(B)]. 此结果表明, 探针4能够进入MCF-7细胞; 并且在细胞内谷胱甘肽的作用下, 探针4分子的硫氧键被切断, 从而释放出荧光团3, 发出红色荧光, 30 min后荧光即趋于稳定, 表明该探针在谷胱甘肽的作用下反应迅速. 由此可见, 探针4具有检测活细胞内谷胱甘肽的潜力.

Fig.5 Bright-field(A, C) and fluorescence(B, D) images of MCF-7 cells(A, B) and MCF-7 cellsincubated with 50 μmol/L probe 4 for 30 min(C, D)
3 结 论
设计合成了用于检测细胞内谷胱甘肽的比率型荧光探针4. 在HEPES缓冲液(0.1 mol/L, pH=7.4, 1%DMSO) 中, 探针4能够较灵敏地检测谷胱甘肽. 在与谷胱甘肽反应后, 探针4在394 nm处的吸收峰消失, 在450和570 nm处出现新的吸收峰, 溶液颜色由淡黄色变为红色, 从而实现“裸眼”检测谷胱甘肽, 其检出限达到8.9×10-7mol/L. 此外, 探针4可用于MCF-7细胞内谷胱甘肽的荧光成像.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20150725.
[1] Wood Z. A., Schröder E., Robin H. J., Poole L. B.,TrendsBiochem.Sci., 2003, 28(1), 32—40
[2] Pastore A., Piemonte F., Locatelli M., Lo R. A., Gaeta L. M., Tozzi G., Federici G.,Clin.Chem., 2001, 47(8), 1467—1469
[3] Wu G., Fang Y. Z., Yang S., Lupton J. R., Turner N. D.,J.Nutr., 2004, 134(3), 489—492
[4] Dalton T. P., Shertzer H. G., Puga A.,Annu.Rev.Pharmacol., 1999, 39(1), 67—101
[5] Stipanuk H. M., Dominy E. J., Lee J. I., Coloso M. R.,J.Nutr., 2006, 136(6), 1652—1659
[6] Wu G. Y., Fang Y. Z., Yang S., Lupton R. J., Turner D. N.,RecentAdv.Nutr.Sci., 2003, 134(3), 489—492
[7] Carmel, R., Jocobsen D. W.,HomocysteineinHealthandDisease, Cambridge University Press, Cambridge, 2001, 12—18
[8] Townsend D. M., Tew K. D., Tapiero H.,Biomed.Pharmacother., 2003, 57(34), 145—155
[9] Estrela J. M., Ortega A., Obrador E.,Crit.Rev.Clin.Lab.Sci., 2006, 43(2), 143—181
[10] Li H. L., Fan J. L., Liu X. J., Sun S. G., Peng X. J.,Chem.J.ChineseUniversities, 2010, 31(9), 1725—1728(李宏林, 樊江莉, 刘晓键, 孙世国, 彭孝军. 高等学校化学学报, 2010, 31(9), 1725—1728)
[11] Wang P., Liu J., Lv X., Liu Y., Zhao Y., Guo W.,Org.Lett., 2012, 14(2), 520—523
[12] Guo Z., Nam S., Park S., Yoon J.,Chem.Sci., 2012, 3(9), 2760—2765
[13] Yang X. F., Huang Q., Zhong Y., Li Z., Li H., Lowry M., Escobedo J. O., Strongin R. M.,Chem.Sci., 2014, 5(6), 2177—2183
[14] Hou J. T., Yang J., Li K., Yu K. K., Yu, X. Q.,SensorsActuatorsB, 2015, 214, 92—100
[15] Samuel J. L., Nicholas R. C., Hsiao-lu D. L., Reichel S., Na L., Robert J. T., Moerner W. E.,J.Am.Chem.Soc., 2008, 130, 9204—9205
[16] Marissa K. L., Jarrod W., Robert J. T., Jiang H. R., Moerner W. E.,Chem.Sci., 2013, 4, 220—225
[17] Li M., Wu X., Wang Y., Li Y., Zhu W. H., James T. D.,Chem.Commun., 2014, 50(14) 1751—1753
[18] Wang S. P., Deng W. J., Sun D., Yan M., Zheng H., Xu J. G.,Org.Biomol.Chem., 2009, 7, 4017—4020
[19] Ji S. M., Guo H. M., Yuan X. L., Li X. H., Ding H. D., Gao P., Zhao C. X., Wu W. T., Wu W. H., Zhao J. Z.,Org.Lett., 2010, 12(12), 2876—2879
[20] Tao Z., Kun P. G., Ling Q., Yu Q. S.,Synth.Commun., 2006, 36(10), 1367—1372
[21] Avetisyan A. A., Alvandzhyan A. G., Avetisyan K. S.,Russ.J.Org.Chem., 2009, 45(12), 1871—1872
[22] Huang C. S., Jia T., Yu C. J., Zhang A. M., Jia N. Q.,Biosens.Bioelectron., 2015, 63, 513—518
(Ed.: N, K )
Ratiometric Fluorescent Probe for the Detection of Glutathione in Living Cells†
YANG Runjie, TANG Yao, ZHU Weiping*
(ShanghaiKeyLabofChemicalBiology,SchoolofPharmacy,EastChinaUniversityofScienceandTechnology,Shanghai200237,China)
A fluorescent probe(4) for the detection of biothiols was designed and synthesized and its properties for labeling glutathione was investigated. After reaction with glutathione in 2-[4-(2-hydroxyethyl)-1-piperazinyl]ethanesulfonic acid(HEPES) buffer, the color of solution changed from light yellow to pink, which could be detected by naked eyes. Meanwhile, the fluorescence was enhanced at 608 nm. Probe 4 was useful for measuring glutathione at concentrations ranging from 1.6×10-5to 2×10-4mol/L with a detection limit of 8.9×10-7mol/L. Besides, probe 4 was sensitive to glutathione in MCF-7 cells, which emitted red fluorescence when it was incubated with MCF-7 cells.
Fluorescent probe; Glutathione; Intracellular imaging
10.7503/cjcu20150725
2015-09-17.
日期: 2016-03-10.
国家自然科学基金(批准号: 21476077)资助.
O657; O625.75
A
联系人简介: 朱维平, 男, 博士, 教授, 主要从事荧光探针及其应用研究. E-mail: wpzhu@ecust.edu.cn
† Supported by the National Natural Science Foundation of China(No.21476077).

