酵母培养物、枯草芽孢杆菌和木瓜蛋白酶对保育猪生长性能、营养物质表观消化率和粪便微生物数量的影响
张 丽 丁宏标
(中国农业科学院饲料研究所,北京100081)
酵母培养物、枯草芽孢杆菌和木瓜蛋白酶对保育猪生长性能、营养物质表观消化率和粪便微生物数量的影响
张 丽 丁宏标*
(中国农业科学院饲料研究所,北京100081)
为了探究从神曲(MMF)和酸面团中分离到的酿酒酵母的作用,本试验研究了新型的复合酵母培养物(YC)、枯草芽孢杆菌(BSK)、木瓜蛋白酶(PE)对保育猪生长性能、营养物质表观消化率和粪便微生物数量的影响。选择平均体重为(15.70±0.26) kg的断奶仔猪225头,随机分为5组,每组3个重复,每个重复15头猪。对照(CT)组饲喂基础饲粮,YC组饲喂基础饲粮+5 g/kg YC,BSK组饲喂基础饲粮+2×1011CFU/kg BSK,PE组饲喂基础饲粮+0.3 g/kg PE,复合(YP)组饲喂基础饲粮+5 g/kg YC+0.3 g/kg PE。预试期5 d,正试期30 d。结果表明:1)YP组末重、平均日增重显著高于CT组(P<0.05),料重显著低于CT组(P<0.05);YC组末重高于CT、BSK、PE组(P>0.05)。各组间平均日采食量无显著差异(P>0.05)。YC、PE和YP组的腹泻率均显著低于CT和BSK组(P<0.05)。2)YC、BSK、PE、YP组总能和干物质的表观消化率显著高于CT组(P<0.05),YC组粗蛋白质、磷的表观消化率显著低于YP组(P<0.05),YC组酸性洗涤纤维、钙的表观消化率显著低于其他各组(P<0.05)。各组间有机物和粗脂肪的表观消化率无显著差异(P>0.05)。3)YC、YP组粪便乳酸菌数量和乳酸菌/大肠杆菌显著高于其他各组(P<0.05),粪便大肠杆菌数量显著低于其他组(P<0.05)。由此可知,新型YC可以改善仔猪生长性能和肠道生态环境,YC和PE的联用对仔猪生长也有积极作用。
神曲;酸面团;酵母培养物;枯草芽孢杆菌;木瓜蛋白酶;保育猪
酵母培养物(yeast culture,YC)是目前已被广泛应用的抗生素替代品之一,其含有丰富的酶、维生素、蛋白质、有机酸、糖类等营养物质。许多研究表明,饲粮添加YC有助于提高反刍动物和断奶仔猪的生长性能、免疫机能,并减少致病菌数量,维持肠道健康[1-2]。但也有研究报道饲粮添加YC的作用效果不显著,对动物生长性能没有显著影响[3]。在YC的研制过程中,产品质量的优劣主要是由菌种性能的好坏决定的[4]。如今,市面上可用于YC制作的酵母菌种很多,由于不同种属间菌种性能差异巨大,同种属不同菌株间也存在较大差异,其对瘤胃发酵和动物机体产生不同效应[5]。因此,优良的酵母菌株是YC研究与应用的基础。神曲(massa medicata fermentata,MMF)和酸面团都是中国传统自然发酵而成的曲剂,与现代YC有相同之处,但含有复杂的微生物群,其中包括制备YC的基础菌种——酿酒酵母。所以将自然发酵得到的菌种应用到现代YC制备上,可能会为后期微生态制剂开拓新的道路。
枯草芽孢杆菌(Bacillussubtilis,BSK)是较理想的国家允许普遍使用的饲料微生物添加剂,其本身耐干燥、高温、高压,抗逆性强,自身能分泌活性较强的脂肪酶、蛋白酶、淀粉酶、果胶酶、纤维素酶等,这些酶能与动物体内消化酶一同发挥作用,降解植物性饲料中的木聚糖、果胶、纤维素等一些复杂碳水化合物,还可降解某些抗营养因子,提高饲料营养物质利用率,进而改善动物生长性能[6]。众多研究证实,BSK能提高断奶仔猪免疫力,改善肠黏膜形态结构,调节肠道微生物平衡,进而促进仔猪生长发育[7-8]。木瓜蛋白酶(papain,PE)是最早被发现、研究和得以广泛应用的植物性蛋白酶,其具有提高营养物质尤其是蛋白质的消化率[9]、降解饲料中抗营养因子(大豆蛋白抗原等)、增强动物机体免疫力的作用。
在兴起的微生态制剂研究领域,人们重视作用机理的研究和作用效果的对比,但对菌株的选择和性能比较未做过多的研究。BSK是一种应用广泛、性能优良的微生态制剂,PE是一种极好的水解蛋白质的植物性酶制剂。YC、BSK和PE均在断奶仔猪早期阶段应用较多,而对生长阶段保育猪的研究报道较少。因此,本文希望通过本实验室研制的新型YC,对比BSK和PE来饲喂生长阶段保育猪,测定饲粮中添加这些有益制剂对保育猪生长性能、营养物质表观消化率和粪便微生物数量的影响,为探索新的微生态制剂提供理论依据。
1 材料与方法
1.1 试验动物与分组
采用单因素随机区组设计,选择健康、平均体重为(15.70±0.26) kg的“杜×长×大”杂交生长猪225头,按体重、性别基本一致的原则随机分为5组,每组3个重复,每个重复15头猪。对照(CT)组饲喂基础饲粮,YC组饲喂基础饲粮+5 g/kg YC,BSK组饲喂基础饲粮+2×1011CFU/kg BSK,PE组饲喂基础饲粮+0.3 g/kg PE,复合(YP)组饲喂基础饲粮+5 g/kg YC+0.3 g/kg PE。试验预试期5 d,正试期30 d。
1.2 试验饲粮与饲养管理
试验采用的基础饲粮为参照NRC(1998)配制的粉状饲粮,饲粮的常规原料根据猪场实际情况而定,其组成及营养水平见表1。试验猪舍为封闭、半漏缝地板式。试验猪按猪场常规程序进行免疫、驱虫、消毒和管理等,自由采食和饮水。

表1 基础饲粮组成及营养水平(风干基础)
1)预混料为每千克饲粮提供 The premix provided the following per kg of the diet:VA 2 000 IU,VD 3 750 IU,VE 175 mg,VB120 mg,VB275 mg,VB625 mg,烟酰胺 nicotilamide 225 mg,泛酸钙 calcium pantothenate 100 mg,叶酸 folic acid 10 mg,氯化胆碱 choline chloride 3 g,Cu 625 mg,Fe 625 mg,Zn 375 mg,Mn 357 mg,I 4 mg,Se 0.6 mg,食盐 NaCl 12 g。
2)实测值 Measured values。
1.3 试验材料
YC:由本实验室研制,为复合型YC,由2株不同品种酿酒酵母发酵所制。BSK:由武汉新华扬生物技术有限公司提供,含活菌数5×1010CFU/g。PE:活力为600 000 U/g,由广西科学院生物研究所提供。
1.4 测定指标
1.4.1 生长性能
以重复为单位,分别于试验始末早饲前空腹称重,获得平均始重和平均末重,用以计算平均日增重(ADG)。试验期间每天以重复为单位记录饲粮投喂量,每周统计剩料量,记录饲粮消耗量,根据饲粮投喂量和剩料量计算平均日采食量(ADFI)。然后根据ADG和ADFI计算料重比(F/G)。
ADG=(平均末重-平均始重)/试验天数;
ADFI=各栏总耗料量/各栏累计饲养天数;
F/G=ADFI/ADG。
1.4.2 腹泻率
以重复为单位,试验期间每天观察并记录猪腹泻情况,于试验结束后计算腹泻率。
腹泻率(%)=(腹泻猪只总数/
饲养天数)×100。
1.4.3 粪便微生物数量
于试验第35天,每个重复随机选取2头猪采集新鲜粪样,-20 ℃保存,用于测定大肠杆菌和乳酸菌数量。大肠杆菌采用麦康凯培养基,37 ℃培养24 h。乳酸菌采用乳酸菌培养基(MRS),37 ℃培养36 h。微生物数量以每克粪便中所含菌群总数的对数[lg(CFU/g)]表示。
1.4.4 营养物质表观消化率
试验结束前3 d,每天上午和下午从各重复中收集200 g左右未被污染的粪样,置于-20 ℃冰箱冷冻保存。采用4 mol/L盐酸不溶灰分(AIA)作为内源指示剂开展消化试验,测定饲料和粪样中干物质(DM)、总能(GE)、粗蛋白质(CP)、粗脂肪(EE)、中性洗涤纤维(NDF)、有机物(OM)、钙(Ca)、磷(P)、AIA的含量。营养物质表观消化率计算公式如下:
营养物质表观消化率(%)=[1-(饲料中AIA的
含量/粪便中AIA的含量)×(粪便中
营养物质的含量/饲料中营养物质的
含量)]×100。
1.5 数据处理
采用SPSS 19.0软件进行单因素方差分析(one-way ANOVA),以Duncan氏法进行多重比较,P<0.05为差异显著。
2 结果与分析
2.1 YC、BSK和PE对保育猪生长性能的影响
由表2可知,YP组末重、ADG显著高于CT组(P<0.05),F/G显著低于CT组(P<0.05),而YC组末重、ADG均高于CT、BSK、PE组(P>0.05),这些有益制剂相对于CT组均有提高动物生长性能的趋势。各组间ADFI无显著差异(P>0.05),但YP组最高,其次是YC组,两者比CT组分别提高了2.36%和1.74%。YC、PE及YP组的腹泻率均显著低于CT和BSK组(P<0.05),但是YC、PE、YP组间没有显著差异(P>0.05)。
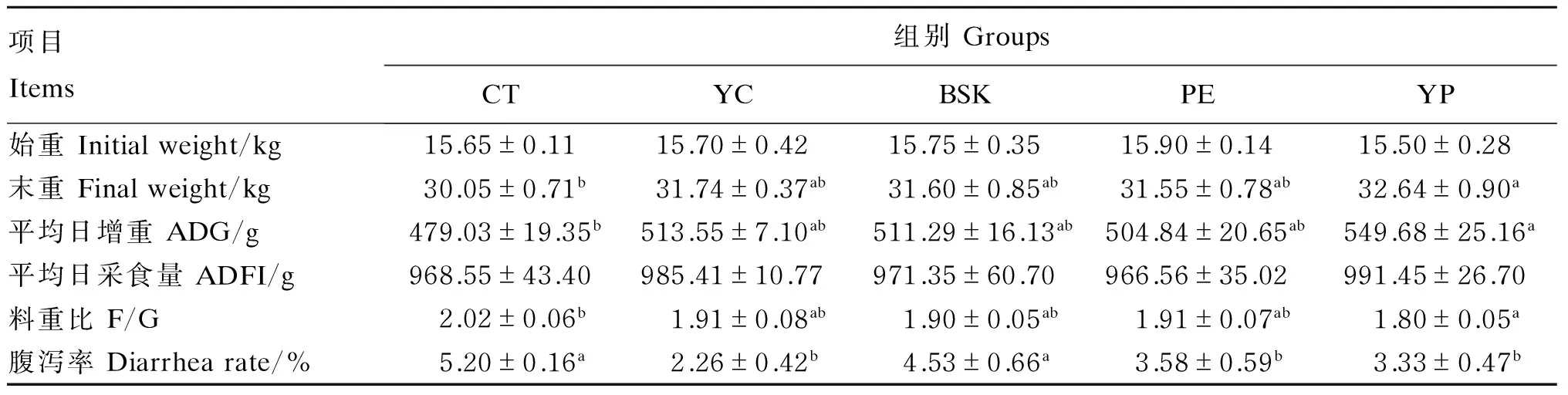
表2 YC、BSK和PE对保育猪生长性能的影响
同行数据肩标不同小写字母表示差异显著(P<0.05),相同或无字母表示差异不显著(P>0.05)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
2.2 YC、BSK和PE对保育猪营养物质表观消化率的影响
由表3可知,YC、BSK、PE、YP组GE和DM的表观消化率均显著高于CT组(P<0.05),而YC、BSK、PE、YP组之间无显著差异(P>0.05)。YC组CP、P的表观消化率显著低于YP组(P<0.05),与其他组间无显著差异(P>0.05)。各组间OM和EE的表观消化率无显著差异(P>0.05)。YC组NDF、Ca的表观消化率最低,显著低于其他各组(P<0.05)。
2.3 YC、BSK和PE对保育猪粪便微生物数量的影响
YC、YP组粪便乳酸菌数量显著高于其他各组(P<0.05),BSK组粪便乳酸菌数量最低。YC、YP组粪便乳酸乳酸菌/大肠杆菌显著高于其他各组(P<0.05),粪便大肠杆菌数量显著低于其他组(P<0.05),而其他组间无显著差异(P>0.05)。
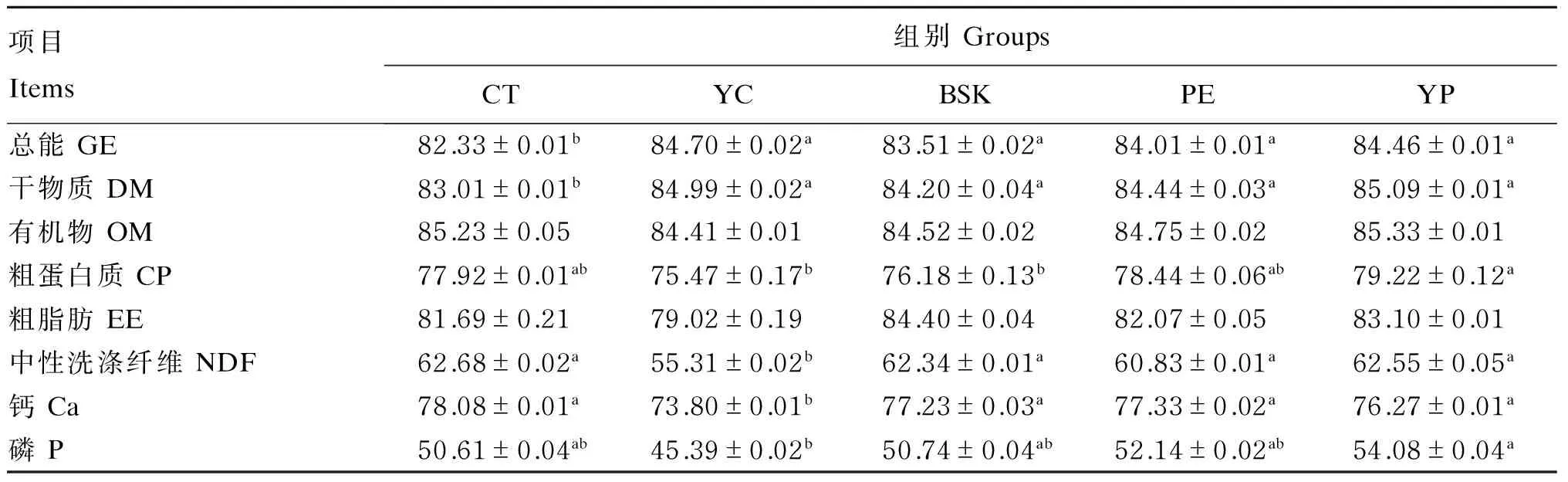
表3 YC、BSK和PE对保育猪营养物质表观消化率的影响

表4 YC、BSK和PE对保育猪粪便微生物数量的影响
3 讨 论
3.1 YC、BSK和PE对保育猪生长性能的影响
YC含有丰富的营养物质以及促生长因子,许多研究已证实YC可以提高断奶仔猪的生长性能。如Mathew等[10]、Bontempo等[11]均研究表明,饲粮添加YC有助于提高断奶仔猪的ADG和ADFI。近年来,科学家利用营养物质组学原理研发了新型复合YC,其主要含5种活性物质即葡聚糖、甘露聚糖、多肽、有机酸和氨基酸等,不同的活性物质有着不同的作用效果[12]。李桉等[13]研究证明了复合YC可显著提高奶牛生长性能。本试验结果表明,与CT组相比,YC组ADG及ADFI没有显著变化,分别提高了7.20%和1.74%,但YC组显著减少了仔猪的腹泻率。这与Van Der Peet-schwering等[14]研究结果相一致。原因可能是当时环境、饲粮等对仔猪的免疫机能造成影响而导致的。Van Heugten等[15]研究解释了动物在高疾病应激下,YC可能会通过触发肠道免疫应答与免疫系统的相互作用,从而使吸收的能量向免疫功能方向流动,而非生长方向。
BSK进入机体胃肠道后,可代谢产生大量的消化酶及营养物质,供宿主消化利用,进而提高生长性能。Alexopoulos等[16]研究表明,饲粮添加BSK可改善仔猪生长性能。本试验结果显示,BSK组ADG、ADFI以及F/G与CT组无显著差异,但有提高的趋势,腹泻率与CT组无显著差异。出现这种不显著的情况,可能是因为添加的剂量过高导致,正如Hu等[17]研究结果显示,仔猪饲粮中添加不同水平的BSK,其中2×1010CFU/kg组ADG、ADFI以及腹泻率均优于其他组。
酶制剂主要通过消化营养物质来提高生长性能。刘景环等[18]研究表明,在体重11 kg左右仔猪饲粮中添加PE后,对仔猪的生长有促进作用,但差异不显著。宾石玉等[19]研究PE对45和75日龄生长猪生长性能的影响,结果表明45日龄组试验猪的ADG和饲料转化率分别提高了29.60%和12.54%,75日龄组试验猪的ADG和饲料转化率分别提高了4.10%和6.05%,表示PE对10~20 kg生长猪的促生长效果显著。随着仔猪日龄增长,酶制剂的作用效果越来越不明显,这是由于仔猪的生长,消化器官相对成熟,对外源酶依赖性减弱[20]。本试验结果显示,PE组对猪生长性能的促进效果最低,仅ADG比CT组提高了5.11%。本试验结果与前人研究结果不同可能是由于酶的添加剂量、仔猪品种以及饲养环境不同。本试验结果表明,与CT组相比,YP组猪末重和ADG显著提高,F/G也显著降低,效果要优于其他组。林谦[21]在益生菌与酶制剂对黄羽肉鸡生长性能影响的协同机理研究结果中表示,饲粮中组合添加益生菌与酶制剂可获得最高的全期ADG,但全期ADFI和F/G没有显著差异,仅在数值上有优化趋势。本试验结果还显示出PE和YP组的仔猪腹泻率均显著低于CT组,可能是由于YC的免疫作用,也可能是由于PE对饲粮中蛋白质的充分消化利用及对豆粕中大豆抗原蛋白的降解。Li等[22]研究表明,大豆抗原能引起仔猪过敏性腹泻,使其肠道损伤,导致肠道吸收功能障碍,进而使仔猪的生长性能下降。而Kawai等[23]、Shutov等[24]等都表明PE可有效降解大豆抗原蛋白。
3.2 YC、BSK和PE对保育猪营养物质表观消化率的影响
神曲是一种传统中药,用于提高人或动物的胃肠道消化能力,而酸面团被用于制作传统的酒酿、黄酒和米饼。有研究表明制作神曲和酸面团的发酵因子为酵母菌[25-26]。Pinloche等[27]研究表明在生长猪饲粮中添加YC,能刺激其后肠的发酵,使挥发性脂肪酸产量和细菌发酵终产物增加,从而提高猪的营养物质表观利用率。Shen等[28]研究表明,在断奶仔猪饲粮中添加5 g/kg的YC可显著提高断奶仔猪CP、DM、GE的表观消化率。本试验研究结果表明,YC组GE和DM的表观消化率显著高于CT组,OM、CP、EE以及P的表观消化率低于CT组,而NDF和Ca的表观消化率则显著低于CT组。这与前人研究结果有相同之处,亦有不一致的效果,这也可能是由于菌剂、饲粮、品种等不同造成的。BSK能分泌活性较强的脂肪酶、蛋白酶、淀粉酶、纤维素酶等,有利于饲料中营养物质的消化。PE是一种分解蛋白质很好的酶,可以增强动物体内蛋白酶的活性,促进蛋白质的消化吸收。本试验结果显示,BSK和PE组GE和DM的表观消化率显著高于CT组,其他营养物质的表观消化利用略高于YC组,但是仍与CT组无显著差异。Noh等[29]研究表明,饲粮中添加5%的BSK可显著提高DM、GE和粗灰分的表观消化率。Xuan等[30]研究表明,在断奶仔猪饲粮中添加复合酶制剂所有营养物质的表观消化率数值上高于CT组,且P的表观消化率显著提高。本试验与前人研究有一定差异,可能是由于过多的益生菌数产生了过量酶,抑制了机体内源性脂肪酶、磷代谢酶的活性和分泌等,从而整体上降低了对这些营养物质的分解作用[31]。YC和PE联合使用对营养物质的表观消化率在本试验中虽然无显著差异,但比其他组在数值上要高。
3.3 YC、BSK和PE对保育猪粪便微生物数量的影响
微生态制剂的主要目的是向动物机体植入外源益生菌或改善其内源菌群,从而达到促生长的效果。解洛香等[32]研究表明,在体外添加5%或10%的YC能极显著促进嗜酸乳杆菌、植物乳杆菌和双歧杆菌3种肠道有益菌体外增殖。本试验结果显示,与CT组相比,YC和YP组能显著减少仔猪肠道大肠杆菌数量和增加乳酸菌数量,且酸乳酸菌/大肠杆菌也显著降低,这与Upadrasta等[33]研究结果一致。其原因可能与饲粮引起的应激有关,YC中酵母多糖抑制有害菌对肠道定植,且其中含的营养物质为肠道有益菌繁殖提供强大的动力,从而改善胃肠道环境[34]。但是YC组生长性能未见显著提高,这也验证了Scheuermann等[35]的研究结论,即活菌制剂对肠道微生物菌群平衡的改善作用不一定能反映在生长性能上。
而本试验PE组乳酸菌和大肠杆菌的数量均有所下降,酸乳酸菌/大肠杆菌没有差异变化,说明PE对肠道菌群没有显著影响。PE本属于蛋白酶,可能其主要作用是对蛋白质的消化利用。尹君[36]研究表明,饲粮中添加0.03%非淀粉多糖复合酶显著抑制肠道中大肠杆菌的生长。可能酶制剂不同,其作用效果亦不同,这还与试验动物品种有关,因为不同试验动物其肠道微生物数量差异很大。芽孢杆菌作为畜禽的微生物饲料添加剂,其主要是通过调节动物自身微生物平衡而发挥其生理作用的。苏勇等[37]研究表明,与CT组相比,芽孢乳杆菌S1能提高断奶后仔猪空肠和结肠食糜中乳酸菌/大肠杆菌。陈惠等[38]也研究表明,在生长育肥猪饲粮中添加芽孢杆菌,肠道中双歧杆菌、乳酸杆菌的数量均较CT组显著增加,而大肠杆菌数量显著减少。本试验结果中BSK组肠道大肠杆菌数量及乳酸菌/大肠杆菌均与CT组无显著差异,但显著降低了乳酸菌的数量,这也说明了肠道有益菌数量与腹泻率存在联系。BSK降低乳酸菌数量可能与添加剂量有关,但需通过对肠道内微生物数量进一步分析来验证这一结论。
4 结 论
新型YC可以改善仔猪生长性能和肠道生态环境,YC和PE的联用对仔猪生长也有积极作用。
[1] HARRIS B,Jr,WEBB D W.The effect of feeding a concentrated yeast culture product to lactating dairy cows[J].Journal of Dairy Science,1990,73(Suppl.1):266.
[2] TRCKOVA M,FALDYNA M,ALEXA P,et al.The effects of live yeastSaccharomycescerevisiaeon postweaning diarrhea,immune response,and growth performance in weaned piglets[J].Journal of Animal Science,2014,92(2):767-774.
[3] MARTIN S A,NISBET D J.Effect of direct-fed microbials on rumen microbial fermentation[J].Journal of Dairy Science,1992,75(6):1736-1744.
[4] CHAUCHEYRAS-DURAND F,WALKER N D,BACH A.Effects of active dry yeasts on the rumen microbial ecosystem:past,present and future[J].Animal Feed Science and Technology,2008,145(1/2/3/4):5-26.
[5] NEWBOLD C J,WALLACE R J,CHEN X B,et al.Different strains ofSaccharomycescerevisiaediffer in their effects on ruminal bacterial numbersinvitroand in sheep[J].Journal of Animal Science,1995,73(6):1811-1818.

[7] LEE S H,INGALE S L,KIM J S,et al.Effects of dietary supplementation withBacillussubtilisLS 1-2 fermentation biomass on growth performance,nutrient digestibility,cecal microbiota and intestinal morphology of weanling pig[J].Animal Feed Science and Technology,2014,188:102-110.
[8] TSUKAHARA T,TSURUTA T,NAKANISHI N,et al.The preventive effect ofBacillussubtilusstrain DB9011 against experimental infection with enterotoxcemicEscherichiacoliin weaning piglets[J].Animal Science Journal,2013,84(4):316-321.
[9] 吕世民,谭艾娟.木瓜蛋白酶对猪血粉蛋白的水解作用[J].贵州农业科学,2001,29(4):6-7.
[10] MATHEW A G,CHATTIN S E,ROBBINS C M,et al.Effects of a direct-fed yeast culture on enteric microbial populations,fermentation acids,and performance of weanling pigs[J].Journal of Animal Science,1998,76(8):2138-2145.
[11] BONTEMPO V,DI GIANCAMILLO A,SAVOINI G,et al.Live yeast dietary supplementation acts upon intestinal morpho-functional aspects and growth in weanling piglets[J].Animal Feed Science and Technology,2006,129(3/4):224-236.
[12] 刘国娟,刘大程,高民,等.复合酵母培养物的营养活性物质组学及其应用技术的研发[J].中国畜牧杂志,2014,50(1):84-88.
[13] 李桉,郭雄全,李亚林.复合酵母培养物对奶牛生产性能的影响[J].中国奶牛,2012(10):27-29.
[14] VAN DER PEET-SCHWERING C M C,JANSMAN A J M,SMIDT H,et al.Effects of yeast culture on performance,gut integrity,and blood cell composition of weanling pigs[J].Journal of Animal Science,2007,85(11):3099-3109.
[15] VAN HEUGTEN E,FUNDERBURKE D W,DORTON K L.Growth performance,nutrient digestibility,and fecal microflora in weanling pigs fed live yeast[J].Journal of Animal Science,2003,81(4):1004-1012.
[16] ALEXOPOULOS C,GEORGOULAKIS I E,TZIVARA A,et al.Field evaluation of the efficacy of a probiotic containingBacilluslicheniformisandBacillussubtilisspores,on the health status and performance of sows and their litters[J].Journal of Animal Physiology and Animal Nutrition,2004,88(11/12):381-392.
[17] HU Y L,DUN Y H,LI S A,et al.Effects ofBacillussubtilisKN-42 on growth performance,diarrhea and faecal bacterial flora of weaned piglets[J].Asian-Australasian Journal of Animal Sciences,2014,27(8):1131-1140.
[18] 刘景环,玉永雄,周群,等.木瓜蛋白酶和苜蓿对断奶仔猪生长性能的影响[J].广东畜牧兽医科技,2010,35(2):25-27.
[19] 宾石玉,盘仕忠.木瓜蛋白酶在生长猪日粮中的应用[J].粮食与饲料工业,1996(7):24-26.
[20] 洪梅毅.饲料中添加酶制剂对仔猪生产性能的影响[J].福建畜牧兽医,2003,25(2):28-29.
[21] 林谦.益生菌与酶制剂对黄羽肉鸡生产性能影响的协同机理研究[D].硕士学位论文.桂林:广西师范大学,2012:20-24.
[22] LI D F,NELSSEN J L,REDDY P G,et al.Transient hypersensitivity to soybean meal in the early-weaned pig[J].Journal of Animal Science,1990,68(6):1790-1799.
[23] KAWAI M,SUZUKI S,ASANO M,et al.Characterization of 30-kDa fragments derived from β-conglycinin degradation process during germination and seedling growth of soybean[J].Bioscience,Biotechnology,and Biochemistry,1997,61(5):794-799.
[24] SHUTOV A D,RUDAKOVA A S,RUDAKOV S V,et al.Degradation of β-conglycinin β-homotrimer by papain:independent occurrence of limited and extensive proteolysis[J].Bioscience,Biotechnology,and Biochemistry,2013,77(10):2082-2086.
[25] MEROTH C B,HAMMES W P,HERTEL C,et al.Identification and population dynamics of yeasts in sourdough fermentation processes by PCR-denaturing gradient gel electrophoresis[J].Applied and Environmental Microbiology,2003,69(12):7453-7461.
[26] HU J,YANG X D,XIA Q P,et al.Research on the microorganism in the traditional Chinese medicine ‘Shenqu’[J].Journal of Mudanjiang Medical College,2004,25(2):19-20.
[27] PINLOCHE E,WILLIAMS M,D'INCA R,et al.Use of a colon simulation technique to assess the effect of live yeast on fermentation parameters and microbiota of the colon of pig[J].Journal of Animal Science,2012,90(Suppl.4):353-355.
[28] SHEN Y B,PIAO X S,KIM S W,et al.Effects of yeast culture supplementation on growth performance,intestinal health,and immune response of nursery pigs[J].Journal of Animal Science,2009,87(8):2614-2624.
[29] NOH H S,INGALE S L,LEE S H,et al.Effects of citrus pulp,fish by-product andBacillussubtilisfermentation biomass on growth performance,nutrient digestibility,and fecal microflora of weanling pigs[J].Journal of Animal Science and Technology,2014,56(1):10.
[30] XUAN Z N,KIM J D,LEE J H,et al.Effects of enzyme complex on growth performance and nutrient digestibility in pigs weaned at 14 days of age[J].Asian-Australasian Journal of Animal Sciences,2001,14(2):231-236.
[31] 华洵璐,钱仁界,张宪中,等.芽孢杆菌复合制剂对断奶仔猪生长、腹泻和饲料消化率的影响[J].安徽农业科学,2015,43(3):166-170.
[32] 解洛香,徐乐,杨倩,等.酵母培养物对3种肠道有益菌体外增殖的影响[J].中国酿造,2012,31(4):82-84.
[33] UPADRASTA A,O’SULLIVAN L,O’SULLIVAN O,et al.The effect of dietary supplementation with spent cider yeast on the swine distal gut microbiome[J].PLoS One,2013,8(10):e75714.
[34] 郭发祥.酵母培养物及其在家禽生产中的应用[J].饲料博览,2011(10):46-48.

[36] 尹君.微生态制剂和酶制剂对异育银鲫生长及消化生理的影响[D].硕士学位论文.南京:南京农业大学,2006.
[37] 苏勇,姚文,黄瑞华,等.芽孢乳杆菌S1对断奶前后仔猪肠道乳酸菌、大肠杆菌和挥发性脂肪酸含量变化的影响[J].福建农林大学学报:自然科学版,2006,35(1):73-76.
[38] 陈惠.芽孢杆菌对生长育肥猪肠道菌群及酶活性的影响[J].四川农业大学学报,1994,12(增刊):550-553,549.
*Corresponding author, professor, E-mail: dinghongbiao@caas.cn
(责任编辑 武海龙)
Effects of Yeast Culture,Bacillussubtilisand Papain on Growth Performance, Nutrient Apparent Digestibility and Fecal Microflora Number of Nursery Piglets
ZHANG Li DING Hongbiao*
(Feed Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100081, China)
For investigating the effect ofSaccharomycescerevisiaeseparated from massa medicata fermentata and sourdough, we studied the effects of newly developed composited yeast culture (YC),Bacillussubtilis(BSK) and papain (PE) on growth performance, nutrient apparent digestibility and fecal microflora number of nursery piglets. A total of 225 weaner piglets with initial body weight of (15.70±0.26) kg were randomly allotted to 5 groups with 3 replicates per group and 15 piglets per replicate. The control (CT) group fed a basal diet, the YC groups fed the basal diet supplemented with 5 g/kg YC, the BSK group fed the basal diet supplemented with 2×1011CFU/kg BSK, the PE group fed the basal diet supplemented with 0.3 g/kg PE, and the complex (YP) group fed the basal diet supplemented with 5 g/kg YC and 0.3 g/kg YP. The pretest period and test period lasted for 5 and 30 days, respectively. The results showed as follows: 1) the final weight and average daily gain (ADG) of YP group were significantly higher than those of CT group (P<0.05), the feed to gain ratio (F/G) of YP group was significantly lower than that of CT group (P<0.05). The final weight of YC group was higher than that of CT, BSK and PE groups (P>0.05). There was no significant difference in average daily feed intake (ADFI) among all groups (P>0.05). The diarrhea rate of YC, PE and YP groups was significantly lower than that of CT and BSK groups (P<0.05). 2) The apparent digestibilities of gross energy (GE) and dry matter (DM) of YC, BSK, PE and YP groups were significantly higher than those of CT group (P<0.05), the apparent digestibilities of crude protein (CP) and phosphorus (P) of YC group were significantly lower than those of YP group (P<0.05), the apparent digestibilities of neutral detergent fiber (NDF) and calcium (Ca) of YC group were significantly lower than those of other groups (P<0.05). There were no significant difference in the apparent digestibilities of organic matter (OM) and ether extract (EE) among all groups (P>0.05). 3) The fecalEscherichiacolinumber andLactobacillus/Escherichiacoliof YC and YP groups were significantly higher than those of other groups (P<0.05), and the fecalEscherichiacolinumber was significantly lower than that of other groups (P<0.05). In conclusion, the newly developed YC can improve the growth performance and intestinal micro-ecology environment of the piglets. The YC and PE combination can also improve the growth performance.[ChineseJournalofAnimalNutrition, 2016, 28(11):3642-3649]
massa medicata fermentata; sourdough; yeast culture;Bacillussubtilis; papain; nursery piglets
2016-04-21
国家高技术研究发展计划(863计划)(2013AA102801);中国农科院科技创新工程;农业部饲料生物技术重点实验室开放课题
张 丽(1990—),女,河南郑州人,硕士,从事动物营养和饲料科学研究。E-mail: zhanglidream@163.com
*通信作者:丁宏标,研究员,博士生导师,E-mail: dinghongbiao@caas.cn
10.3969/j.issn.1006-267x.2016.11.034
S828
A
1006-267X(2016)11-3642-08

