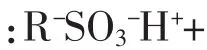基于解离度控制的桑枝生物碱树脂分离工艺优化*
牛安松,刘志华,金毅群,朱向阳,刘玉玲
(1.中国医学科学院药物研究所,天然药物活性物质与功能国家重点实验室,北京 100050;2.中国医学科学院药物研究所,药物传输技术及新型制剂北京重点实验室,北京 100050;3.北京五和博澳药业有限公司,北京 102600)
·中药研究·
基于解离度控制的桑枝生物碱树脂分离工艺优化*
牛安松1,2,刘志华1,2,金毅群3,朱向阳3,刘玉玲1,2
(1.中国医学科学院药物研究所,天然药物活性物质与功能国家重点实验室,北京 100050;2.中国医学科学院药物研究所,药物传输技术及新型制剂北京重点实验室,北京 100050;3.北京五和博澳药业有限公司,北京 102600)
[目的]基于生物碱解离常数(pKa)与氨基酸等电点(pI)的差异,筛选树脂处理的活化剂种类,优化桑枝生物碱分离纯化工艺。[方法]分别采用常规的盐酸及不同pH值的缓冲液为活化剂对732阳离子树脂进行处理,柱前衍生化-高效液相色谱(HPLC)法对生物碱及氨基酸进行分析,比较桑枝水提液经吸附交换后的生物碱与氨基酸泄漏曲线,测定1-脱氧野尻霉素(DNJ)吸附量,考察氨水洗脱后产物中生物碱的色谱纯度。[结果]常规的盐酸活化剂处理树脂,生物碱及总氨基酸均未泄漏,而采用pH 5.6及4.6的缓冲液作为活化剂,总氨基酸提前泄漏;与pH 5.6缓冲液相比,pH降至4.6时,生物碱吸附量由1.84 mg/g(DNJ质量/树脂质量)提高至2.23 mg/g;缓冲液处理后的生物碱提取物,色谱纯度由23.6%提高至79.6%。[结论]通过调节树脂的pH值环境,可使生物碱和氨基酸以不同的解离状态存在,减少氨基酸吸附,提高阳离子树脂吸附选择性,提高生物碱分离纯化效果。
桑枝生物碱;1-脱氧野尻霉素;阳离子交换树脂;解离常数;吸附选择性
文献报道[8-9],桑枝中所含的氨基酸与桑叶类似,以天冬氨酸(pI=2.77)、谷氨酸(pI=3.15)、脯氨酸(pI=6.3)、丙氨酸(pI=6.0)和精氨酸(pI=10.76)为主。其中除精氨酸为碱性外,其余均为中性或酸性氨基酸,pI在2.77±6.3之间,均低于生物碱的pKa值。
前期曾有学者根据氨基酸等电点不同,对混合氨基酸进行分离纯化[10]。但基于生物碱pKa值与氨基酸pI值的差异,通过控制药物的解离度,优化桑枝生物碱树脂分离纯化工艺,国内外均未见报道。为此,本研究拟利用生物碱pKa与中性和酸性氨基酸pI的差异,通过对树脂活化剂的优选,将树脂分离的pH值环境调节至低于生物碱的pKa值,且控制在氨基酸的等电点范围内,以确保生物碱解离为阳离子状态,而氨基酸则更多以[HOOC-RH-NH3]分子或[OOC-RH-NH3]-形式存在。基于中性和酸性氨基酸的pI范围,考察不同pH值环境对树脂吸附生物碱的影响,为提高树脂吸附选择性、优化桑枝生物碱分离纯化工艺提供支持。
1 实验材料及仪器
高效液相色谱仪Angilent1100;电子天平MS104S(万分之一,梅特勒-托利多北京有限公司);桑枝(药材采自广西);钠型市售732阳离子交换树脂(国药集团化学试剂有限公司,批号20140922);DNJ对照品(自制,纯度在98%以上);FA对照品(MedChem Express,批号HY-13005);9-氯甲酸芴甲酯(FOMC-Cl,Sigma公司);乙腈为色谱纯;氨基酸、二水合柠檬酸三钠、盐酸、乙酸钠、乙酸磷酸氢二钠、柠檬酸均为分析型。
2 实验方法
2.1 桑枝生物碱及氨基酸分离与检测
2.1.1 色谱条件 参考文献[11],按柱前衍生化-高效液相(HPLC)色谱方法,DIKMA C18柱(5 μm,250 mm×4.6 mm);流速:1.5 mL/min;柱温32℃;进样量10 μL;检测波长:264 nm。

表1 HPLC梯度洗脱程序Tab.1 HPLC gradient eluted program
2.1.2 系统适用性 1)对照溶液制备:分别精密称取DNJ、FA及20种不同氨基酸10 mg,置50 mL量瓶中,加水适量,超声5 min,加水稀释至刻度,摇匀,滤过。2)系统适用性:精密量取上述对照溶液各1 mL,置具塞试管中,精密加入200 mmol/L碳酸氢钠1 mL,摇匀,再精密加入5 mmol/L FMOC-Cl丙酮溶液2 mL,摇匀,30℃加热30 min,精密加入0.1%乙酸4 mL,摇匀,滤过,精密量取10 μL,注入液相色谱仪,依法测定,记录色谱图,考察分离检测效果。
2.2 树脂活化剂选择及树脂再生处理 1)树脂装柱:取钠型732阳离子交换型湿树脂90 g,分装于2.5 cm×30 cm层析柱中,加入过量去离子水,反复冲洗树脂。2)活化剂选择及树脂再生处理:采用如下不同pH值的活化剂,对树脂柱进行再生处理。常规活化剂处理:以2 mol/L盐酸为活化剂,以1.5个柱体积(BV)/h的流速洗脱树脂,用量约2.5 BV,最后用水冲洗至出水pH=5左右,备用。改良活化剂处理:以pH=5.6及pH=4.6的磷酸氢二钠-柠檬酸缓冲液(CNa+=0.2 mol/L)代替常规的盐酸,进行树脂活化处理,备用。
2.3 不同pH值的树脂环境对桑枝生物碱吸附与分离的影响
2.3.1 桑枝水提液的制备及柱前衍生化-HPLC测定 取桑枝5 kg,加入6倍水,煎煮2次,分别1.5 h、 1 h,合并煎煮液,滤过,离心浓缩。取浓缩液,精密量取1 mL,照2.1项下方法进行衍生化处理和HPLC测定,记录色谱图中DNJ、FA及总氨基酸的峰面积,另根据DNJ对照溶液结果,按外标法计算浓缩液中DNJ的含量。
2.3.2 树脂上样吸附与洗脱 取2.3.1项下的桑枝水提浓缩液280 mL共3份,分别上样于2.2.2项下不同活化剂处理得到的3种树脂柱,流速3 BV/h,按50 mL收集流份,共5份,约280 mL,用0.5 mol/L氨水洗脱至酸性硅钨酸试剂无反应,合并洗脱液并蒸干,得“生物碱纯化产物”。
2.3.3 不同pH值的树脂环境对吸附选择性的影响 1)泄漏曲线考察:取2.3.2项下的流份各1 mL,照2.1项下方法进行衍生化处理和HPLC测定,记录色谱图中DNJ、FA及总氨基酸的峰面积。以流份数为X轴,以泄漏液中生物碱(以DNJ、FA计)及总氨基酸峰面积Y轴,分别绘制泄漏曲线。2)树脂对DNJ的吸附量考察:根据2.3.1项下的桑枝水提液DNJ的含量测定结果,按280 mL上样体积,计算树脂对DNJ的吸附量:树脂吸附量(mg/g)=(上样量-流份体积×流份DNJ浓度)/树脂质量。3)生物碱提取物的色谱纯度考察:取2.3.2项下氨水洗脱后的“生物碱纯化产物”约10 mg,精密称定,置25 mL量瓶中,加水适量,超声5 min,加水稀释至刻度,摇匀,滤过,精密量续滤液1 mL,照2.1项下方法进行衍生化处理和HPLC测定,记录色谱图中DNJ、FA的峰面积,以及除溶剂峰及衍生化试剂峰以外的色谱峰面积的总和,归一化法按下式计算生物碱占总峰面积的相对百分比例,考察以“DNJ与FA”计的生物碱色谱纯度。生物碱百分比例=(DNJ+FA)峰面积/除溶剂峰及衍生化试剂峰以外的色谱峰面积总和。另根据DNJ对照溶液结果,按外标法计算产物中DNJ的含量。
3 结果与讨论
3.1 生物碱及氨基酸分离检测的系统适用性实验 在2.1项中柱前衍生化-HPLC色谱条件下,桑枝生物碱的主要成分DNJ、FA,以及20种氨基酸的色谱图如图1所示,基于柱衍生化-HPLC检测原理,化学结构中含有氨基的成分均可发生衍生化反应,因此,色谱图除溶剂峰及衍生化试剂峰外,其余为生物碱和氨基酸的总色谱峰。图1中,1号为溶剂峰;17号为衍生化试剂峰。18、19号分别为DNJ、FA峰,2-16为氨基酸。比较各色谱图的保留时间,生物碱主要成分DNJ为10.7 min,FA为12.8 min,而氨基酸在相应位置没有色谱峰,提示氨基酸与生物碱的主要成分DNJ和FA可实现良好分离。
3.2 桑枝水提浓缩液柱前衍生化-HPLC测定结果 根据图2结果,DNJ及FA的峰面积分别为9.54%、5.58%,氨基酸的总峰面积为84.88%,表明提取液中DNJ及FA含量较低,而氨基酸含量较高。根据对照溶液结果,按外标法计算,提取浓缩液中DNJ的质量分数为0.80%。
3.3 不同pH的树脂环境对生物碱吸附与分离效果的影响
3.3.1 不同活化剂的泄漏曲线比较 结果表明以盐酸为活化剂,生物碱以及总氨基酸均未泄漏,几乎完全被树脂吸附,此时树脂表现为对生物碱、氨基酸吸附选择性较差;以pH 4.6、pH 5.6的缓冲液为活化剂时,泄漏液中存在大量氨基酸,而生物碱比例较少,此时树脂表现为对生物碱具有选择性吸附作用,且pH 4.6与pH 5.6的生物碱的选择吸附效果接近。见图3。
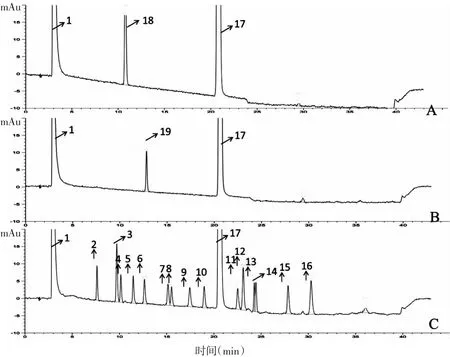
图1 桑枝生物碱DNJ(A)、FA(B)和20种氨基酸(C)的柱前衍生化-HPLC色谱图Fig.1 RP-HPLC with pre-column derivatization chromatograms of DNJ(A),FA(B)和20 amino acids(C)
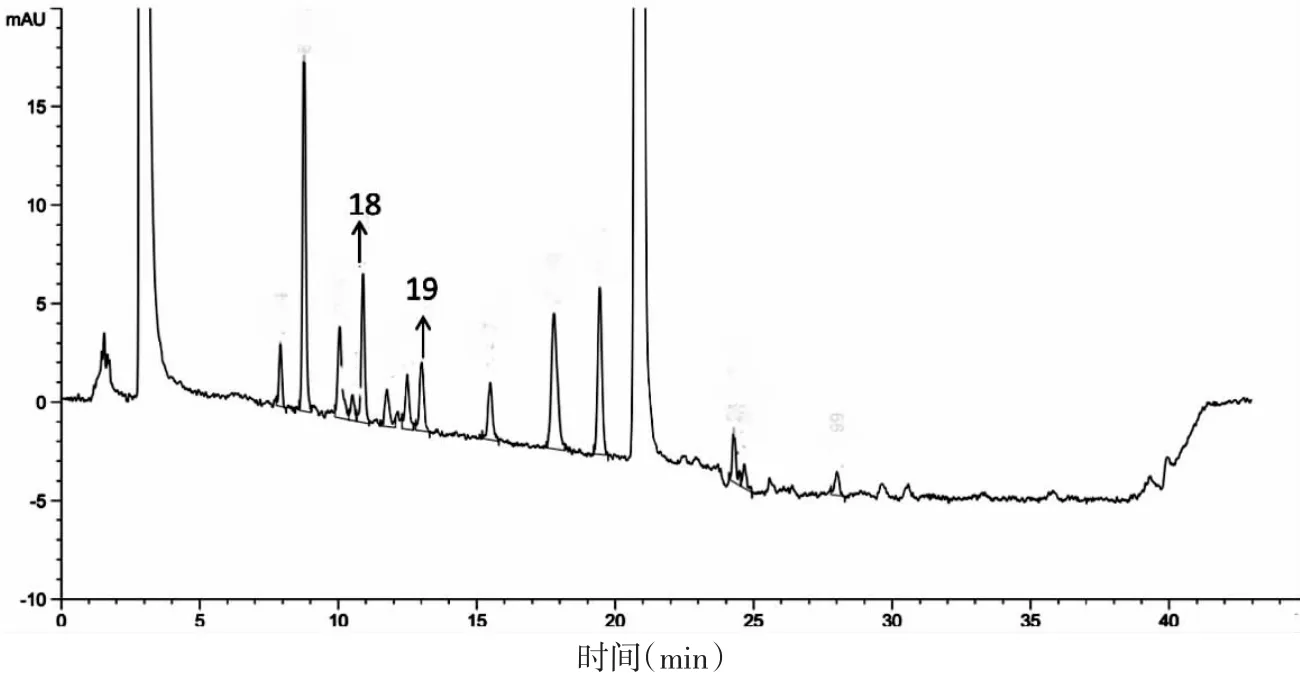
图2 桑枝提取浓缩液的色谱图Fig.2 Chromatograms of concentrated solution extracted from mulberry branches
3.3.2 不同活化剂的DNJ吸附量比较 结果如表2所示,以盐酸为活化剂的树脂常规处理方法,DNJ的吸附量为2.93 mg/g,pH 5.6缓冲液处理后DNJ的吸附量为1.84 mg/g,pH 4.6缓冲液处理后DNJ的吸附量为2.23 mg/g。由此提示,缓冲液代替盐酸,会使生物碱吸附量有所下降,pH越高,与生物碱的pKa值(7.53)差值相对较小,吸附量则越低。
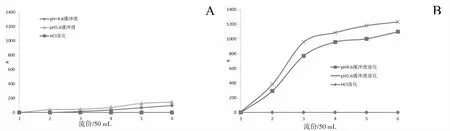
图3 不同活化剂处理树脂生物碱(A,以DNJ、FA计)及总氨基酸(B)的泄漏曲线Fig.3 Leakage curves of alkaloids(A,DNJ,FA-based)and total amino acids(B)by regenerating agent

表2 不同活化方式对732阳离子树脂吸附量影响(以DNJ计)Tab.2 Adsorption quantity of 732 resin(DNJ-based)by different regenerating reagent
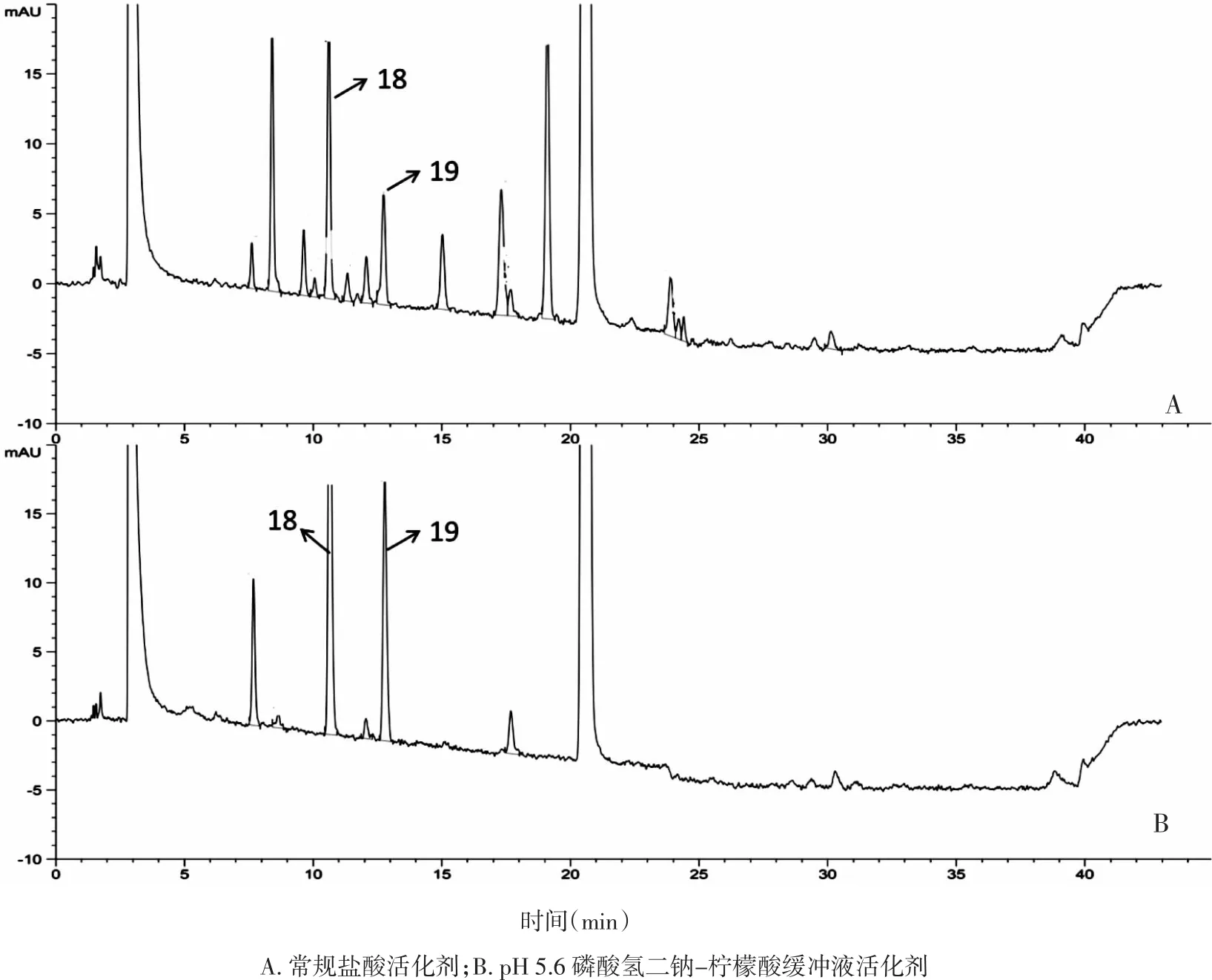
图4 不同活化剂处理树脂后的生物碱提取物HPLC色谱图Fig.4 HPLC chromatograms of products by different regenerating agent
3.3.3 不同活化剂对生物碱提取物色谱纯度的影响 对盐酸及pH 5.6磷酸氢二钠-柠檬酸缓冲液为活化剂处理树脂后的生物碱提取物按2.1方法进行测定,HPLC色谱图如下图4所示。桑生物碱以1-DNJ,FA为主,通过调节树脂内环境pH,保证生物碱以阳离子形式被吸附于酸性树脂,当pH在4.6~5.6时,使其接近氨基酸pI后,酸性树脂对氨基酸的吸附量急剧减小,非常有利于对氨基酸杂质的去除。图谱可见缓冲液预处理的产物杂质峰明显减少。根据图4色谱图,树脂常规盐酸活化后生物碱峰面积(以DNJ和FA计)占总峰面积的23.6%,DNJ质量分数为7.05%。pH 5.6缓冲液活化后生物碱峰面积(以DNJ和FA计)占总峰面积的79.6%,DNJ质量分数为13.96%,表明生物碱分离纯化效果显著提高。
4 结论
盐酸是723强酸型阳离子树脂再生的常规活化剂,由于交换过程的H+置换,树脂内环境成酸性,氨基酸与生物碱同时以阳离子形式存在,表现为树脂对生物碱、氨基酸吸附没有选择性。调节树脂环境pH在4.6~5.6时,接近氨基酸pI时,通过影响解离度使氨基酸在树脂上的吸附降低。此时pH远小于生物碱pKa,DNJ以阳离子形式被树脂吸附;两种pH的缓冲液相比,pH值由5.6调节至4.6时,对吸附选择性没有明显影响,但生物碱吸附量明显增加;通过缓冲液调节树脂内环境pH,对其进行活化处理,经氨水洗脱得到的生物碱产物中,生物碱含量明显提高。本研究基于氨基酸pI与生物碱pKa的差异,以缓冲液代替常规的盐酸作为活化剂,通过调节树脂的pH值环境,既可减少阳离子树脂对氨基酸的吸附,又可确保生物碱的吸附量并提高吸附选择性。研究取得的结果,为提高桑枝生物碱分离纯化效果提供了理论基础及实验数据支持。
[1]国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2015:299.
[2]陈 震.桑枝水提物中抑制α-葡萄糖苷酶活性成分的研究[D].北京:中国协和医科大学,1999.
[3]冉艳萍,廖森泰,刘吉平.1-脱氧野尻霉素 (DNJ)的研究进展[J].广东蚕业,2012,46(3):44-47.
[4]苏 楠.桑叶降糖活性物质DNJ分离纯化及体外药理活性研究[D].广州:广州中医药大学,2014.
[5]刘韦鋆,赵 骏,高秀梅,等.1-脱氧野尻霉素提取精制工艺的研究[J].中华中医药学刊,2009,27(10):2079-2081.
[6]魏晓蕊.桑叶中1-脱氧野尻霉素的提取纯化及其降血糖活性的研究[D].扬州:扬州大学,2012.
[7]贾冬冬.桑叶与莲子心药用成分的分离及关键技术的应用研究[D].天津:天津大学,2009.
[8]Yamashita T.Variations in amounts of carbohydrates,amino acids andadeninenucleotidesinmulberrytree(Morusalba L.)stems during transitional phases of growth[J].Tree Physiol,1990(6):191-200.
[9]张雁冰,魏爱卿,李 玲,等.河南马桑中氨基酸和微量元素的测定[J].郑州大学学报,2005,37(3):90-91.
[10]张金龙,王静康,尹秋响.氨基酸的提取与精制[J].化学工业与工程,2004,21(2):101-105.
[11]夏学军,汪仁芸,刘玉玲.柱前衍生化RP-HPLC法测定桑枝总生物碱的含量[J].中国新药杂志,2008,17(23):2044-2047.
(本文编辑:高 杉,于春泉)
Optimization the purification progress on mulberry alkaloids based on the dissociation constants
NIU An-song1,2,LIU Zhi-hua1,2,JIN Yi-qun3,ZHU Xiang-yang3,LIU Yu-ling1,2
(1.Chinese Academy of Medical Sciences,State Key Laboratory of Bioactive Substances and Function of Natural Medicines,Beijing 100050,China;2.Chinese Academy of Medical Sciences,Beijing City Key Laboratory of Drug Delivery Technology and Novel Formulations,Beijing 100050,China;3.Beijing Wehand-Bio Pharmaceutical Co.LTD.,Beijing 102600,China)
[Objective]To select optimum regenerating agent of ion-exchange resin and optimize purification of mulberry alkaloids based on the pKa of the alkaloids and the pI of amino acids.[Methods]The 732 resins were regenerated with hydrochloric acid and different pH buffer solution,respectively.The productions were determined by RP-HPLC with pre-column derivatization.This article calculated the leakage amount of alkaloids and amino acids the adsorbing amount.Meanwhile it also determined the peak ratio of alkaloids in products.[Results]Ultimately,the total amino acids leaked in a short time with the buffer solution at pH 4.6 as regenerating agent.However,both of the alkaloids and amino acids didn't leak with hydrochloric acid as regenerating agent.The adsorption amount was increased from 1.84 to 2.23 mg/g with the buffer solution at pH 4.6 compared to pH 5.6.The relative peak ratio of the alkaloids in productions is 79.6%with the buffer solution at pH 5.6 as regenerating agent,and 23.6%with hydrochloric acid as regenerating agent.[Conclusion]Through adjusting the pH of resin separation and controlling the dissociation degree of the alkaloids and the amino acids,the purity of the production was improved with decreased adsorption of amino acids and increased selectivity of the resin.
mulberry alkaloids;1-deoxynojirimycin;cation exchange resin;dissociation constant;selective adsorption
R284.2
A
1672-1519(2016)10-0619-05
“重大新药创制”国家科技重大专项(2013ZX09101-005);“重大新药创制”科技重大专项(2012ZX09309002-001-008);北京市科技计划“十病十药”研发(Z11100059011010)。
牛安松(1990-),男,硕士研究生在读,研究方向为中药有效组分提取分离及质控。
刘玉玲,E-mail:ylliu@imm.ac.cn。
2016-05-25)
10.11656/j.issn.1672-1519.2016.10.11