镉胁迫下苦楝(MeliaazedarachL.)幼苗的生长及生理响应
苏明洁,廖源林,叶 充,蔡仕珍,龙聪颖,邓辉茗
(四川农业大学风景园林学院,成都 611130)
镉胁迫下苦楝(MeliaazedarachL.)幼苗的生长及生理响应
苏明洁,廖源林,叶 充,蔡仕珍*,龙聪颖,邓辉茗
(四川农业大学风景园林学院,成都 611130)
采用盆栽试验研究不同浓度Cd(0、30、60、90、120、150、180 mg·kg-1)处理对苦楝(Melia azedarach L.)幼苗生长、Cd积累、光合、质膜透性以及渗透调节的影响。结果表明,当Cd2+浓度≤60 mg·kg-1时显著促进苦楝幼苗生物量的积累(P<0.05),Cd2+浓度>60 mg·kg-1时抑制作用逐渐增强,但≤120 mg·kg-1Cd处理对株高影响不显著(P>0.05),植株能正常生长且保持较大的生物量;苦楝对Cd具有一定的积累能力,其根、茎、叶中Cd含量随Cd处理浓度的增加而增加,且根系是主要积累部位;随着Cd处理浓度的增加,叶绿素(Chla+b)含量和光合速率(Pn)下降,相对电导率(REC)和丙二醛(MDA)含量增大,但≤60 mg·kg-1Cd处理时均无明显变化;随Cd浓度的升高,可溶性糖含量下降,可溶性蛋白和游离脯氨酸呈先升后降趋势,游离脯氨酸含量始终高于CK,苦楝通过增加可溶性蛋白和游离脯氨酸的含量来维持Cd胁迫下的渗透平衡,从而降低Cd毒害。上述结果表明,苦楝对Cd具有一定耐性,其耐Cd胁迫的阈值浓度大约是120 mg·kg-1,可以将其应用于土壤Cd污染区域,在美化环境的同时修复土壤Cd污染。
苦楝;镉积累;生物量;光合特性;渗透调节物质
苦楝(Melia azedarach L.)又名苦苓、楝树、森树等,为楝科(Meliaceae)楝属(Melia)的落叶乔木,其材质坚韧,纹理美丽[1],且根、皮、花、果均可入药[2],抗病虫害能力强,可作为植物源农药[3],是一种综合利用价值较高的乡土树种,广泛分布于我国南方地区[4]。苦楝生长迅速,树形优美,具有耐烟尘,耐瘠薄,可吸收二氧化硫等特点,是城市及矿区优良的绿化和造林树种[5],宜配植于池边、园路两侧,可孤植、列植和丛植。前人对苦楝的抗盐性[6]、抗旱性[7]和抗寒性[8]进行了探究,近年来对苦楝的研究主要集中在遗传多样性分析方面[9-11],而对其重金属胁迫下的响应机制则鲜有报道。廖源林等[12]探讨了苦楝叶片抗氧化系统对镉(Cd)胁迫的响应,但Cd胁迫下苦楝的Cd积累特征、光合特性以及渗透调节相关物质含量变化情况尚未明确。
随着城市化和工业化的不断推进,城市土壤Cd污染问题日益加剧。四川内江城市表层和下层土壤中Cd含量超标样点比例为94.6%和88.2%,且城市土壤Cd含量具有显著积累趋势[13];付娟林等[14]对杭州市区50个居民区Cd污染状况进行评价,结果显示96%的土壤处于中度或重度污染。因此,耐Cd性应作为筛选园林绿化植物的重要参考指标。选择对Cd具有耐性的植物进行城市绿化,在增加绿量、美化环境的同时,还能缓解土壤Cd污染,甚至还能在一定程度上起到重金属污染修复的作用[15]。苦楝作为一种生长迅速、生物量大、观赏性强的多功能园林树种,具有极高的实际应用价值和重金属污染修复潜力,而其对Cd是否具有一定的抗性,尚待进一步明确。探究Cd胁迫下苦楝的生理响应机制,对城市及矿区Cd污染区域绿化和造林树种的选择具有重要意义。本研究通过盆栽试验,探究Cd胁迫下苦楝的生物量、Cd积累、光合特性、质膜透性以及渗透调节物质含量变化,以期为揭示苦楝的耐Cd性及其在城市土壤Cd污染区域的综合应用提供参考依据。
1 材料与方法
1.1 材料和处理
2014年年底于四川温江7~8年生苦楝母株上采集树种,净种后筛选出饱满籽粒,2015年3月上旬播种至上口径15 cm、高15 cm的塑料盆中,播种基质由园土、草炭和河沙混合而成(体积比为5∶3∶2),于四川农业大学科研基地内培养。
种植土配比为园土∶草炭土∶河沙=5∶1∶1,将园土风干、碾碎、剔除杂物,研磨,与草炭土和河沙按比例混合均匀后过5 mm钢筛,再用800倍多菌灵消毒,堆积静置45 d后,按照每盆7 kg的标准装入带托盘的花盆(口径25 cm,高20 cm)中,用不含Cd等干扰物质的清水控制其土壤含水量为田间持水量的60%。种植土中有机质、全氮、全磷、全钾含量分别为43.05、0.47、0.69、3.72 g·kg-1,Cd含量为1.8 mg·kg-1。参照国家土壤环境质量标准和四川盆地重金属污染概况[16],试验以不添加Cd为对照(0 mg·kg-1;CK),设置Cd处理(不包括种植土中Cd背景值)浓度梯度为30、60、90、120、150、180 mg·kg-1,用分析纯CdCl2·2.5H2O配制而成的约500 mL溶液均匀浇灌盆土,渗出液需反复回浇,直到Cd2+与盆土混合均匀,在室内稳定15 d后用于试验。
8月初选取生长旺盛、长势相近的苦楝幼苗,移栽至含Cd处理土壤的塑料盆中,每盆3株,每个处理10盆,共计210株。移栽后第1周保证叶片不失水,1周后正常管理,试验期间每隔3 d浇400 mL清水至田间持水量,胁迫处理60 d。该试验大棚中透光率为80%,棚内温度为(25±3)℃,室内外温度接近,相对湿度为70%。分别于移栽后20、40、60 d上午9:00取植物第3~5片叶鲜样进行各项生理指标测定,60 d时观察记录叶片颜色及形态特征,测定生物量、Cd含量和光合作用相关指标。
1.2 测定指标与方法
1.2.1 株高与生物量的测定
处理60 d后,拍照记录苦楝幼苗叶形和叶色;每个处理选取3株长势一致的植株,用卷尺从植株基部测量,其平均值作为该处理的株高;收获所有的根、茎、叶,用自来水洗净后,再用蒸馏水冲洗3遍,105℃杀青30 min,80℃恒温烘干至恒重,电子天平称重。
1.2.2 Cd含量
处理60 d后,将苦楝根、茎、叶样品烘干、粉碎,称取0.5 g,采用混合酸(硝酸:高氯酸=4∶1)于电炉上消解,过滤,定容至50 mL,用原子吸收分光光度计(上海精密科学仪器有限公司,AA320N型)测定根、茎、叶中Cd含量。
1.2.3 质膜透性和渗透调节物质含量
各项生理指标于处理20、40、60 d测定,质膜透性采用相对电导率法(REC)测定;丙二醛(MDA)含量采用硫代巴比妥酸法测定;可溶性糖含量测定采用蒽酮比色法;可溶性蛋白含量测定采用考马斯亮蓝法;游离脯氨酸含量测定采用酸性茚三酮法。以上指标均参照熊庆娥[17]的方法测定。
1.2.4 光合作用相关指标
处理60 d后,利用丙酮-乙醇浸提法测定叶绿素含量[17];由便携式光合仪(Li-6400XT,美国)测定气体交换参数,测定过程中保证光合有效辐射为1000 μmol·m-2·s-1,大气CO2浓度为400 μmol·mol-1,叶室温度为25℃。
1.3 数据处理
采用Microsoft Office Excel 2007进行数据处理和图表分析,并用SPSS 20.0统计软件进行单因素方差分析(One-way ANOVA)、新复极差法(Duncan′s)多重比较。显著性水平设定α=0.05。
2 结果与分析
2.1 Cd2+对苦楝幼苗生长的影响
形态特征观测发现,Cd处理对叶片形态无显著影响,随Cd浓度的增加,叶片颜色逐渐变浅(图1)。Cd2+浓度≤60 mg·kg-1时,叶片呈墨绿色;浓度为90~120 mg·kg-1时,叶片呈绿色;浓度为150~180 mg·kg-1时,叶片开始泛黄,失绿症状由叶基沿叶脉逐渐向上蔓延。
由表1可见,Cd胁迫后幼苗的生长受到一定影响。浓度低于60 mg·kg-1的Cd处理,对根、茎干重有一定促进效果,与CK相比分别提高了2.58%~16.01%和4.78%~11.85%;株高在Cd2+浓度≤120 mg· kg-1处理下与CK差异不显著(P>0.05)。株高、根部干重和茎部干重在Cd2+浓度为180 mg·kg-1时,依次较CK降低了19.83%、17.04%和18.50%。
2.2 Cd2+在苦楝幼苗根、茎中的分布特征
表2显示,根、茎、叶中的Cd含量均随Cd处理浓度的增加而增加,Cd2+分布特征为根>茎>叶。Cd2+浓度≤30 mg·kg-1时,根、茎间Cd含量差异较小,根、茎、叶Cd含量均显著高于CK(P<0.05);Cd2+浓度为60~180 mg·kg-1时,根Cd含量上升幅度明显大于茎和叶,为茎的1.80~3.45倍、叶的2.26~4.51倍。根、茎、叶Cd含量的最大值出现在180 mg·kg-1Cd处理,分别为181.94 μg·g-1、52.65 μg·g-1和40.36 μg·g-1。
2.3 Cd2+对苦楝幼苗光合作用的影响
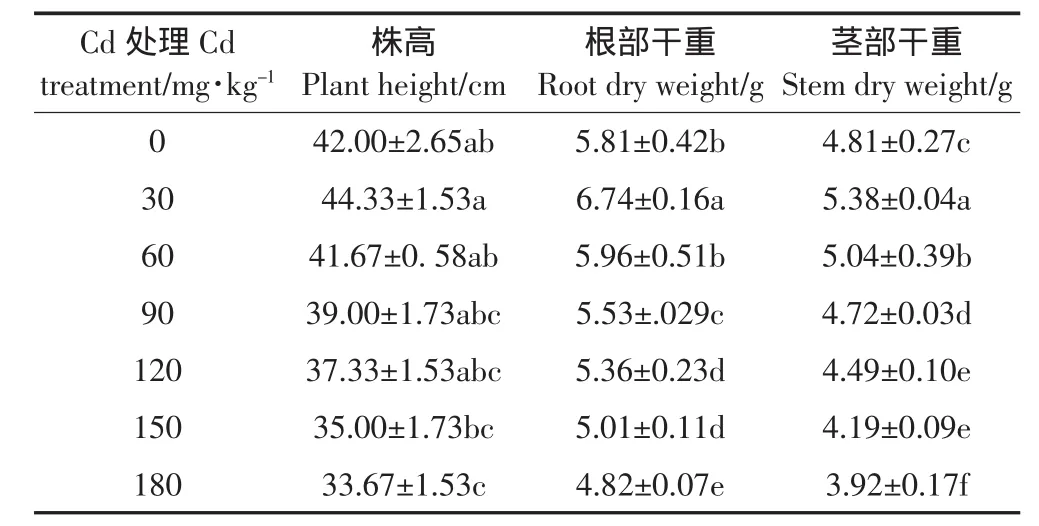
表1 不同浓度Cd处理对苦楝幼苗株高、根部干重和茎部干重的影响Table 1 Effects of cadmium stress on the caulis height,root and stem dry weight of Melia azedarach L.seedlings
随着Cd胁迫浓度增大,叶片叶绿素a(Chla)、叶绿素b(Chlb)和总叶绿素(Chla+b)含量略有下降,叶绿素a/b(Chla/b)无明显变化(表3)。当Cd2+浓度≤120 mg·kg-1时,Chla和Chlb与CK差异不显著(P>0.05)。Chla+b在Cd2+浓度≤150 mg·kg-1时,各浓度之间差异不显著(P>0.05),但在Cd2+浓度≥90 mg·kg-1时,显著低于CK(P>0.05);各浓度处理下Chla/b之间差异不显著(P>0.05),但均略高于CK。180 mg·kg-1Cd处理的Chla、Chlb和Chla+b含量最低,较CK分别下降了37.00%、47.62%和39.16%。
由表4可知,各项光合参数均随Cd处理浓度的增加而下降。Cd2+浓度≤60 mg·kg-1时,净光合速率(Pn)、胞间CO2浓度(Ci)和蒸腾速率(Tr)与CK差异不显著(P>0.05),而各处理下气孔导度(Gs)均显著低于CK(P<0.05)。180 mg·kg-1Cd处理下,Pn、Gs、Ci和Tr较CK依次下降了34.59%、37.50%、20.39%和40.00%。

图1 不同浓度Cd对苦楝幼苗叶片形态的影响(60 d后)Figure 1 Effects of cadmium stress on the leaf morphology of Melia azedarach L.seedlings(after 60 d)
2.4 Cd2+对苦楝幼苗质膜透性和丙二醛含量的影响
表5显示,Cd处理后,幼苗叶片的细胞膜透性逐渐增大。胁迫20 d,各浓度的相对电导率均显著高于CK(P<0.05),说明叶片细胞膜受到Cd2+伤害。胁迫40 d和60 d,Cd2+浓度≤60 mg·kg-1时,相对电导率与CK相比差异不显著(P>0.05),说明胁迫处理一段时间后,苦楝幼苗产生了一定的适应性;150 mg·kg-1和180 mg·kg-1Cd处理下差异不显著,说明Cd2+浓度达到一定高度后,对苦楝细胞膜透性的影响逐渐减弱。MDA含量随Cd浓度增加呈缓慢上升趋势,Cd胁迫20 d、Cd2+浓度≥60 mg·kg-1以及胁迫处理40 d和60 d、Cd2+浓度≥90 mg·kg-1时,MDA含量显著高于对照(P<0.05);三个处理时间节点下,Cd2+浓度为180 mg· kg-1时,MDA含量分别是CK的6.38、2.19倍和1.90倍,而且胁迫20 d,与150 mg·kg-1Cd处理相比,180 mg·kg-1处理的MDA含量上升幅度较大。
2.5 Cd2+对苦楝幼苗渗透调节物质含量的影响
如表6所示,可溶性糖含量随Cd胁迫浓度增加而降低,180 mg·kg-1Cd处理下有最小值,20、40、60 d时,较CK分别下降27.21%,20.36%和24.23%,而30 mg·kg-1Cd处理与CK差异不显著(P>0.05)。
可溶性蛋白含量随Cd处理浓度的增加先升后降,20 d和40 d的峰值出现在Cd2+浓度60 mg·kg-1时,分别较CK上升15.65%和35.48%;处理60 d,峰值出现在Cd2+浓度30 mg·kg-1时,较CK上升18.06%;且Cd2+浓度≤120 mg·kg-1时,可溶性蛋白含量均不低于CK。
游离性脯氨酸含量也随Cd2+浓度的增加先升后降,20、40、60 d其峰值分别出现在Cd2+浓度为150、90、60 mg·kg-1时,分别较CK上升193.38%、214.32%和123.03%,且各处理下游离脯氨酸含量均显著高于对照(P<0.05)。
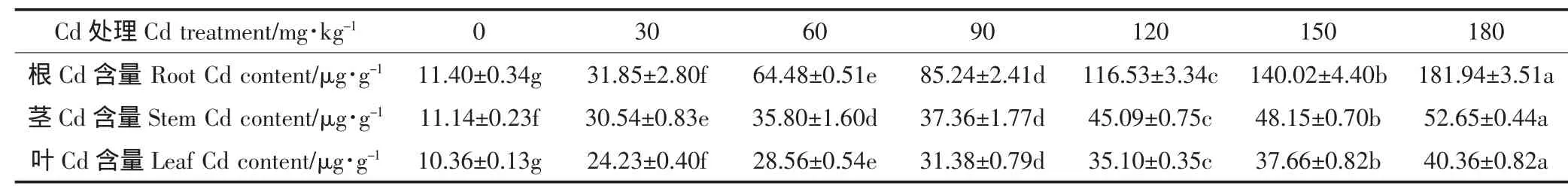
表2 不同浓度Cd胁迫对苦楝幼苗根、茎、叶Cd含量的影响Table 2 Effects of cadmium stress on the Cd content in the root,stem and leaf of Melia azedarach L.seedlings

表3 不同浓度Cd处理对苦楝幼苗叶片叶绿素含量的影响Table 3 Effects of cadmium stress on chlorophyll contents in leaf of Melia azedarach L.seedlings
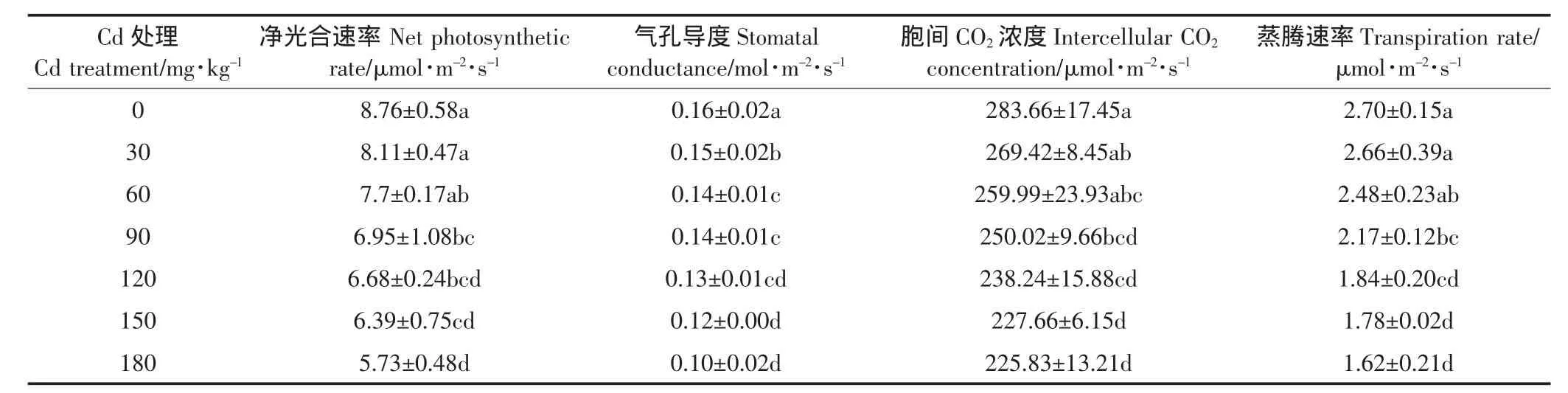
表4 不同浓度Cd处理对苦楝幼苗光合作用参数的影响Table 4 Effects of cadmium stress on photosynthetic parameters of Melia azedarach L.seedlings
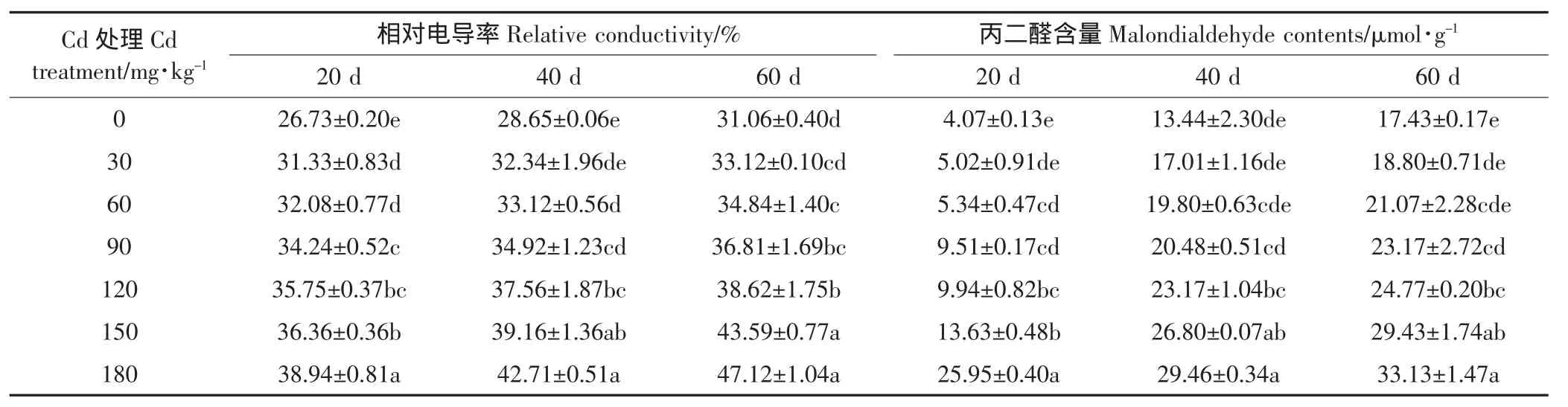
表5 不同浓度Cd处理对苦楝幼苗叶片相对电导率和丙二醛含量的影响Table 5 Effects of cadmium stress on leaf REC and MDA contents of Melia azedarach L.seedlings
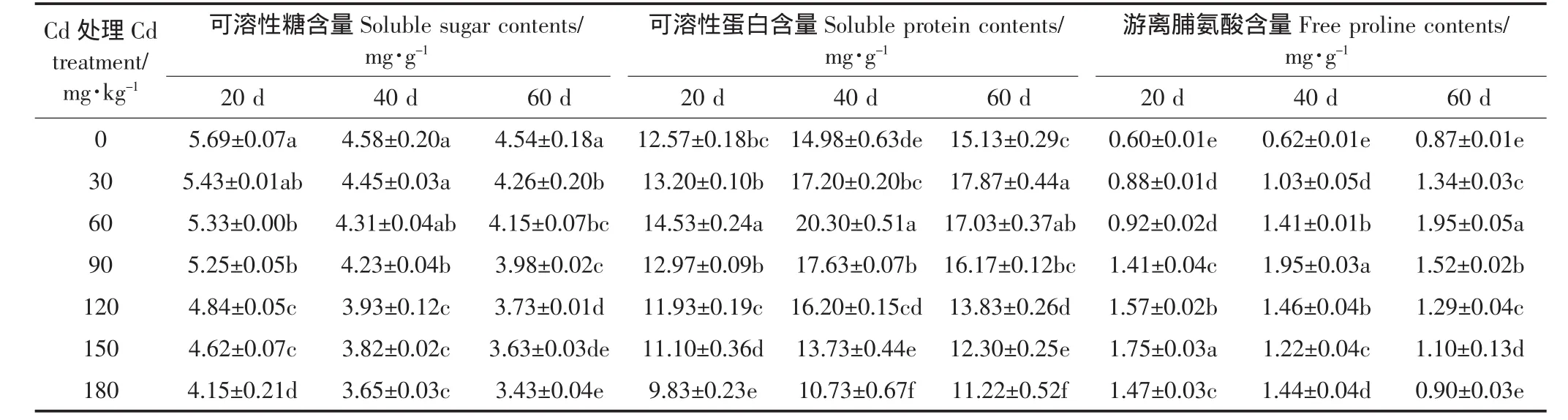
表6 不同浓度Cd处理对苦楝幼苗可溶性糖、可溶性蛋白和游离脯氨酸含量的影响Table 6 Effects of cadmium stress on the soluble sugar,soluble protein and the free proline contents of Melia azedarach L.seedlings
3 讨论
Cd是植物生长发育的非必需元素,但其在土壤中有高度移动性,易被植物吸收,从而影响植物蒸腾作用、光合作用和呼吸作用等正常生理代谢过程[18]。Cd对植物的毒害首先反映在生物量的变化上[15],实验结果显示,随着Cd2+浓度的增大,苦楝幼苗根、茎干重呈“低促高抑”效应。这与具有耐Cd性的园林植物海桐[19]的研究结果一致,且苦楝比海桐的耐性更强。随着Cd处理浓度的升高,苦楝幼苗根、茎、叶中的Cd含量上升,Cd在苦楝体内的分布特征为根>茎>叶,且根中Cd含量远高于茎和叶,说明根是苦楝积累Cd的主要部位。这与超富集植物龙葵[20]的研究结果不同,但与同为楝科的香椿和红椿[21]的研究结果一致,可能与不同植物独特的解毒机制有关。苦楝通过根系固定的方式限制Cd2+转移,既能维持地上部的观赏特性,又能达到修复土壤污染的目的。
叶绿素是植物进行光合作用的重要色素,其含量变化与光合作用密切相关[16]。本研究中,低于90 mg· kg-1Cd处理,苦楝幼苗叶片Chla+b与CK无显著差异(P<0.05),而当Cd2+浓度超过120 mg·kg-1,Chla和Chlb含量下降,叶片颜色变浅发黄,品质变差。究其原因,可能是高浓度Cd2+与叶绿体中蛋白质的巯基(-SH-)结合,破坏叶绿体的结构和功能,最终导致叶绿素的降解[22]。此外,Cd2+还可以通过抑制卡尔文循环相关的酶活性和使气孔部分关闭等途径,直接或间接影响植物的光合作用[23]。低于60 mg·kg-1Cd处理的Pn与CK差异不显著(P>0.05),表明苦楝对低浓度Cd2+具有较强的光合耐受性。随Cd处理浓度增加,叶片的Pn、Gs和Ci均呈下降趋势,说明气孔的部分关闭是苦楝叶片光合速率降低的主要原因[24]。120 mg·kg-1Cd处理的Pn、Gs、Ci和Tr明显低于CK,此时苦楝幼苗的有机物合成能力显著下降,其原因与气孔限制引起的Ci降低以及Chla+b含量下降有关。而Tr下降导致的叶片蒸腾拉力降低,是否与苦楝养分的吸收受阻相关,有待进一步研究。
细胞膜是保障植物细胞内外物质交换运输的重要结构,Cd胁迫诱导产生活性氧自由基(ROS),引发膜脂过氧化,导致细胞膜结构和功能损伤[25]。MDA是膜脂过氧化的产物,其含量的高低和细胞质膜透性的变化可以反映细胞膜受伤害的程度[26]。本研究中,高浓度Cd胁迫下,苦楝幼苗叶片相对电导率增大,MDA含量上升。Cd2+诱导产生的ROS积累到一定程度,可以促进Cd2+与含N、S基团或蛋白质结合,形成二硫键(-S-S-),导致膜离子通道结构破坏[16]。而低浓度处理,REC和MDA含量变化不显著(P>0.05),说明此时膜系统能够正常运行,可能与其启动了抗氧化酶保护机制[12]和渗透调节机制有关。
植物在遭遇干旱、高盐、低温以及重金属胁迫等逆境时,会迅速积累脯氨酸、可溶性蛋白、可溶性糖、甜菜碱以及有机酸等一系列渗透调节物质,从而增强植物的防御能力[27]。可溶性糖可以有效地提高细胞渗透浓度,降低水势,同时也是构成生物大分子的碳架和重要的能量来源[28]。本研究发现,Cd2+浓度高于60 mg·kg-1时,苦楝幼苗可溶性糖含量显著低于CK(P<0.05)。这与刺槐幼苗[29]的研究结果不同,可能是因为Cd2+干扰了苦楝对营养物质的吸收和分配,使得氧化和光合过程受阻,从而导致可溶性糖含量下降[30]。此外,研究发现脯氨酸等有机渗透调节物质的合成,需要可溶性糖提供碳源和能量[31],也是可溶性糖含量下降的原因。Cd2+胁迫下可溶性蛋白含量先升后降,可能是因为低浓度Cd2+能诱导植物形成Cd结合蛋白(Cd-Bp),如金属硫蛋白和类金属螯合蛋白等[32],从而降低Cd毒害,提高苦楝的抗逆性;另一方面增加的可溶性蛋白有助于维持细胞渗透压,保障植物进行正常的生理代谢。当Cd2+浓度高于90 mg·kg-1,可溶性蛋白含量下降并低于对照,表明此时Cd2+浓度已经超过了可溶性蛋白调节的阈值,高浓度的Cd2+抑制了DNA的合成,加速了蛋白质的分解,导致其含量下降。脯氨酸是植物蛋白的组成之一,是维持细胞渗透平衡的重要调节物质,因其具有偶极性,在稳定细胞膜结构方面也起着重要作用[31],其含量变化是植物受到逆境胁迫的一种信号。本研究中苦楝幼苗游离脯氨酸含量随Cd2+浓度的增加呈先升后降的趋势,但各处理下均显著高于CK(P<0.05),低浓度下游离脯氨酸迅速积累,最高可达对照组的2~3倍。脯氨酸含量的增加在一定程度上维持了细胞渗透压,保持了细胞膜结构和功能的完整性,还有利于清除过量积累的ROS,调节细胞氧化还原电势[33],对提高植物对Cd的耐受性具有重要意义。
4 结论
(1)苦楝对Cd有一定的积累能力,且Cd的分布特征为根>茎>叶,根系是积累Cd的主要部位。
(2)低于60 mg·kg-1Cd处理,对苦楝幼苗的根、茎部干重有显著促进作用,对Chla+b含量、Pn、相对电导率以及MDA含量无显著影响,植株能较好地生长;120 mg·kg-1Cd处理下,株高、Chla和Chlb含量与CK无显著差异(P>0.05),植株能正常生长且保持较大的生物量,说明苦楝对Cd有一定的耐受能力。
(3)苦楝幼苗可溶性蛋白和游离脯氨酸含量均随Cd2+浓度的增大呈先升后降的趋势,低Cd2+浓度处理下的渗透调节以可溶性蛋白为主,游离脯氨酸调节为辅,高Cd2+浓度下则以游离脯氨酸调节为主。
综上所述,苦楝耐Cd胁迫的阈值浓度大约是120 mg·kg-1,即苦楝可以作为绿化和造林树种应用于Cd污染低于此浓度的城市和矿区,且其在土壤Cd污染的修复中具有较大的应用潜力。
[1]廖柏勇,陈晓阳,陈丽君,等.苦楝种源间种子发芽变异的观测[J].广东农业科学,2014(11):43-47.
LIAO Bo-yong,CHEN Xiao-yang,CHEN Li-jun,et al.Observation of Melia azedarach seed germination variation among provenances[J]. Guangdong Agricultural,2014(11):43-47.
[2]王家源,郭杰,喻方圆.不同种源苦楝种子生物学特性差异[J].南京林业大学学报(自然科学版),2013,37(1):49-54.
WANG Jia-yuan,GUO Jie,YU Fang-yuan.The differences of seed biological characters in Melia azedarach L.from different provenances[J]. Journal of Nanjing Forestry University(Natural Science Edition),2013, 37(1):49-54.
[3]刘佳敏,徐华潮.苦楝对星天牛的引诱研究[J].浙江农林大学学报, 2014,31(3):437-441.
LIU Jia-min,XU Hua-chao.Attractiveness of Melia azedarach to Anoplophora chinensis[J].Journal of Zhejiang A&F University,2014,31(3):437-441.
[4]杨吉安,马玉花,苏印泉,等.苦楝研究现状及发展前景[J].西北林学院学报,2004,19(1):115-118.
YANG Ji-an,MA Yu-hua,SU Yin-quan,et al.Review and prospect of research and development in chinaberry tree[J].Journal of Northwest Forestry University,2004,19(1):115-118.
[5]陈丽君,邓小梅,丁美美,等.苦楝种源果核及种子性状地理变异的研究[J].北京林业大学学报,2014,36(1):15-20.
CHEN Li-jun,DENG Xiao-mei,DING Mei-mei,et al.Geographic variation in traits of fruit stones and seeds of Melia azedarach[J].Journal of Beijing Forestry University,2014,36(1):15-20.
[6]张子晗,王家源,喻方圆.盐胁迫对两种源苦楝种子萌发特性的影响[J].南京林业大学学报(自然科学版),2014,38(5):107-112.
ZHANG Zi-han,WANG Jia-yuan,YU Fang-yuan.Effects of NaCl stress on germination characteristics of Melia azedarach L.seeds from two provenances[J].Journal of Nanjing Forestry University(Natural Sciences Edition),2014,38(5):107-112.
[7]陈平,万福绪,顾汤华,等.干旱胁迫下侧柏、苦楝等树种的生理生化响应及抗旱性评价[J].林业科技开发,2012,26(4):43-48.
CHEN Ping,WAN Fu-xu,GU Tang-hua,et al.Physiological and biochemical response and drought tolerance evaluation on five tree species under drought stress[J].Forestry Science and Technology,2012,26(4):43-48.
[8]王家源,郭杰,喻方圆.不同产地苦楝苗木抗寒性差异[J].林业科技开发,2011,25(3):67-69.
WANG Jia-yuan,GUO Jie,YU Fang-yuan.The difference of cold resistance in Melia azedarach seedlings among different provenance[J]. Forestry Science and Technology,2011,25(3):67-69.
[9]陈丽君,刘明骞,廖柏勇,等.苦楝SRAP分子标记及遗传多样性分析[J].华南农业大学学报,2016,37(1):70-74.
CHEN Li-jun,LIU Ming-qian,LIAO Bo-yong,et al.Analysis of genetic diversity of Melia azedarach with SRAP markers[J].Journal of South China Agricultural University,2016,37(1):70-74.
[10]王芳,廖柏勇,李培,等.苦楝SSR-PCR反应体系优化及引物筛选[J].林业科学研究,2016,29(2):167-175.
WANG Fang,LIAO Bo-yong,LI Pei,et al.Optimization of SSR-PCR reaction system and primer screening of Melia azedarach[J].Forest Research,2016,29(2):167-175.
[11]陈丽君,刘明骞,廖柏勇,等.苦楝SRAP-PCR反应体系的建立及优化[J].华南农业大学学报,2015,36(3):104-108.
CHEN Li-jun,LIU Ming-qian,LIAO Bo-yong,et al.Establishment and optimization of SRAP-PCR system in Melia azedarach[J].Journal of South China Agricultural University,2015,36(3):104-108.
[12]廖源林,蔡仕珍,邓辉茗,等.苦楝叶片抗氧化系统对Cd2+胁迫的响应[J].东北林业大学学报,2015,43(11):22-27.
LIAO Yuan-lin,CAI Shi-zhen,DENG Hui-ming,et al.Response of antioxidative system to cadmium stress in Melia azedarach leaf[J].Journal of Northeast Forestry University,2015,43(11):22-27.
[13]谢贤健.基于GIS和地积累指数法的内江市城市土壤镉含量及污染评价[J].地球与环境,2016,44(1):82-88.
XIE Xian-jian.Concentration and spatial distribution characteristics and pollution evaluation on Cd in soil from Neijiang City,China based on GIS and Index of Geoaccumulation[J].Earth and Environment, 2016,44(1):82-88.
[14]符娟林,章明奎,厉仁安.基于GIS的杭州市居民区土壤重金属污染现状及空间分异研究[J].土壤通报,2005,36(4):575-578.
FU Juan-lin,ZHANG Ming-kui,LI Ren-an.GIS-Assisted assessment and spatial variation of heavy metal pollution in soils of residential areas of Hangzhou City[J].Chinese Journal of Soil Science,2005,36(4):575-578.
[15]顾翠花,王懿祥,白尚斌,等.四种园林植物对土壤镉污染的耐受性[J].生态学报,2015,35(8):2536-2544.
GU Cui-hua,WANG Yi-xiang,BAI Shang-bin,et al.Tolerance and accumulation of four ornamental species seedlings to soil cadmium contamination[J].Acta Ecologica Sinica,2015,35(8):2536-2544.
[16]刘柿良,杨容孑,马明东,等.土壤镉胁迫对龙葵(Solanum nigrum L.)幼苗生长及生理特性的影响[J].农业环境科学学报,2015,34(2):240-247.
LIU Shi-liang,YANG Rong-jie,MA Ming-dong,et al.Effects of soil cadmium on growth and physiological characteristics of Solanum nigrum L.plants[J].Journal of Agro-Environment Science,2015,34(2):240-247.
[17]熊庆娥.植物生理学实验教程[M].成都:四川科学技术出版社, 2003.
XIONG Qing-e.Plant physiology experiment tutorial[M].Chengdu:Sichuan Science and Technology Press,2003.
[18]王玉萍,常宏,李成,等.Ca2+对镉胁迫下玉米幼苗生长、光合特征和PSⅡ功能的影响[J].草业学报,2016,25(5):40-48.
WANG Yu-ping,CHANG Hong,LI Cheng,et al.Effects of exogenous Ca2+on growth,photosynthetic characteristics and photosystemⅡfunction of maize seedlings under cadmiun stress[J].Acta Prataculture Sinica,2016,25(5):40-48.
[19]曹霞,郭朝晖,肖细元,等.海桐(Pittosporum tobira)对污染土壤中镉的耐受和吸收特征[J].农业环境科学学报,2015,34(4):627-632.
CAO Xia,GUO Zhao-hui,XIAO Xi-yuan,et al.Cadmium tolerance and uptake characteristics in Pittosporum tobira in contaminated soil [J].Journal of Agro-Environment Science,2015,34(4):627-632.
[20]郭智,王涛,奥岩松.镉对龙葵幼苗生长和生理指标的影响[J].农业环境科学学报,2009,28(4):755-760.
GUOZhi,WANGTao,AOYan-song.Physiologicalresponsesof Solanum nigrum L.seedlings to cadmium stress[J].Journal of Agro-Environment Science,2009,28(4):755-760.
[21]徐睿.Cd污染对四川珍贵乡土树种的影响及螯合剂效应研究[D].成都:四川农业大学,2015.
XU Rui.The effect of Cd on valuable native woody species in Sichuan Province and the chelators′effect on the candidate species[D].Chengdu:Sichuan Agricultural University,2015.
[22]简敏菲,杨叶萍,余厚平,等.不同浓度Cd2+胁迫对苎麻叶绿素及其光合荧光特性的影响[J].植物生理学报,2015,51(8):1331-1338.
JIAN Min-fei,YANG Ye-ping,YU Hou-ping,et al.Influences of different cadmium concentration stress on chlorophyll and its photosynthetic fluorescence characteristics of Ramie(Boehmeria nivea)[J].Plant Physiology Journal,2015,51(8):1331-1338.
[23]贾中民,王力,魏虹,等.垂柳和旱柳对镉的积累及生长光合响应比较分析[J].林业科学,2013,49(11):51-59.
JIA Zhong-min,WANG Li,WEI Hong,et al.Comparative analysis of Salix babylonica and Salix matsudana for their cadmium accumulation, growth and photosynthesis in response to cadmium contamination[J]. Scientia Silvae Sinicae,2013,49(11):51-59.
[24]许大全.光合作用气孔限制分析中的一些问题[J].植物生理学通讯,1997,33(4):241-244.
XU Da-quan.Some problems in stomatal limitation analysis of photo-synthesis[J].Plant Physiology Communications,1997,33(4):241-244.
[25]张然然,张鹏,都韶婷.镉毒害下植物氧化胁迫发生及其信号调控机制的研究进展[J].应用生态学报,2016,27(3):981-992.
ZHANG Ran-ran,ZHANG Peng,DOU Shao-ting.Oxidative stress-related signals and their regulation under Cd stress[J].Chinese Journal of Applied Ecology,2016,27(3):981-992.
[26]田治国,王飞.不同品种万寿菊对镉胁迫的生长和生理响应[J].西北植物学报,2013,33(10):2057-2064.
TIAN Zhi-guo,WANG Fei.Growth and physiological response of Tagetes cultivars to cadmiun stress[J].Acta Bot Boreal-Occident Sin, 2013,33(10):2057-2064.
[27]张丽萍,刘志强,金竹萍,等.H-2S对镉胁迫下白菜幼苗根系渗透胁迫的调节作用[J].农业环境科学学报,2016,35(2):247-252.
ZHANG Li-ping,LIU Zhi-qiang,JIN Zhu-ping,et al.Regulation of H2S on Cd-induced osmotic stress in roots of Chinese cabbage seedling [J].Journal of Agro-Environment Science,2016,35(2):247-252.
[28]马玉心,蔡体久,宋丽萍,等.兴安鹿蹄草[Pyrola dahurica(H.Andr.)Kom.]雪盖前后丙二醛及渗透调节物质含量的变化[J].生态学报, 2007,27(11):4596-4602.
MA Yu-xin,CAI Ti-jiu,SONG Li-ping,et al.Changes in contents of MDA and osmoregulatory substances during snow cover for Pyrola dahurica[J].Acta Ecologica Sinica,2007,27(11):4596-4602.
[29]陆秀君,关欣,许有博,等.镉对刺槐幼苗生长和与渗透调节有关物质含量的影响[J].中国土壤与肥料,2008(6):82-83.
LU Xiu-jun,GUAN Xin,XU You-bo,et al.Study on ammonia-oxidizing activity and biological characteristics of a Corynebacterium spp. strain[J].Soil and fertilizer of China,2008(6):82-83.
[30]夏建国,兰海霞.镉胁迫对蒙山茶树生长及叶片生理指标的影响[J].茶叶科学,2008,28(1):56-61.
XIA Jian-guo,LAN Hai-xia.Effects of cadmium stress on growth of tea plant and physiological index in leaves of Mengshan Tea[J].Journal of Tea Science,2008,28(1):56-61.
[31]徐智敏,何宝燕,李取生,等.盐分胁迫下两个苋菜品种对镉及主要渗透调节物质累积的差异[J].生态学杂志,2015,34(2):483-490.
XU Zhi-min,HE Bao-yan,LI Qu-sheng,et al.Differences between two amaranth cultivars in accumulations of Cd and main osmotic adjustment substances under salt stress[J].Chinese Journal of Ecology, 2015,34(2):483-490.
[32]张静,赵秀侠,汪翔,等.重金属镉(Cd)胁迫对水芹生长及生理特性的影响[J].植物生理学报,2015,51(11):1969-1974.
ZHANG Jing,ZHAO Xiu-xia,WANG Xiang,et al.Effects of cadmium stress on the growth and physiological property of Oenanthe javanica[J]. Plant Physiology Journal,2015,51(11):1969-1974.
[33]梁泰帅,刘昌欣,康靖全,等.硫对镉胁迫下小白菜镉富集、光合速率等生理特性的影响[J].农业环境科学学报,2015,34(8):1455-1463.
LIANG Tai-shuai,LIU Chang-xin,KANG Jing-quan,et al.Effects of sulfur on cadmium accumulation,photosynthesis and some other physiological characteristics of Pakchoi(Brassica chinensis L.)under cadmium stresses[J].Journal of Agro-Environment Science,2015,34(8):1455-1463.
The growth and physiological responses of Melia azedarach L.seedlings to cadmium stress
SU Ming-jie,LIAO Yuan-lin,YE Chong,CAI Shi-zhen*,LONG Cong-ying,DENG Hui-ming
(College of Landscape Architecture,Sichuan Agricultural University,Chengdu 611130,China)
Melia azedarach L.is a garden tree that can grow in poor soil,and has high ornamental and medicinal value.In this study,the effects of cadmium(Cd)on growth,cadmium accumulation,photosynthetic characteristic,membrane permeability as well as osmotic adjustment in Melia azedarach L.seedlings were investigated in a pot experiment.Results showed that the biomass accumulation was enhanced when≤60 mg·kg-1Cd treatments,whereas>60 mg·kg-1Cd2+inhibited plant growth and biomass accumulation,however,≤120 mg·kg-1Cd treatments had no significant differences on plant height compared with CK(P>0.05),plants could grow normally and keep large biomass. Melia azedarach L.showed capacity in Cd accumulation,and the Cd content in roots,stems and leaves increased when Cd content increased in soil,and root was the main accumulation area.With increased Cd concentration,Chlorophyll a+b content and net photosynthetic rate were reduced but relative conductivity(REC)and malondialdehyde(MDA)content were increased,however,no significant difference with Cd treatments(≤60 mg·kg-1)was found.Cd stress caused the content of soluble sugar decreased,the contents of soluble protein and free proline were increased at first then decreased when Cd concentration increased,free proline content was always higher than CK.By increasing soluble protein and free proline contents Melia azedarach L.maintained the osmotic balance under Cd stress,thus alleviated Cd toxicity. These results suggests that Melia azedarach L.has strong tolerance for Cd2+,the threshold concentration is about 120 mg·kg-1.Therefore Melia azedarach L.can be used in Cd contaminated soil,which remediate Cd contaminated soil.
Melia azedarach L.;cadmium accumulation;biomass;photosynthetic characteristic;osmotic-regulating substance
X503.23
A
1672-2043(2016)11-2086-08
10.11654/jaes.2016-0929
2016-07-18
四川省教育厅重点项目(12ZA116);四川农业大学大学生创新性实验计划项目(201410626068)
苏明洁(1992—),女,重庆江北人,硕士研究生,主要从事植物生理生态与园林植物配置应用研究。E-mail:498319628@qq.com
*通信作者:蔡仕珍E-mail:415455088@qq.com
苏明洁,廖源林,叶充,等.镉胁迫下苦楝(Melia azedarach L.)幼苗的生长及生理响应[J].农业环境科学学报,2016,35(11):2086-2093.
SU Ming-jie,LIAO Yuan-lin,YE Chong,et al.The growth and physiological responses of Melia azedarach L.seedlings to cadmium stress[J].Journal of Agro-Environment Science,2016,35(11):2086-2093.

